截至4月2日,在武汉进行的新冠疫苗一期临床试验的108位受试者均已完成接种,其中18位志愿者结束隔离。每一位解除隔离时都要拍CT,目前身体状况均良好。
目前,全球新冠肺炎确诊病例破百万,死亡人数突破5万。随着新冠肺炎在全球蔓延,防疫形势异常严峻,人们对于疫苗的研发与问世十分关注与期待。据报道,目前全球至少有90家机构,超过20种新冠疫苗正在研发中,而中国和美国的COVID-19 疫苗已进入临床试验阶段。
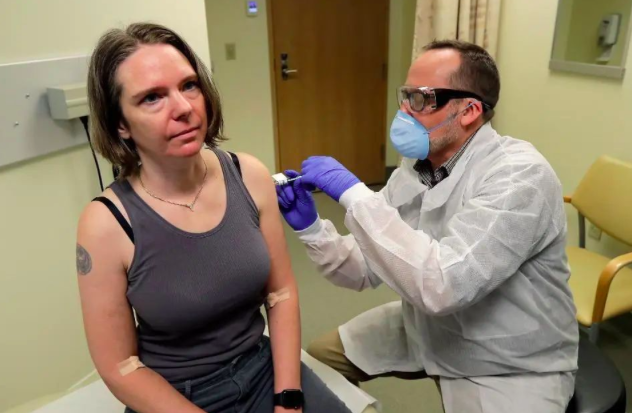
3月16日,43岁的詹妮弗·哈勒是第一位接受疫苗注射的人

「人类对付传染病最强的武器就是疫苗。」中国疾病预防控制中心艾滋病首席专家、国家卫健委传染病标准委员会委员、国际病毒的命名委员会成员邵一鸣教授认为,跟艾滋病比起来,我个人认为,新冠病毒疫苗研制成功的希望很大。因为新冠病毒是一个急性传染病,其病原体的免疫原性,可以刺激我们机体产生很强具有保护性的免疫反应,不像艾滋病等慢性传染病,机体对其产生保护性免疫反应是比较难的。
疫苗分两大类,一类叫传统疫苗,现在临床使用的多数是传统疫苗,它分为减毒疫苗和灭活疫苗。
减毒疫苗就是改变病原体在体外细胞或动物体内的培育体系或条件(如改变温度等)进行传代,致使病原体(菌株或病毒株)减毒。由此研制出来的细菌疫苗比如卡介苗,病毒疫苗比如小儿麻痹或麻疹,这些疫苗都属于传统疫苗中的减毒疫苗。
灭活疫苗是把病原体病毒在体外细胞大量培养起来,然后用化学方法把它杀灭后就变成一个死疫苗,再接种到人体。我们国家用的就是灭活疫苗老大有霍乱,狂犬病,甲型肝炎,新的像流感和手足口病也都是灭活疫苗。

另外一大类疫苗叫基因工程疫苗,就是通过基因工程的操作制成的。主要包括,亚单位疫苗(蛋白疫苗)、病毒或细菌载体疫苗、核酸疫苗(DNA和mRNA疫苗)等。美国这次试验的mRNA疫苗,陈薇院士和康希诺合作的腺病毒载体疫苗都是属于这一大类。
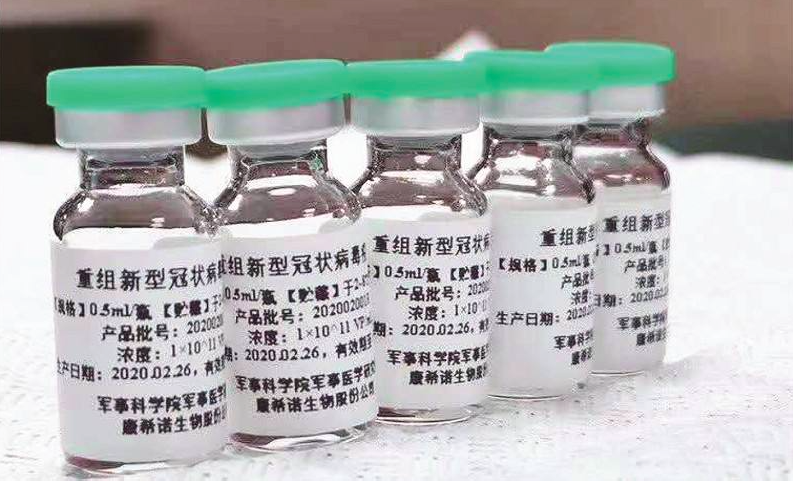
康希诺展示的新冠疫苗样品
简单理解基因工程载体疫苗就是使用对人体无害的的病毒或者细菌,一般多是已安全使用多年的细菌或病毒载体疫苗,如卡介苗、天花疫苗或流感疫苗,利用它们自然感染细胞的能力,把拟研制疫苗的基因高效地带到人体细胞内,让它在体内细胞里面表达出蛋白抗原,来诱导人体产生免疫力。因此,携带的工具就叫载体。邵一鸣教授举例说,就好比人乘坐汽车到达目的地,乘坐的汽车就是一个载体。这次陈薇院士用的是腺病毒做载体,我们研制艾滋病疫苗则是使用作为天花疫苗的痘苗病毒作载体,结果都是把拟研制的新冠病毒或艾滋病病毒的抗原基因重组到载体上,通过病毒感染进入到人体细胞内,在细胞内合成预期的蛋白质,完成激发免疫系统产生对新冠病毒或艾滋病毒免疫力的目的,包括中和病毒的抗体反应和杀灭病毒感染细胞的T细胞免疫反应。

腺病毒结构示意图
研究发现,采用与待预防病原体自然感染途径相同的免疫途径,可以更好地诱导机体的保护性免疫反应。因为这样不仅能刺激机体产生很强的全身体液免疫或细胞免疫反应,还可以在病原体自然侵入部位,如呼吸道病毒侵入的上呼吸道或肠道细菌侵入的胃肠道,诱导出很强的黏膜免疫反应。即同时诱导机体产生局部黏膜免疫和全身系统免疫应答会更有效地保护人体对抗病毒或细菌的侵袭。
目前,国内外有众多的团队在研制新冠病毒疫苗,美国和我国已有志愿者接种了新冠病毒疫苗,进入了临床试验阶段,那么后续还需要哪些试验、多久时间?
邵一鸣教授说,如果按照常规疫苗研发进程来算的话,一般疫苗上市前要经临床前研究和临床试验两个大的阶段。临床前研究的目的就是完成对疫苗设计的概念验证和安全性评价。包括在病原体的众多抗原中,选择哪个或哪些个作为疫苗?把其基因组装如载体后,否能在细胞内高效表达?插入基因是否能稳定存在?注射给动物后能诱导出设计的免疫反应?用活的病原体攻击时能否保护动物对抗感染?如果上述每一步都顺利成功的话,最后还要按药品法的规定,在GMP条件下生产三批质量稳定可控的疫苗,使用规定的多种动物开展和通过安全性的测试,以确保疫苗进入人体的副作用和风险都很低。完成上述看临床前研究后,即进入临床试验的申报,获得药监局的临床试验批件和临床试验机构的伦理审查后,才算进入临床试验阶段。常规的疫苗临床试验要经过实验目的和试验设计都不一样的一期、二期、三期才能完成。各期必须顺序开展,可以加快,但不能跨越。
一期临床试验目的是测试疫苗的安全性,因为在体外对动物安全不一定对人安全,所以要通过一期临床实验来确定其人体安全性。为避免意外并减少损失,一般仅在几十名健康的,无相关疾病风险的志愿者者进行。
二期临床试验的目的是测试疫苗的免疫原性,同时进一步观察安全性。本阶段主要检测疫苗对抗病原体的免疫反应指标是否能够达到设计的要求,如能否在人体内诱导出来抗病原体的抗体和或细胞免疫反应,以及这些反应的强度和广度。一般需要在一百至几百名,健康的志愿者进行。可以选择无或者有相关疾病风险的人群参与。
三期临床试验的目的是测试疫苗的有效性,这里的设计必需用双盲实验,就是分实验组和对照组,一组用疫苗,一组用安慰剂,测验者与被测验者都不知道被测试者属于哪组。实验结束的时候把所有的数据测试和收集完成后,再由独立的统计分析团队进行揭盲,按照实验组和对照组,遵循实现制定好的统计方案的进行最后分析。通过比较使用疫苗的实验组和使用安慰剂的疫苗组的发病率的差异,来计算出疫苗有无保护以及保护率是多高。需要几千名健康的志愿者开展实验,都是选择有相关疾病风险的人群参与,以降低所需志愿者人数,提高试验的成本效益。
关于每一期疫苗的临床试验需要多长时间,邵一鸣教授解释要根据不同疫苗的免疫程序来定。减毒活疫苗常规打一针,基因工程疫苗一般打三针,如乙型肝炎疫苗按照0、1、6的免疫程序需要6个月完成接种。按照疫苗临床试验法规,在完成全部疫苗接种后一期临床要观察半年,二期临床要观察一年,三期临床一般要观察2—3年,常规疫苗都是这么研制出来的。以在付出最小代价的情况下,得到可靠的疫苗保护率数据。邵一鸣教授强调说,对于突发传染病的疫苗研制,需要把握好安全、有效和应急之间的平衡。根据既往相关疫苗、尤其是冠状病毒疫苗研究的规律,可以选择有限病毒抗原和较成熟的技术路线,以加快临床前研究进程。他认为可滚动推进I、II期临床试验,以缩短试验进程。但对于疫苗的III期临床试验,他则认为则不应简化,还要早做筹划慎重推进。其主要原因二,首先我国新冠病毒新发感染已降至基线水平,本次流行季已无法在国内开展III期临床。应该根据国际流行趋势,尽早与相关国家协调,在满足他国条件下准备III期临床试验。二是,包括我国香港大学学者在内的研究显示,SARS冠状病毒疫苗发生过加重疾病的免疫增强效应。新冠病毒疫苗有无此风险,只能在有新冠病毒感染者参加的三期临床试验中才能检验。为保障志愿者的安全,不应简化和加快III期临床,而应增加测试密度,实时监控疫苗安全性的同时,推进获得疫苗的保护性数据。
3月17日,国务院联防联控机制召开新闻发布会,介绍药物、疫苗和检测试剂研发攻关最新进展。中国工程院院士王军志介绍,目前我国正按照5种技术路线(灭活疫苗、基因工程亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗、 核酸疫苗)开展新冠肺炎疫苗的紧急研制,总体进展顺利。第一批确定的9项任务,都已完成动物的有效性、安全性研究等临床前研究的大部分工作,大部分研发团队4月份都能完成临床前研究,并逐步启动临床试验,有的团队进展更快。
专家简介

邵一鸣
中国疾病预防控制中心艾滋病首席专家。从事艾滋病和传染病防治研究三十多年,查明我国艾滋病病毒及其耐药毒株的起源、传播路线和流行特征;研制艾滋病疫苗并完成I、II期临床试验。在2003年非典疫情时曾研制SARS疫苗并完成临床前研究测试。发表800多篇学术论文,引用一万多次,多次获部委级和国家级科技进步。曾任中国微生物学会病毒学专业委员会主任委员,现任中国微生物学会副理事长、国家卫健委疾病防控咨询专家、传染病标准委员会委员、世界卫生组织疫苗发展顾问、国际病毒命名委员会成员和美国微生物科学院Fellow。他曾获国家杰出青年基金,全国优秀科技工作者和全国先进工作者称号,是第十、十一和十二届全国政协委员。


