为应对此次突如其来的COVID-19疫情,FDA先后为Remdesivir(瑞德西韦,商品名Veklury)、COVID-19 convalescent plasma(COVID-19恢复期血浆)、Bamlanivimab(中和抗体LY-CoV555)、Baricitinib(巴瑞克替尼,商品名Olumiant)联合Remdesivir、Casirivimab和Imdevimab联合使用(REGN-COV2鸡尾酒疗法)等治疗药物以及Pfizer-BioNTech COVID-19 Vaccine和Moderna COVID-19 Vaccine新冠肺炎疫苗签发了EUA,用于COVID-19的临床治疗和预防。
但需要注意的是EUA仅是在临床证据不充分时紧急授权一些药物和疫苗用于COVID-19防治,这些医疗产品将来并不一定会通过FDA的批准,本文对这些方案做简单的介绍,以期对美国的COVID-19紧急治疗手段有所了解。
COVID-19 convalescent plasma [1]
COVID-19 convalescent plasma是从含有较高抗SARS-COV-2抗体且符合所有供体资格要求的康复患者收集的人血浆。根据对以往呼吸道病毒暴发流行中使用恢复期血浆的历史证据、部分临床前证据、目前对恢复期血浆进行的小型临床试验的结果等的回顾,有理由认定COVID-19 convalescent plasma治疗COVID-19住院患者已知和潜在的益处大于风险。2020年8月23日,FDA签发了COVID-19 convalescent plasma的EUA,用于治疗COVID-19住院患者。
需要根据医院的标准程序以及医疗和护理实践,提供COVID-19 convalescent plasma,临床可首先考虑从一个恢复期血浆单位(约200毫升)开始,后续根据医生的判断和患者的临床反应,再增加给药单位。通过外周静脉导管或中心静脉导管输注COVID-19 convalescent plasma,心功能受损和心力衰竭的患者给药时可能需要更低的输血速率或更长的输血时间。
严重过敏反应或输血过敏反应史患者禁止使用COVID-19 convalescent plasma。另外已知与输血相关的副作用和危害包括输血传播感染性疾病、过敏反应、发热性非溶血反应、输血相关急性肺损伤等。
关于使用COVID-19 convalescent plasma的早期证据来自中国一系列的病例报道中,这些针对重症患者的研究发现,患者的病毒载量、症状和影像学表现在给药后都有所改善,提示COVID-19 convalescent plasma可能起到很大帮助 [2,3] 。Rasheed等 [4] 研究中观察了入院ICU少于3天(出现症状时长平均14-16天)的COVID-19患者COVID-19 convalescent plasma输注后情况,发现1/21例(4.8%)患者在观察期内死亡,而对照组患者在观察期内死亡8/28例(28.6%)。但前期关于COVID-19 convalescent plasma的随机对照试验结果并未显示出其明显的有效性,可能也受限于入组患者的数量和状态,需要更加严格的双盲的随机对照试验 [5] ,另外COVID-19 convalescent plasma的中和抗体滴度,对于阐明恢复期血浆的确切作用也很重要 [6] 。
Bamlanivimab
[7]
Bamlanivimab是Eli Lilly and Company’s公司研发推出的一种中和性IgG1单克隆抗体,可与SARS-CoV-2刺突蛋白的受体结合域结合,目前还是研究用药物。2020年11月9日,FDA批准了Bamlanivimab的EUA,用于治疗病毒核酸检测结果阳性,且有进展为重度和/或住院的高风险的轻中度成人和儿童(12岁及以上且体重至少40kg)COVID-19患者。
1、适用人群
上文所说的高风险患者定义为至少包含下列一项标准:①身体质量指数(BMI)≥35;②患有慢性肾病;③糖尿病;④患有免疫抑制的疾病(immunosuppressive disease);⑤目前正在接受免疫抑制治疗;⑥年龄≥65岁;⑦年龄≥55岁,且有心血管疾病,或高血压,或慢性阻塞性肺疾病/其他慢性呼吸道疾病;⑧年龄12-17岁,并且有BMI≥85%对应年龄和性别的值(基于CDC发布相关图表https://www.cdc.gov/growthcharts/clinical_charts.htm)或镰状细胞病,或先天/后天性心脏病或神经发育障碍(例如,脑性瘫痪),或依赖医疗支持,例如气管造口术、胃造口术,或正压通气(COVID-19无关),或哮喘及其他需要每日用药控制慢性呼吸道疾病。
2、使用剂量
在病毒核酸检测阳性后和症状出现10天内尽快使用Bamlanivimab,成人和儿童患者(12岁及以上体重至少40kg)中的剂量为700 mg。Bamlanivimab必须经稀释后单次静脉输注。配制的液体不能与其他药物同时使用,与0.9%氯化钠注射液以外的其他药物的配伍性尚不清楚。
不建议根据年龄、性别、种族、体重、妊娠期或哺乳期肾脏或轻度肝脏损害、疾病严重程度或炎症情况调整剂量。如果临床中出现明显的过敏反应或过敏反应的体征及症状,立即停止给药,并开始适当的药物和/或支持治疗。
3、禁忌症
在COVID-19住院的患者中,尚未观察到Bamlanivimab治疗的益处。单克隆抗体用于需要高流量氧气或机械通气的COVID-19住院患者时,可能造成更糟糕的临床结局。因此,Bamlanivimab未被授权用于下列患者:①因COVID-19住院的患者;②因COVID-19需要氧疗的患者;③因非COVID-19相关病症接受长期氧疗的需要增加基线氧流量(baseline oxygen flow rate)的COVID-19患者。
在针对轻中度门诊患者的随机安慰剂对照研究中,结果显示在第2天到第6天,接受Bamlanivimab的患者比接受安慰剂的患者症状轻微。Bamlanivimab组出现COVID-19相关住院或急诊就诊的患者比例为1.6%,而安慰剂组为6.3% [8]。此外在无终末器官衰竭(end-organ failure)的Covid-19住院患者研究中,在Remdesivir治疗存在情况下,Bamlanivimab未显示具有疗效 [9]。但对于不同给药剂量的Bamlanivimab对于病毒载量的影响仍需要进一步研究说明。
CASIRIVIMAB和IMDEVIMAB联合使用
[11]
Casirivimab和Imdevimab是Regeneron Pharmaceutical公司研发生产的针对SARS-CoV-2刺突蛋白受体结合域的重组人IgG1单克隆抗体,目前尚为研究用药物(investigational drugs)。2020年11月21日,FDA批准了Casirivimab和Imdevimab联合使用的EUA,两者联合给药用于治疗病毒核酸检测结果阳性,且有进展为重度和/或住院的高风险的轻中度成人和儿童(12岁及以上且体重至少40kg)COVID-19患者。
1、适用人群
同Bamlanivimab。
2、使用剂量
两者必须同时使用,并通过静脉输注。Casirivimab和Imdevimab均以单剂小瓶的形式提供,在给药前必须稀释。
成人和儿童患者(12岁以上且体重至少40kg)的剂量为1200毫克Casirivimab和1200毫克Imdevimab一起静脉输注至少60分钟。在病毒核酸检测阳性后及症状出现10天内,应尽快联合使用Casirivimab和Imdevimab。
孕妇或哺乳期妇女和肾脏损害患者也并不推荐调整剂量。使用Casirivimab和Imdevimab有可能发生严重的过敏反应。如果出现临床显著的过敏反应或过敏反应的迹象或症状,立即停止给药,并开始适当的药物和/或支持治疗。
3、禁忌症
同Bamlanivimab。
因为普遍认为患者病情严重程度很可能与病毒载量以及清除有关,在非人类灵长类动物的体内研究表明casirivimab和imdevimab联合使用具有强大的抗病毒活性,可以降低病毒载量,改善病毒清除情况 [11] 。在针对非住院患者的临床研究显示,该联合疗法降低了病毒载量,在免疫应答尚未启动或基线时病毒载量较高的患者中效果更明显 [12] 。但进一步的临床证据还尚待公布。
Remdesivir
[13]
Remdesivir是Gilead Sciences公司研发生产的一种具有广谱抗病毒活性的腺苷类似物,参与并影响RNA复制过程而发挥抗病毒作用,最初研发用于治疗埃博拉病毒感染,属于抗病毒药物。关于Remdesivir的EUA许可,前后出现过多次的修订。2020年5月1日,美国食品和药物管FDA签发的EUA允许Remdesivir用于治疗重症COVID-19住院患者;同年8月28日,FDA将Remdesivir的EUA许可范围扩大至全部住院成人和儿童患者,不再考虑症状程度 [14]。随后在10月22日,FDA批准了Remdesivir用于治疗成人和儿童(12岁及以上,体重至少40公斤)住院COVID-19患者,根据批准Remdesivir只能在医院或能够提供类似住院治疗的急症照护的医疗保健机构中使用 [15]。也因此,FDA同步更改了Remdesivir的EUA范围,变更为适用于体重3.5kg至40kg以下或体重3.5kg以上的12岁以下儿科住院COVID-19患者(这一范围患者并未处在FDA批准Remdesivir使用范围内,因此仅适用于EUA范围),并且必须通过静脉输注。
1、适用人群
体重3.5kg至40kg以下或体重3.5kg以上的12岁以下儿科住院COVID-19患者。
实验室确认SARS-CoV-2感染之前,可以考虑对疑似COVID-19的住院患者进行经验性治疗。住院患者出现症状后何时使用没有限制。儿童患者(大于28天)必须测定其估算肾小球滤过率,足月新生儿(至少7天至小于或等于28天间)治疗前必须检测血清肌酐,并根据临床需要在治疗期间监测。在治疗前和治疗期间,根据临床需要对所有患者进行肝脏功能及凝血酶原时间检测。
2、使用剂量
唯一授权用于体重3.5kg至40kg以下或体重3.5kg以上的12岁以下儿科住院COVID-19患者的Remdesivir剂型是输注用VEKLURY(每瓶100毫克冻干粉)。
对于体重3.5kg至40kg以下的儿科患者,推荐剂量是在第1天单次5 mg/kg,然后从第2天开始每天一次2.5 mg/kg。对于12岁以下、体重40公斤及以上的儿童患者,在第1天给予单次200mg,然后从第2天开始维持每天一次100mg。
不需要有创机械通气和/或体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)的患者的推荐治疗时间是5天,如果治疗后未出现临床症状改善,治疗可以延长5天,总治疗时间可达10天。对于需要有创机械通气和/或ECMO的患者,建议总治疗时间为10天。Remdesivir静脉输注前必须重新配制并进一步稀释。
3、禁忌症
Remdesivir不推荐用于估算肾小球滤过率小于30mL/min的儿童患者(大于28天)或血清肌酐大于或等于1mg /dL的足月新生儿(至少7天到小于或等于28天)。
如果谷丙转氨酶水平增加到超过正常上限的10倍,考虑停用;如果谷丙转氨酶升高伴有肝脏炎症的体征或症状,立刻停用。不推荐Remdesivir与磷酸氯喹(chloroquine phosphate)或硫酸羟氯喹(hydroxychloroquine sulfate)联合用药。
Remdesivir被FDA批准使用主要是基于现有来自3项针对COVID-19成年患者的随机临床试验数据。在针对住院并有下呼吸道感染证据的成人COVID-19患者一项双盲、随机、安慰剂对照试验,患者按照推荐剂量或安慰剂治疗10天,主要结局是恢复时间,定义为出院或仅为住院期间感染控制。接受瑞德西韦治疗的患者中位恢复时间为10天,而安慰剂组为15天,根据8分顺序量表评估关键的次要终点分析显示瑞德西韦组比安慰剂组在第15天更有可能出现临床改善 [16]。另一项随机、开放标签的3期临床试验,包括COVID-19确诊住院患者,并且呼吸环境空气时氧饱和度为94%或更低以及存在肺炎影像学证据,患者随机分配接受Remdesivir静脉输注推荐用量5天或10天,主要终点是第14天的临床状态,采用7分序量表进行评估,对于不需要机械通气的重症COVID-19患者,结果并未显示Remdesivir两种疗程之间有显著差异 [17]。针对确诊COVID-19中度肺炎住院患者(存在肺浸润和呼吸环境空气时氧饱和度>94%)的随机开放标签试验结果显示,接受瑞德西韦10天疗程的患者在开始治疗后11天的临床状态与标准治疗(standard care)患者相比没有显著统计学差异,而5天疗程的患者与标准治疗相比的临床状态差异有统计学意义[18]。
但目前世界卫生组织仍然并不建议使用Remdesivir治疗COVID-19。
Baricitinib联合Remdesivir [19]
Baricitinib是一种Janus kinase (JAK)抑制剂。JAKs是细胞内酶,通过通路来影响造血细胞过程和免疫细胞功能。Baricitinib是Eli Lilly and Company’s公司生产的已获FDA批准用于对一种或多种肿瘤坏死因子拮抗剂治疗反应不充分的中度至重度活动性类风湿性关节炎(active rheumatoid arthritis)成人患者的治疗。FDA于2020年11月19日签发Baricitinib联合Remdesivir治疗疑似或实验室确诊需要补充氧气、有创机械通气或体外膜肺氧合的成人和2岁及以上儿童住院COVID-19患者。
估算肾小球滤过率≥60 mL/min/1.73m2的成人推荐剂量为每天一次4 mg,连续治疗14天或直至出院(14天内出院)。9岁及以上患者的推荐剂量为每天一次4 mg,连续治疗14天或直至出院(14天内出院);2岁至9岁以下患者的推荐剂量为每天一次2 mg,连续治疗14天或直至出院(14天内出院)。肾或肝损伤患者的调整建议剂量见表1。
表1. 实验室检查值异常患者的推荐剂量调整
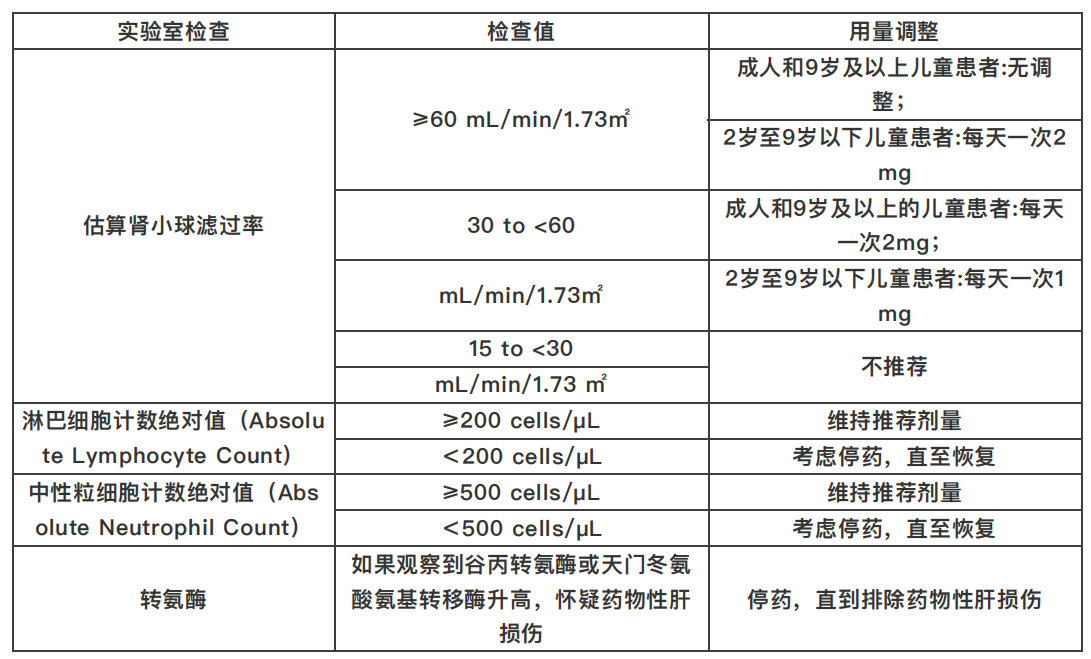
Baricitinib片口服,每日一次,随或不随餐均可。对于不能吞服的患者,可以将药片在温水容器中碾碎分散经胃造口管或鼻胃管送服。
Baricitinib不推荐用于正在透析,有终末期肾病(end-stage renal disease)且估算肾小球滤过率的患者<15 mL/min/1.73㎡,或患有急性肾损伤患者;存在已知活动性肺结核患者。2岁以下儿童禁用。接受Baricitinib治疗的COVID-19患者中已观察到严重静脉血栓形成(包括肺栓塞)和严重感染,COVID-19住院患者除非有禁忌症推荐预防静脉血栓栓塞。
一项双盲、随机、安慰剂对照试验,评估Baricitinib联合Remdesivir治疗COVID-19成人住院患者,均接受Remdesivir (≤10天)和Baricitinib (≤14天)或安慰剂(对照)治疗,主要观察结局是恢复时间,关键的次要结果是第15天的临床状态,结果显示接受Baricitinib治疗组中位恢复时间为7天,而对照组为8天,在第15天,Baricitinib治疗组临床状态改善的几率增加30%。入组时接受高流量氧气或无创通气的患者联合治疗恢复时间10天,对照组18天,Baricitinib联合Remdesivir在减少COVID-19患者的恢复时间和加速改善临床状况方面优于单独使用Remdesivir[20] 。也有学者认为使用Baricitinib治疗COVID-19相关肺炎的易感患者应该非常谨慎[21] 。
Pfizer-BioNTech COVID-19 Vaccine[22]
Pfizer-BioNTech COVID-19 Vaccine是Pfizer公司研发生产的新冠肺炎疫苗,该疫苗含有一种核苷修饰信使RNA (nucleoside-modified messenger RNA),该RNA编码SARS-CoV-2病毒的刺突蛋白,仍是一款实验性疫苗。2020年12月11日,FDA签发了该疫苗用于16岁及以上人群预防COVID-19的EUA。
Pfizer-BioNTech COVID-19 Vaccine是一种通过肌肉注射的悬浮液,分为两剂(每次0.3 mL),注射间隔为3周。该疫苗产品为容量0.45 mL不含防腐剂的冷冻悬液小瓶,需要储存在-80ºC至-60ºC之间的超低温冰箱中,在准备使用之前需要避光,然后稀释使用。
如需立即使用,可以在室温(上至25ºC)解冻未稀释的小瓶30分钟,解冻后的小瓶可以在有室内光线的环境下处理,但在室温下存放不超过2小时,稀释前药瓶必须达到室温。稀释后,在2ºC至25ºC室温6小时内使用,尽量避免暴露在室内光线下,避免阳光直射和紫外线照射。任何剩余的疫苗产品必须在6小时后丢弃,禁止再冷冻。
在前一剂疫苗后出现严重过敏反应以及对该疫苗的任何成分(如信使核糖核酸,脂类和胆固醇等)有严重过敏反应者不应接种疫苗。免疫缺陷患者,包括接受免疫抑制剂治疗的患者,可能疫苗反应会减弱。
其可能的副作用包括:注射部位疼痛;疲劳;头痛;肌肉疼痛;发冷;关节疼痛;发烧;注射部位肿胀;注射部位发红;恶心;感觉不适;淋巴结肿大(淋巴结炎症)。
一项跨国、安慰剂对照、单盲试验中,16岁或以上的受试者随机分配,按1:1比例接受两剂安慰剂或Pfizer-BioNTech COVID-19 Vaccine注射,间隔21天,主要终点是疫苗对实验室确认COVID-19的有效性和安全性,结果显示疫苗接种组中,有8/18,198例至少在第二剂接种后7天COVID-19发病,安慰剂组有162/18,325例,在年龄、性别、种族、民族、基线体重指数和是否存在并存疾病的亚组中观察到类似的疫苗效力,严重不良事件疫苗组和安慰剂组发生率均较低[23]。其他相关的临床试验尚在进展中,需要更多的临床数据进行评估。
Moderna COVID-19 Vaccine[24]
Moderna COVID‑19 Vaccine是ModernaTX公司研发的新冠肺炎疫苗,用以引起18岁及以上人群免疫预防COVID-19。FDA于2020年12月18日为其签发EUA授权。
Moderna COVID-19 Vaccine是一种用于肌肉注射的悬浮液,分为两剂(每剂0.5 mL),间隔1个月。产品小瓶需要保存在-25ºC至-15ºC之间避光冷冻保存。
不要储存在干冰或-40ºC以下。小瓶首次使用前可以储存冷藏2ºC至8ºC之间长达30天。在2ºC至8ºC的冷藏条件下解冻2小时30分钟,解冻后在室温下放置15分钟后给药。解冻后不要再冷冻,6小时后未用完也需要丢弃。
已报告的Moderna COVID-19 Vaccine不良反应包括,注射部位:与注射手臂同侧的淋巴结疼痛、压痛和肿胀、肿胀(发硬)和发红;全身:疲劳、头痛、肌肉痛、关节痛、寒战、恶心和呕吐、发热。
该疫苗三期随机、单盲、安慰剂对照试验中将感染SARS-CoV-2高风险人群按1:1的比例随机分配,分别接受间隔28天两次肌肉注射疫苗或安慰剂,主要终点是接种前未感染过SARS-CoV-2的参与者在第二次注射后至少14天COVID-19发病的情况,随机分配接受疫苗或安慰剂(每组15210名,超过96%的受试者接受了两剂注射),安慰剂组185/14,073名受试者在主要终点时感染COVID-19,疫苗组为11/14,134名,两组严重不良事件都很少见[25]。但对于这些新冠疫苗引起的免疫保护作用可以持续多久仍是大家更加关心的问题,相关的临床证据尚待公布。
Chloroquine phosphate和Hydroxychloroquine sulfate[26]
Chloroquine phosphate和Hydroxychloroquine sulfate需要特别说明一下,这两种药物是FDA最早签发EUA用于COVID-19治疗的药物,但是随后被撤销了EUA授权。
Chloroquine phosphate的某些产品被FDA批准用于预防和治疗某些疟疾毒株的急性发作,以及肠外阿米巴病的治疗。Hydroxychloroquine sulfate的一些产品被FDA批准用于预防和治疗疟疾,治疗红斑狼疮和风湿性关节炎。2020年3月28日FDA为Chloroquine和Hydroxychloroquine签发了EUA,这一时期COVID-19逐渐演变成为全球性的危机,而应当办法又显得捉襟见肘,因此FDA在基于一定临床证据就给予了紧急授权。
授权许可中规定Chloroquine phosphate和Hydroxychloroquine sulfate只能用于治疗体重50公斤或以上,因COVID-19住院的成人和青少年(adolescent)患者。Chloroquine phosphate建议剂量为治疗第一天1 g,然后根据临床评估,每天500 mg,共计治疗4至7天[27];Hydroxychloroquine sulfate建议剂量是治疗的第一天800 mg,然后根据临床评估,每天400 mg,共计治疗4至7天[28]。在当时最佳剂量和治疗时间是未知,建议的剂量和持续时间可能会随着临床试验数据的获得而更新。
有任何病因的视网膜或视野变化以及已知对4-氨基喹啉化合物过敏的患者,基线QT间期延长或心律失常风险增加的患者均禁用Chloroquine phosphate和Hydroxychloroquine sulfate。
但随着研究增加,鉴于其有效性以及潜在的严重不良事件,6月15日FDA又撤销了相关EUA授权,Chloroquine phosphate和Hydroxychloroquine sulfate相应产品在美国已经不再用于临床治疗COVID-19患者了。
最早相关证据来自中国的100例COVID-19患者临床报告,与对照组相比,Chloroquine治疗组的临床改善和病毒清除效果更好[29]。此后不久,法国一项开放标签非随机临床试验中,20例确诊患者每日Hydroxychloroquine口服600mg为治疗组,对照组16例,主要终点是在治疗第6天病毒清除情况,结果显示与对照组(12.5%,2/16))相比,治疗组70%(14/20)患者鼻咽部核酸检测阴性[30]。也正是通过这些等其他研究结果数据,FDA紧急签发了这类药物的EUA,然而之后更加严谨的研究却显示了不同的结果[31],FDA根据当时正在开展和报道的随机对照试验数据,决定撤销紧急授权许可。2020年5月发表的一项开放标签、随机对照试验研究了150名轻至中度COVID-19住院患者治疗第28天的核酸检测转阴情况,治疗组给予Hydroxychloroquine每天1200mg,连续3天,维持剂量每天800mg,连续2-3周,结果显示治疗组与标准护理组28天的病毒转阴率无显著差异,治疗组不良事件发生率却更高,其中腹泻最为常见[32]。
FDA除了上述药物以外,还在另外还签发了诸如用于年龄超过16岁、疑似或确诊COVID-19且需要重症监护室机械通气的患者持续输注维持镇静的Propoven 2%等辅助治疗的EUA[33]。而我国经过严格临床试验和审批,也批准了国药集团中国生物新冠灭活疫苗附条件上市,这都是为了尽可能更加高效地应对COVID-19采取的防治措施。
在应对诸如COVID-19这类重大新发呼吸道传染病时,现有的手段有时很难起到疗效,这时候不可避免需要对一些未完成严格临床试验以及新研发的医疗产品进行非常规应用,FDA这些紧急授权的治疗药物以及临床治疗数据也对我们认识这些药物也有很大启发。
背景
自2019年12月中国湖北武汉发现新型冠状病毒肺炎(COVID-19)以来,COVID-19已经席卷全球。截止2021年1月30日,全球已累计确诊101,561,219例,其中死亡2,196,944例,给人类带来了巨大灾难。不同COVID-19患者的症状存在着显著差异,从无症状、轻度呼吸系统疾病到肺炎,再到严重危及生命的急性呼吸窘迫综合征,甚至多器官功能衰竭和死亡,COVID-19患者最常见的症状包括气短、发热、疲劳、肌痛和干咳。
美国首例COVID-19病例于2020年1月20日在华盛顿州确诊后,美国本土COVID-19患者数量持续激增,到目前确诊超过两千五百万,死亡病例高达四十多万。FDA在批准药物使用中有极为严格的审批流程,但COVID-19的大流行毫无疑问迫使其加快推进新的治疗手段的紧急使用。
紧急使用授权(Emergency Use Authorization,EUA)是美国根据《联邦食品、药品和化妆品法案》(Federal Food, Drug, and Cosmetic Act)设立的,并在近些年不断进行过修订。当美国卫生与公众服务部宣布进入紧急状态后,FDA可以为「未经批准的医疗产品或未经批准使用的被批准的医疗产品」签发EUA。FDA签发EUA涵盖治疗药物,诊断手段等方面,但必须考虑以下标准:出现严重或威胁生命的疾病或状况,支持有效性的证据,风险和收益合理性分析以及无其他替代治疗手段[33]。紧急情况下签发EUA可以允许FDA在由于时间限制缺乏足够的临床试验证据时,批准使用具有一定治疗价值的研究性药物。
FDA此前在包括H7N9流感病毒(2013年),冠状病毒(2013),埃博拉病毒(2014),肠道病毒D68(2015年)及寨卡病毒(2016年)流行期间都签发过相关的EUA[31]。
参考文献
[1] FDA. Fact sheet for health care providers emergency use authorization (eua) of covid-19 convalescent plasma for treatment of covid-19 in hospitalized patients, 2020 [EB/OL]. [2021-1-31] https://www.fda.gov/media/141478/download
[2] Duan, K., et al., Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc. Natl. Acad. Sci. U. S. A., 2020. 117(17): p. 9490-9496.
[3] Shen, C., et al., Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. JAMA, 2020. 323(16): p. 1582-1589.
[4] Rasheed AM, Fatak DF, Hashim HA, et al. The therapeutic potential of convalescent plasma therapy on treating critically-ill COVID-19 patients residing in respiratory care units in hospitals in Baghdad, Iraq. Infez Med. 2020;28(3):357-366.
[5] Bloch EM, Shoham S, Casadevall A, et al. Deployment of convalescent plasma for the prevention and treatment of COVID-19. J Clin Invest. 2020;130(6):2757-2765.
[6] Khani E, Khiali S, Entezari-Maleki T. Potential COVID-19 Therapeutic Agents and Vaccines: An Evidence-Based Review. J Clin Pharmacol. 2021;10.1002/jcph.1822.
[7] FDA. Fact sheet for health care providers emergency use authorization (eua) of bamlanivimab, 2020 [EB/OL]. [2021-1-31] https://www.fda.gov/media/143603/download
[8] Chen P, Nirula A, Heller B, et al. SARS-CoV-2 Neutralizing Antibody LY-CoV555 in Outpatients with Covid-19. N Engl J Med. 2021;384(3):229-237.
[9] ACTIV-3/TICO LY-CoV555 Study Group, Lundgren JD, Grund B, et al. A Neutralizing Monoclonal Antibody for Hospitalized Patients with Covid-19 [published online ahead of print, 2020 Dec 22]. N Engl J Med. 2020;NEJMoa2033130.
[10] FDA. Fact sheet for health care providers emergency use authorization (eua) of casirivimab and imdevimab, 2020 [EB/OL]. [2021-1-31] https://www.fda.gov/media/143892/download
[11] Baum A, Ajithdoss D, Copin R, et al. REGN-COV2 antibodies prevent and treat SARS-CoV-2 infection in rhesus macaques and hamsters. Science 2020; 370: 1110-5.
[12] Weinreich DM, Sivapalasingam S, Norton T, et al. REGN-COV2, a neutralizing antibody cocktail, in outpatients with Covid-19. N Engl J Med 2021;384:238-251.
[13] FDA. Fact sheet for healthcare providers emergency use authorization (eua) of veklury® (remdesivir) for hospitalized pediatric patients weighing 3.5 kg to less than 40 kg or hospitalized pediatric patients less than 12 years of age weighing at least 3.5 kg, 2020[EB/OL]. [2021-2-1] https://www.fda.gov/media/137566/download.
[14] FDA NEWS RELEASE. COVID-19 Update: FDA Broadens Emergency Use Authorization for Veklury (remdesivir) to Include All Hospitalized Patients for Treatment of COVID-19, 2020 [EB/OL]. [2021-2-1]https://www.fda.gov/news-events/press-announcements/covid-19-update-fda-broadens-emergency-useauthorization-veklury-remdesivir-include-all-hospitalized.
[15] FDA. FDA’s approval of Veklury (remdesivir) for the treatment of COVID-19—The Science of Safety and Effectiveness, 2020[EB/OL]. [2021-2-1] https://www.fda.gov/drugs/drug-safety-and-availability/fdas-approval-veklury-remdesivir-treatment-covid-19-science-safety-and-effectiveness .
[16] Beigel JH, Tomashek KM, Dodd LE, et al. Remdesivir for the Treatment of Covid-19 - Final Report. N Engl J Med. 2020;383(19):1813-1826.
[17] Goldman JD, Lye DCB, Hui DS, et al. Remdesivir for 5 or 10 Days in Patients with Severe Covid-19. N Engl J Med. 2020;383(19):1827-1837.
[18] Spinner CD, Gottlieb RL, Criner GJ, et al. Effect of Remdesivir vs Standard Care on Clinical Status at 11 Days in Patients With Moderate COVID-19: A Randomized Clinical Trial. JAMA. 2020;324(11):1048-1057.
[19] FDA. Fact sheet for healthcare providers emergency use authorization (eua) of baricitinib, 2020[EB/OL]. [2021-2-1] https://www.fda.gov/media/143822/download.
[20] Kalil AC, Patterson TF, Mehta AK, et al. Baricitinib plus Remdesivir for Hospitalized Adults with Covid-19 [published online ahead of print, 2020 Dec 11]. N Engl J Med. 2020;NEJMoa2031994.
[21] Favalli EG, Biggioggero M, Maioli G, Caporali R. Baricitinib for COVID-19: a suitable treatment?. Lancet Infect Dis. 2020;20(9):1012-1013.
[22] FDA. Fact sheet for healthcare providers administering vaccine (vaccination providers) , 2020[EB/OL]. [2021-2-1] https://www.fda.gov/media/144413/download.
[23] Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603-2615.
[24] FDA. Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (eua) of the moderna covid-19 vaccine to prevent coronavirus disease 2019 (covid-19) , 2020[EB/OL]. [2021-2-1] https://www.fda.gov/media/144637/download.
[25] Baden LR, El Sahly HM, Essink B, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine [published online ahead of print, 2020 Dec 30]. N Engl J Med. 2020;NEJMoa2035389.
[26] FDA. Memorandum Explaining Basis for Revocation of Emergency Use Authorization for
Emergency Use of Chloroquine Phosphate and Hydroxychloroquine Sulfate, 2020[EB/OL]. [2021-2-2] https://www.fda.gov/media/138945/download.
[27] FDA. Fact sheet for health care providers emergency use authorization (eua) of chloroquine phosphate supplied from the strategic national stockpile for treatment of covid-19 in certain hospitalized patients, 2020[EB/OL]. [2021-2-2] https://www.fda.gov/media/136535/download.
[28] FDA. Fact sheet for health care providers emergency use authorization (eua) of hydroxychloroquine sulfate supplied from the strategic national stockpile for treatment of covid-19 in certain hospitalized patients, 2020[EB/OL]. [2021-2-2] https://www.fda.gov/media/136537/download.
[29] Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020;14(1):72-3.
[30] Gautret P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020;56(1):105949.
[31] Cassidy C, Dever D, Stanbery L, Edelman G, Dworkin L, Nemunaitis J. FDA efficiency for approval process of COVID-19 therapeutics. Infect Agent Cancer. 2020;15(1):73.
[32] Tang W, et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ. 2020;369:m1849.
[33] Emergency Use Authorization. Emergency Preparedness and Response2020, [EB/OL]. [2021-1-31]https://www.fda.gov/emergency-preparedness-andresponse/mcm-legal-regulatory-and-policy-framework/emergency-useauthorization.
作者介绍

贾举
首都医科大学儿科学硕士,北京协和医学院内科学博士研究生在读,师从中日友好医院曹彬教授,主要从事流感等呼吸系统感染性疾病相关研究工作。
本文完
排版:Jerry


