7月5日,引发北京、西安新一轮聚集性疫情的新冠病毒基因测序结果公布为奥密克戎变异株BA.5。7月8日,上海浦东新区报告1例社会面感染者的病毒为奥密克戎BA.5变异株,与境外输入相关。兵临城下、来势汹汹的新变种BA.5,R0值高达18.6,是人类有史以来传播力最强的病毒。世卫组织总干事谭德塞指出,BA.5正逐步成为全球范围内的主流毒株,更糟糕的是,BA.5具有更强的免疫逃逸能力,可能导致更多的感染和再感染发生。
新冠病毒的变异之旅:目前发展到了奥密克戎BA.5,其R0值高达18.6?
新冠病毒的结构很简单,蛋白质外壳加上遗传物质RNA。每个新冠病毒表面都有24~40 个刺突蛋白(又称S蛋白,见模式图),可以帮助病毒骗过人体免疫系统。新冠病毒要进入细胞,其突刺蛋白上的受体结合区域RBD,是打开细胞膜门锁的「钥匙」,它会与细胞上的ACE2受体结合,从而完成对细胞的入侵。当新冠病毒入侵人体细胞后,它携带的RNA就会开启疯狂复制模式。病毒在复制过程中随机出现的错误,可能导致核苷酸序列改变,这就是突变(Mutation)。可怕的是,新冠病毒作为RNA病毒,要比乙肝病毒等DNA病毒更容易发生突变。至今为止新冠病毒已经出现了上万种突变,当突变累积到一定程度,便会形成独特的变种(Variant),于是一种新的变异新冠毒株就产生了。
世界卫生组织从2020年1月起一直在监测和评估全球新冠病毒的变异,一张表格盘点既往和当前须密切关注的变异株:
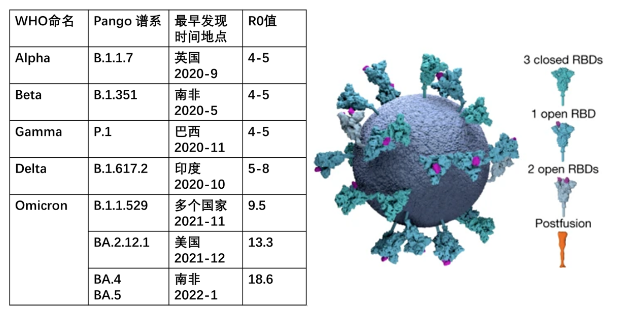
Alpha、Beta和Gamma变异毒株的刺突蛋白受体结构域中都存在N501Y突变,即第501位的氨基酸残基由天冬酰胺变成酪氨酸。该位点是受体结合域中的六个关键接触残基之一,N501Y突变增加了新冠病毒对血管紧张素转化酶ACE2蛋白的结合亲和力,进而增强病毒进入人体细胞的能力。
Delta变异株中最关键的突变有四处,均发生在病毒的刺突蛋白区域,分别是D614G,T478K, P681R和L452R,提高了病毒入侵细胞的能力,使得它的传染性增强,且增加了免疫逃逸能力。
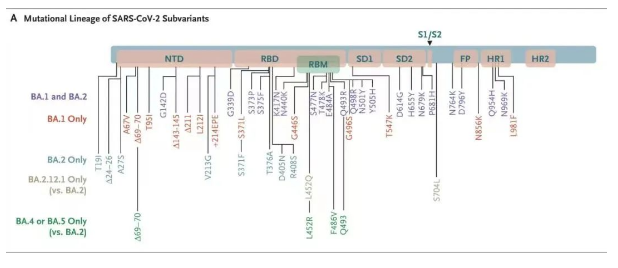
奥密克戎B.1.1.529最早于2021年11月在南非被发现。当时它被认为是「最危险的毒株」,是因为在它的刺突蛋白上发现了32处突变,导致其具有更强的传染性,奥密克戎毒株BA.1的传播速度比Delta增加约70%。仅仅过了1个月,奥密克戎就在美国进化出了第二代BA.2.12.1,在它的刺突蛋白基因上共检测到33个氨基酸突变位点,其中最关键的是L452Q。L452Q位于新冠病毒S蛋白的受体结合域,使得BA.2.12.1更容易发生突破性感染。前文提到Delta变异株有一个发生在同一位置的突变L452R,具有相同的作用。在原始的奥密克戎变异株出现的时候,并不携带L452突变,但在BA.2.12.1上,这一突变又出现了。因此BA.2.12.1可以说是叠加了奥密克戎与德尔塔的传播优势。
2022年1月,具有更多突变的BA.4和BA.5在南非横空出世,与之前的BA.1和BA.2相比,BA.5刺突蛋白的关键结构域RBD发生了三个突变——L452R、F486V和Q493,而这三个突变的直接后果就是BA.5的免疫逃逸能力和传播效率大大提升。评价病毒传播能力的主要指标是基本传染数(R0值),是指在人群无免疫力、没有采取防疫措施的情况下,一个病毒携带者感染的人数。在新冠大流行的初期,病毒的R0值约为3.3。随着病毒变异,其传染性不断增强。阿尔法变异毒株的R0值为4-5,德尔塔变异毒株的R0值为5-8。目前发展到了奥密克戎BA.5,其R0值高达18.6,超过了人类史上传染性最强的麻疹病毒(R0值18),而大家熟知的高传染性水痘,其R0值也才10。
人类对抗新冠病毒的两大利器:疫苗对BA.5还有效果吗?
BA.5变异毒株之所以更易传播,部分原因在于其较强的免疫逃逸能力。那么人类对抗新冠病毒的两大利器:疫苗对BA.5还有效果吗?近日Nature和NEJM分别刊登了关于BA.5的最新研究,结论则是「冰火两重天」。
哥伦比亚大学华裔科学家,「鸡尾酒疗法之父」何大一的研究团队在Nature发文,评估19种已上市的单抗类药物,其中18种对BA.5的中和活性被削弱,只有bebtelovimab的中和活性未受显著影响,这种现象可能与BA.5存在的F486V突变有关。此外,mRNA疫苗接种者血清(至少接种过三针)对BA.5的中和抗体滴度也同样显著下降。这些数据提示BA.5突破疫苗保护、导致重复感染的可能性很高。
而中国疾控中心主任高福团队在NEJM则发文称,接种国产重组蛋白疫苗ZF2001,并且将第二针与第三针的接种间隔延长到4-6个月,能使接种者对BA.5的中和抗体水平相对更高,这可能是国内应对BA.5最佳的接种策略。
新冠疫苗与病毒变异的博弈一直是魔高一尺道高一丈的较量。奥密克戎BA.1和BA.2时期,原来的疫苗接种方案虽然在预防感染方面有所不足,但对降低重症和死亡率仍有效果,尤其是强化第三针接种增加了这种保护作用。但是面对狡猾的BA.5,可能需要一些新的疫苗思路来应对。目前主流学术界有两种观点,一是WHO推荐以奥密克戎 BA.1为对象改进疫苗,二是美国FDA推荐直接以BA.5变异株为对象改进疫苗。两个方案都已启动,有望在今年冬季前推出新疫苗。
引起继发的细菌感染给救治带来更严峻的挑战
新冠病毒攻进人体后,除了造成上呼吸道感染和病毒性肺炎,还常常引起继发的细菌感染,从而导致患者出现更严重的症状,给救治带来更严峻的挑战。那么,为什么病毒感染后容易继发细菌感染呢?
第一个原因是病毒会破坏呼吸道的天然屏障。呼吸道的表面覆盖着上皮细胞,上皮细胞表面有一层黏液,可以吸附少量病毒和细菌,然后用柔软的纤毛将病原体扫地出门。当病毒大量入侵呼吸道时,上皮细胞坏死脱落,黏液浓缩变得粘稠,纤毛变得僵硬,清扫能力变弱,于是细菌乘虚而入并快速繁殖。
第二个原因是病毒会诱导人体免疫大军「自相残杀」。单纯的细菌感染时,人体免疫大军就会出动,各个部队(如巨噬细胞、中性粒细胞、淋巴细胞等)会相互协作,产生细胞因子和抗菌物质。同时还有一支免疫调节部队,在杀伤细菌之后,及时吹响收兵的号角,以防止免疫系统滥杀无辜。笔者在美国康奈尔大学医学院访学期间,曾发现受体相互作用蛋白RIPK3 介导的巨噬细胞程序性坏死是机体对抵御肺炎链球菌感染的一种有效的免疫防御机制:一方面分泌促炎细胞因子、募集免疫细胞,起到快速杀菌作用;另一方面吞噬清除死细菌和细胞碎片,防止过度的炎症反应,维持机体的免疫稳态。
可是当大量病毒入侵呼吸道上皮细胞后,机体的免疫系统会被病毒蒙蔽双眼,无法正确指挥免疫大军,从而产生过量的细胞因子,如肿瘤坏死因子、白介素等,而且收兵号不能及时吹响,反而对细胞造成过度伤害。如此便进一步创造了细菌感染的机会。
参考文献
1. Tracking SARS-CoV-2 variants. https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/.
2. Ke, Z, Oton, J, Qu, K. et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature, 2020.
3. Wang Q, Guo Y, Iketani S, et al. Antibody evasion by SARS-CoV-2 Omicron subvariants BA.2.12.1, BA.4, & BA.5. Nature, 2022.
4. Zhao X, Zhang R, Qiao S, et al. Omicron SARS-CoV-2 Neutralization from Inactivated and ZF2001 Vaccines. New England Journal of Medicine, 2022.
5. Huang HR, Cho SJ, Harris RM, et al. RIPK3 Activates MLKL-mediated Necroptosis and Inflammasome Signaling during Streptococcus Infection. Am J Respir Cell Mol Biol, 2021.
作者介绍

黄华蓉
上海市肺科医院呼吸与危重症医学科医师,2017年至2019年美国康奈尔大学医学院联合培养博士生。2019年同济大学医学院内科学博士毕业。研究方向:肺部感染与宿主免疫应答。


