本文亮点
1、免疫应答缺陷能区分重度与中度的COVID-19
2、重症COVID-19单核细胞抗原递呈通路基因表达较低
3、淋巴细胞毒性通路降低,B细胞活化减弱
4、干扰素信号在淋巴细胞中升高,但在单核细胞中减少
最近的研究表明,重症冠状病毒病(COVID-19)患者存在免疫功能障碍。
Yao等人使用单细胞RNA测序(scRNA-Seq)分析了来自健康(n=3)和COVID-19的中度疾病(n=5)、COVID-19的急性呼吸窘迫综合征(ARDS,n=6)或从ARDS(n=6)恢复的COVID-19患者外周血单个核细胞(PBMCs)的转录组数据。
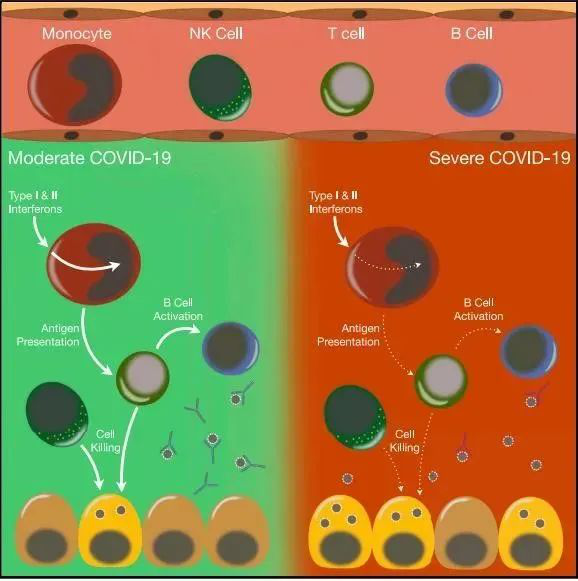
研究数据显示,ARDS患者单个核细胞的转录组学特征表明单核细胞中抗原呈递和干扰素(IFN)应答存在缺陷,这与在淋巴细胞中IFN信号的高反应性形成对比。此外,自然杀伤(NK)细胞和CD8+T淋巴细胞的参与细胞毒活性的基因都受到了抑制,B细胞活化也存在缺陷,这与重症COVID-19患者的病毒清除延迟是一致的。
研究表明存在ARDS的COVID-19患者存在免疫失衡,先天性和适应性免疫反应的失调可能导致更严重的疾病进程。
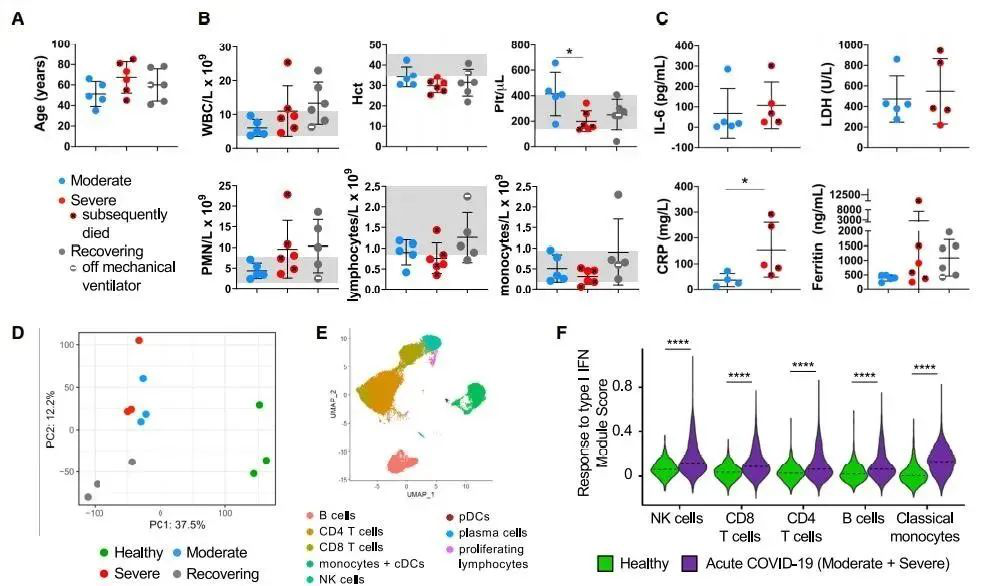
Figure 1. 中、重度(ARDS)以及恢复期(ARDS后)COVID-19患者的血细胞类型评估。(A) 各组住院COVID-19患者的年龄分布,最小呼吸支持(中度,n = 5), ARDS(重度,n = 6),恢复期(n = 6)。(B) 全血细胞计数,*p < 0.05. (C) 入院时外周血中炎症因子水平(恢复期患者没有IL-6, LDH和CRP的数据)*p < 0.05. (D) 患者与健康对照的外周血白细胞的单细胞RNA测序和主要成分分析(PCA)。(E)UMAP 可视化分析展示了主要免疫细胞的分型;(F)对I型IFN应答基因的表达评分;总体差异p < 2.2ⅹ1016, ****p < 0.0001.
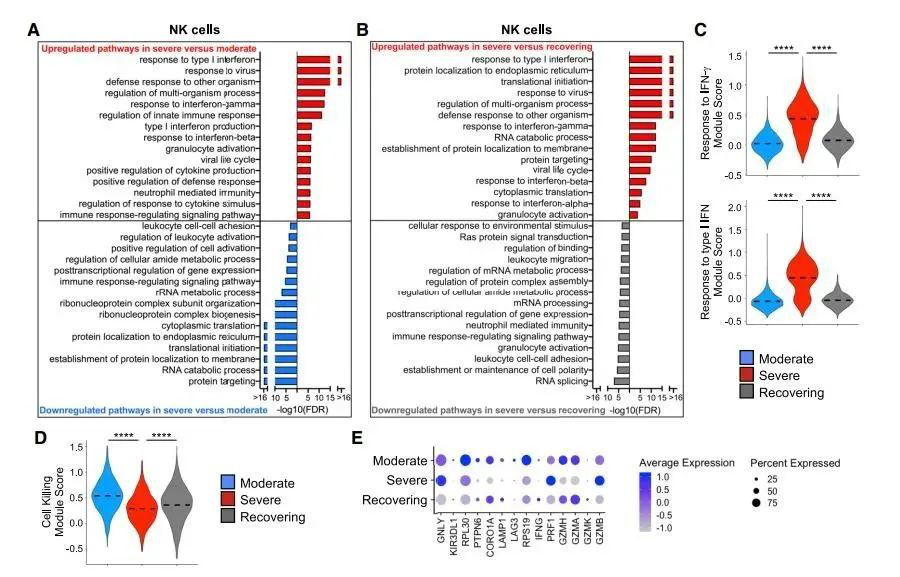
Figure 2. 重症患者中NK细胞的基因表达图显示高INF信号,但是存在细胞杀伤缺陷 (A和B) 。通过生物过程上调和下调通路的过表达分析,采用全部NK细胞来评估重度与中度患者(A)以及重度与恢复期患者的转录组学差异(B)。(C 和 D) 不同组别患者的细胞中INF-γ以及I型IFN 应答基因的表达评分(C)和细胞杀伤基因表达评分(D) ****p < 0.0001. (E) 不同患者组别中细胞毒基因的差异表达情况(DEGs)
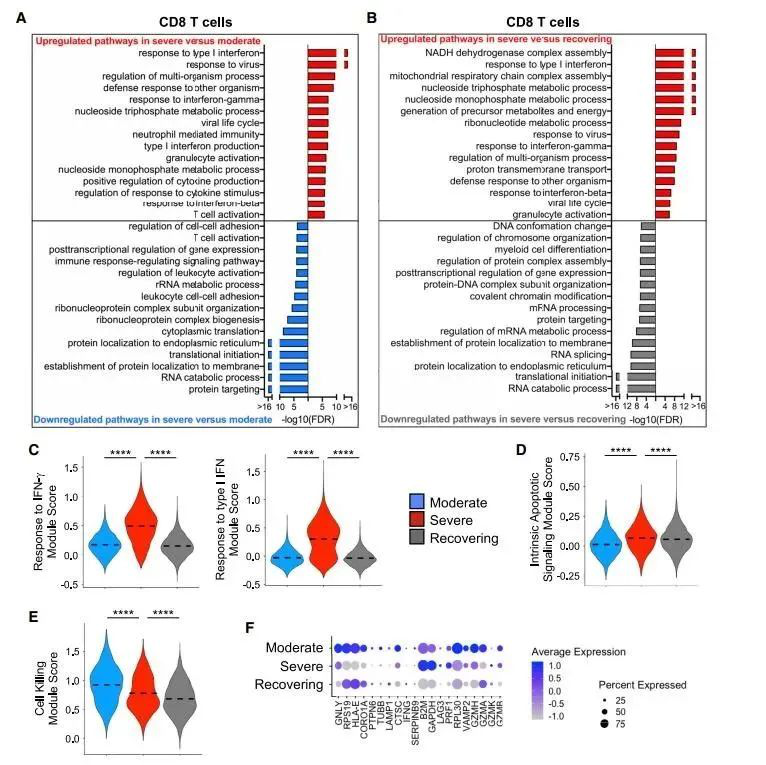
Figure 3.重症患者中CD8+T细胞的基因表达图显示高INF信号,凋亡基因表达升高,细胞杀伤缺陷(A和B)。通过生物过程上调和下调通路的过表达分析,采用全部CD8阳性T细胞来评估重度与中度患者(A)以及重度与恢复期患者的转录组学差异(B)。(C-E) 不同组别患者的细胞中对INF-γ的反应以及I型IFN 调控(C)内在凋亡信号调控(D)和细胞杀伤调控(E) ****p < 0.0001.(F)不同患者组别中细胞毒的差异性表达基因(DEGs).
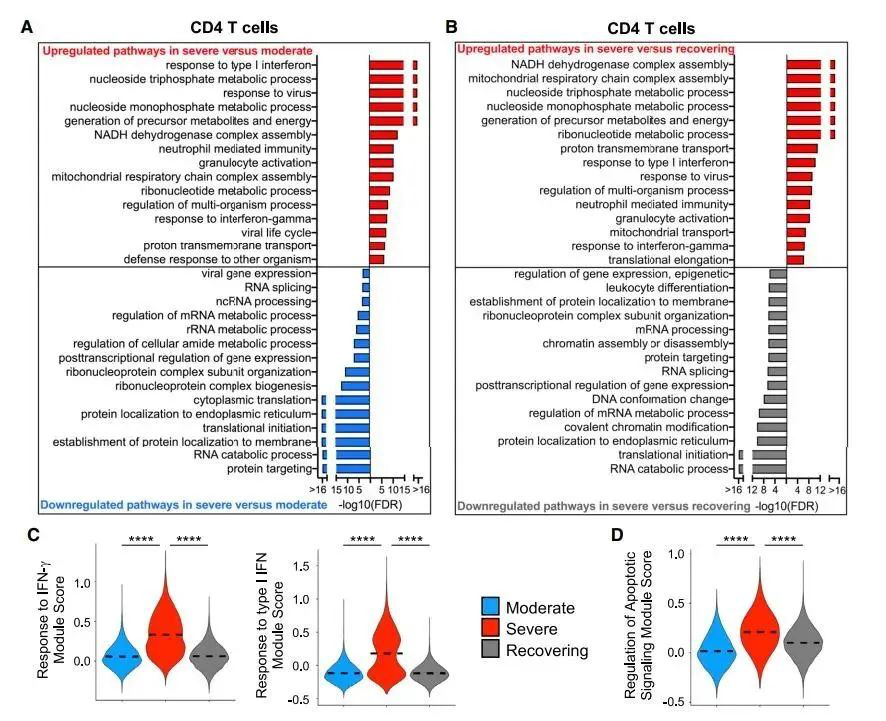
Figure 4. 重症组患者的CD4+T细胞基因表达谱表明IFN信号增高,凋亡调控基因表达增加(A和B)。通过对生物过程上调和下调途径的过度表达分析,评估重度和中度(A)以及重度和恢复期(B)之间的CD4+T细胞代谢活化(A和B)的整体转录组差异(C和D)。不同患者组别中每个细胞对IFN-g和I型IFN(C)的反应以及凋亡信号(D)的调节曲线图。p < 2.2ⅹ1016;****p < 0.0001.

Figure 5. B细胞在重症组患者的基因表达谱表明IFN信号更高,凋亡基因表达和代谢活性增加(A和B)。通过对生物过程上调和下调途径的过度表达分析,评估重度和中度(A)以及重度和恢复期(B)之间的B细胞和浆细胞中代谢活化的整体转录组差异(C和D)。不同患者组别中每个细胞对IFN-g和I型IFN(C)的反应以及凋亡信号(D)的调节曲线图。p < 2.2ⅹ1016;****p < 0.0001。(E)中度、重度和恢复期患者之间B细胞活化通路的DEGs平均表达。(F)IPA因素通路分析显示,SYK是B细胞中区分恢复期与重症组的上调通路的主要上游介质。

Figure 6. 重症组患者中的经典单核细胞中IFN信号、吞噬功能和抗原呈递的基因表达降低(A和B)。通过生物过程上调和下调通路的过表达分析,评估重度和中度(A)以及重度和恢复期(B)患者之间的经典单核细胞(CD14+CD16)整体转录组差异。(C–E)不同患者组别中,每个细胞对IFN-g和I型IFN(C)的反应、吞噬作用(D)和凋亡信号(E)模块的调节的小提琴图。p<2.2ⅹ1016;*****p<0.0001。(F)不同组别患者的经典单核细胞差异表达人类白细胞抗原(HLA)基因的平均表达。

Figure 7. 经典途径分析展示了重症COVID-19患者的所有免疫细胞中有缺陷的信号程序。(A)在所有细胞类型中,重度与中度和重度与恢复期患者之间激活或抑制的通路存在明显富集。FDR<0.01用于定义显著富集的通路,z评分用于确定严重状态下特定通路的激活/抑制状态。(B)DEGs的上游调控分析确定IRF7是所有细胞类型的关键调控基因。左上角:IRF7上游基因在不同类型免疫细胞间的表达模式。右上角:该网络的每个成员本身就是每个细胞类型中许多其他DEG的关键调控因子。底部:一份热图摘要,强调在重度和中度患者中,IRF7下游基因在每个免疫细胞群是被激活还是被抑制。(C)重症和恢复期组患者的mTOR经典通路。上调(红色)和下调(蓝色)的节点是基于所有细胞类型的复合信息。一些节点不代表单个DEG,但可能代表一个基因家族(例如,40S核糖体)。(D) eIF2通路的基因产物相互作用网络分析,与中度患者相比,重度患者的淋巴细胞中eIF2通路下调,但在单核细胞中不下调。大多数相互作用的节点在不同的细胞类型中有差异表达,特别是在中心显示的密集连接的网线中。
文献来源:Yao, Changfu et al. “Celltype-specific immune dysregulation in severely ill COVID-19 patients.” medRxiv: the preprint server for health sciences 2020.07.23.20161182. 24 Jul. 2020,doi:10.1101/2020.07.23.20161182. Preprint.
原文通讯作者团队
Dr. Sina A. Gharib,美国西雅图华盛顿大学附属港景医疗中心呼吸危重症与睡眠医学科教授;肺生物学中心计算医学中心主任。
Helen Goodridge,来自加州洛杉矶西奈医学中心生物医学科学部,免疫学家,研究领域为中性粒细胞、巨噬细胞和树突状细在免疫和炎症的作用。
Peter Chen,加州洛杉矶西奈医学中心呼吸与危重症医学科主任,专攻重症监护和呼吸病学;American Journal of Respiratory Cell and Molecular Biology 编委成员。
摘译:田欣伦、刘松
本文转载自公众号「帅府园论坛」
原链接戳:重症COVID-19患者的免疫紊乱


