
我们防治新冠的“武器库”又多了一件武器。
继去年12月国家药监局(NMPA)批准安巴韦单抗/罗米司韦单抗之后[1],今年2月12日,NMPA又批准了口服小分子抗新冠病毒药物奈玛特韦片/利托那韦片(Paxlovid)[2]。Paxlovid也成为第二个获得NMPA批准的新冠特效药。
这就意味着,我们已经拥有了疫苗、中和抗体和小分子药物这个三个防治新冠肺炎的有力武器。
在前面的几篇文章中,我们已经介绍了包括疫苗在内的新冠预防措施,这一篇文章我们将深入介绍中和抗体和小分子药物的作用机制和治疗效果,以及我们从中看到的战胜新冠的希望。
中和抗体的杀手锏——阻断新冠病毒感染人体细胞
新冠病毒感染人体细胞包括五步:吸附、释放遗传物质、复制增殖、组装和释放病毒粒子。其中吸附人体细胞是第一步,也是最关键的一步。
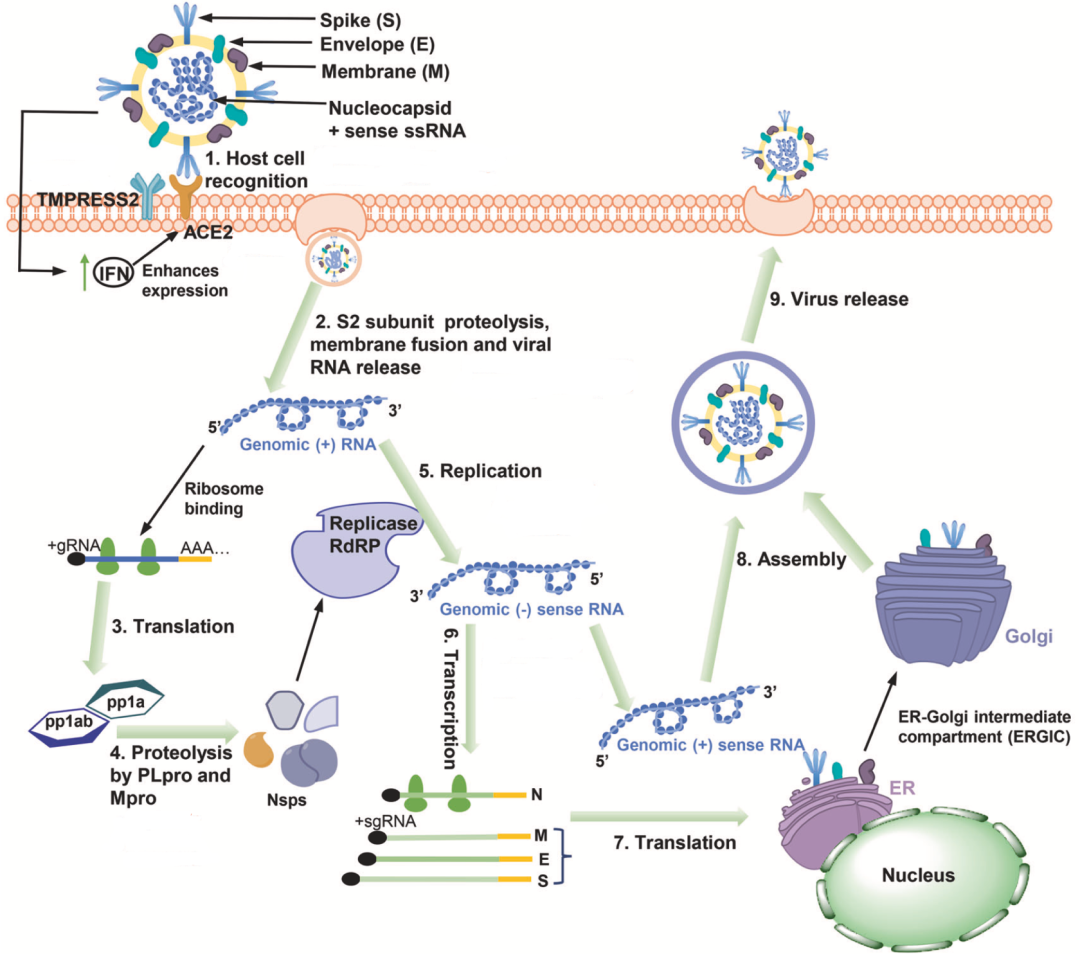
新冠病毒感染人体细胞的生命周期示意图[3]
众所周知,新冠病毒通过S蛋白受体结合区域(RBD)与宿主细胞血管紧张素转化酶2(ACE2)结合,完成吸附人体细胞这个动作。在RBD与ACE2结合之后,S蛋白的构像会发生变化,并被细胞表面的跨膜丝氨酸蛋白酶2(TMPRSS2)切割,导致融合肽(FP)暴露,在人体细胞膜上创建融合孔,新冠病毒随即将遗传物质注入人体细胞[4] 。
如果能在这一步阻断新冠病毒RBD与ACE2结合,就能有效阻止新冠病毒感染人体细胞,实现防治新冠肺炎的目的。靶向新冠病毒S蛋白的单克隆中和抗体,就是在这一思路下开发出来的。
实际上,除了上面描述的中和作用之外,单克隆中和抗体还有另外两个潜在的作用机制:其一是,单克隆中和抗体可以与表达病毒抗原性的被感染细胞结合,这会促进巨噬细胞吞噬、激活抗体及补体依赖的细胞凋亡,加速感染细胞清除;其二,单克隆中和抗体结合病毒后,可促进病毒被巨噬细胞吞噬清除[5]。
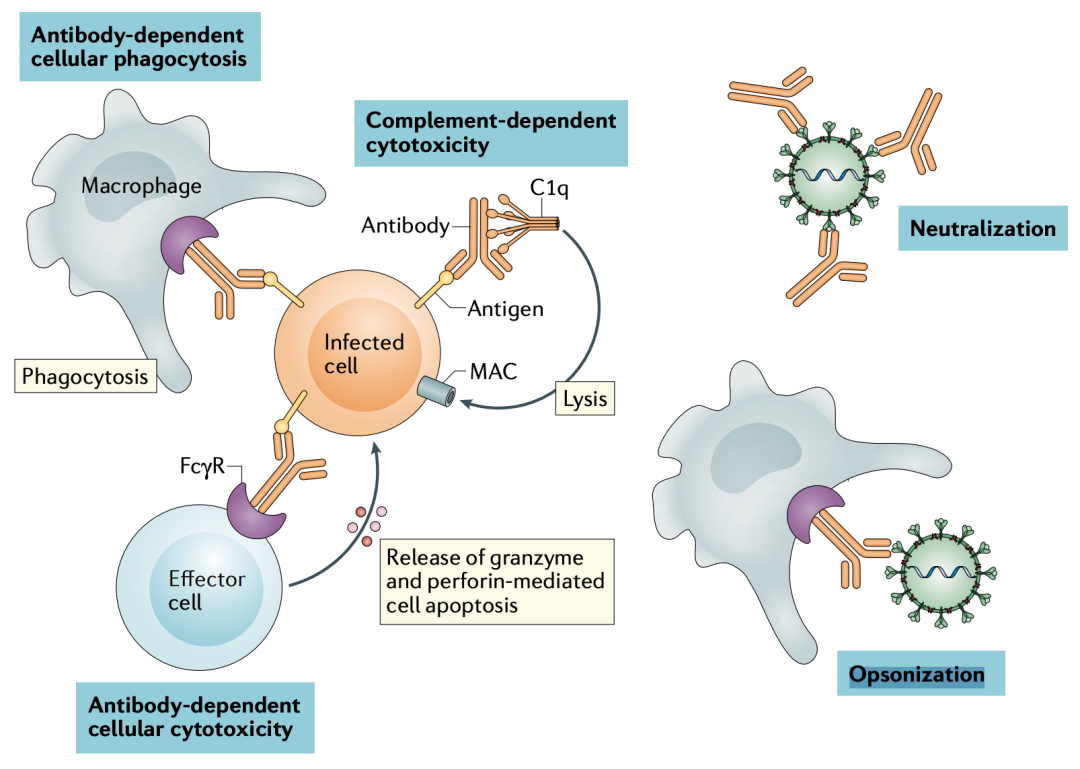
中和抗体的作用机制示意图[5]
拿唯一在我国获批的单克隆抗体组合安巴韦单抗/罗米司韦单抗来说,它们的前身是从众多与RBD特异性结合单抗中挑选出来的一对活性高、互补性强的中和抗体[6]。
从作用机制上看,安巴韦单抗与RBD结合后,会促进S蛋白中包含RBD的S1部分快速从新冠病毒上脱落[7],进而导致新冠病毒无法进入细胞内部[8]。
至于罗米司韦单抗,有研究团队发现,结合位点与罗米司韦单抗相同的抗体,可抑制病毒与细胞发生膜融合所必须的S蛋白重排,从而阻止病毒入侵细胞[9-12]。
也就是说,安巴韦单抗/罗米司韦单抗这对组合能从两个方面发挥中和作用,阻止新冠病毒感染人体细胞。
小分子药物的杀手锏——阻断新冠病毒的复制增殖
如果新冠病毒顺利完成了吸附和遗传物质的注入,那么它们就进入了生命周期的下一个重要阶段。
从现有的研究来看,新冠病毒的遗传物质(正单链RNA)进入细胞之后,会被人体细胞的核糖体翻译成两种聚合蛋白——pp1a和pp1ab,此时负责切割这两种聚合蛋白的酶——Mpro——会以自溶性切割的方式脱落下来[13]。
随后,自行脱落的Mpro会去切割pp1a和pp1ab这两个聚合蛋白,并产生十余个对新冠病毒基因组复制至关重要的非结构性蛋白[14]。因此,如果能开发出一种抑制Mpro活性的小分子,就有希望阻断新冠病毒在人体细胞内的复制。
好消息是,新冠病毒的Mpro与2002年爆发的SARS-CoV-1病毒的序列同源性为100%[14]。科学家为了应对SARS-CoV-1病毒,已经开发出了Mpro的小分子抑制剂——PF-00835231[14]。在这个小分子的基础上,科学家们开发出了可以口服的PF-07321332[14],也就是Paxlovid的主要成分奈玛特韦。
奈玛特韦的作用机制很好理解,它就是抑制Mpro的活性,导致pp1a和pp1ab这两个聚合蛋白无法被切割,因此参与新冠病毒基因组复制的酶无法形成,新冠病毒的复制也就戛然而止了。不过,由于奈玛特韦通过肝脏CYP3A代谢,半衰期短,为了提高奈玛特韦的治疗浓度,研究人员给奈玛特韦搭配了CYP3A强抑制剂利托纳韦[14]。Paxlovid就是二者的组合。
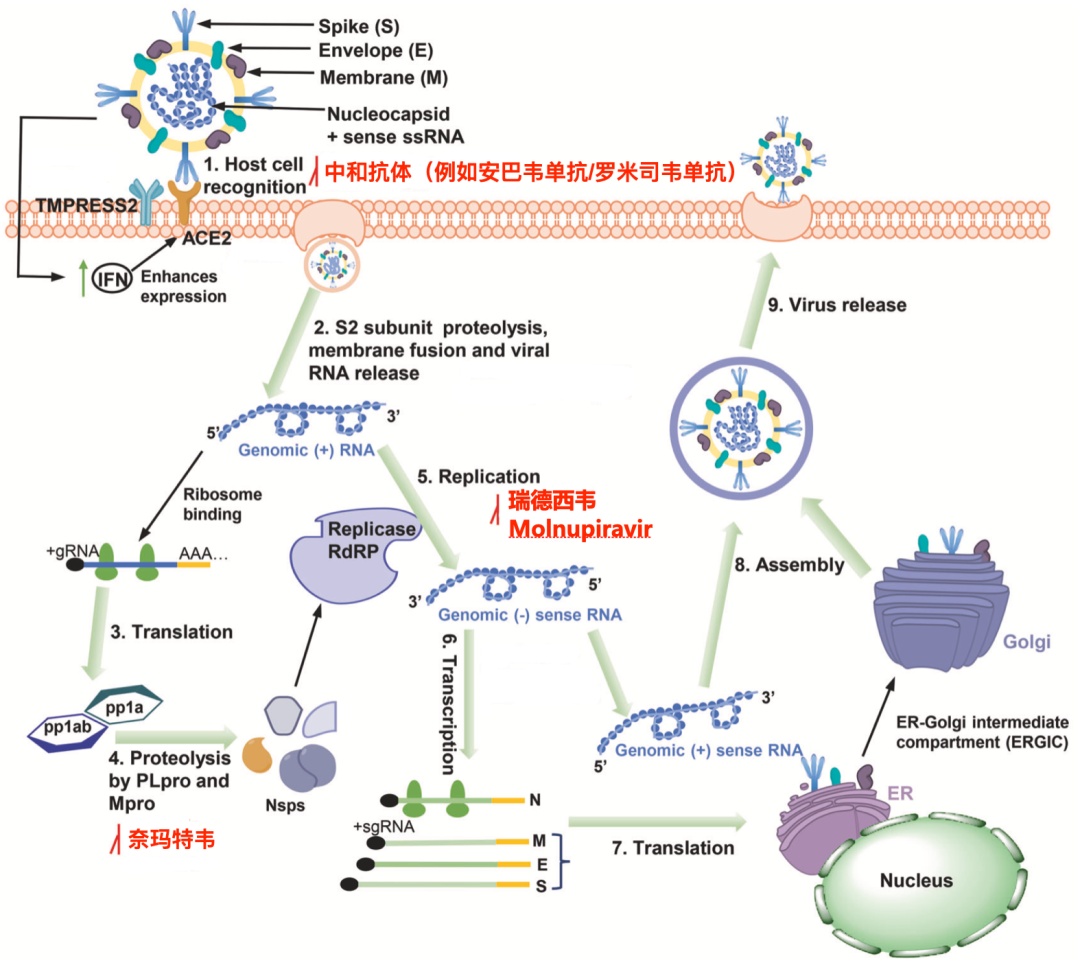
中和抗体和小分子药物的作用位点[3]
如果新冠病毒Mpro的活性正常,那么病毒基因组复制的重要机器RNA依赖的RNA聚合酶(RdRp)就会诞生。在RdRp的帮助下,新冠病毒才能完成基因组的复制。因此这个过程也是阻止新冠病毒复制的关键点。
已经获得美国FDA批准的核苷酸类似物Remdesivir和Molnupiravir,就是在这个过程中发挥抗病毒的作用。
简单来讲,在RNA的复制过程中,Remdesivir会模拟ATP进入复制机器RdRp中,卡在RdRp和模版RNA之间,导致RNA的合成终止,达到抑制病毒复制的目的[15]。
而Molnupiravir的结构比较灵活,在新冠病毒的合成过程中,它能模拟CTP和UTP插入到新冠病毒的RNA中[16,17],导致“致命诱变”,实现抑制新冠病毒的复制增殖的目的。
从抗病毒机制来看,中和抗体和三种小分子药物各有所长,而且几乎没有重叠。那么它们的治疗效果究竟如何呢?
“能捉老鼠的都是好猫”
我们先以安巴韦单抗/罗米司韦单抗为例来回顾一下单克隆中和抗体的临床疗效。
评估安巴韦单抗/罗米司韦单抗联合疗有效性的ACTIV-2是一项全球多中心、随机、双盲2/3期临床研究[18],入组患者为出现症状不超过10天、非住院、且有发展为重症风险因素的成年新冠患者。
从腾盛博药在2021 IDweek上发表的中期分析报告显示,与安慰剂组相比,安巴韦单抗/罗米司韦单抗治疗组患者的住院及死亡风险降低78%(P值=0.00001)[19]。具体来讲,在症状出现后5天内接受安巴韦单抗/罗米司韦单抗联合疗法治疗的受试者中,有2%进展为住院或死亡,而安慰剂组为11%;同样,在症状出现后6至10天接受安巴韦单抗/罗米司韦单抗联合疗法治疗的受试者中,有2%进展为住院或死亡,而安慰剂组的受试者中,这一比例为11%[19]。
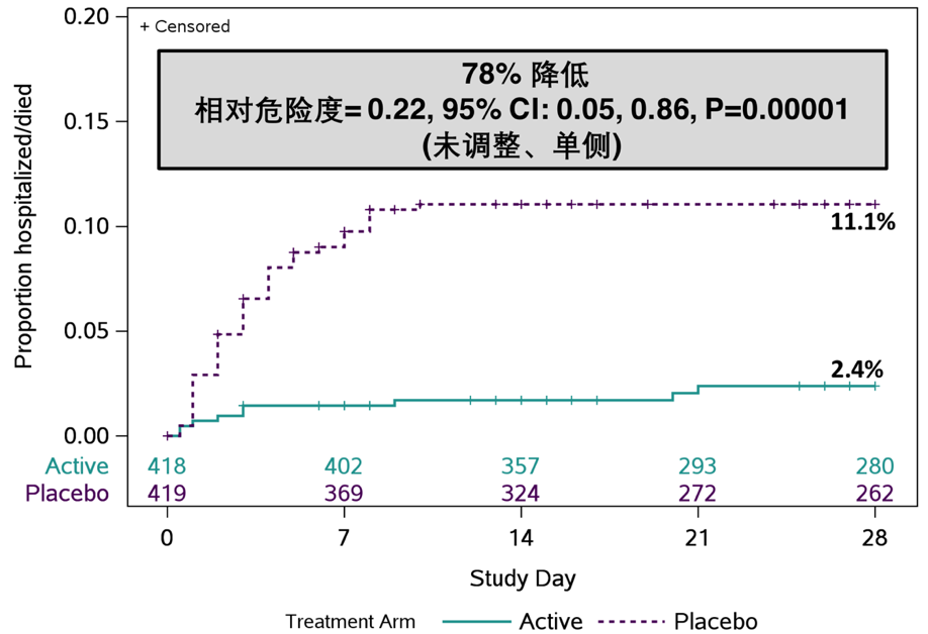
第28天时住院/死亡的累计发生率(图示为8月25公布的研究中期分析数据)
12月5日发布的三期最终分析数据显示,安巴韦单抗/罗米司韦单抗治疗组患者的住院及死亡风险降低80%(P值<0.00001),治疗组受试者在28天的治疗期内无死亡病例,而安慰剂组有9例死亡[20]。
再来看看小分子药物的疗效。
从已经发布的临床研究论文来看[21],Paxlovid的2/3期临床试验EPIC-HR招募对象的是:发病不超过5天、具有至少一个进展为重症的高危因素、且未接种疫苗的门诊成人患者。
最终有2246名患者被随机分成了两组,其中1120名患者接受300毫克奈玛特韦联合100毫克利托那韦治疗(Paxlovid组),余下1126名患者接受安慰剂治疗(安慰剂组)。两组患者都是每12小时口服给药一次,连续5天,研究终点之一是评估第28天的新冠相关住院或全因死亡。
从研究结果来看,在症状出现5天内开始治疗的患者,到第28天,Paxlovid组新冠相关的住院或全因死亡的发生率为0.77%,安慰剂组的这一数据为6.31%。这意味着Paxlovid组新冠相关住院或全因死亡的相对风险降低了87.8%(P<0.001)。

在症状出现5天内开始治疗的患者,第28天的新冠相关住院或全因死亡
与Paxlovid一样,Molnupiravir的3期临床试验MOVe-OUT招募的患者也是发病不超过5天、具有至少一个进展为重症的高危因素、且未接种疫苗的门诊成人患者[22]。共有1433名参与者接受了随机分组。在对所有接受随机分组的参与者进行的分析后,Molnupiravir组在第29天住院或死亡发生率为6.8%,安慰剂组这一数据为9.7%,相对风险下降30%。
Remdesivir的3期临床试验PINETREE与前面的两个稍有不同,它纳入了12岁及以上、发病不超过7天、具有至少一个进展为重症的高危因素、且未接种疫苗的门诊患者[23]。
在筛选的630名患者中,最终562名接受了随机分组,并接受至少一次Remdesivir或安慰剂输注。分析结果表明,第28天时,Remdesivir组和安慰剂组发生新冠相关住院或全因死亡的比例分别为0.7%和5.3%(风险比,0.13;P=0.008)。这意味着,接受Remdesivir治疗的患者住院或死亡风险下降87%。
从临床数据来看,在以上四种药物中,Molnupiravir疗效一般,Remdesivir需要输注三天,便捷性较差;余下的安巴韦单抗/罗米司韦单抗和Paxlovid疗效相似,不过二者也存在一些差异。
例如,接受安巴韦单抗/罗米司韦单抗治疗的患者发病时间在10天之内,而接受Paxlovid治疗的患者发病时间在5天之内,这意味着安巴韦单抗/罗米司韦单抗的应用时间窗更长;另外,从对照组的累计住院/死亡发生率来看,ACTIV-2研究是11%,比EPIC-HR研究的6.31%高,这意味着ACTIV-2研究入组的患者病情可能更重。
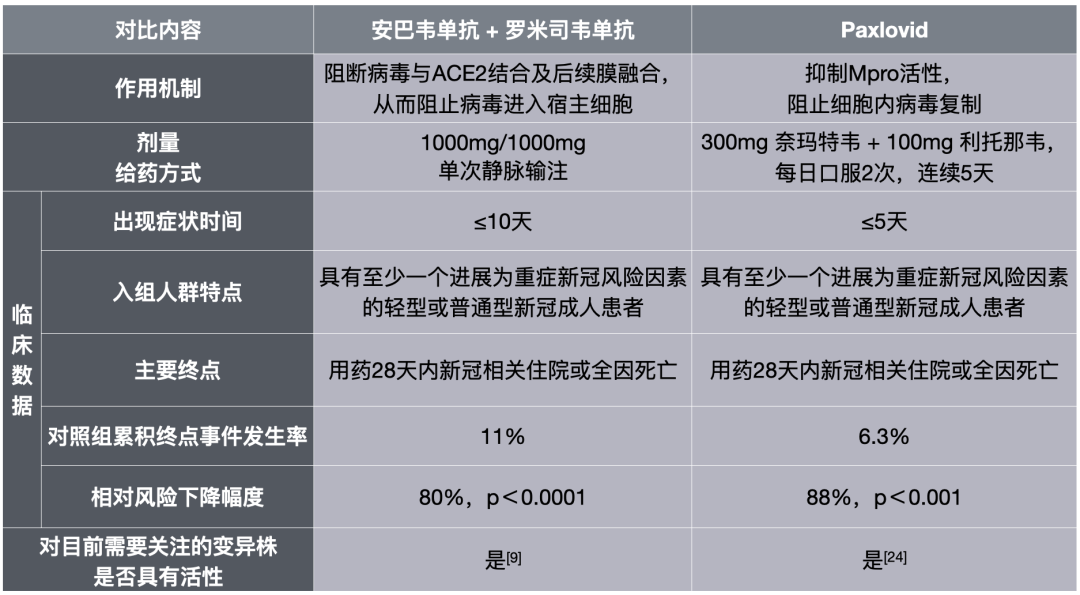
安巴韦单抗/罗米司韦单抗组合与Paxlovid的比较
不同的药物究竟怎么用?NIH发布了一份参考意见
既然中和抗体和小分子药物的疗效相似,那么临床上究竟该如何选择呢?
实际上,从2020年4月开始,美国国立卫生研究院(NIH)的新冠肺炎治疗指南小组就开始不间断地更新新冠肺炎的治疗指南了。
由于Omicron突变株已经成为全球的主要流行毒株,因此,今年的1月19日,NIH的新冠肺炎治疗指南小组对新冠肺炎的治疗指南做了相应的更新[25]。
在这份针对Omicron突变株的最新指南中,对于存在高危因素的轻至中度新冠肺炎患者,NIH推荐了4种已经获得FDA批准的药物:Paxlovid(AIIa)、Sotrovimab(AIIa)、Remdesivir(BIIa)和Molnupiravir(CIIa)。
之前获批的Bamlanivimab/Etesevimab和Casirivimab/Imdevimab组合,因为基础研究显示它们对Omicron突变株的活性降低,在最新的指南中就不再推荐使用。而FDA批准的中和抗体中,对Omicron突变株保持活性的只有Sotrovimab,因此最新版的指南推荐的中和抗体只保留了Sotrovimab。
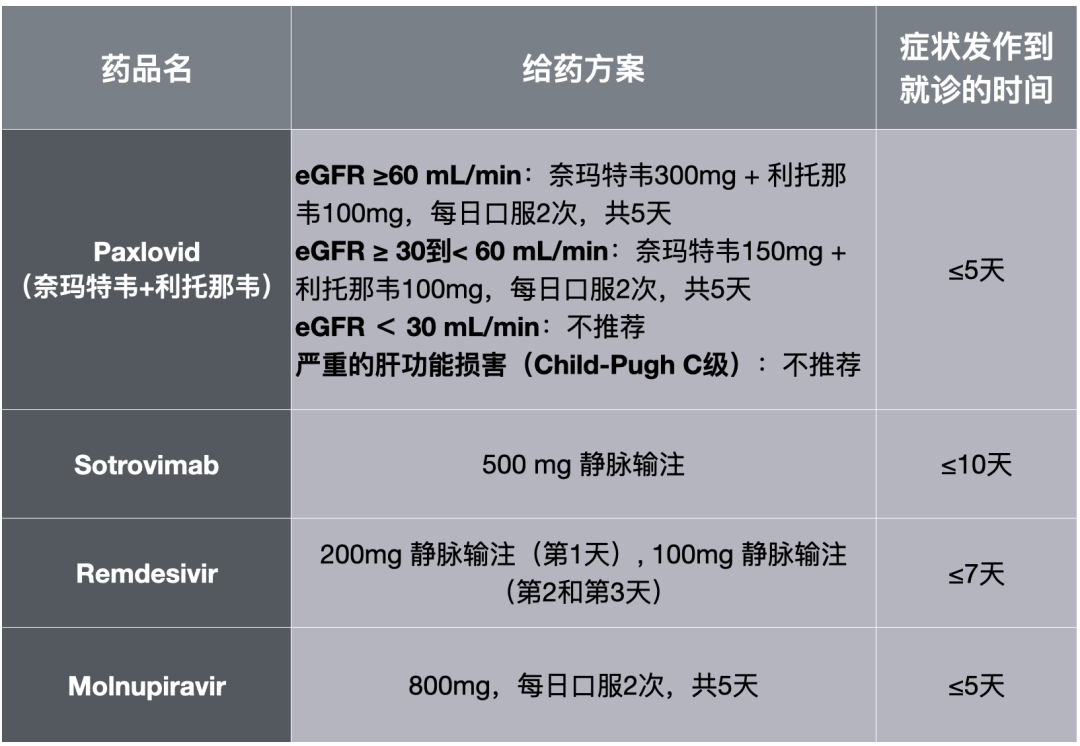
FDA推荐使用的药物及使用限制条件
从上表不难看出,在临床上使用上述4种药物不仅需要考虑患者症状发作到就诊的时间,还需要考虑患者的肾功能。
此外,需要指出的是,Paxlovid包含的利托那韦是CYP3A的强抑制剂,而生活中很多常用的药物是通过CYP3A代谢的,它可能会增加这些药物的毒性。此外,还有一些药物(例如利福平等)能增强CYP3A的活性,这些药物与Paxlovid联用可能会降低奈玛特韦的血药浓度。在最新更新的治疗指南中,NIH也明确列出了不能与Paxlovid同时使用,或需要调整剂量的药物[26]。

NIH对Paxlovid合并用药的建议
结合以上内容不难看出,临床上治疗具有高危因素的中轻度新冠患者时需要考虑的因素比较多。如果患者出现症状超过10天,目前还没有可用的药物;7到10天只有中和抗体可以使用;7天以内有多种选择,不过需要进一步评估,例如患者的肾功能,以及正在使用的药物与治疗新冠的药物之间是否存在相互作用等。总的来看,中和抗体受到的限制更少,使用范围要更广一些。
实际上,为了让治疗流程更清晰规范,美国卫生与公众服务部(HHS)的备灾和响应事务助理部长办公室(ASPR)制作了如下图所示的轻中症新冠肺炎患者治疗路径图[27]。
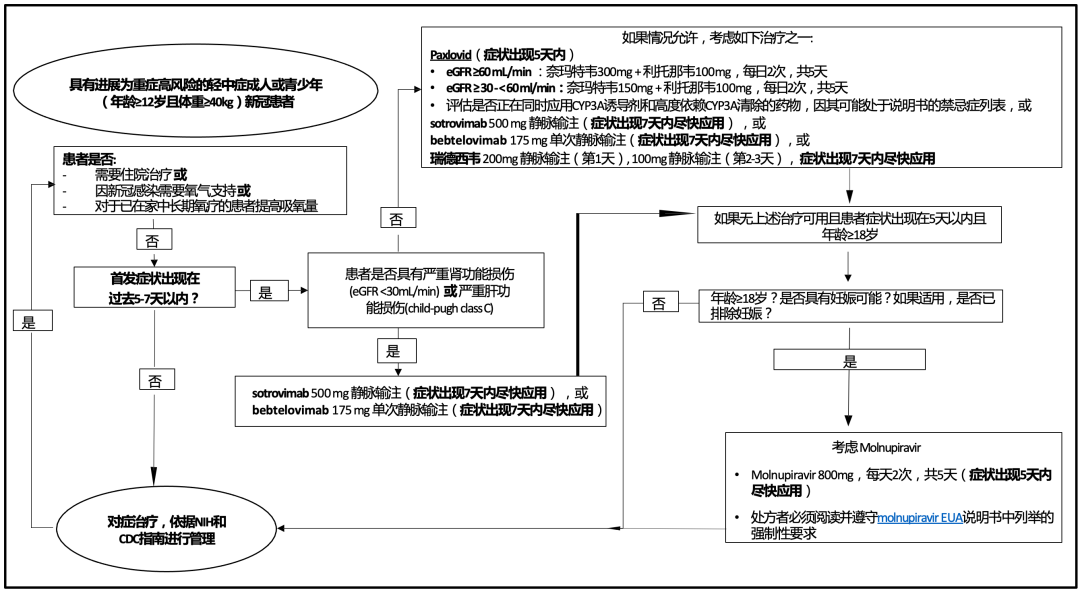
轻中症新冠肺炎患者治疗路径图[27]
从我国的情况来看,目前获批的治疗药物有安巴韦单抗/罗米司韦单抗组合和Paxlovid。与NIH的建议类似,NMPA在批准Paxlovid时也强调,“患者应在医师指导下严格按说明书用药,使用中应高度关注说明书中列明的与其他药物相互作用信息”。
总的来说,从以上的临床研究数据来看,已经获批上市的药物基本都能有效地治疗轻中度新冠肺炎,显著降低患者的住院和死亡风险。而且,从基础研究来看,这些药物的作用机制并不重叠,这也提示这些药物之间或许有互补的作用。
未来,科学家可以探索不同作用机制药物的联用,或许能收到意想不到的效果。这也就是我们说“看到战胜新冠的希望”的原因。
无论如何,期待未来能有更多安全有效的药物获批,让新冠病毒“无处安身”。
参考文献
[1].https://www.nmpa.gov.cn/yaowen/ypjgyw/20211208212528103.html
[2].https://www.nmpa.gov.cn/yaowen/ypjgyw/20220212085753142.html
[3].Yan W, Zheng Y, Zeng X, et al. Structural biology of SARS-CoV-2: open the door for novel therapies[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 1-28.
[4].Jackson C B, Farzan M, Chen B, et al. Mechanisms of SARS-CoV-2 entry into cells[J]. Nature Reviews Molecular Cell Biology, 2022, 23(1): 3-20.
[5].Taylor P C, Adams A C, Hufford M M, et al. Neutralizing monoclonal antibodies for treatment of COVID-19[J]. Nature Reviews Immunology, 2021, 21(6): 382-393.
[6].Ju B, Zhang Q, Ge J, et al. Human neutralizing antibodies elicited by SARS-CoV-2 infection[J]. Nature, 2020, 584(7819): 115-119.
[7].Ge J, Wang R, Ju B, et al. Antibody neutralization of SARS-CoV-2 through ACE2 receptor mimicry[J]. Nature communications, 2021, 12(1): 1-9.
[8].Wec A Z, Wrapp D, Herbert A S, et al. Broad neutralization of SARS-related viruses by human monoclonal antibodies[J]. Science, 2020, 369(6504): 731-736.
[9].Liu L, Iketani S, Guo Y, et al. Striking Antibody Evasion Manifested by the Omicron Variant of SARS-CoV-2[J]. nature, 2021.
[10].Piccoli L, Park Y J, Tortorici M A, et al. Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology[J]. Cell, 2020, 183(4): 1024-1042. e21.
[11].Corti D, Purcell L A, Snell G, et al. Tackling COVID-19 with neutralizing monoclonal antibodies[J]. Cell, 2021.
[12].Lempp FA, Soriaga LB, Montiel-Ruiz M, et al. Lectins enhance SARS-CoV-2 infection and influence neutralizing antibodies. Nature. 2021;598(7880):342-347.
[13].Jin Z, Du X, Xu Y, et al. Structure of Mpro from SARS-CoV-2 and discovery of its inhibitors[J]. Nature, 2020, 582(7811): 289-293.
[14].Owen D R, Allerton C M N, Anderson A S, et al. An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19[J]. Science, 2021, 374(6575): 1586-1593.
[15].Tchesnokov EP, Feng JY, Porter DP, Götte M. Mechanism of Inhibition of Ebola Virus RNA-Dependent RNA Polymerase by Remdesivir. Viruses. 2019;11(4):326. Published 2019 Apr 4. doi:10.3390/v11040326
[16].Urakova N, Kuznetsova V, Crossman DK, et al. β-d-N4-Hydroxycytidine Is a Potent Anti-alphavirus Compound That Induces a High Level of Mutations in the Viral Genome. J Virol. 2018;92(3):e01965-17. Published 2018 Jan 17. doi:10.1128/JVI.01965-17
[17].Kabinger F, Stiller C, Schmitzová J, et al. Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis. Nat Struct Mol Biol. 2021;28(9):740-746. doi:10.1038/s41594-021-00651-0
[18].https://clinicaltrials.gov/ct2/show/NCT04518410
[19].Teresa Evering. Oral presentation. IDWeek 2021 Virtual Conference, Sep 29 – Oct 3
[20].安巴韦单抗注射液说明书/罗米司韦单抗注射液说明书(2021年12月8日)
[21].Hammond J, Leister-Tebbe H, Gardner A, et al. Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19[J]. New England Journal of Medicine, 2022.
[22].Jayk Bernal A, Gomes da Silva M M, Musungaie D B, et al. Molnupiravir for oral treatment of Covid-19 in nonhospitalized patients[J]. New England Journal of Medicine, 2022, 386(6): 509-520.
[23].Gottlieb R L, Vaca C E, Paredes R, et al. Early remdesivir to prevent progression to severe covid-19 in outpatients[J]. New England Journal of Medicine, 2021.
[24]. Vangeel L, Chiu W, De Jonghe S, et al. Remdesivir, Molnupiravir and Nirmatrelvir remain active against SARS-CoV-2 Omicron and other variants of concern[J]. Antiviral Research, 2022: 105252.
[25].https://www.covid19treatmentguidelines.nih.gov/therapies/statement-on-therapies-for-high-risk-nonhospitalized-patients/
[26].https://www.covid19treatmentguidelines.nih.gov/therapies/statement-on-paxlovid-drug-drug-interactions/
[27].https://www.phe.gov/emergency/events/COVID19/therapeutics/Documents/COVID-Therapeutics-Decision-Aid.pdf
本文内容来源自「奇点网」,作者:BioTalker


