12月8号,注定是中国抗击新冠疫情的历史性时刻。
腾盛华创研发的抗新冠单克隆抗体组合安巴韦单抗/罗米司韦单抗(BRII-196/BRII-198)正式获得国家药品监督管理局(NMPA)批准,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12—17岁,体重≥40kg)新型冠状病毒感染(COVID-19)患者。其中,青少年(12—17岁,体重≥40kg)适应症人群为附条件批准,暂无临床试验数据,有效性和安全性尚待进一步最终确证[1]。

▲ 国家药品监督管理局官网截图
这不仅意味着,历时20个月的研发之后,我国有了第一个抗新冠的「特效药」;也标志着我国抗击新冠疫情进入了有特效药可用的全新阶段。
接下来,咱们就一起来看看中国首个抗新冠特效药究竟是如何诞生的。
从新冠患者体内找到一对「最能打」的中和抗体
中国对新冠疫情的响应可谓神速。
两年前,新冠疫情爆发之后,奋战在临床一线的医生与全国各地的科学家迅速展开合作。在疫情爆发不到一个月的时间内,也就是2020年1月10日,中国科学家即发布了全球首个新冠病毒的基因组测序结果。这给新冠的诊断、治疗和预防奠定了基础。
在新冠病毒基因组发布的一两周后,中国科学院上海巴斯德研究所[2]和武汉病毒研究所[3]先后发布的研究成果表明:新冠病毒感染人体细胞取决于病毒刺突蛋白受体结合区域(RBD)与宿主细胞上血管紧张素转化酶2(ACE2)受体的结合。
这些研究成果意味着:阻断新冠病毒RBD与人体细胞ACE2受体的结合,是防治新冠的关键所在。
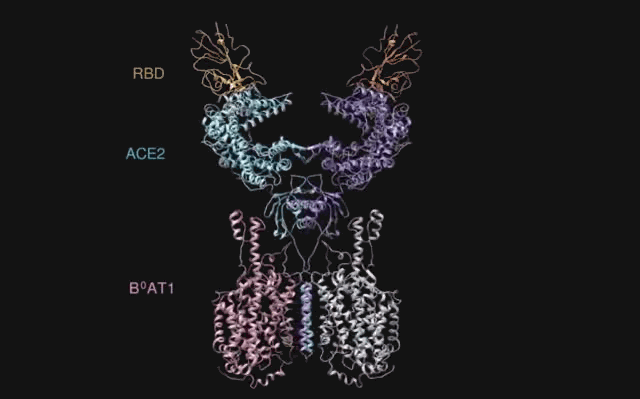
▲ S蛋白的RBD与ACE2结合的动图
其后不久,2020年3月,腾盛博药,清华大学和深圳市第三人民医院(深圳三院)宣布成立腾盛华创,迅速组织攻关团队,着手进行新冠抗体的研发工作。
最终,在对众多人源特异性单克隆抗体与RBD结合能力及结合RBD区域进行了详细分析之后,确定了一对活性最高、互补性超强的中和抗体,它们就是安巴韦单抗/罗米司韦单抗的前身P2C-1F11/P2B-1G5[4]。两个抗体的联合疗法不仅可以降低治疗中产生耐药病毒株的风险,同时更有可能对多个新发变异株保持中和活性。
从作用机制上看,P2C-1F11与RBD结合后,会促进包含RBD的S1部分快速从新冠病毒上脱落[5],进而导致新冠病毒无法进入细胞内部[6]。
更厉害的是,在Delta突变株等变种出现之后,清华大学张林琦团队测试了28种新冠突变类型对12种中和抗体的影响[7],结果发现:P2C-1F11对当时发现的所有突变株都具有中和活性,不愧为「最能打」的中和抗体。
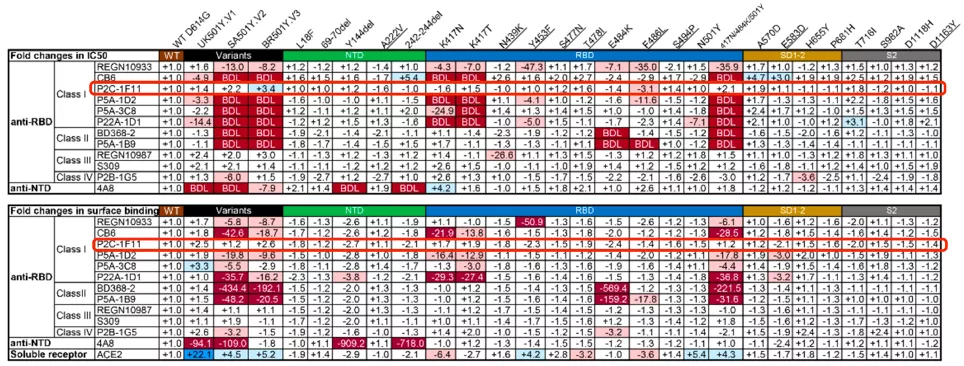
▲ P2C-1F11对当时发现的所有突变株都有中和活性
超长「待机」,保护效果升级,为预防奠基
尽管P2C-1F11/P2B-1G5已经展现出强大的中和新冠病毒能力,研究人员对它们还有更高的期待,那就是提高中和抗体的半衰期,延长对患者的保护时间。通俗地讲,就是得具备「超长待机」的能力。
从已经发表的数据来看,P2C-1F11/P2B-1G5作为全人源IgG1抗体,半衰期在20天左右[8],不具备提供长期保护的能力,显然还需要改造升级。
我们先来看看IgG类抗体的结构。一般来讲,IgG类抗体可以简单地分成两部分,一部分是抗原结合段(Fab),也就是抗体分子的两个臂,它的作用是识别并结合特定的抗原;剩下的部分叫可结晶段(Fc),是抗体与效应分子或者细胞相互作用的部位,Fc段与抗体的半衰期密切相关。
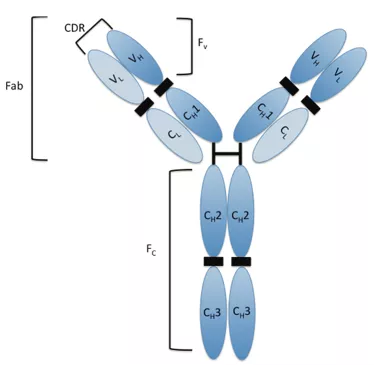
▲ IgG类抗体的结构示意图
已有众多研究证明,Fc的三个氨基酸(M252Y/S254T/T256E [YTE])突变,会大幅延长抗体的半衰期[9]。因此,腾盛华创的研究人员给P2C-1F11/P2B-1G5的Fc段做了YTE改造,安巴韦单抗/罗米司韦单抗就正式诞生了。
改造后,安巴韦单抗/罗米司韦单抗的半衰期是普通抗体的2-3倍,即从21天延长到46-76天[10]。这种「超长待机」的能力,为安巴韦单抗/罗米司韦单抗以后用于预防新冠感染的临床研究打下了坚实的基础。
值得一提的是,从筛选中和抗体,到安巴韦单抗/罗米司韦单抗完成升级,仅用了短短半年时间。2020年7月,安巴韦单抗/罗米司韦单抗正式获得中国临床批件,完成首次人体给药。
住院/死亡风险降低80%,疗效居世界前列
那么安巴韦单抗/罗米司韦单抗的疗效究竟如何?与国外已获批的中和抗体疗法相比,又有哪些独到之处呢?
要解答上面这两个问题,我们得从今年1月份,由美国国立卫生研究院(NIH)下属国家过敏症和传染病研究所(NIAID)主导的ACTIV-2研究说起。
ACTIV-2是一项全球多中心、随机、双盲2/3期临床研究[11],评估安巴韦单抗/罗米司韦单抗联合疗法对有症状、非住院、且有发展为重症风险因素的成年新冠患者的安全性和有效性。
这个研究于2021年的1到7月之间(Delta和Lambda流行期),在全球范围内招募了847例患者,所有受试者按照1:1随机分组,最终837例患者分到抗体治疗组或安慰剂组。
8月25日,腾盛博药发布中期分析数据显示,与安慰剂组相比,安巴韦单抗/罗米司韦单抗治疗组患者的住院及死亡风险降低78%(P值<0.00001);12月5日发布的三期最终分析数据显示,安巴韦单抗/罗米司韦单抗治疗组患者的住院及死亡风险降低80%(P值<0.00001),治疗组受试者在28天的治疗期内无死亡病例,而安慰剂组有9例死亡[12]。
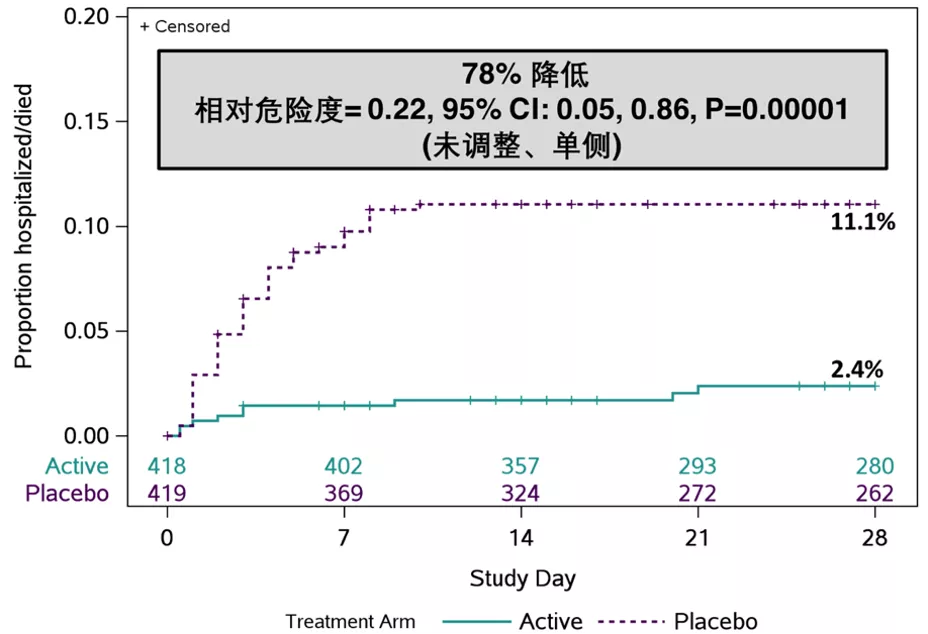
▲ 第28天时住院/死亡的累计发生率(图示为8月25公布的研究中期分析数据)
从有效性数据上看,与已经获得FDA紧急使用授权的Etesevimab/Bamlanivimab [13]、Casirivimab/Imdevimab[14]和Sotrovimab[15,16]相比,安巴韦单抗/罗米司韦单抗毫不逊色,达到了世界一流水平。
而且值得一提的是,与上述药物的临床研究相比,ACTIV-2研究对照组患者的住院/死亡累计发生率更高,提示入组患者病情更重。此外,接受安巴韦单抗/罗米司韦单抗治疗的患者从发病到入组的时间为≤10天,相对其他研究更长[13-16]。
不难看出,在取得同等水平疗效数据的情况下,安巴韦单抗/罗米司韦单抗治疗的患者病情更严重,而药物治疗有效的应用时间窗更长,更加符合实际临床操作,因此这一组合有可能在抗疫中发挥更大的作用。
从治疗到预防,潜力无限
从前面的内容不难看出,中和抗体在新冠肺炎的治疗中发挥着重要的作用。实际上,中和抗体的作用远不止这些,在预防感染新冠的战场上,例如暴露后预防和暴露前预防,中和抗体也能发挥重要的作用。
顾名思义,暴露后预防就是曾与新冠感染者有过接触,也就是我们比较熟悉的密接者和次密接者。这些人即使接种过疫苗,也存在突破性感染的风险。
今年1月份,礼来发布了重组中和单抗Bamlanivimab暴露后预防的研究数据。研究结果显示,与安慰剂相比,使用Bamlanivimab的受试者出现有症状新冠感染的风险降低了57%[17]。
另外,一项在新冠感染者家庭成员中开展的3期临床试验结果显示,皮下注射单剂量中和抗体组合Casirivimab/Imdevimab将有症状新冠感染的风险降低了81%[18]。
Casirivimab/Imdevimab和Etesevimab/Bamlanivimab都已经获得了FDA紧急使用授权(EUA),用于高危人群的暴露后预防。
▲ 新冠病毒(来自NIAID-RML)
至于暴露前预防,其实是对疫苗的一种补充。因为有一小部分人因为各种各样的原因不能接种疫苗,或者接种疫苗之后不能产生足够的免疫应答。
例如近期刚刚发表的一项研究显示,新冠疫苗虽然能降低癌症患者感染新冠的风险,但是对于存在免疫抑制的患者而言,仍有较高的感染风险,应考虑采取额外的风险降低策略[19]。
另一项研究表明,在接种第二剂BNT162b2疫苗6个月后,体液反应会显著降低,尤其是男性、65 岁及以上人群,以及免疫抑制人群;特别需要注意的是,免疫抑制人群接种疫苗后,无论是峰值还是试验结束时的中和抗体滴度,都只有正常人的30%[20]。
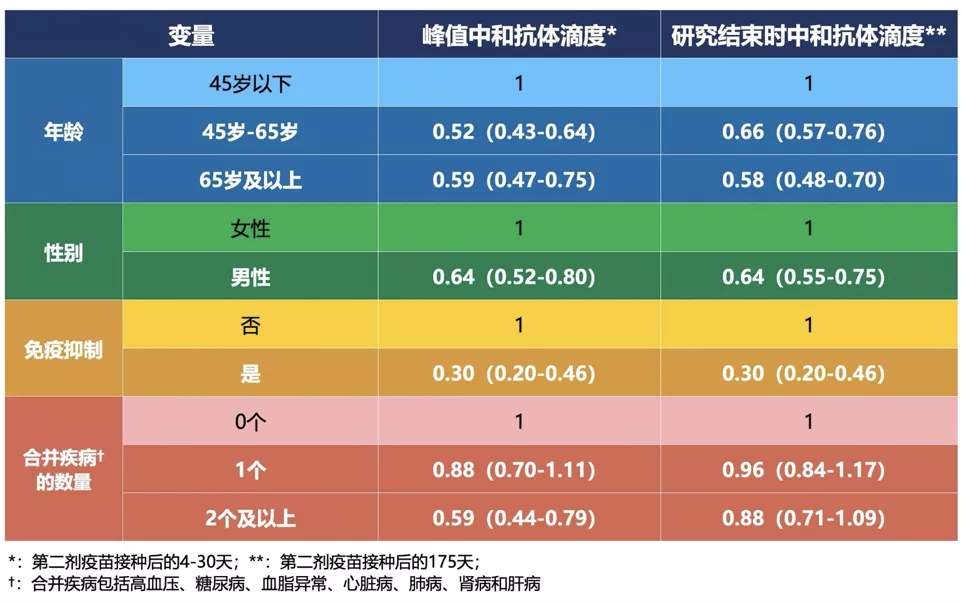
▲ 不同人群峰值和试验结束时的抗体滴度比较
好消息是,今年8月长效抗体组合Tixagevimab/Cilgavimab的暴露前预防3期临床研究数据发布:与安慰剂相比,Tixagevimab/Cilgavimab可将出现症状的新冠感染风险降低77% [21]。
总的来说,新冠中和抗体是新冠疫苗的有力补充,能给不能接受疫苗或疫苗效果反应欠佳的人群提供其他保护方法。
虽然安巴韦单抗/罗米司韦单抗此次没有获得新冠预防适应症,但其超长半衰期的特点,为以后新冠暴露后和暴露前预防的临床研究(进行中)提供了基础。
无论如何,期待安巴韦单抗/罗米司韦单抗的获批会成为我国新冠治疗的转折点,也希望新冠疫情在全球范围内尽快结束。
参考文献
[1].https://www.nmpa.gov.cn/yaowen/ypjgyw/20211208212528103.html
[2].Xu X, Chen P, Wang J, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J]. Science China Life Sciences, 2020, 63(3): 457-460.
[3].Zhou P, Yang X L, Wang X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. nature, 2020, 579(7798): 270-273.
[4].Ju B, Zhang Q, Ge J, et al. Human neutralizing antibodies elicited by SARS-CoV-2 infection[J]. Nature, 2020, 584(7819): 115-119.
[5].Ge J, Wang R, Ju B, et al. Antibody neutralization of SARS-CoV-2 through ACE2 receptor mimicry[J]. Nature communications, 2021, 12(1): 1-9.
[6].Wec A Z, Wrapp D, Herbert A S, et al. Broad neutralization of SARS-related viruses by human monoclonal antibodies[J]. Science, 2020, 369(6504): 731-736.
[7].Wang R, Zhang Q, Ge J, et al. SARS-CoV-2 variants resist antibody neutralization and broaden host ACE2 usage[J]. bioRxiv, 2021.
[8].Mould D R, Sweeney K R D. The pharmacokinetics and pharmacodynamics of monoclonal antibodies-mechanistic modeling applied to drug development[J]. Current Opinion in Drug Discovery and Development, 2007, 10(1): 84.
[9].Robbie G J, Criste R, Dall'Acqua W F, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults[J]. Antimicrobial agents and chemotherapy, 2013, 57(12): 6147-6153.
[10].Zhang Y, Hao X, Ma J, et al. Phase 1 safety and pharmacokinetics studies of BRII-196 and BRII-198, SARS-CoV-2 spike-targeting monoclonal antibodies[J]. medRxiv, 2021.
[11].https://clinicaltrials.gov/ct2/show/NCT04518410
[12].https://newsfile.futunn.com/notice/2021/12/05/10041073-0.PDF
[13].Dougan M, Nirula A, Azizad M, et al. Bamlanivimab plus etesevimab in mild or moderate Covid-19[J]. New England Journal of Medicine, 2021, 385(15): 1382-1392.
[14]. Weinreich D M, Sivapalasingam S, Norton T, et al. REGEN-COV antibody combination and outcomes in outpatients with Covid-19[J]. New England Journal of Medicine, 2021.
[15].Gupta A, Gonzalez-Rojas Y, Juarez E, et al. Early Treatment for Covid-19 with SARS-CoV-2 Neutralizing Antibody Sotrovimab[J]. New England Journal of Medicine, 2021.
[16].https://www.gsk.com/en-gb/media/press-releases/gsk-and-vir-biotechnology-announce-continuing-progress-of-the-comet-clinical-development-programme-for-sotrovimab/
[17].Cohen M S, Nirula A, Mulligan M J, et al. Effect of Bamlanivimab vs Placebo on Incidence of COVID-19 Among Residents and Staff of Skilled Nursing and Assisted Living Facilities: A Randomized Clinical Trial[J]. JAMA, 2021.
[18].O’Brien M P, Forleo-Neto E, Musser B J, et al. Subcutaneous REGEN-COV antibody combination to prevent Covid-19[J]. New England Journal of Medicine, 2021, 385(13): 1184-1195.
[19]. Wu JT, La J, Branch-Elliman W, et al. Association of COVID-19 Vaccination With SARS-CoV-2 Infection in Patients With Cancer: A US Nationwide Veterans Affairs Study. JAMA Oncol. 2021.
[20].Levin E G, Lustig Y, Cohen C, et al. Waning immune humoral response to BNT162b2 Covid-19 vaccine over 6 months[J]. New England Journal of Medicine, 2021.
[21].https://www.astrazeneca.com/media-centre/press-releases/2021/azd7442-prophylaxis-trial-met-primary-endpoint.html


