引言
自2019年12月以来,新型冠状病毒肺炎(COVID-19)在全球范围爆发。由于其具有极强的传染性和致病性,截至6月28日,全球已确诊超过1000万例,死亡超过50万例。并且,即便使用了多种高级器官支持技术,重症COVID-19患者的28天死亡率仍旧高达61.5%(32/52)[1]。目前研究认为COVID-19发生发展的主要机制是过度的炎症风暴,因而可以推测,下调过度的炎症反应很可能有潜力缓解病情。通过该病例的分析,我们想向大家分享关于糖皮质激素治疗COVID-19的调整策略。
治疗COVID-19时,GCs的使用应个体化,并及时积极评估,调整整体治疗方案以期疗效最大化
糖皮质激素(GCs)有抗炎作用,在多种炎症性疾病被广泛使用。然而,在病毒性肺炎中,由于缺乏关于使用时机、剂量和疗程等方面的循证医学证据,GCs的应用备受争议。这也导致一些作者甚至不推荐使用GCs治疗COVID-19肺炎 [2]。
经临床实践,我们认为在治疗COVID-19肺炎时,GCs的使用应个体化,并及时积极评估,调整整体治疗方案以期疗效最大化。这其中,GCs的使用时机及效果评估是重点。接下来的病例报告中,我们将结合一例GCs初始治疗失败的COVID-19肺炎患者,介绍以计算机断层扫描(CT)及实验室检查结果辅助下调整GCs的使用。
案例
患者为54岁女性,有COVID-19感染患者密切接触史,主诉发热、寒战4天,最高体温38.4℃,并伴有呼吸困难和腹泻。既往史无特殊,无吸烟史。入院时,血氧饱和度为51%(呼吸空气),呼吸急促,其他生命体征基本稳定。院前血常规检查发现淋巴细胞减少和单核细胞增多,胸部CT显示双肺多灶性毛玻璃样渗出和浸润,提示病毒性肺炎可能性大(图1A-Ⅰ)。鼻咽拭子RT-PCR检测SARS-nCoV-2阳性。
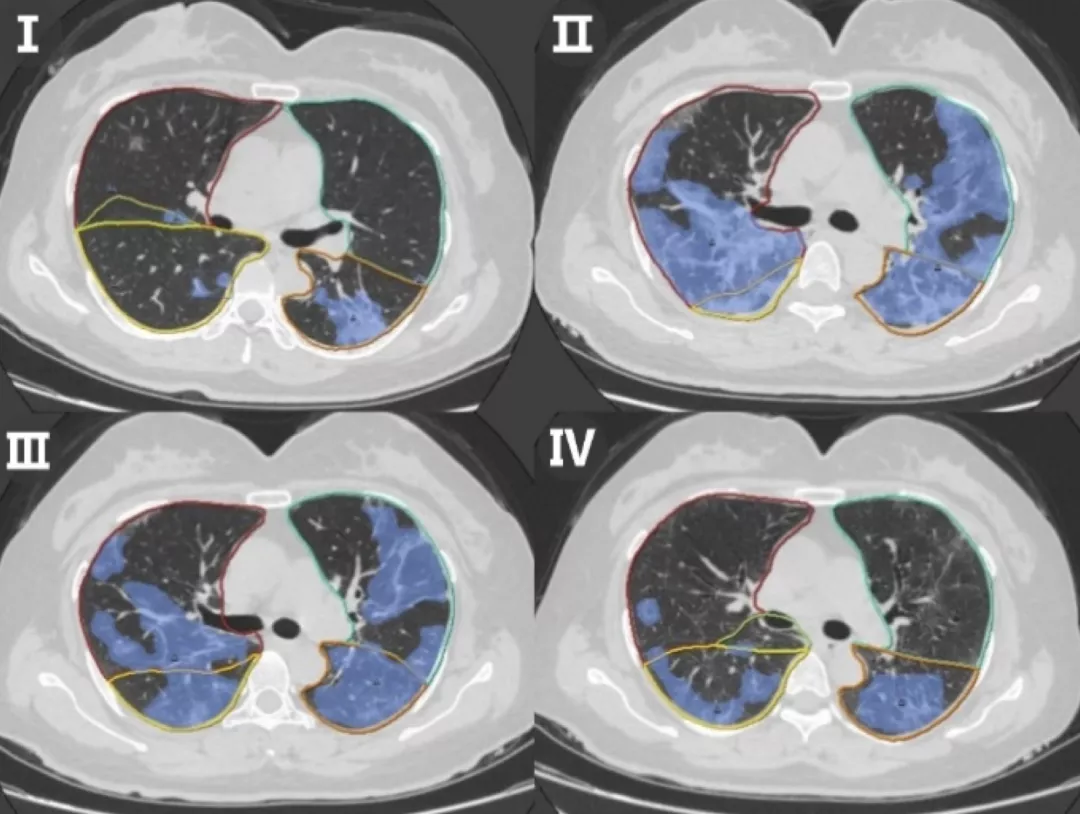
【图1】应用人工智能系统对病例进行连续CT扫描分析。
A.病例胸部CT图像,彩色实线表示AI系统绘制的各肺叶边界。
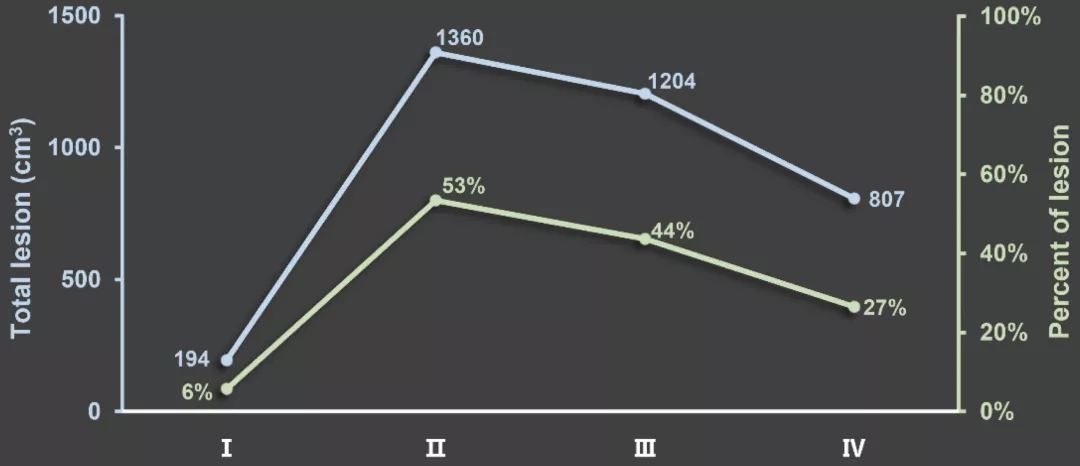
入院时(Ⅰ)CT图像见散在改变,随后开始治疗,入院第10天(Ⅱ)CT显示双肺弥漫性浸润,随后调整MP剂量,入院第14天(Ⅲ)CT显示双肺明显弥散,随后MP逐渐减少;(IV)第17天CT图像显示肺部渗出明显吸收
患者入院后,接受面罩吸氧等支持治疗,以及阿比朵尔(abidol)、免疫球蛋白(IVIG)10g/d和小剂量甲基强的松龙(MP)40mg/d等经验性治疗共4天。病情改善不明显。
入院第7天,患者体温再次上升到38.5℃,并伴有呼吸困难加重,随访CT证实肺炎进展,双侧弥漫性阴影明显增大,伴有支气管充气征(图1A-Ⅱ),病变面积占比急剧增加至53%(图1B)。同时,中性淋巴细胞比(NLR)较前升高,C反应蛋白(CRP)水平较前升高,PaO2/FiO2下降。因此,我们增加面罩吸氧流量至10L/min,并在接下来的4天内增加MP剂量至40mg Bid,其他治疗方案不变。调整激素剂量后,患者的临床情况有所改善,包括体温和氧合;治疗期间CRP、NLR水平也逐渐恢复到正常范围。
第14天CT图像显示双侧弥漫性渗出和浸润明显消散(图1A-Ⅲ,Ⅳ),病变面积占比较第10天减少9%(图1B)。因此,我们对MP逐渐减量。于住院第17天停止吸氧,观察氧合恢复正常,病变面积占比降至27%。患者鼻咽拭子RT-PCR检测SARS-CoV-2报告为阴性,随后以良好状态出院。
及时的CT及实验室检查(包括NLR等)评估,能及时调整GCs剂量,有效阻止COVID-19进展,改善临床疗效
该患者早期肺部病灶相对较小,并接受了包括小剂量MP(40mg,qd)在内的经验性治疗。然而根据CT图像显示及实验室检查结果(包括CRP、NLR),早期治疗似乎不能有效阻止临床症状加重以及病灶范围扩大。随后我们在维持其它经验性治疗措施不变的基础上,调整了GCs的剂量,发现临床症状和CT影像均平稳改善,最终该患者康复出院。该病例提示,及时的CT及实验室检查(包括NLR等)评估,能及时调整GCs剂量,有效阻止COVID-19肺炎进展,改善临床疗效。
根据我们对COVID-19肺炎发病机制的认识,该病毒可诱导机体特别是肺部的过度免疫反应,造成大量细胞因子的释放和炎症细胞的聚集,导致弥漫性内皮细胞损伤和间质水肿。同时,持续的促炎状态可能导致相对性肾上腺皮质功能减退。COVID-19肺炎患者的病理表现与急性呼吸窘迫综合征(ARDS)的诊断相符,与严重急性呼吸综合征(SARS)或中东呼吸综合征(MERS)患者相似 [3]。这些均提示,应考虑及时、适当地使用GCs,以预防ARDS的发生。
既往研究表明GCs治疗对ARDS似乎有更加积极的效果[25-27]。有研究显示短期使用低至中等剂量的GCs可抑制肺炎,改善ARDS预后。也有研究甚至建议在早期ARDS人群中MP的初始剂量可达1mg/kg/d并持续用药2周。我们之前的研究表明,中等剂量的GCs可能改善肾移植术后患者重症肺炎[28]。因此,我们认为,在治疗重症COVID-19肺炎时应注意GCs的剂量和疗程。
GCs在肺炎治疗中的应用可以追溯到60多年前[4]。然而,对于GCs治疗肺炎的方案意见尚未统一,包括治疗起始时机或剂量等。尽管在早期的研究中,GCs似乎对社区获得性肺炎(CAP)人群中有积极作用 [5-8],但在病毒性肺炎中的作用仍存在争议。早期SARS研究声称,对于重症患者,大剂量(超过500mg/d的MP等量剂量,下同)的GCs治疗非常有效,可显著降低肺部浸润的进展、疾病的严重程度、住院治疗和死亡率 [9,10]。然而,高血糖、高钾血症和股骨头坏死等并发症的发生率也明显升高 [11,12]。在H1N1流感中,没有临床研究表明使用GCs后疾病严重程度、住院死亡率和长期死亡率有所降低 [13-23]。治疗失败的一个可能解释是GCs剂量范围不明确(5-180 mg/d)。在MERS中,只有一项多中心回顾性研究聚焦于GCs的治疗效果[24]。结果显示,GCs组的90天粗死亡率更高,住院时间更长。然而,该研究纳入的患者病情更危重,氧合需求更高,需要更多种类的生命支持治疗,这些可能会增加结果的偏倚。
综上,从既往的研究中我们无法获得关于激素起始时机、剂量和疗程的有效信息。而随机对照试验(RCT)因无法根据病情调整剂量,最终的参考价值也有限。总的来说,尽管大多数临床医生仍然认为GCs对病毒性肺炎有治疗作用,但没有足够的循证医学支持GCs治疗病毒性肺炎有效。但我们认为在GCs的治疗过程中应反复评估症状的严重程度和其他参数,为患者制定个体化治疗方案。
在近期文献中,我们发现COVID-19肺炎的CT表现多种多样,如磨玻璃结节(GGO)、片状实变、不规则实性结节 [29]。无症状的患者也可能出现异常的肺部CT改变。病变部位可以在症状出现后1-3周内迅速发展为弥漫性磨玻璃样阴影或实变,发病后约2周达到高峰[29]。然而,肉眼观察CT图像改变比较主观且耗时。而我们对CT图像进行「定量」评估,准确、客观地判断了病灶的体积和密度,将人工智能分析结果作为调整GCs治疗方案的依据并进行临床实践,最终取得了满意的效果。因此,随着「影像人工智能肺炎辅诊系统」的问世,精准的个体化GCs治疗将成为可能。
另一方面,越来越多的研究提示新冠病毒严重影响患者的免疫功能[30],包括CD3+、CD4+淋巴细胞计数及比例的变化等。而中性淋巴比(NLR)作为一个临床极易获得的指标,已有研究提示其数值越高,COVID-19肺炎患者的预后越差[31]。因此,我们在临床工作中,如果发现患者的NLR有下降趋势,同时CT评估提示进展,则考虑及时给予GCs干预。在GCs的使用过程中,也可通过随访NLR来了解病情及治疗效果。当然,在实际操作中,也遇到初始淋巴细胞计数较低,或NLR较高的患者,提示其细胞免疫功能受损严重,此时是否可予GCs治疗,可能需要进一步的大样本研究来确定。
综上所述,该病例表明优化GCs用药方案可有效治疗COVID-19肺炎,CT影像学人工智能分析系统及实验室免疫功能的检查可辅助调整GCs方案。今后,我们将继续努力挖掘该方案的潜力。
参考文献
[1] Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X et al: Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet (London, England) 2020, 395(10223):497-506.
[2] Russell CD, Millar JE, Baillie JK: Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. The Lancet 2020, 395(10223):473-475.
[3] Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, Liu S, Zhao P, Liu H, Zhu L et al: Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med 2020.
[4] Blom PS, Van Leeuwen P: [Recovery in a case of fulminating influenza virus pneumonia following a rapid intravenous administration of hydrocortisone]. Nederlands tijdschrift voor geneeskunde 1959, 103(3):109-110.
[5] Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J, Gabarrus A, Sellares J, Restrepo MI, Anzueto A et al: Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA 2015, 313(7):677-686.
[6] Nawab QU, Golden E, Confalonieri M, Umberger R, Meduri GU: Corticosteroid treatment in severe community-acquired pneumonia: duration of treatment affects control of systemic inflammation and clinical improvement. Intensive Care Med 2011, 37(9):1553-1554.
[7] Meijvis SC, Hardeman H, Remmelts HH, Heijligenberg R, Rijkers GT, van Velzen-Blad H, Voorn GP, van de Garde EM, Endeman H, Grutters JC et al: Dexamethasone and length of hospital stay in patients with community-acquired pneumonia: a randomised, double-blind, placebo-controlled trial. Lancet 2011, 377(9782):2023-2030.
[8] Lee FE, Walsh EE, Falsey AR: The effect of steroid use in hospitalized adults with respiratory syncytial virus-related illness. Chest 2011, 140(5):1155-1161.
[9] Yam LY, Lau AC, Lai FY, Shung E, Chan J, Wong V: Corticosteroid treatment of severe acute respiratory syndrome in Hong Kong. The Journal of infection 2007, 54(1):28-39.
[10] Chen RC, Tang XP, Tan SY, Liang BL, Wan ZY, Fang JQ, Zhong N: Treatment of severe acute respiratory syndrome with glucosteroids: the Guangzhou experience. Chest 2006, 129(6):1441-1452.
[12] Sung JJ, Wu A, Joynt GM, Yuen KY, Lee N, Chan PK, Cockram CS, Ahuja AT, Yu LM, Wong VW et al: Severe acute respiratory syndrome: report of treatment and outcome after a major outbreak. Thorax 2004, 59(5):414-420.
[12] Zhao R, Wang H, Wang X, Feng F: Steroid therapy and the risk of osteonecrosis in SARS patients: a dose-response meta-analysis. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA 2017, 28(3):1027-1034.
[13] Boudreault AA, Xie H, Leisenring W, Englund J, Corey L, Boeckh M: Impact of corticosteroid treatment and antiviral therapy on clinical outcomes in hematopoietic cell transplant patients infected with influenza virus. Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation 2011, 17(7):979-986.
[14] Brun-Buisson C, Richard JC, Mercat A, Thiebaut AC, Brochard L, Group R-SAHNvR: Early corticosteroids in severe influenza A/H1N1 pneumonia and acute respiratory distress syndrome. Am J Respir Crit Care Med 2011, 183(9):1200-1206.
[15] Han K, Ma H, An X, Su Y, Chen J, Lian Z, Zhao J, Zhu BP, Fontaine RE, Feng Z et al: Early use of glucocorticoids was a risk factor for critical disease and death from pH1N1 infection. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2011, 53(4):326-333.
[16] Linko R, Pettila V, Ruokonen E, Varpula T, Karlsson S, Tenhunen J, Reinikainen M, Saarinen K, Perttila J, Parviainen I et al: Corticosteroid therapy in intensive care unit patients with PCR-confirmed influenza A(H1N1) infection in Finland. Acta anaesthesiologica Scandinavica 2011, 55(8):971-979.
[17] Delgado-Rodriguez M, Castilla J, Godoy P, Martin V, Soldevila N, Alonso J, Astray J, Baricot M, Canton R, Castro A et al: Prognosis of hospitalized patients with 2009 H1N1 influenza in Spain: influence of neuraminidase inhibitors. The Journal of antimicrobial chemotherapy 2012, 67(7):1739-1745.
[18] Al-Busaidi M, Al Maamari K, Al'Adawi B, Alawi FB, Al-Wahaibi A, Belkhair A: Pandemic Influenza A H1N1 in Oman: Epidemiology, Clinical Features, and Outcome of Patients Admitted to Sultan Qaboos University Hospital in 2009. Oman medical journal 2016, 31(4):290-297.
[19] Cao B, Gao H, Zhou B, Deng X, Hu C, Deng C, Lu H, Li Y, Gan J, Liu J et al: Adjuvant Corticosteroid Treatment in Adults With Influenza A (H7N9) Viral Pneumonia. Crit Care Med 2016, 44(6):e318-328.
[20] Delaney JW, Pinto R, Long J, Lamontagne F, Adhikari NK, Kumar A, Marshall JC, Cook DJ, Jouvet P, Ferguson ND et al: The influence of corticosteroid treatment on the outcome of influenza A(H1N1pdm09)-related critical illness. Crit Care 2016, 20:75.
[21] Huang SF, Fung CP, Perng DW, Wang FD: Effects of corticosteroid and neuraminidase inhibitors on survival in patients with respiratory distress induced by influenza virus. Journal of microbiology, immunology, and infection = Wei mian yu gan ran za zhi 2017, 50(5):586-594.
[22] Li H, Yang SG, Gu L, Zhang Y, Yan XX, Liang ZA, Zhang W, Jia HY, Chen W, Liu M et al: Effect of low-to-moderate-dose corticosteroids on mortality of hospitalized adolescents and adults with influenza A(H1N1)pdm09 viral pneumonia. Influenza and other respiratory viruses 2017, 11(4):345-354.
[23] Moreno G, Rodriguez A, Reyes LF, Gomez J, Sole-Violan J, Diaz E, Bodi M, Trefler S, Guardiola J, Yebenes JC et al: Corticosteroid treatment in critically ill patients with severe influenza pneumonia: a propensity score matching study. Intensive Care Med 2018, 44(9):1470-1482.
[24] Arabi YM, Mandourah Y, Al-Hameed F, Sindi AA, Almekhlafi GA, Hussein MA, Jose J, Pinto R, Al-Omari A, Kharaba A et al: Corticosteroid Therapy for Critically Ill Patients with Middle East Respiratory Syndrome. Am J Respir Crit Care Med 2018, 197(6):757-767.
[25] Steinberg KP, Hudson LD, Goodman RB, Hough CL, Lanken PN, Hyzy R, Thompson BT, Ancukiewicz M: Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. The New England journal of medicine 2006, 354(16):1671-1684.
[26] Meduri GU, Golden E, Freire AX, Taylor E, Zaman M, Carson SJ, Gibson M, Umberger R: Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial. Chest 2007, 131(4):954-963.
[27] Confalonieri M, Urbino R, Potena A, Piattella M, Parigi P, Puccio G, Della Porta R, Giorgio C, Blasi F, Umberger R et al: Hydrocortisone infusion for severe community-acquired pneumonia: a preliminary randomized study. American journal of respiratory and critical care medicine 2005, 171(3):242-248.
[28] Tu G-W, Ju M-J, Han Y, He H-Y, Rong R-M, Xu M, Xue Z-G, Zhu T-Y, Luo Z: Moderate-dose glucocorticoids as salvage therapy for severe pneumonia in renal transplant recipients: a single-center feasibility study. Renal Failure 2013, 36(2):202-209.
[29] Pan Y, Guan H, Zhou S, Wang Y, Li Q, Zhu T, Hu Q, Xia L: Initial CT findings and temporal changes in patients with the novel coronavirus pneumonia (2019-nCoV): a study of 63 patients in Wuhan, China. Eur Radiol 2020.
[30] Santosha A Vardhana, Jedd D Wolchok: The Many Faces of the anti-COVID Immune Response. J Exp Med 2020, 217 (6): e20200678
[31] Aijia Ma , Jiangli Cheng, Jing Yang, Meiling Dong, Xuelian Liao, Yan Kang: Neutrophil-to-lymphocyte Ratio as a Predictive Biomarker for Moderate-Severe ARDS in Severe COVID-19 Patients. Crit Care 2020, 24 (1): 288.
专家介绍

罗哲
主任医师,医学博士。复旦大学附属中山医院重症医学科行政副主任,中山医院厦门分院麻醉危急重症平台副主任和危急重症科执行主任,复旦大学附属中山医院心脏大血管重症亚专科主任,上海市医学会危重病专科分会青委副主委,上海市医学会危重病专科分会重症心脏学组副组长,上海市医学会心血管外科分会青年委员,上海市医学会心血管外科分会重症监护学组副组长。主要研究方向:心脏重症、呼吸重症、血流动力学监测。同时研究ICU管理、心源性休克生命支持技术合理使用、免疫抑制病人合并重症肺炎诊疗规范。以第一作者/通讯作者在SCI杂志上发表论文三十余篇,承担上海市自然科学基金、上海市卫计委、中山医院骨干基金等多项课题。
居旻杰
副主任医师,医学博士。复旦大学附属中山医院重症医学科副主任医师,中国医学救援协会重症医学分会理事,中国医学救援协会重症医学分会早期康复学组副组长。主要研究方向:呼吸重症、感染性休克的机制研究。同时研究ICU管理、免疫抑制病人合并重症肺炎诊疗规范。以第一作者在SCI杂志上发表论文二十余篇,承担国家自然科学基金、复旦大学自主创新基金、中山医院优秀青年基金等多项课题。


