前言
德尔塔新冠病毒变异体B.1.167.2引起的新冠肺炎潜伏期短、传染性强,逐渐成为全球流行最重要的变异体。该变异株今天5月首次传入中国引起广东局部爆发疫情,此后先后发生云南瑞丽、南京禄口机场、郑州等地局部疫情,9月10日福建莆田局部爆发一起新加坡入境人员在厦门隔离酒店被感染的德尔塔变异体导致的新冠疫情,共引起228例患者感染。李鸿茹为福建省立医院呼吸与危重症医学科主任医师,受福建省卫健委委派,随福建省立医院援莆医疗队到莆田支援抗疫,抗疫期间较深入了解德尔塔变异株新冠肺炎的特点,并阅读大量文献。其中,我们学习了在bioRxiv上发表的来自英国剑桥大学的一篇有关德尔塔新冠病毒变异体在体外实验的研究(SARS-CoV-2 B.1.617.2 Delta variant replication, sensitivity to neutralising antibodies and vaccine breakthrough.),该文从机制上充分地探讨和阐述了德尔塔变异体的特点,经作者授权,将其翻译成中文,以期帮助同行加深对德尔塔新冠变异体的了解。
SARS-CoV-2 B.1.617.2 Delta变体的出现、复制和对中和抗体的敏感性

钟文翻译 李鸿茹校对(福建医科大学省立临床医学院)
摘要
SARS-CoV-2 B.1.617.2 (Delta) 变体于 2020 年底在马哈拉施特拉邦首次被发现,并传播到整个印度,超出了先前存在的包括 B.1.617.1 (Kappa) 和 B.1.1 7(Alpha) 在内的谱系的范围。在体外,与携带 D614G 的武汉-1野生型相比,B.1.617.2 对来自恢复个体的血清中和抗体的敏感性低6倍,对疫苗引发的抗体的敏感性低8倍。与 BNT162b2 疫苗接种者相比,ChAdOx-1 中针对 B.1.617.2 的血清中和滴度较低。B.1.617.2 刺突假型病毒对针对受体结合域 (RBD) 和 N 端域 (NTD) 的单克隆抗体表现出敏感性受损,特别是对临床批准的 bamlavinimab 和 imdevimab 单克隆抗体。与 B.1.1.7 相比,B.1.617.2 在气道器官和人类气道上皮系统中表现出更高的复制效率,且B.1.617.2 的刺突主要处于裂解状态。此外,我们观察到,与 B.1.617.1 相比,B.1.617.2 具有更高的复制能力和更多刺突介导的细胞入侵,这可能解释了 B.1.617.2 的优势。在混合谱系循环期间,对来自印度的3个中心的130多名感染SARS-CoV-2的医护人员进行的一项分析中发现,相对于非B.1.617.2, ChAdOx-1疫苗对B.1.617.2的有效性显著降低。针对具有高度适应力和免疫逃避的B.1.617.2 Delta变体的疫苗效力降低,使得有必要在疫苗接种后时代继续采取感染控制措施。
介绍
印度在2020年中期的爆发的第一波 SARS-CoV-2 感染相对温和,并受到全国封锁的控制。自从放宽限制以来,随着疫情的不断传播,自2021年3月起,印度的SARS-CoV-2病例数不断增加,死亡人数超过 400,000。B.1.1.7 Alpha变体于 2020年底从英国 (UK) 传入印度,并在印度北部发展,比先前带有 D614G 刺突突变的病毒更具传播性,同时对疫苗引起的中和抗体保持敏感性。B.1.617变体于2020年末/2021年初在马哈拉施特拉邦首次被发现,传播到整个印度并传播到至少 90个国家/地区。
第一个被检测到的亚系是 B.1.617.1,接着是 B.1.617.2,两者都带有B.1.427/B.1.429中发现的L452R 刺突受体结合基序突变。此前的报道表明,这种突变会增加感染性,并适度降低对中和抗体的敏感性。B.1.617.2 被世界卫生组织称为 Delta 变体,此后在 B.1.617.1(Kappa 变体)和包括 B.1.1.7 在内的其他谱系中占主导地位(https://nextstrain.org/sars-cov-2 )。B.1.617.2 带有与武汉-1号 D614G 相关的刺突突变:T19R、G142D、E156G、F157del、R158del、L452R、T478K、D614G、P681R 和 D950N。
尽管疫苗自2021年初就已面世,但要在成年人中实现近乎全民覆盖一直是一个巨大的挑战,特别是在B.1.617.2增长迅速、发病率和死亡率相当高的人口大国。目前的疫苗是针对B.1和武汉-1型病毒设计的,而对B.1.351和P.1等疫苗敏感性降低的变异的出现,引发了人们对通过接种疫苗进行长期控制和保护的担忧,尤其是高风险组。B.1.617.2在全球人口中爆炸性增长的具体原因尚不清楚。可能的解释包括:逃避通过接种疫苗或先前感染产生的中和抗体的作用,以及传染性增加。
结果
SARS-CoV-2 B.1.617.2 对中和抗体的敏感性降低
我们首先绘制了印度自2021年初以来新病例中SARS-CoV-2变异的相对比例。虽然B.1.617.1较早出现,但已被Delta变种B.1.617.2所取代(图1a)。我们假设B.1.617.2会对先前SARS-CoV-2感染产生的抗体反应会产生免疫逃避。我们使用了2020年中期英国第一波感染期间(可能是在感染SARS-CoV-2武汉-1之后)12名感染者的血清。这些血清被用来测试中和 B.1.617.2 病毒分离株(从鼻/喉拭子获得)的能力,并与B.1.1.7 变异分离株和刺突携带 D614G 的野生型 (WT) 武汉-1 病毒相比。Delta变体包含几个位于结构内预计会改变其功能的刺突突变(图1b)。我们发现 B.1.1.7 病毒分离株对血清的敏感性比 WT 低 2.3 倍,而B.1.617.2 对血清的敏感性低 5.7 倍(图 1c)。重要的是,在同样的检测中,出现在南非的 B.1.351 Beta 变体表现出相对于WT的中和敏感性下降8.2倍。
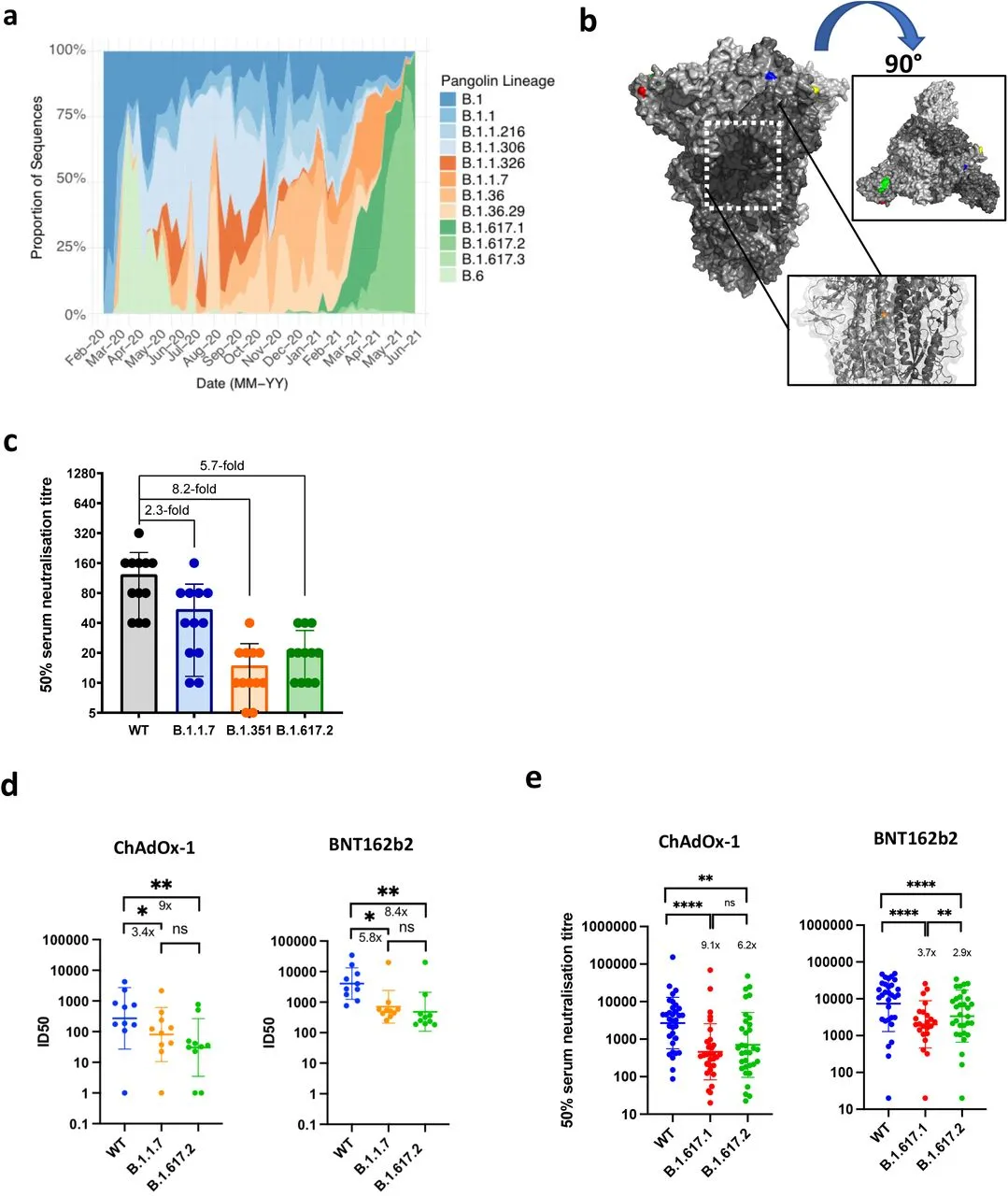
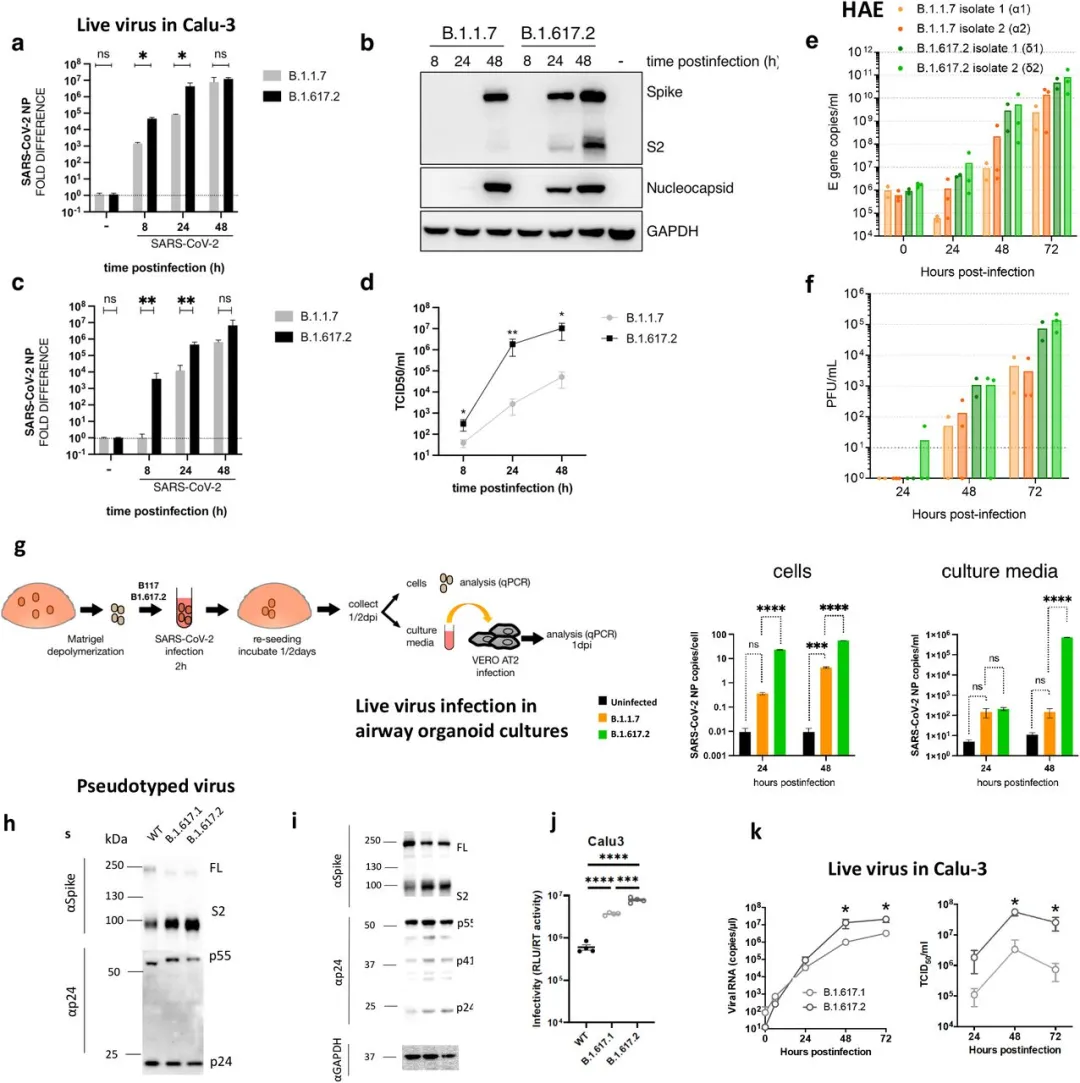
图1:Delta变体 B.1.617.2在印度迅速扩展,并降低了对感染和疫苗接种后血清中产生的中和抗体的敏感性
a.2020-2021年印度SARS-CoV-2病例中谱系所占比例。b.SARS-CoV-2 B.1.671.2 刺突三聚体的表面表征(PDB: 6ZGE)。L19R(红色)、del157/158(绿色)、L452R(蓝色)和T478K(黄色)。白色虚线框表示D950N的位置(橙色)。c.在Vero-hACE2 TMPRSS2细胞中,2020年中期恢复期人血清对Delta变体的中和作用。B.1.17 (Alpha)、B.1.351 (Beta)和B.1617.2 (Delta)变体相对于野生型(IC19)的血清中和100 TCID50的倍数变化, n=12。d.用接种个体(n=10 ChAdOx-1或n=10 BNT12b2)的血清中和Delta变异活病毒分离物,与B.1.1.7和武汉-1野生型(WT)比较。将5倍稀释的疫苗血清与野生型(WT)或病毒变体(MOI 0.1)在37℃混合1h。将混合物加入Vero-hACE2/TMPRSS2细胞中72h。细胞固定,考马斯亮蓝染色,计算存活率%。ID50采用非线性回归计算。图表示两个独立实验的平均值。e.用疫苗血清(n=33 ChAdOx-1或n=32 BNT162b2)中和B.1.617刺突假型病毒(PV)和野生型病毒(WT, Wu-1 D614G)。显示了带有s.d的GMT(几何平均滴度)。数据代表两个独立的实验,每个实验有两个技术重复。**p<0.01, ***p<0.001, ****p<0.0001 Wilcoxon配对符号秩检验,ns不显著。
我们使用相同的 B.1.617.2 活病毒分离株来测试对接种两剂 ChAdOx-1或BNT162b2 后的个体的疫苗引发的血清中和抗体的敏感性。这些实验表明,与含有 D614G 的野生型武汉-1 相比,两组疫苗血清对B.1.617.2 的敏感性下降约为 8 倍,而B.1.1.7的下降则没有达到统计学意义(图 1d)。这次为了对比 B.1.617.1 和 B.1.617.2 的刺突与武汉 1 D614G 刺突,我们使用了一个假型病毒 (PV) 系统来测试更大的 65 种疫苗引发血清的中和效力(图 1e)。疫苗接种者人口统计数据的比较显示出相似的特征(扩展数据表 1)。与 BNT162b2 相比,ChAdOx-1 针对 Delta 变体刺突PV的平均 GMT 较低(GMT 3372 对 654,p<0001,扩展数据表 1)。
我们通过测试从 WT SARS-CoV-2 恢复的 6 个个体中分离出的33种(3种NTD、21 种 RBM 和9种非RBM 特异性)刺突特异性 mAb(单克隆抗体),在体外,用表达跨膜蛋白酶丝氨酸2(TMPRSS2)和武汉-1 D614G SARS-CoV-2 刺突或 B.1.617.2 刺突的 Vero E6 靶细胞进行PV中和试验,研究了 B.1.617.2 刺突逃逸机制的作用(图2a-c,扩展数据图1a-c和扩展数据表2)。此外,还使用Vero E6 细胞检测了5个临床阶段的 RBM-mAb(etesevimab、casirivimab、regdanvimab、imdevimab 和 bamlanivimab)(图 2c,扩展数据图 1d和扩展数据表 2)。我们发现所有三种 NTD-mAb (100%) 和九分之四 (44%) 非 RBM mAb 完全失去了对 B.1.617.2 的中和活性(图 2 bc和扩展数据图 1a)。在 RBM 结合组中,26 种 mAb 中有16种 (61.5%) 表现出对 B.1.617.2 的中和活性显著降低(2-35 倍变化减少)或完全丧失(> 40 倍变化减少),表明在相当大一部分 RBM 抗体中,L452R 和 T478K 突变是导致它们丧失中和活性的原因(图 2b-c,扩展数据图 1b)。在进行临床阶段测试的RBM-mAb 中,bamlanivimab 在临床试验中显示出针对先前变体的益处,但没有中和 B.1.617.2。Imdevimab 是 REGN-COV2 治疗性双抗体混合物的一部分,在 Vero E6-TMPRSS2 细胞中显示出降低的中和活性(图 2c和扩展数据图 1d-f)。其余的临床阶段 mAb,包括 S309(索托维单抗的来源亲本抗体),保留了针对 B.1.617.2 的有效中和活性。
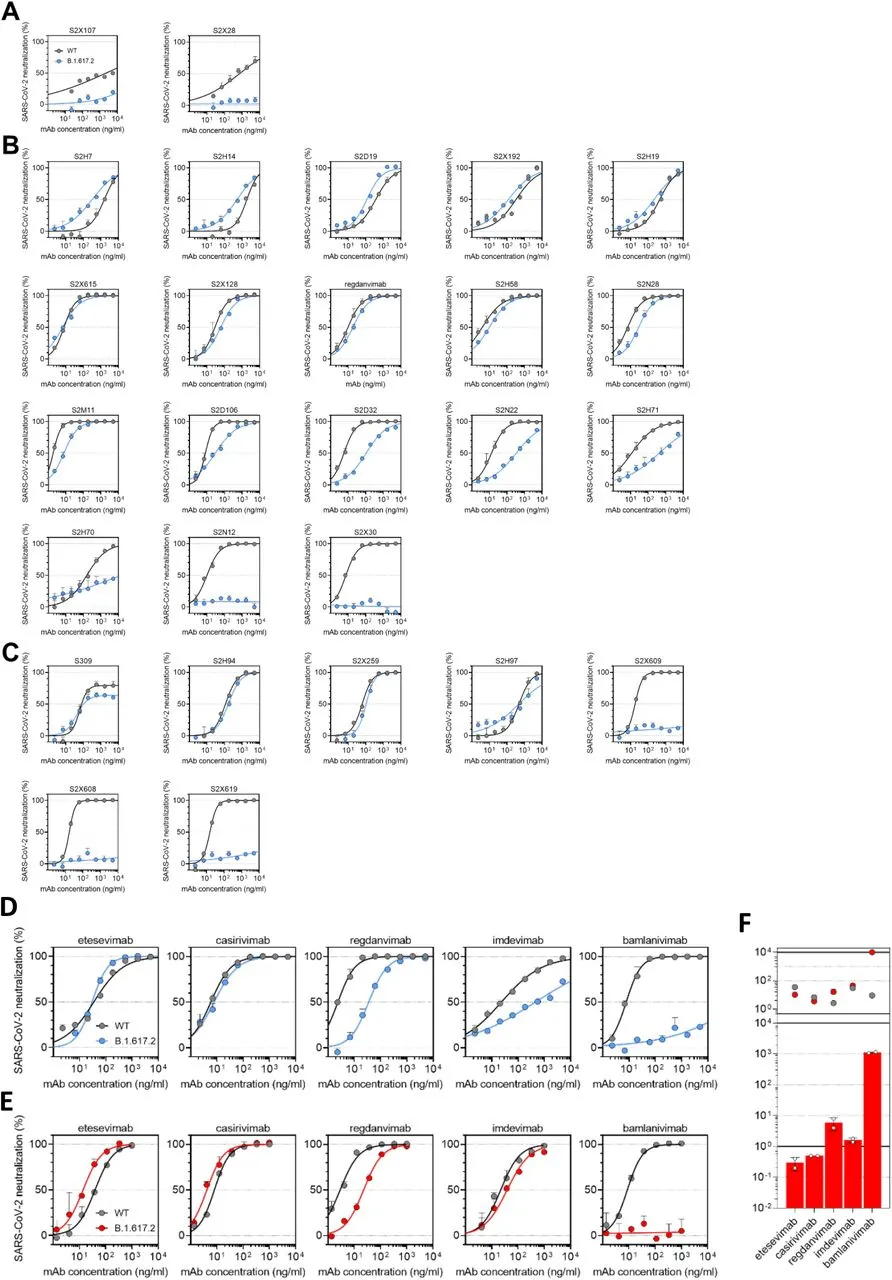
扩展数据图 1:一组 NTD 和 RBD 特异性 mAb 对 WT 和 B.1.617.2 突变型 SARS-CoV-2 假型病毒的中和作用
a-c,通过靶向NTD (A, n=3)、RBM (B, n=18)和非RBM (C, n=7)的27个mAbs对WT(武汉-1 D614,黑色)和B.1.617.2突变体(蓝色)假型SARS-CoV-2-VSV进行中和。图中是两个独立实验中的一个代表性实验。d-e, 使用表达(d)TMPRSS2或不表达(e)TMPRSS2的Vero E6细胞,对5个处于临床阶段的mAbs进行对WT D614(黑色)和B.1.617.2突变体(蓝色/红色)假型SARS-CoV-2-VSV的中和试验。图中是两个独立实验中的一个代表性实验。f,在使用不表达TMPRSS2的Vero E6细胞进行的2个独立实验中,5个临床阶段的mAbs的平均IC50值(上图)和B.1.617.2相对于WT的平均倍数变化(下图),显示了中和作用(与图e相关)。
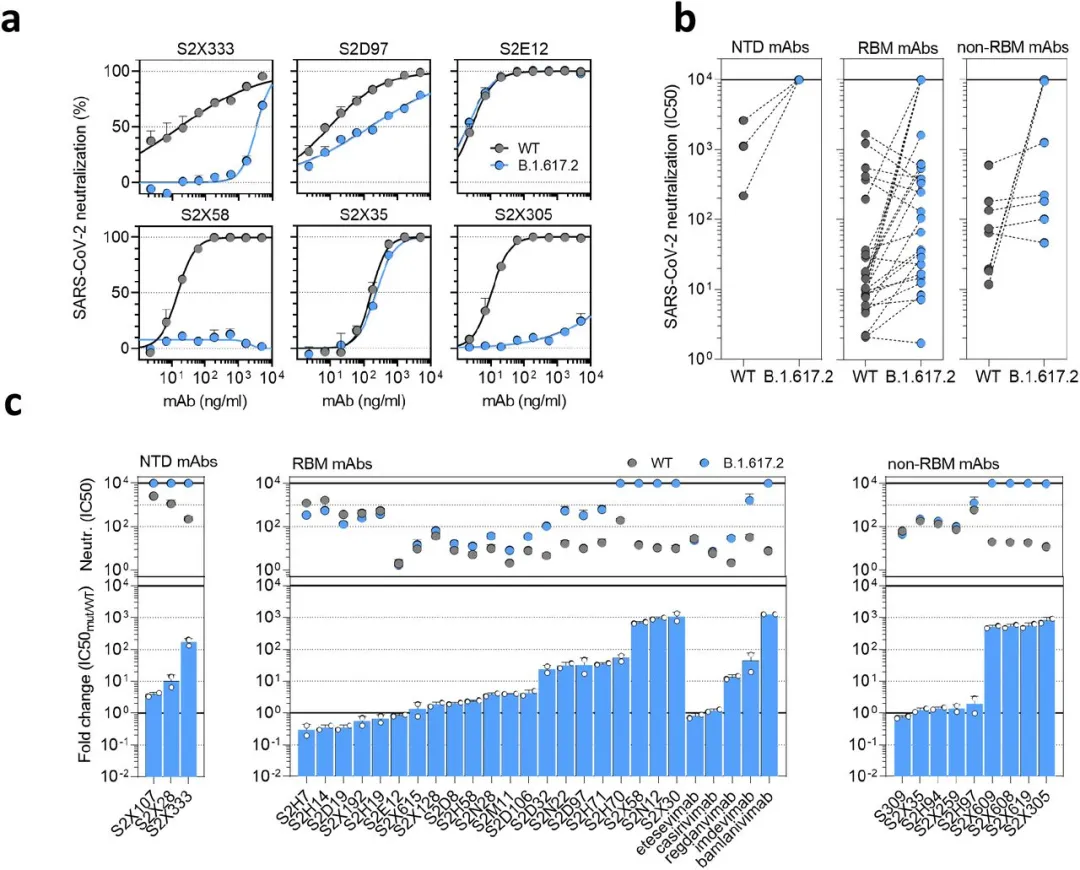
图2:Delta变体 B.1.617.2对单克隆抗体的敏感性降低。
a.从2个独立实验中的1个代表性实验中选择6个单克隆抗体对WT D614(黑色)和B.1.617.2突变体(蓝色)假型SARS-CoV-2-VSV进行中和。S2X333是NTD特异性单抗,S2D97、S2E12和S2X58是RBM特异性单抗,而S2X35和S2X305是非RBM特异性单抗。b.38株针对NTD (n=3)、RBM (n=26,包括5例临床期mAb)和非RBM (n=9)的单克隆抗体对WT和B.1.617.2 VSV的中和作用。图中为2个独立实验的IC50平均值(ng/ml)。非中和IC50滴度设为104 ng/ml。c.使用表达TMPRSS2的Vero E6细胞进行的2个独立实验(包括5个临床期单克隆抗体)中检测的38个单克隆抗体的平均IC50值(上图)和B.1.617.2相对于WT的平均倍数变化(下图)显示了中和作用。
SARS-CoV-2 B.1.617.2变异在人类气道模型系统中复制率较高
接下来,我们寻找从模型中预测的更高的传播率的生物学证据。复制增加可能是产生更多病毒颗粒的原因,或者颗粒本身更有可能导致生产性感染。我们首先感染了肺上皮细胞系,Calu-3,比较了 B.1.1.7 和 B.1.617.2(图 3a-d)。我们观察到 B.1.617.2 的复制优势,细胞内 RNA 转录物和 S 和 N 蛋白(图 3a-b)以及从细胞释放的病毒粒子的分析(图 3c-d)可以证明。接下来,我们在人气道上皮模型中针对 B.1.617.2 的两个独立分离株测试了 B.1.1.7。在这个系统中,我们再次观察到 B.1.617.2 分离株比 B.1.1.7 具有显著的复制优势(图 3e-f)。最后,我们用 B.1.617.2 和 B.1.1.7 病毒分离株感染了初级 3D 气道类器官(图 3g),注意到 B.1.617.2 比 B.1.1.7 具有显著的复制优势。这些数据明显支持B.1.617.2比B.1.1.7有更高的复制率和传播率。
图3:SARS-CoV-2 B.1.617.2 Delta变体复制和刺突介导的入侵效率。
a-d.在CaLu-3肺细胞中比较B.1.1.7和B.1.617.2的活病毒复制。Calu-3细胞是:感染了MOI 0.1的变异。在感染后8、24和48小时,收集含有释放病毒的细胞和上清液用于RNA分离、western blot和TCID50。a.在细胞裂解液中用qPCR检测病毒载量。b.在细胞裂解液中检测病毒蛋白水平。c-d.收集感染Calu3细胞产生的活病毒,用病毒感染Vero Ace2/TMPRSS2细胞进行检测。c.Vero细胞的病毒载量。d.测量 TCID50/ml。e-f.利用两株B.1.617.2和两株B.1.1.7分离株,在具有气液界面ALI的人气道上皮(HAE)系统中的病毒复制动力学。g.活病毒在气道上皮样器官培养中的复制。在MOI 1中,呼吸道上皮样器官感染SARS-CoV-2变体B.1.1.7和B.1.617.2。感染24、48h后细胞裂解,总RNA分离。采用qPCR方法检测核蛋白基因在类器官细胞中的拷贝数,并通过感染Vero AT2细胞检测游离病毒的感染性。数据代表代表两个独立的实验,h和i。用表达慢病毒载体和SARS-CoV-2 S B.1.617.1和Delta变体B.1.617.2的质粒转染293T产生细胞后,用HIV-1 p24和SARS-CoV-2 S2的抗体探针,对假型病毒(PV)病毒粒子(h)和细胞裂解物(i)进行western blot。j.在293T细胞中产生的WT D614G亲本质粒PV与B.1.617.2刺突和B.1.617.1单轮侵染Calu-3。数据代表了三个独立的实验。k.B.1.617.1和B.1.617.2变异株的生长动力学。将B.1.617.1和B.1.617.2[200 50%组织培养感染剂量(TCID50)]的病毒分离株接种到Calu-3细胞中,实时RT-PCR检测培养上清中病毒RNA随时间的拷贝数。随时间变化测定上清液中释放病毒的TCID50。一式四份进行测定。*,通过 Mann-Whitney U 检验,P <0.05。ns,不显著;* p<0.05;** p < 0.01;***p<0.001, ****p<0.0001 (-) 未感染细胞。数据代表两个独立实验。
在上述实验中,我们注意到与B.1.1.7相比,细胞内B.1.617.2刺突处于裂解状态中的比例更高(图 3b)。为了进一步研究这一点,我们在Vero-hACE2-TMPRSS2细胞中产生了这两种病毒以及B.1 D614G病毒,并在用western blots检测刺突S2和核蛋白前48小时收集并纯化上清液。该分析表明,与 B.1 和 B.1.1.7相比,B.1.617.2 刺突主要以裂解形式存在(扩展数据图 2a-b)。
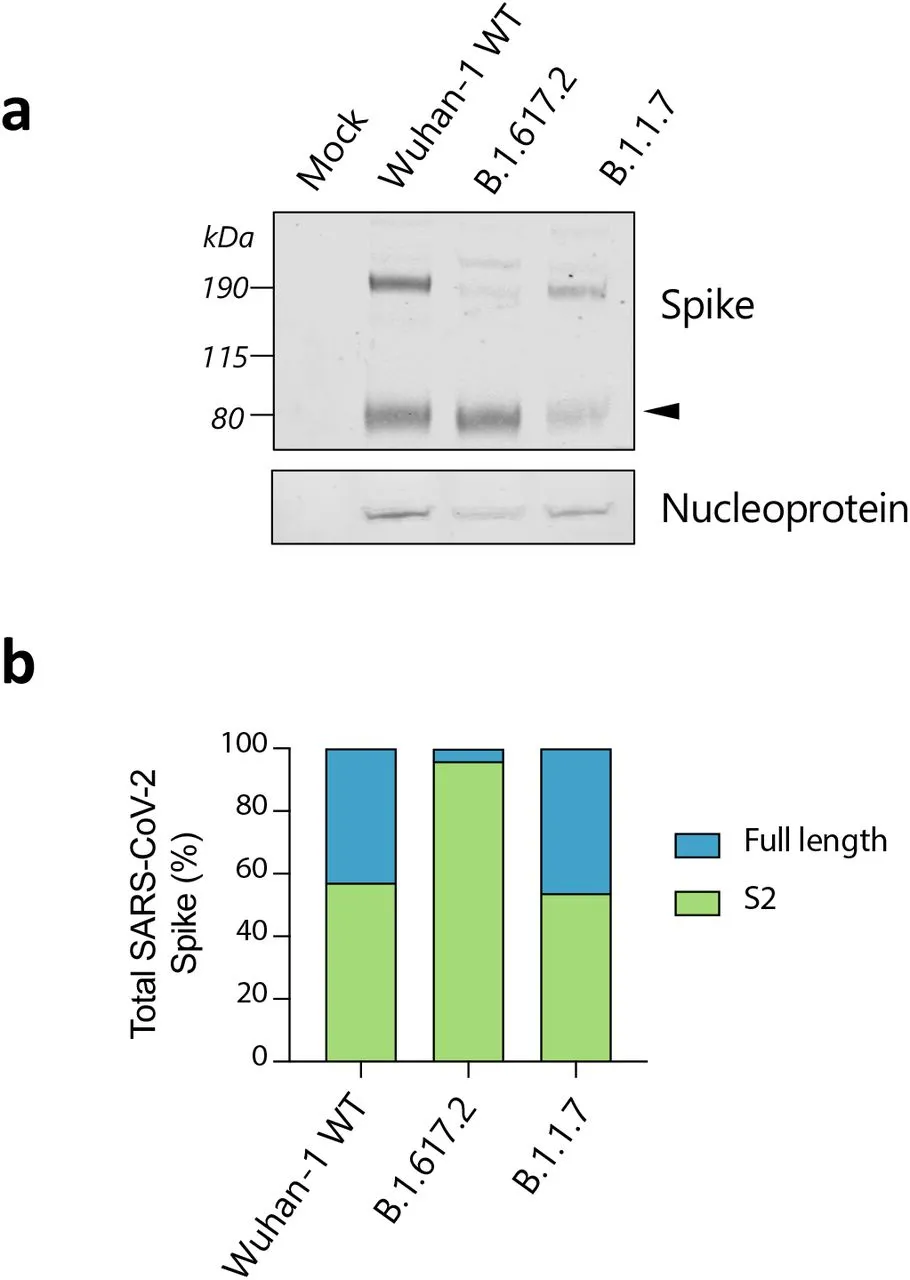
扩展数据图 2:与B.1.1.7相比,B.1.617.2病毒粒子中的刺突裂解。
a.对感染48小时后Vero-hACE2-TMPRS22细胞产生的SARS-CoV-2病毒颗粒中的刺突和核蛋白进行代表性的western blot分析。箭头表示S2亚基。b.所示病毒刺突的裂解和全长的量化。
SARS-CoV-2 B.1.617.2 刺突增强了细胞入侵效率与刺突裂解有关
SARS-CoV-2 刺突通过与ACE2和TMPRSS2 的相互作用介导进入细胞,是病毒感染性的主要决定因素。为了深入了解B.1.617.2传染性增强的机制,我们使用假型病毒(PV)系统测试了B.1.617.1和B.1.617.2刺突的单轮病毒入侵(图3h,i和扩展数据图3a-b)。感染表达内源性ACE2(血管紧张素转换酶2)和TMPRSS2(跨膜蛋白酶丝氨酸2)的Calu-3肺细胞(图3j),以及其他被转换或瞬时转染ACE2 / TMPRSS2的细胞(扩展数据图3b)。我们首先探测PV病毒粒子和细胞裂解液中的刺突蛋白,发现与WT相比,B.1.617刺突主要以剪切形式存在于细胞和病毒粒子中(图3h-i,扩展数据图3c)。与武汉-1 D614G野生型相比,我们观察到一个日志增加了B.1.617.1和B.1.617.2的进入效率(扩展数据图3b)。此外,与B.1.617.1相比,B.1.617.2在某些细胞中似乎具有进入优势,特别是在含有内源性受体的Calu-3细胞中(图3j)。最后,我们希望利用B.1.617.1和B.1.617.2活病毒分离物证实其具有更高的传染性。正如PV比较的预期,通过上清液RNA和TCID50测量,在48小时内,B.1.617.2在Calu-3细胞中复制动力学B.1.617.1增加(图3k)。
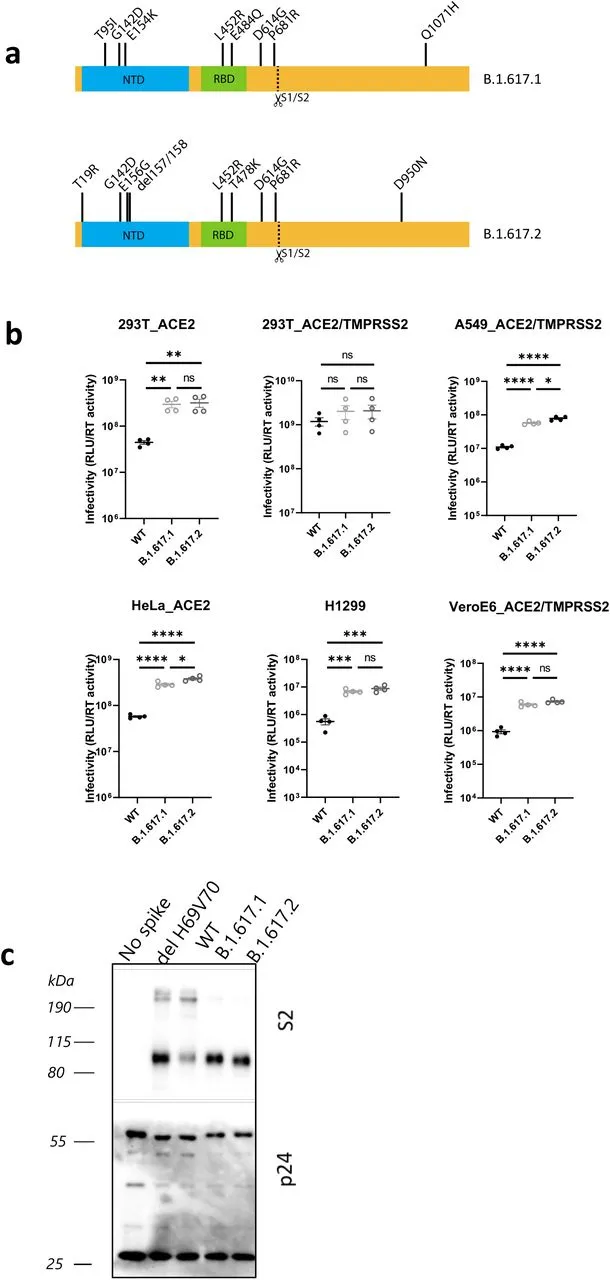
扩展数据图 3:B.1.617.2刺突促进侵入细胞
a.用于细胞进入PV实验的刺突质粒的突变图。b.通过B.1.617.1刺突和B.1.617.1对293T细胞产生的WT (Wuhan-1 D614G) PV进行单轮侵染。数据代表了三个独立的实验。使用未配对学生t检验进行统计。c.对转染293T的上清液进行Western blotting,检测PV中的S2和p24,未发现刺突控制。
SARS-CoV-2 B.1.617.2刺突增加合胞体的形成
在动物模型中,质膜的进入途径,以及实际上的传播能力,关键依赖于S1和S2 之间的多碱基切割位点(PBCS)和病毒粒子从生产细胞释放前的刺突切割;这与内体进入途径不同,内体进入途径不需要在产生细胞中切割刺突。在多个SARS-CoV-2谱系中,PBCS中P681的突变已被观察到,最明显的是在B.1.1.7 Alpha变体中。我们之前的研究表明,携带P681H的B.1.1.7刺突具有明显高于D614G武汉-1病毒的融合潜力。在这里,我们使用split GFP系统检测B.1.617.1和B.1.617.2 刺突,以监测细胞-细胞融合(图4a, b, c)。我们将带有刺突的质粒转染到稳定表达Split-GFP两个不同部分的Vero细胞中,使GFP信号在细胞融合后随时间变化而变化(图4d)。与WT相比,B.1.617.1和B.1.617.2刺突蛋白介导的融合活性和合胞体形成更高,与B.1.1.7相似(图4d,e)。单个P681R突变能够再现这一表型(图4d,e)。最后,我们探讨了疫苗后血清是否可以阻断合胞体的形成,因为这可能是疫苗预防发病的一种机制。我们滴定了ChAdOx-1疫苗接种者的血清,结果表明,细胞-细胞融合确实可以被抑制,这种抑制方式反映了血清对PV感染细胞的中和活性(图4f)。因此,B.1.617.2可能在呼吸道中诱导细胞-细胞融合,甚至在接种中和抗体的个体中可能具有更高的致病性。
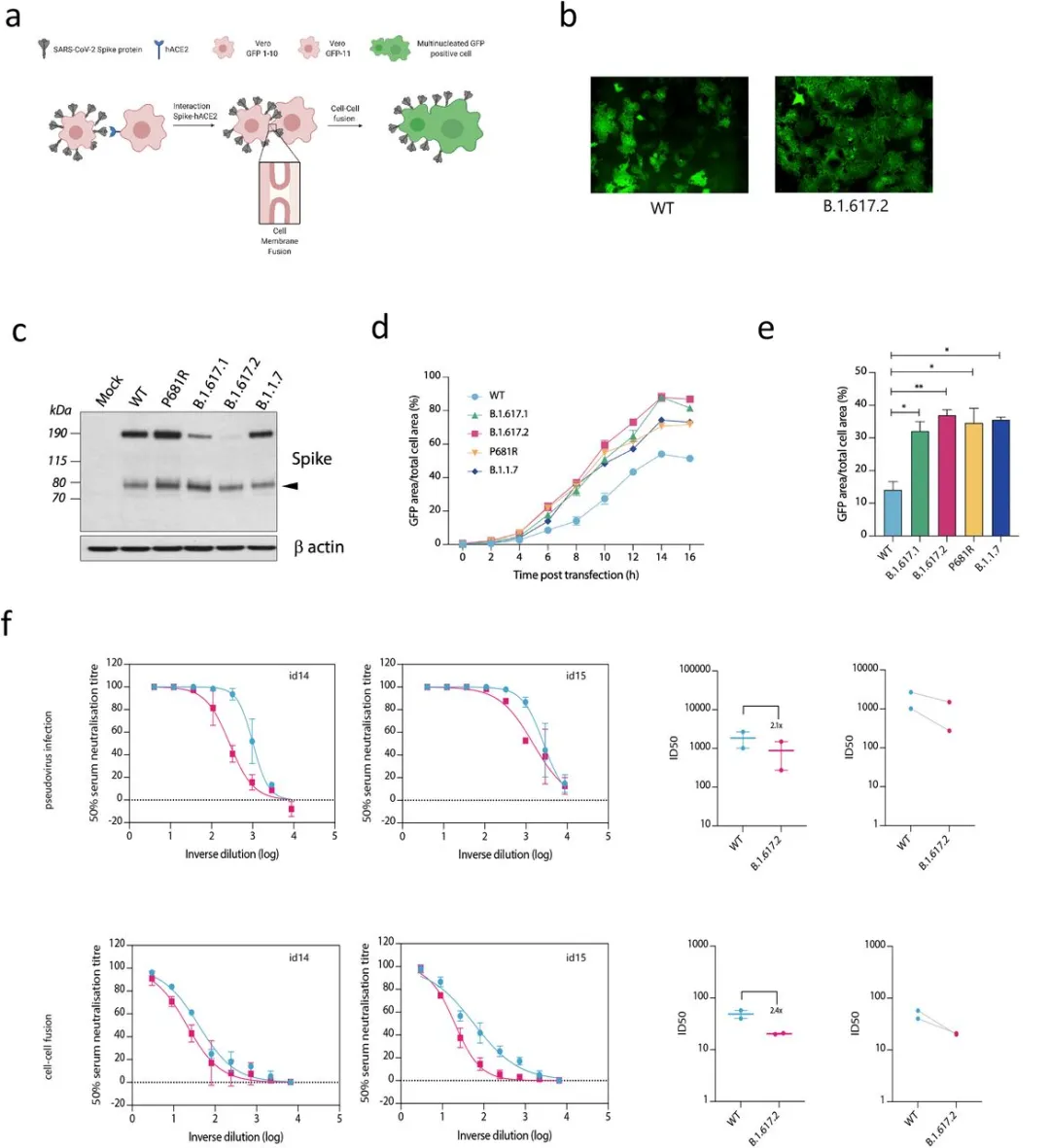
图4:B.1.617.2 Delta变体刺突赋予加速的细胞-细胞融合活性,可被血清中的抗刺突中和抗体阻断。
a.细胞-细胞融合实验原理图。b.GFP阳性合胞体形成10小时后的重建图像。标尺为400 mm。c.转染刺突质粒48小时后细胞裂解液的western blot。Anti-S2抗体。d,e.细胞-细胞融合动力学的定量显示绿色面积占总细胞面积随时间的百分比。平均值用代表SEM的误差线绘制。f.比较疫苗接种后血清(n=2)对PV中和(上)和细胞-细胞融合(下)的影响,比较WT和Delta变种B.1.671.2。这些数据至少代表了两个独立的实验。
已接种疫苗的医护人员中的 SARS-CoV-2 B.1.617.2 突破性感染
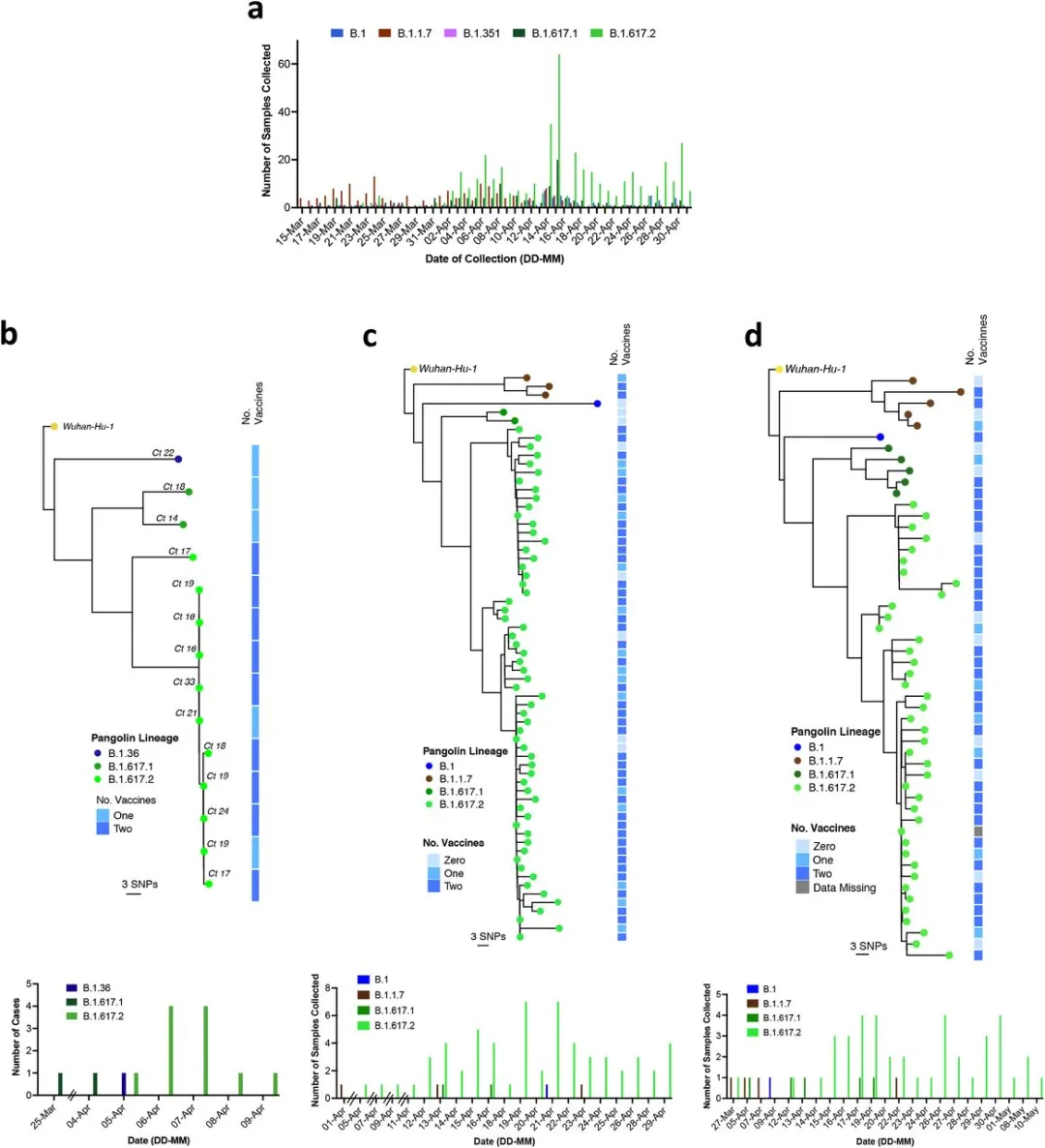
迄今为止,我们已收集到流行病学和生物学证据,表明B.1.617.2的生长优势可能与病毒复制/传播能力的增加以及由于逃避先前感染的中和抗体而导致的再次感染有关。我们假设疫苗对B.1.617.2的有效性相对于其他流行变异株会打折扣。尽管印度2021年第一季度全国疫苗接种率总体较低,但卫生保健工作者(HCW)已于2021年初开始使用ChAdOx-1疫苗(Covishield)进行疫苗接种。在3月和4月的感染浪潮中,通过对鼻咽拭子(年龄范围为27-77岁)的RT-PCR,在德里一个三级中心3800名全体工作人员中的30名接种人员中确认了有症状的SARS-CoV-2暴发。来自印度的基因组数据显示,2021年第一季度,B.1.1.7总体优势(图1a)和德里地区优势(图5a), 2021年3月B.1.617有所增长。到2021年4月,在向GISAID报告的604种德里基因序列中,有385种为B.1.617.2。对HCW疫情中有症状个体的短读测序显示,大多数为B.1.617.2,还有一系列其他B系病毒,包括B.1.1.7和B.1.617.1(图5b)。尽管一名医护人员接受了氧疗,但没有病例需要通气。系统发育分析显示了一组高度相关的,在某些情况下,在彼此相隔一两天内采样的遗传模糊序列(图5b)。这些数据与来自受感染个体的单一传播一致,构成了过度扩散或超级传播者事件。接下来我们更详细地研究了疫苗接种病例的历史。几乎所有人都至少在21天前接受过两次注射,而第二次注射后的中位数时间是27天。
图5.接种疫苗的医护人员感染 SARS-CoV-2 B.1.617.2
a.2021年3月至4月的六周内,发生在德里的最常发生的五种SARS CoV-2谱系的病例频率。b-d.介绍了三个中心接种的HCW中疫苗突破SARS-CoV-2序列的最大似然系统发育。用IQTREE2和1000个引导重复进行系统发育推断。系统发育树以Wuhan-Hu-1为基础,以穿山甲v.2.4.2为谱系进行注释。每个人接受的COVISHIELD (ChAdOx-1)疫苗接种数量由右侧的热图显示。空白表示缺少数据。在每棵树的底部是按测试日期绘制的案例频率图。
我们在德里的另外两个卫生设施获得了类似的关于疫苗突破性感染的数据,这两个卫生设施分别有1100名和4000名医务人员(图5 c-d)。在第2家医院,有118个序列来自有症状的非致命感染,在4周内占劳动力的10%以上。筛选后,我们用66个高质量的全基因组覆盖率>95%的系统发育序列重建系统。在第3家医院中,有70个有症状的、非致命的感染产生了基因组,其中52个高质量的基因组在过滤后用于推断系统发育(图5c-d)。正如在社区中传播的变异所预料的那样,我们观察到B.1.617.2占疫苗突破性HCW感染的主导(图5 c-d)。
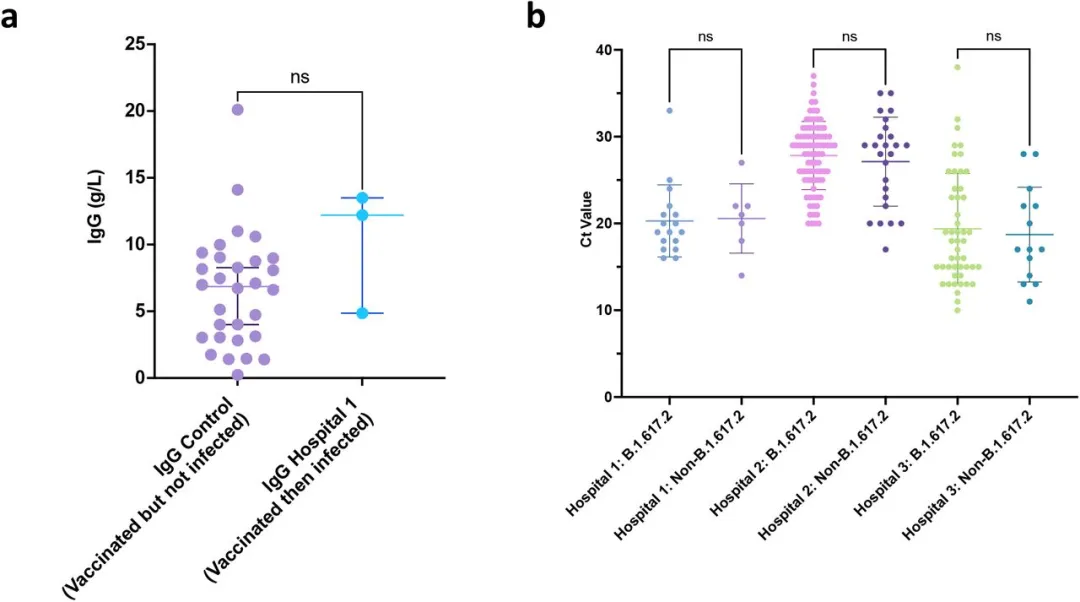
在三个中心,我们注意到感染B.1.617.2和非B.1.617.2的患者的中位年龄相似[36.5和32.5,p=0.56,(扩展数据表3)]。有一半的突破性感染病例是女性,不管其变异情况如何。我们观察到B.1.617.2感染和非B.1.617.2感染的中位症状持续时间没有显著差异(分别为1.5天和1.0天,扩展数据表3),这与有效的有症状人员的检测一致。大约5%的有症状感染导致住院治疗,没有证据表明B.1.617.2与住院的风险更高有关(扩展数据表3)。对随后突破感染的有限医护人员样本中的疫苗反应程度进行了测量,结果与随后未检测出 SARS-CoV-2 阳性的医护人员对照组的反应相似(扩展数据图 4)。医院对阳性样本的 Ct 值分析未显示感染 B.1.617.2 与非 B.1.617.2 的医护人员之间存在显著差异(扩展数据图 4)。
扩展数据图 4:在接种疫苗的医护人员 (HCW) 中出现的SARS-CoV-2 突破感染
a.对照组(未感染SARS-CoV-2的接种过两剂ChadOx-1疫苗的个体)与接种过两剂并随后检测出SARS-CoV-2阳性的接种过疫苗的医护人员之间的IgG抗体滴度比较。b.医院HCW检测阳性的鼻/喉拭子Ct值。条形图代表均值和95% CI。用Student t test比较Ct值。
接下来,与其他谱系相比,我们评估了B.1.617.2对HCW中针对症状性感染的疫苗有效性(VE)的影响。在观察性研究方面,试验阴性病例对照方法将是理想的。鉴于在我们的HCW环境中缺乏检测阴性数据,我们使用了一种替代方法来估计英国公共卫生(PHE)使用的VE。如果疫苗对B.1.617.2和非B.1.617.2有同样的效果,预计在接种疫苗和未接种疫苗的个人中,B.1.617.2和非B.1.617.2突破病例的比例将相似。然而,在我们的HCW中,与未接种疫苗的病例相比,完全接种疫苗组的症状病例中分离出的非B.1.617.2的比例较低(扩展数据表4)。我们使用多变量logistic回归来估计接种 B.1.617.2 与非 B.1.617.2 的检测阳性相对于未接种疫苗的个体的比值比,并根据年龄、性别和医院进行调整。在两次疫苗剂量中,B.1.617.2相对于非B.1.617.2的调整优势比为5.45 (95% CI 1.39-21.4, p=0.018)(扩展数据表4)。由于研究时间较短,通常与疫苗接种状态相关的日历时间不太可能是一个显著的混杂因素。该分析虽然局限于相对较少的非B.1.671.2感染,并可能受到未测量混杂因素的影响,但仍与英国的数据一致,非B.1.617.2感染主要是B.1.1.7。
讨论
在这里,我们结合了体外实验和分子流行病学,提出增加复制适应度和降低SARS-CoV-2 B.1.617.2对中和抗体的敏感性,有助于B.1.617.2快速取代B.1.1.7和其他谱系在印度、英国、美国(https://www.gisaid.org)等其他国家的流行,尽管在这些国家成人疫苗接种率高和/或以前感染的流行率高。
我们证明了一种B.1.617.2活病毒与康复患者的血清以及接种了两种不同疫苗(一种基于腺病毒载体(ChAdOx-1),另一种基于mRNA (BNT162b2))的个人血清之间的中和抗体逃逸。我们关于B.1.617.2对疫苗诱导血清敏感性降低的研究结果与其他报告类似 ,包括与 BNT162b2 相比,两剂 ChAdOx-1 后 GMT 较低。虽然我们没有绘制相关的突变图,但之前的研究表明,刺突RBD中的L452R和T478K以及刺突NTD突变可能都与此有关。NTD在入侵细胞的效率和抗体逃逸方面的重要性日益被认识到,需要进一步的工作来绘制B.1.617.2 NTD的特定决定因素。
我们还报告了ChAdOx-1疫苗在德里三家医院的卫生保健工作者中的突破性感染。这些感染主要是B.1.617.2,还有包括B.1.1.7在内的其他谱系的混合,反映了社区感染的流行情况。在HCW分析中,我们评估了B.1.617.2与其他谱系相比的ChAdOx-1疫苗的相对VE,发现在两次接种后,与非B.1.617.2相比,有B.1.617.2的ChAdOx-1疫苗的症状感染和疾病几率增加。这些数据表明,对B.1.617.2的VE降低,支持B.1.617.2的免疫逃避优势。
重要的是要考虑到粘膜表面感染的增加以及细胞-细胞融合和扩散也可能促进病毒从「抗体」中的逃逸。事实上,我们的研究也表明,B.1.617.2在包括HAE和3D气道类器官在内的生理相关系统中比B.1.1.7具有适应优势,在这些系统中细胞游离和细胞-细胞感染可能同时发生。这些数据支持 B.1.617.2 更高传染性的概念,要么是由于更高的病毒负荷,要么是更高的颗粒传染性,导致更高的人际传播概率。我们注意到,与B.1.1.7相比,B.1.617.2活病毒颗粒含有更高比例的裂解的刺突,并推测这可能与侵袭力增加的机制有关。与这一假设一致,我们观察到携带B.1.617.2 刺突的PV粒子显著增强了进入靶细胞的能力。
在印度,B.1.617.1变体比B.1.617.2早发现,B.1.617.2优于B.1.617.1的原因尚不清楚。我们报道,与B.1.617.1相比,B.1.617.2在肺细胞中具有复制优势,这反映在由刺突驱动的PV进入优势。鉴于我们的数据显示,B.1.617.2和B.1.617.1的刺突对疫苗接种者的血清具有相似的敏感性,所以更强的适应力是B.1.617.2优于B.1.617.1的增长优势的一个简单的解释。
由PBCS介导的病毒感染性和融合性是致病性和传染性的关键决定因素,有迹象表明巨细胞/合胞体的形成与致命疾病相关。因此,刺突裂解和刺突裂解的稳定性可能是未来SARS-CoV-2变体的关键参数。与B.1.1.7相比,B.1.617.2刺突表现出类似的合胞体形成动力学,可能与P681R有关。我们发现,疫苗诱导的血清可以抑制合胞体的形成,而这种细胞-细胞融合的阻断作用受到B.1.617.2的影响,这也可能允许病毒从一个细胞传递到另一个细胞,从而逃避疫苗接种后产生的中和抗体。
包含casirivimab和imedevimab的REGN-COV2双单克隆抗体治疗被证明可以提高非B.1.617.2感染的存活率。imedevimab 对 B.1.617.2 的疗效降低可能转化为临床疗效受损。此外,它可能导致在免疫受损和慢性 SARS-CoV-2 感染 B.1.617.2的情况下的逃逸变体的选择。迫切需要进一步探索这些可能性。
尽管已经证明至少有三种疫苗具有抗B.1.351(对中和抗体最不敏感的变种)感染的保护作用,进展为严重疾病和死亡的几率很低。因此,在人口规模上,广泛的疫苗接种可能会预防由B.1.617.2引起的中度至重度疾病。事实上,来自英国的数据已经表明,接种疫苗者中严重疾病的发病率很低(PHE技术报告17)。然而,鉴于医院经常治疗因合并症而对疫苗接种免疫反应不佳的个体,我们关于疫苗突破和疫苗对有症状的 B.1.617.2 感染有效性降低的数据令人担忧。这些患者在感染HCW后可能面临严重疾病的风险,事实上,我们在这里记录了一个涉及接种HCW疫苗的感染的超级传播事件。因此,加强疫苗对变异反应的策略是必要的,在后疫苗时代需要关注感染控制程序。
参考文献来源:Petra Mlcochova, Steven Kemp, Mahesh Shanker Dhar,et al. SARS-CoV-2 B.1.617.2 Delta variant replication, sensitivity to neutralising antibodies and vaccine breakthrough. 2021: p. 2021.05.08.443253.(https://doi.org/10.1101/2021.05.08.443253)
该译文已得到:Partha Rakshit, Anurag Agrawal, Ravindra K. Gupta1,等三位通讯作者邮件授权同意。
参考文献更新:该文章已发表于9月份Nature杂志上:Mlcochova P, Kemp SA, Dhar MS, et al. SARS-CoV-2 B.1.617.2 Delta variant replication and immune evasion [published online ahead of print, 2021 Sep 6]. Nature. 2021;10.1038/s41586-021-03944-y. doi:10.1038/s41586-021-03944-y
专家介绍

李鸿茹
医学博士,福建省立医院呼吸与危重症医学科主任医师,福建医科大学副教授,硕士生导师。福建医科大学呼吸内科整合医学负责人,福建省呼吸病学分会青委会副主任委员,中国医药教育协会肺癌专委会青年委员,中国肺癌防治联盟肺癌免疫治疗委员会委员,中国医药教育协会慢性气道疾病专委会青年委员,福建省抗癌协会肺癌专委会青年委员,福建省海峡肿瘤防治科技交流协会肿瘤临床研究协作分会理事,《THORAX》青年编委,《中国实验动物学报》通讯编委,《中国比较医学杂志》通讯编委。
参与国家重大专项“十二五、十三五”及“863”课题,主持国自然青年基金一项,省厅级课题多项,发表SCI论文20余篇。曾获福建省科学技术三等奖1项,福建省自然科学优秀论文2次,曾获全国中青年呼吸医师论坛优秀论文奖及全国呼吸年会优秀论文奖。
2020年初援鄂抗击新冠肺炎,后作为中国赴菲律宾专家组成员援助菲律宾,工作受到国家卫健委肯定和表扬。获“全国卫生健康系统新冠肺炎疫情防控工作先进个人”表彰获“省直机关最美逆行者”称号。2021年9月因福建莆田新冠疫情局部爆发再次赴莆田抗疫。

钟文
福建医科大学省立临床医学院2021级(“5+3一体化”)硕士研究生,导师:福建省立医院呼吸与危重症医学科李鸿茹主任医师,福建医科大学副教授。研究方向:病毒性肺炎发病机制。
特别感谢李鸿茹老师给《呼吸界》的投稿!