社区获得性肺炎(community-acquired pneumonia,CAP)是一组高度异质性疾病,病原体千差万别、宿主免疫状态不一、对病原体的免疫应答程度也不相同,结局高度异质。相当比例CAP患者病情进展很快,预后不佳。因此,CAP的早期评估和预测CAP病情轻重具有重要临床意义。
1、感染宿主常规标志物:PCT
CAP的发病率高,约1.5-14.0例/1000人/年,住院患者的短期死亡率(30天死亡率)约4.0%-18.0%,入住重症监护病房治疗的重症CAP患者死亡率可高达50%。感染CAP的病原体包括细菌、病毒、真菌、非典型病原体等,随着精准治疗概念的普及,以及多项研究发现早期鉴别病毒感染与细菌感染,有助于区分机体发生的不同炎症反应,直接决定或指导CAP患者的临床治疗方案,影响患者预后,降低CAP死亡率和抗生素不适当使用率。故而,临床上对CAP病原学诊断的需求日益显现。
1.1 降钙素原(procalcitonin, PCT)
降钙素原(procalcitonin, PCT),是临床上常见的感染宿主标志物,也是区分细菌感染和病毒感染的重要指标。PCT在反映细菌感染具有较好的动力学特征,在细菌感染后3~4h即可检测到PCT升高,6~12h内达峰值,感染控制后24h内下降约50%。因此,PCT在监测CAP患者病情进展和指导抗生素使用方面显示出了良好的应用价值(图1)[1]。
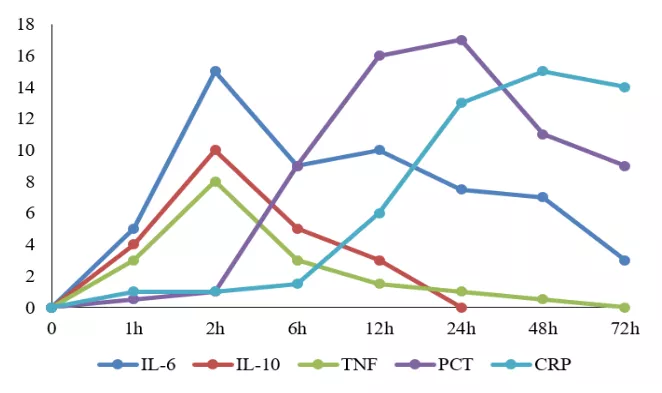
图1:PCT及其他标志物在细菌感染时浓度变化
1.2 降钙素原指导抗生素使用策略
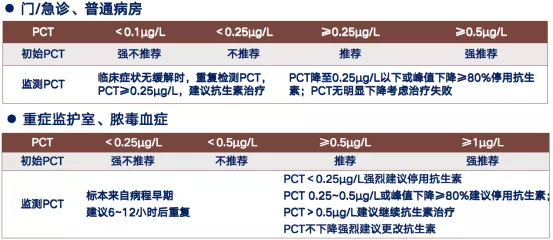
降钙素原指导抗生素使用主要取决于PCT的水平。对于门/急诊、普通病房的患者,若PCT<0.25ug,不推荐使用抗生素;若PCT≥0.25ug,推荐或者强烈推荐使用抗生素。而对于重症监护室(ICU)、脓毒血症(sepsis)的患者,PCT<0.25ug时,基本不推荐使用抗生素类药物。实际临床治疗过程中,多数采用不同级别的抗生素进行治疗(表1)[2]。
表1:降钙素原指导抗生素使用策略
1.3 PCT对阴性杆菌性CAP的表达水平不高
研究表明,PCT处于高水平时,金黄色葡萄球菌、肺炎链球菌等革兰氏阳性球菌检出居多,而当PCT处于低水平时,病原体检出以肺炎克雷伯菌、大肠埃希氏菌等革兰氏阴性杆菌检出明显增多。因此,在临床上,细菌性CAP阴性杆菌PCT分层处于较低水平,难以发挥其指导抗感染药物的作用(图2)。
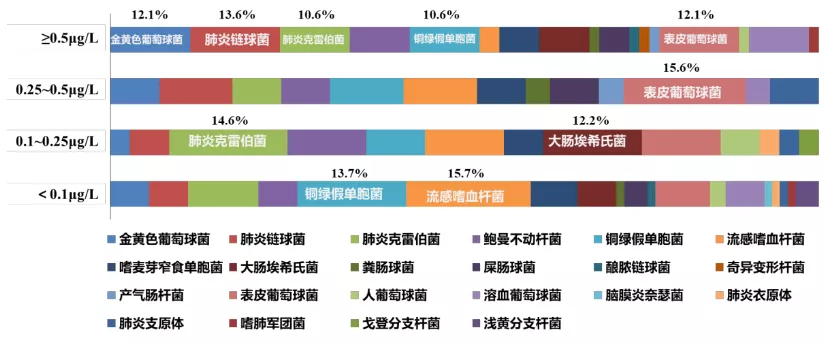
图2:不同细菌感染的PCT水平
1.4 PCT分层在病毒性CAP时呈高度异质性
对于收集的病毒性肺炎的研究显示,病毒,特别是流感病毒、腺病毒,在各PCT水平等级内均有相当高比例检出病毒性CAP患者的PCT分层呈高度异质性(图3)。
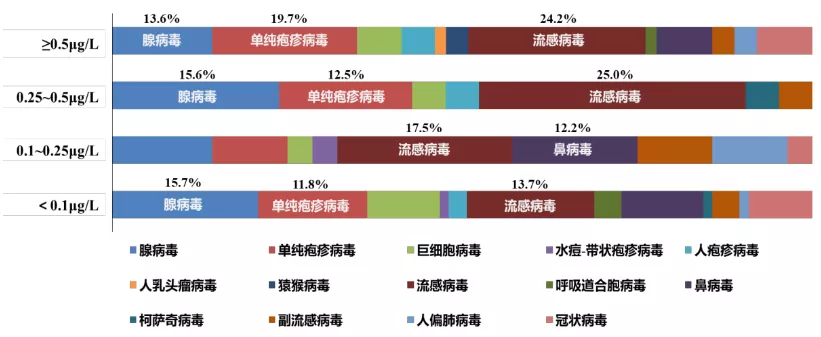
图3:不同病毒感染的PCT水平
PCT对于感染CAP的宿主而言,是常规标志物,但效能欠佳。
2、迫切需要探寻宿主新型感染分子标志物
在生命科学领域中,代谢组学(metabolomics/metabonomics)与基因组学(genomics)、转录组学(transcriptomics)、蛋白质组学(proteomics)共同构成了系统生物学(systems biology)。基于系统生物学的快速发展,人们在基因组、转录组、蛋白质组、代谢组学层面发现了多种可用于CAP诊断、严重程度及预后评估的生物标志物,为我们理解CAP这一疾病提供了新视点。
2.1 代谢组学及代谢表型定义:
代谢组学是一种通过分析化学方法来研究代谢物组中小分子物质及其变化规律的科学,可检测分子量在1000Da以内的小分子物质。代谢处于生命活动调控的末端,因此代谢组学比基因组学、蛋白质组学更接近表型。基因型、生活方式、饮食、营养、药物治疗、环境暴露和肠道微生物群之间复杂相互作用的表型结果现在可以通过在分子水平上对内源性和外源性代谢物进行全面的识别和量化。2000年Gavaghan等人提出「代谢表型」(metabolicphenotype,或简称metabotype)的概念,将代谢表型定义为「基于对生物体的细胞类型、生物体液或组织的分析,对生物体在给定生理状态下的一种可能的多参数描述」。NabilSemmar进一步完善了代谢表型的定义,指出人们可以分析:(1)代谢物的有无;(2)代谢物的浓度水平;(3)不同代谢物之间的相对水平(比例);(4)不同代谢谱——通过多种代谢物水平表征生物系统中不同结构和功能状态四个方面来实现生物体的代谢分型。代谢组学作为生物医学研究新兴领域,在判断疾病状态,揭示疾病潜在分子机制,区分疾病亚型,实现基因型功能定义等发挥重要作用。目前代谢组学已广泛应用于慢阻肺、哮喘、ARDS、肺栓塞等呼吸系统疾病研究中。
2.2 代谢组学广泛应用于肺炎相关研究
近年来已有多项研究基于不同的检测手段、检测平台和研究目的分析了肺炎特异性代谢物。我们对既往文献中报道的在肺炎或脓毒症显著改变的代谢物进行回顾,主要集中于四大类:类固醇激素、生物胺、能量代谢中间产物以及生物活性脂质。改变形式包括代谢物的浓度变化、不同代谢物的相对比例变化以及代谢谱变化。具体研究成果如下:
(1)类固醇激素:皮质醇、脱氢异雄酮(DHEA)、DHEAS水平变化等与CAP患者的PSI、全因死亡率相关;
(2)生物胺:精氨酸、色氨酸衍生物水平在脓毒症死亡与存活患者中存在差异;
(3)能量代谢物:乳酸、谷胱甘肽浓度与脓毒症死亡率相关;
(4)生物活性脂质:神经酰胺、溶血磷脂酰胆碱水平在脓毒症患者中升高[3~9]。
2.3 代谢组学对肺炎病情和预后评估的应用
2.3.1 血清代谢组学对肺炎病情和预后评估的研究
血清非靶向代谢组学离子流色谱图的研究显示,非重症社区获得性肺炎(NSCAP)组、重症社区获得性肺炎(SCAP)组和健康对照组的样本总离子流色谱图色谱峰形状具有一致性,表明该研究中样本前处理方法效果良好,LC-MS仪器平台运行稳定,可保证后续多变量统计分析的可靠性。但组间谱峰响应、谱峰信号的差异,提示CAP患者血清代谢成分及浓度发生了变化。
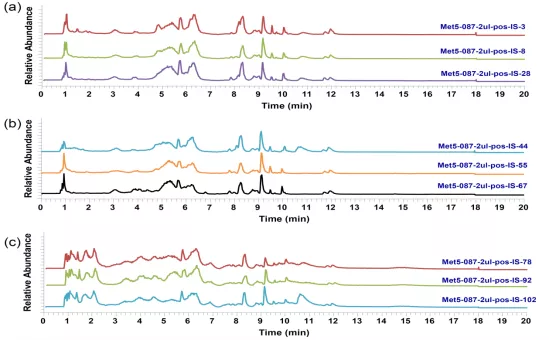
图4:三组患者血清样本TIC图
注:横坐标为保留时间(RT),纵坐标为峰强度,不同峰代表不同化合物。(a)非重症CAP组3例患者(样本编号:3、8、28)TIC图;(b)重症CAP组3例患者(样本编号:44、55、67)TIC图;(c)对照组3例受试者(样本编号:78、92、102)TIC图。
可见每组内3份样本色谱峰形状有高度一致性。与健康对照组(c)相比,(a)、(b)CAP患者在1-2min谱峰数量和强度明显减少,3-5min谱峰响应减弱,9-10min谱峰信号增强,提示CAP患者血清代谢成分发生变化。
2.3.1.1 与CAP发病相关的血清代谢通路
血清非靶向代谢组学研究发现,与健康对照组相比,15种代谢产物水平发生显著变化(图5)。与非重症CAP患者相比,重症CAP患者血清中8种代谢产物水平有显著差异。重症CAP组血清中二氢鞘氨醇、植物鞘氨醇、肌酸、乳酸及甲氧基乙酸水平高于非重症CAP组,DHEA-S、L-精氨酸及4-羟基苯磺酸水平低于非重症CAP组[10]。
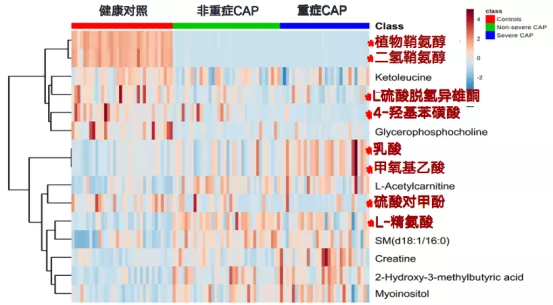
图5:CAP患者与健康对照组血清中15种差异代谢产物相对峰面积热图
注:class红色为健康对照组,绿色为非重症CAP组,蓝色为重症CAP组。横轴代表每个样本,纵轴代表15种显著差异代谢产物。深红色表示代谢产物水平较高,淡蓝色表示代谢产物水平较低。
分别对CAP患者中筛选出的15种代谢产物进行拓扑通路分析,发现与健康对照相比,CAP患者的鞘脂通路、精氨酸和脯氨酸代谢通路、丙酮酸代谢通路、磷酸肌醇代谢通路发生显著变化(图6)[10]。

图6:代谢通路拓扑分析所得气泡图
注:每个气泡代表一个代谢通路,气泡所在横坐标及气泡大小表示该通路在拓扑分析中的影响大小,气泡越大,表明影响越大;纵坐标及气泡颜色表示富集分析的p值(取负常用对数,即-log10 p value),p值越小,颜色越深,富集程度越显著,表明该通路中匹配到的化合物越多,横坐标Pathway impact>0.1的为关键通路。
2.3.1.2 与CAP发病相关的血清差异代谢物定量分析
(1)二氢鞘氨醇(Sphinganine):与健康对照组相比,鞘脂代谢通路的二氢鞘氨醇的水平在CAP组明显降低,SCAP组比NSCAP组高(图7)。
(2)硫酸脱氢异雄酮(DHEA-S):与对照组相比,皮质醇代谢通路中的DHEA-S水平低于CAP组。随着病情加重,CAP患者血清中DHEA-S的水平持续降低(图7)。其原因可能是当人体感染危重状态时,下丘脑-垂体-肾上腺皮质轴激活、皮质醇释放昼夜节律受到干扰,导致血液中DHEA和DHEA-S降低。
(3)乳酸(Lactate):乳酸是葡萄糖无氧代谢的最终产物,CAP患者机体在缺氧条件下,NADH蓄积,乙酰CoA生成受抑制,葡萄糖无氧酵解增强,导致乳酸含量增加。研究发现CAP患者血清中乳酸浓度显著高于健康对照组,且与非重症CAP患者相比,重症CAP患者血清中乳酸浓度持续升高(图7)。
(4)硫酸对甲酚(p-Cresol sulfate):微生态代谢通路的p-Cresol sulfate是一种人-微生物共有代谢产物,参与慢性肾脏疾病及心血管疾病的发生发展。CAP患者血清中p-Cresol sulfate含量较健康对照组降低,但SCAP组的p-Cresol sulfate水平高于NSCAP组(图7)。体外实验显示其可减少细胞表面分子如IL-12 p40及p70生成,而增加IL-10产生,继之抑制单核巨噬细胞表面脂多糖诱导的CD-40表达,因此其有可能抑制单核巨噬细胞防御功能,参与机体免疫防御过程[11]。
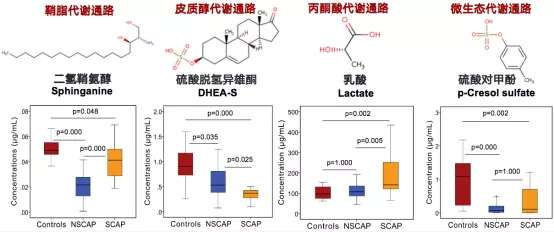
图7:CAP血清差异代谢物定量分析
2.3.1.3 可用于区分CAP与健康对照组的候选生物标记物ROC曲线
二氢鞘氨醇、硫酸对甲酚、DHEA-S 3种物质的AUC(Area Under Curve)均大于0.7,因此这3种物质具有较好的区分CAP与健康对照组的能力,但三种代谢物敏感性、特异性欠佳,将其联合作为代谢物标志组进行协相关Logistic回归后,其AUC(95% CI)为0.954(0.901-1.000),敏感性为90.0%,特异性为94.1%。血清中三种物质区分CAP与健康对照者的最佳浓度阈值分别为二氢鞘氨醇<0.040μg/mL,硫酸对甲酚<0.209μg/mL,DHEA-S<0.728μg/mL(图8)[10]。
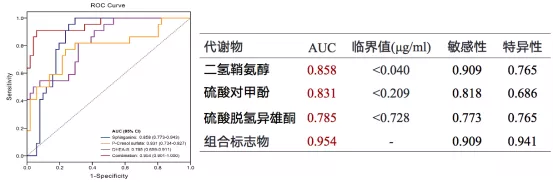
图8:CAP与健康对照组的候选生物标记物ROC曲线
2.3.1.4 可用于区分SCAP与NSCAP的候选生物标记物ROC曲线
二氢鞘氨醇、乳酸、DHEA-S 3种物质区分重症与非重症CAP的AUC均大于0.7,优于ESR、CRP及PCT的AUC,但不及CURB-65、PSI评分。3种代谢产物联合后AUC可达0.911,敏感性为83.7%,特异性为96.9%,高于CURB-65和PSI评分(图9)。3种代谢产物区分重症与非重症CAP的浓度阈值分别为二氢鞘氨醇>0.030μg/mL,乳酸>120μg/mL,DHEA-S<0.431μg/mL(图9)。
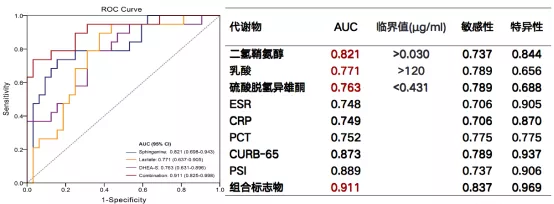
图9:SCAP与NSCAP的候选生物标记物ROC曲线
2.3.2 血清脂质组学对肺炎病情和预后评估的研究
NSCAP、SCAP患者与HC组血清脂质谱的主成分分析(principal component analysis,PCA)图可见:三组间脂质谱表现出明显的组内聚类和组间分离,说明无论是CAP患者与HC组相比,还是NSCAP组与SCAP组对比,患者的血清脂质谱发生了显著变化。经筛选,最终发现4种磷脂酰胆碱(phosphatidylcholine, PC)小分子与CAP患病、病情严重程度及预后密切相关,可作为预测CAP患病及病情加重的潜在生物标记物,分别是PC(16:0/18:1)、PC(18:2/20:4)、PC(36:4)和PC(38:6)。SCAP组生物标记物的水平与健康对照组及NSCAP组相比,磷脂酰胆碱PC (16:0_18:1)小分子脂质水平显著增高,其他小分子脂质均降低(图10-11)[12]。

图10:NSCAP、SCAP患者与HC组血清脂质谱PCA图
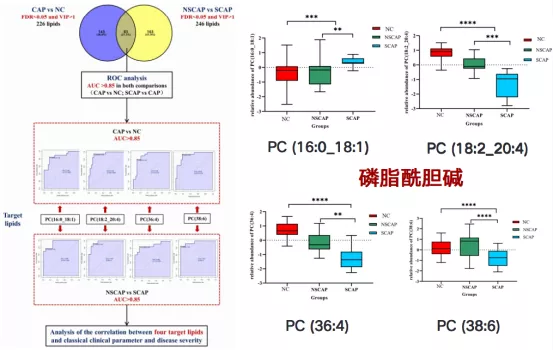
图11:NSCAP、SCAP患者与HC组中4种PC类筛选和水平标记图
2.3.2.1 血清脂质组学筛选区分CAP患病及疾病进展的脂质AUC
4种PC类小分子脂质在区分CAP组及健康对照组,区分重症CAP患者组及30天内死亡结局患者中,均展现出很高的灵敏性及特异性。预测患者30天内死亡,磷脂酰胆碱PC(16:0/18:1)的AUC高达0.885,预测性能优于CURB-65及PSI(图12)。
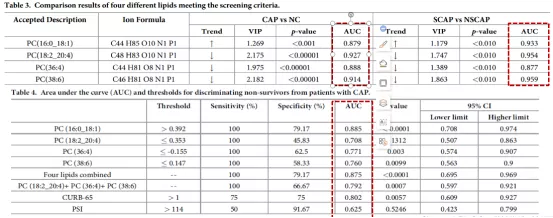
图12:筛选出的4种小分子脂质ROC分析
2.3.2.2 血清脂质丰度与患者住院时间及预后相关
以ROC分析中计算的最佳阈值为参考,将每个目标脂质按相对丰度排序,并重新分组为高丰度组(标准化后的相对丰度高于阈值)和低丰度组(标准化相对丰度小于阈值);与低丰度组相比,PC(16:0/18:1)高丰度组患者的住院时间显著延长(P <0.05)。随着CAP患者血清中PC(18:2/20:4)、PC(36:4)和PC(38:6)水平的逐渐降低,患者的住院天数也显著增加(所有P <0.05)。Kaplan–Meier曲线显示,PC(18:2/20:4、PC(16:0/18:1)、PC(36:4)和PC(38:2)的高丰度组和低丰度组间的30天死亡率有显著的统计学差异(P = 0.0035、0.0338、0.0340和0.0219)。因此,血清中特定脂质相对丰度的动态变化与疾病的进展和预后密切相关(图13)。

图13:PC(16:0/18:1)、PC(18:2/20:4)、PC(36:4)和PC(38:6)的高丰度组和低丰度组间的住院天数比较和患者30天死亡率的Kaplan–Meier分析
2.3.3 肺泡灌洗液代谢组学研究
2.3.3.1 与CAP发病相关的代谢通路
与健康对照组相比,CAP患者支气管肺泡灌洗液(BALF)中发生显著变化的有24种脂类物质和46种代谢产物。相关代谢通路分析显示6条关键代谢通路发生了改变,其中以鞘脂代谢通路改变最为显著。其余5条代谢通路分别为:甘氨酸、丝氨酸和苏氨酸代谢通路、生物素代谢、苯丙氨酸代谢、赖氨酸降解、精氨酸和脯氨酸代谢(图14)。
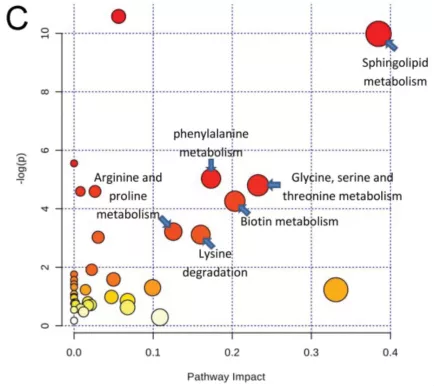
图14:CAP差异化合物通路拓扑结构图
发生显著改变的通路主要涉及中心碳代谢、氨基酸代谢、鞘脂代谢、脂肪酸β-氧化及尿素循环。CAP患者的整体代谢改变中以氨基酸(中间区域)和鞘脂(右上角区域)代谢改变最为显著(图15)。
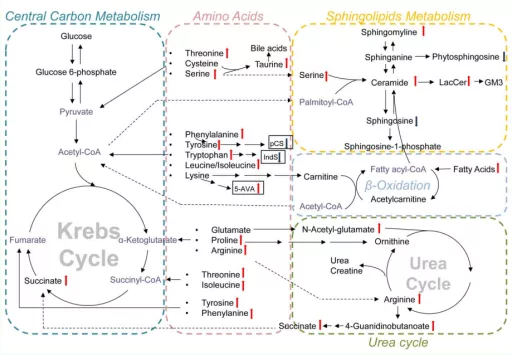
图15:CAP患者BALF中差异化合物富集通路图
注:红色箭头代表在CAP患者BALF中显著升高,蓝色箭头代表在CAP患者BALF中显著减少。黑框所示为3种细菌代谢产物:pCS,硫酸对甲酚;IndS,硫酸吲哚酚;5-AVA,5-氨基戊酸。
2.3.3.2 鞘脂代谢通路中各化合物丰度的变化
位于鞘脂代谢通路中的差异脂类共9种,包括2种神经酰胺(Cer)、1种鞘氨醇(So)、3种乳糖神经酰胺(LacCer),2种鞘磷脂(SM)和植物鞘氨醇(Pso)。在疾病组中,多数鞘脂代谢产物的丰度呈降低状态,部分鞘氨醇的浓度升高(图16)。

图16:神经酰胺合成途径及差异鞘脂在各组间表达情况
注:图中展示了神经酰胺合成的三个主要途径:橙色箭头,从头合成途径(由丝氨酸和棕榈酰辅酶A合成)、鞘磷脂酶途径(SM经鞘磷脂酶水解)、补救途径(So经神经酰胺合成酶合成)。红色箭头代表该脂质在CAP患者BALF中表达水平升高,蓝色箭头代表在CAP患者BALF中表达降低。紫色字体代表未在本次BALF质谱检测中未检出。虚线箭头引出的箱线图展示了相关鞘脂在各组间BALF样本的表达情况:红色箱形:重症CAP,SCAP;橙色箱形:非重症CAP,NSCAP;绿色箱形:健康对照,HC;蓝色箱形:疾病对照,DC GM3:单唾液酸四己糖神经节苷脂-3)。
2.3.3.3 硫酸对甲酚和硫酸吲哚酚可区分CAP与CTD-ILD
校正混杂因素后,微生物代谢产物硫酸吲哚酚(indoxyl sulfate, IndS)以及硫酸对甲酚(p-Cresol sulfate, pCS)在CAP与结缔组织病相关间质性肺炎(CTD-ILD)患者BALF中表达水平存在显著差异。CAP患者血清PCT或CRP联合BALF中IndS或pCs水平,可显著提高其对CAP和CTD-ILD的区分度(图17)。
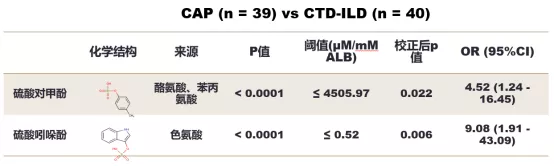
注:使用二元回归模型,对可能影响微生物代谢产物表达的因素进行校正,包括年龄、性别、吸烟史、近期抗生素使用史、近期糖皮质激素使用史、血清丙氨酸氨基转移酶(ALT)水平、血清总蛋白(TP)水平和血清肌酐(Cr)水平进行校正。校正模型中实验室指标采用的阈值分别为ALT > 80 U/L, TP < 60.0 g/L及Cr > 133µmol/L。
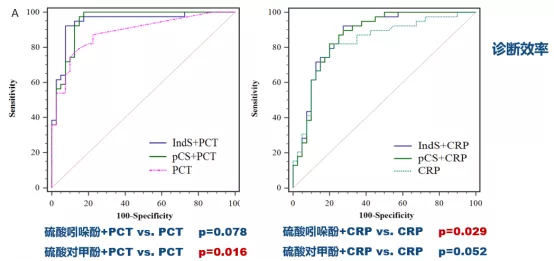
图17:ROC曲线分析显示验证队列中BALF硫酸吲哚酚(IndS)和硫酸对甲酚(pCs)水平可有效区分CAP和CTD-ILD
2.3.3.4 BALF脂质组成结构与气道炎症水平相关
肺泡灌洗液脂质代谢的构成包含不同表型,k-均值聚类分析将所有受试者分为3个脂质簇(lipidclusters),将其分别命名为LClus1(n=6)、LClus2(n=74)和LClus3(n=40)。三个脂质簇之间BALF多形核白细胞(PMN)比例及巨噬细胞比例存在显著差异(p< 0.0001),LClus1中PMN比例最高,LClus3中PMN最低,巨噬细胞比例则呈相反趋势。根据PMN浸润程度,将三个脂质簇分为强炎症反应组(LClus1)、中炎症反应组(LClus2)及低炎症反应组(LClus3),经检验,三组间炎症反应强度(强、中、低)与病情严重程度(分别以CURB-65、PSI、APACHE II评分分级)密切相关(图18)。
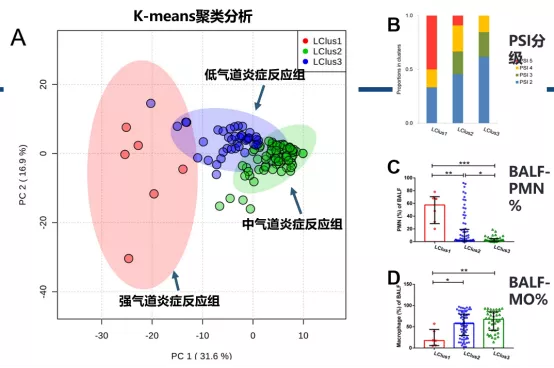
图18:不同BALF脂质簇间差异
图A. BALF样本PCA得分图。k-均值聚类法将所有受试者BALF样本分为3个脂质簇:红色圈内,LClus1;蓝色圈内,LClus2;绿色圈内,LClus3。
图B. 不同脂质簇间CAP患者的PSI分级组成。蓝色部分,PSI 2,即PSI评分51-70分;绿色部分,PSI 3,即PSI评分71-90分;黄色部分,PSI 4,即PSI评分91-130分;红色部分,PSI 5,即PSI评分131-395分。
图C. 不同脂质簇间BALF-PMN(%)差异。
图D. 不同脂质簇间BALF巨噬细胞(%)差异。可见LClus1中BALF-PMN(%),而巨噬细胞(%)最低。
2.3.3.5 特定脂质与气道炎症水平相关
鞘磷脂(d34:1)与BALF中巨噬细胞水平呈负相关(校正后r = -0.462, p < 0.0001),而磷脂酰乙醇胺(18:1p/20:4)与BALF中PMN水平呈正相关(校正后r = 0.541, p < 0.0001),如图19所示。这两种脂质表达水平与BALF中吞噬细胞(巨噬细胞及PMN)比例显著相关,有可能作为生物标记物来评估气道炎症反应程度。
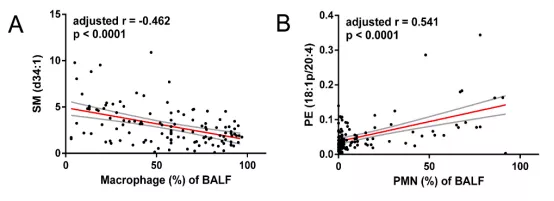
图:19 两种脂质与BALF中细胞成分呈显著相关
图A.SM (d34:1)与BALF中巨噬细胞比例呈负相关(校正后r = -0.462, p < 0.0001);图B.PE (18:1p/20:4)与BALF中PMN呈正相关(校正后r = 0.541, p < 0.0001)。红色为趋势线,灰色线之间区域代表95%置信区间。
2.3.4 脂质酶水平在预测CAP预测患病、严重程度及结局的研究
2.3.4.1 Lands循环
先前的研究发现重症肺炎患者血清及BALF中的溶血磷脂酰乙醇胺(LPE)水平明显下调,而磷脂酰乙醇胺(PE)水平显著上调;溶血磷脂酰乙醇胺酰基转移酶(lysophosphatidylethanolamine acyltransferase,LPEAT)是一种在Lands循环中将LPE酰化为PE的酰基转移酶(图20)。因此,重症患者中可能存在Lands循环的激活;
探究Lands循环中,LPE/PE转化的关键酶LPEAT与CAP疾病严重程度和30天死亡率的有明显相关性,LPEAT对早期预测病情及预后的确切作用[13]。
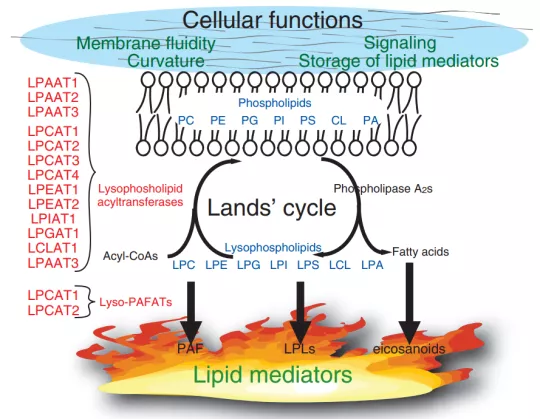
图 20:Lands循环图示
2.3.4.2 不同组血清中LPEAT水平
比较健康对照组(HC)、疾病对照组(DC)、非重症社区获得性肺炎组(non-SCAP)、重症社区获得性肺炎组(SCAP)患者血清中的LPEAT水平,结果发现:SCAP患者的LPEAT水平显著高于NSCAP组患者,30天内死亡患者的LPEAT水平明显高于存活者。各类型病原体感染患者的LPEAT水平组间无显著统计学差异(P = 0.9510)(图21)[12]。CURB-65得分高(3-4)的CAP患者的血清LPEAT水平显著高于其他患者(P <0.05)。高风险PSI(IV-V)的患者的LPEAT水平显著高于低风险PSI(I-II,III)的患者(P <0.0001,P<0.001)(图22)[13]
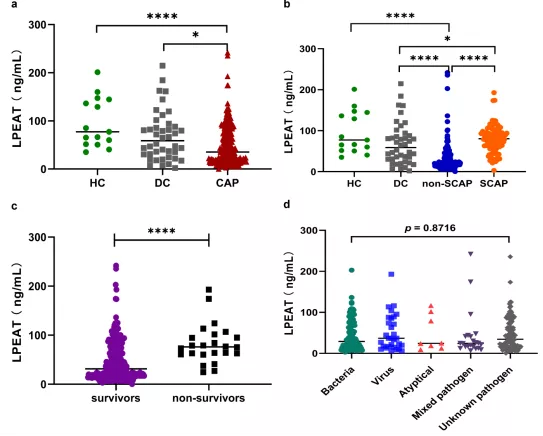
图21:多组受试者血清中溶血磷脂酰乙醇胺酰基转移酶(lysophosphatidylethanolamine acyltransferase,LPEAT)的水平
(a)健康对照组(HC),疾病对照组(DC)和CAP患者组的LPEAT水平。绿色圆点:HC组;灰色方块:DC组;红色三角,CAP组。
(b)HC,DC,NSCAP及SCAP患者的LPEAT水平。绿色圆点:HC组;灰色方块:DC组;蓝色圆点:NSCAP组;橙色圆点:SCAP组。
(c)入院30天内幸存者和死亡患者组的LPEAT水平。紫色圆点:幸存者组;黑色方块:最终死亡患者组。
(d)比较各类型致病病原体感染的CAP患者的血清LPEAT水平。感染病原体包括:细菌(绿色圆点),病毒(蓝色方块),非典型病原体(包括肺炎支原体,肺炎衣原体和肺炎军团菌)(红色三角)和混合病原体(紫色三角)。通过Kruskal–Wallis H检验进行比较,P> 0.05。

图 22:初入院时不同CURB-65评分及PSI评分患者血清中LPEAT水平
(a)初入院时不同CURB-65评分的CAP患者血清中LPEAT水平存在统计学差异。
(b)初入院时不同PSI评分的CAP患者血清中LPEAT水平比较。*P<0.05 **P<0.01 ***P<0.001 ****P<0.0001。
2.3.4.3 CAP患者血清中LPEAT水平与临床指标的相关性分析
患者入院时血清中LPEAT水平与CURB-65、PSI、呼吸频率、NEU%和NLR呈正相关(校正后),与LYM%呈负相关(校正后)(图23)[12]。

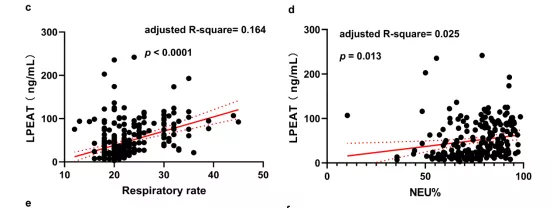
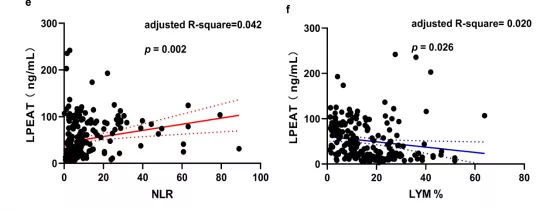
图 23:CAP患者血清中LPEAT水平与临床指标的相关性分析
患者LPEAT水平与CURB-65评分(a),PSI评分(b),呼吸频率(c),NEU%(d),NLR(e)呈显著正相关。LPEAT水平与患者LYM%呈负相关(f)。实线代表趋势线,虚线之间区域为95%置信区间。
2.3.4.4 入院时LPEAT水平预测CAP患者30天结局的效能分析
将CURB-65和PSI分别与LPEAT浓度结合,其AUC分别为0.883(0.837-0.920)和0.911(0.869-0.943)(图24 a),组合指标预测30天内死亡率的能力显著高于单个指标。
Kaplan–Meier生存曲线用于评估CAP患者血清中LPEAT水平与30天死亡率之间的关系(图24 b)。参照ROC分析计算出的最佳阈值58.54 ng/mL,将CAP患者按LPEAT检测浓度分为高LPEAT浓度组(血清浓度大于58.54 ng/mL)和低LPEAT浓度组(血清浓度小于或等于58.54 ng/mL)。结果显示:高、低LPEAT浓度组间的患者30天死亡率在统计学上有显著差异(log-rank c2=34.68,P<0.0001)。高LPEAT浓度组的CAP患者死亡风险是低LPEAT浓度组CAP患者的12.26(5.08-29.62)倍(图24 b)。
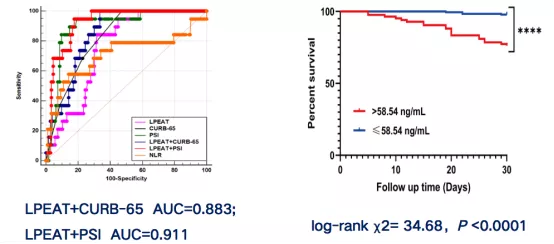
图24:入院时LPEAT水平预测SCAP患者及30天结局的ROC分析及组间30天死亡率Kaplan-Meier分析
小结
与CAP患病及病情进展、预后相关的小分子代谢物:
①血清代谢组学:二氢鞘氨醇、硫酸对甲酚、硫酸普拉睾酮、乳酸等;
②血清脂质组学:磷脂酰胆碱(PC),包括PC (16:0/18:1)、PC (18:2/20:4)、PC (36:4)、PC (38:6)等;
③BALF代谢组学:鞘脂类;
④脂质酶:溶血磷脂酰乙醇胺酰基转移酶(LPEAT)。
代谢组小分子与CAP病情严重程度及预后密切相关,既可作为相关标志物,也可用于机制探讨[10~14]。
参考文献
[1] Covington EW, et al. Pharmacotherapy, 2018, 38(5): 569-581.
[2] Schuetz P, et al. Clin Chem Lab Med, 2019.
[3] BMC Infect Dis, 2012.
[4] Crit Care Med, 2001.
[5] Crit Care, 2018.
[6] Thorax, 2015.
[7] Clin Sci (Lond), 2012.
[8] J Lipid Research, 2003.
[9] Mucosal Immunol, 2021.
[10] Ning et al. Critical Care (2018) 22:130.
[11] Toxicol Lett, 2016, 245:24-30.
[12] Chen et al. PLoS One (2021) 16:e0245770.
[13] Chen et al. Infection (2021) 10.
[14] Zheng et al. Respir Res (2019).
专家介绍

高占成
北京大学人民医院呼吸与危重症医学科主任,北京大学教授、主任医师、博士生导师,厦门大学医学院讲座教授、博士生导师,香港中文大学客座教授。
中华医学会呼吸病学分会常委,北京医学会呼吸病学分会副主任委员,北京中西医结合学会呼吸专业委员会副主任委员,中国残疾人康复协会「肺康复专业委员会」副主任委员,卫健委突出贡献中青年专家,卫健委新冠肺炎第2~8版指南编写专家组成员。
经历2003年SARS以来的中国历次突发急性呼吸道传染病公共卫生事件。承担着多项科技部、卫健委、“十一五”、“十二五”、“十三五”、 “十四五”和国家重点研发计划“精准医学研究”等临床及基础研究课题。主编著作26部,主译著作2部,发表SCI论文120余篇,中文论文200余篇。
本文由《呼吸界》编辑 Asiya 整理,感谢高占成教授的审阅修改!
本文完,排版:Jerry
未经许可,请勿转载


