摘要
慢性血栓栓塞性肺动脉高压(CTEPH)属于第四大类肺动脉高压(PH),以肺动脉管腔内慢性血栓阻塞与继发肺血管重塑为主要病理特征,继而引起肺动脉管腔狭窄和(或)闭塞,肺血管阻力进行性升高,最终可导致右心衰竭甚至死亡。近年来CTEPH领域诊断及治疗进展迅速,日益增多的患者得到了及时、正确的诊断与病情评估。尽管如此,在CTEPH规范化诊治技术推广、CTEPH中心建设等方面还需进一步加强。为了更好指导我国的临床实践,经过多学科专家研讨和德尔菲专家论证,中华医学会呼吸病学分会肺栓塞与肺血管病学组、中国医师协会呼吸医师分会肺栓塞与肺血管病工作组、全国肺栓塞与肺血管病防治协作组及全国肺动脉高压标准化体系建设项目专家组联合多学科专家制订了《慢性血栓栓塞性肺动脉高压诊断与治疗指南(2024)》。本指南系统评价了国内外CTEPH相关循证医学研究资料,提出符合我国临床实践的推荐意见,主要内容包括:定义、流行病学、发病机制、诊断与评估、治疗与管理,以期进一步规范我国CTEPH的临床诊疗工作。
慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)是以肺动脉管腔内慢性血栓阻塞与继发肺血管重塑为主要病理特征的疾病,慢性血栓与血管重塑引起肺动脉管腔狭窄和(或)闭塞,肺血管阻力进行性升高,最终可导致右心衰竭甚至死亡,属于肺动脉高压(pulmonary hypertension,PH)的第四大类[1]。近年来,CTEPH领域进展迅速,随着手术、介入技术的广泛开展以及靶向治疗药物的应用,CTEPH患者的预后显著改善。另一方面,CTEPH的诊治又相对复杂,需要呼吸与危重症医学科、心血管内外科、影像科、麻醉科等多学科专家共同制订诊治方案,但不同学科对其认识存在差异,临床诊治亟待规范[2]。国内发表的《肺血栓栓塞症诊治与预防指南》[3]、《肺动脉高压诊断与治疗指南(2021版)》[4]对CTEPH诊断与治疗均有涉及,但一直缺乏专门针对CTEPH的诊治指南。
基于此,中华医学会呼吸病学分会肺栓塞与肺血管病学组、中国医师协会呼吸医师分会肺栓塞与肺血管病工作组联合多学科专家制订了本指南。在指南制订过程中,系统评价了国内外CTEPH相关循证医学研究资料,提出了符合我国临床实践的推荐意见,有助于进一步规范我国CTEPH的临床诊疗工作。
既往指南将PH血流动力学标准定义为静息状态下右心导管测得肺动脉平均压(mean pulmonary artery pressure,mPAP)≥25 mmHg(1 mmHg=0.133 kPa),第六次国际肺动脉高压大会以及2022年欧洲心脏病学会和欧洲呼吸学会肺动脉高压指南对PH的血流动力学定义做了修改[5],将诊断标准调整为mPAP>20 mmHg,将毛细血管前PH的肺血管阻力(pulmonary vascular resistance,PVR)阈值从3 WU降低到2 WU。为便于CTEPH的早期管理,本指南将CTEPH的血流动力学诊断标准定为满足mPAP>20 mmHg、肺动脉楔压(pulmonary artery wedge pressure,PAWP)≤15 mmHg和PVR>2 WU。
第一部分 指南编写方法
一、指南设计及整体技术路线方法
指南设计与制订步骤依据2015年《世界卫生组织指南制订手册》[6]以及2022年中华医学会发布的《中国制订/修订临床诊疗指南的指导原则(2022版)》[7]。本指南的报告和撰写参考临床指南研究与评估系统Ⅱ(The Appraisal of Guidelines for Research and Evaluation Ⅱ,AGREE Ⅱ)[8]和国际实践指南报告规范(Reporting Items for Practice Guidelines in Healthcare,RIGHT)[9]。本指南的整体技术路线见图1。
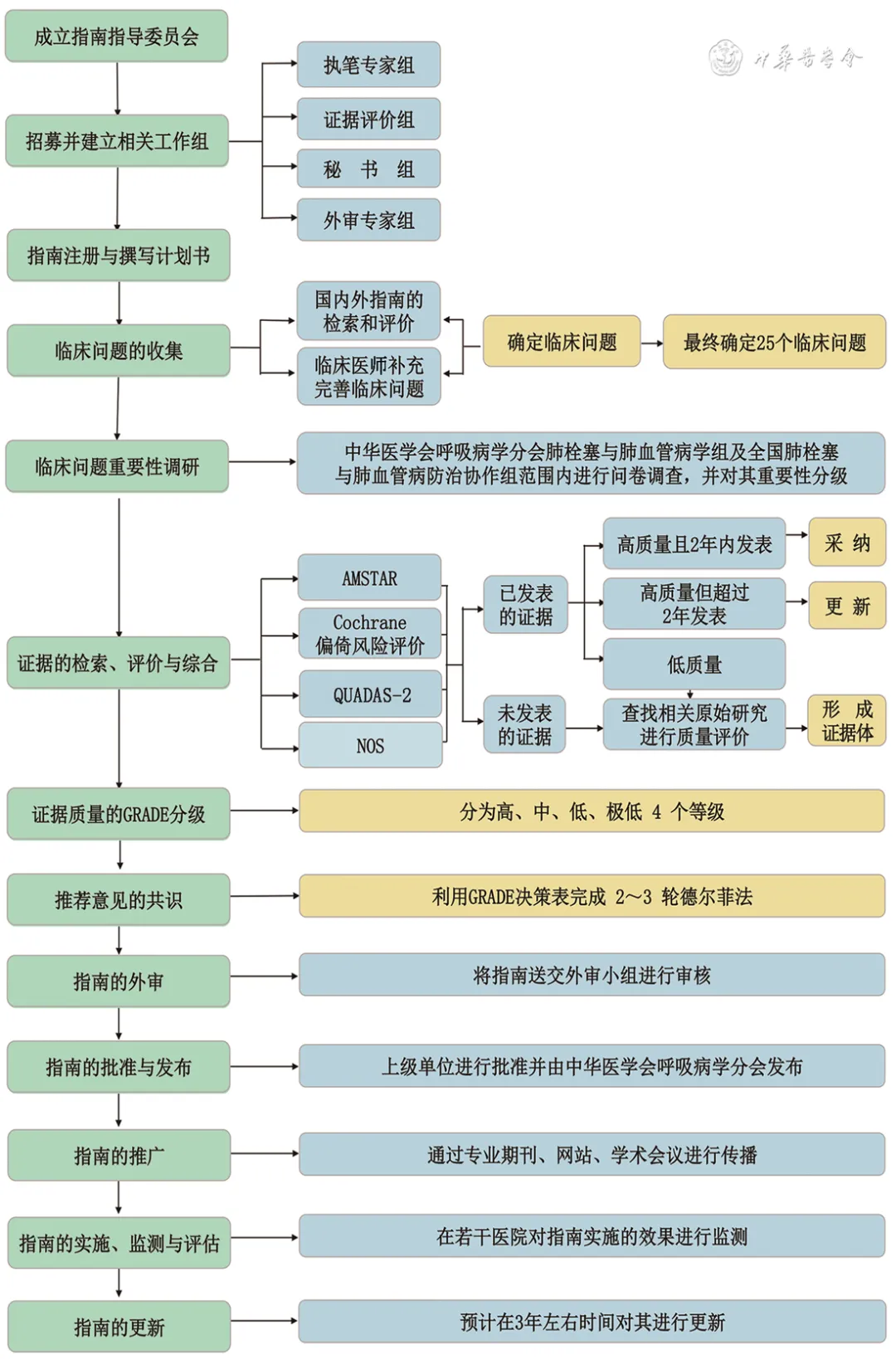
图1 本指南整体技术路线
本指南小组应用AGREE Ⅱ对相关性比较高的指南进行评价。通过筛选,最终纳入指南33部,其中英文指南26部,中文指南7部。4名研究人员应用AGREE Ⅱ对纳入指南独立进行评价,预试验结果显示4名研究人员对评分条目的理解一致性较好。经过评价每部指南各领域的得分情况,对每部指南是否推荐使用的结果显示,18部(54.5%)指南被推荐使用,11部(33.3%)被推荐修订后使用,4部(12.1%)不推荐使用(表1)。
二、指南注册与计划书的撰写
本指南已在国际实践指南注册与透明化平台(http://www.guidelines-registry.cn)进行注册(注册号:IPGRP-2021CN018),读者可联系指南发起组织索要指南的计划书。
三、指南工作组
本指南成立了多学科专家工作组,包括呼吸与危重症医学科、心血管内科、风湿免疫科、胸外科、心外科、影像科、基础医学和循证医学等。工作组成员按照主要职能,划分为:执笔专家组、证据评价组、统稿专家组、秘书组和外审专家组。
四、利益冲突声明
本指南工作组成员均填写了利益冲突声明表,不存在与本指南撰写内容直接相关的利益冲突。
五、指南使用者与目标人群
本指南供中国内科(呼吸与危重症医学科、心血管科、风湿免疫科等)、外科(胸外科、心外科等)、急诊科、药剂科、影像科及其他与CTEPH诊疗和管理相关学科的专业人员使用。指南推荐意见的应用目标人群为CTEPH患者。
六、临床问题遴选和确定
(1)通过系统检索PH和CTEPH领域已经发表的指南和系统评价,初步收集临床问题408个;(2)对初步收集的临床问题进行去重合并,然后邀请临床医师对其进一步修改和补充,形成临床问题139个;(3)在中华医学会呼吸病学分会肺栓塞与肺血管病学组(41位专家)、中国医师协会呼吸医师分会肺栓塞与肺血管病工作组(48位专家)和全国肺栓塞-肺血管病防治协作组范围内进行问卷调查,对临床问题按其重要程度进行1~7分打分。基于调查结果,最终确定本指南需解决的25个临床问题。
七、证据检索及筛选
针对最终纳入的临床问题,按照“人群、干预、对照和结局”(PICO)格式对其进行解构,然后分别制订检索策略,并进行系统检索。(1)检索Medline、Embase、Cochrane Library、Epistemonikos、CBM、万方和CNKI数据库,纳入系统评价/荟萃分析、随机对照试验、队列研究、病例对照研究、病例系列、流行病学调查和指南等;(2)补充检索Uptodate和DynaMed。检索时间为建库至2023年1月21日。完成检索后,针对每个临床问题,均由4名证据评价组成员两两一组独立按照标题、摘要和全文的顺序阅读筛选文献,纳入符合临床问题的文献并交叉核对,如遇分歧通过讨论或咨询第三方解决。
八、证据质量评价
证据评价与分级小组使用评估系统评价偏倚风险评价工具(assessment of multiple systematic reviews,AMSTAR)[39]对纳入的系统评价/荟萃分析进行方法学质量评价,使用Cochrane偏倚风险评价工具(risk of bias,ROB,针对随机对照试验)[40]、诊断准确性研究的质量评价工具(quality assessment of diagnostic accuracy Studies-2,QUADAS-2,针对诊断准确性研究)[41]、纽卡斯尔-渥太华文献质量评价量表(Newcastle-ottawa Scale,NOS,针对队列研究和病例-对照研究)[42]对相应类型的原始研究进行方法学质量评价。评价过程由4名证据评价组成员两两一组独立完成并交叉核对,如遇分歧通过讨论或咨询第三方解决。
九、证据和推荐意见分级
证据和推荐意见分级采用推荐分级的评估、制订与评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)分级系统(表2、3)[43],由兰州大学循证医学中心/GRADE兰州大学中心和北京大学公共卫生学院提供方法学支持。
十、推荐意见形成
共识专家小组基于证据评价与分级小组提供的CTEPH诊断、治疗安全性和有效性的国内外循证医学证据,同时考虑中国患者的偏好与价值观,干预措施的成本、利弊和可及性等,通过讨论形成初步的推荐意见。经过3轮德尔菲法和2轮面对面专家小组会,对推荐意见达成共识,最终形成24条推荐意见。
十一、指南的撰写和外审
各部分初稿确定后,统稿专家组进行指南初稿整合。经统稿专家组审议通过后的指南初稿提交外审专家组进行审阅。根据外审专家组的反馈意见,执笔专家组对初稿进行修改,最后由指南专家组讨论批准指南的发布。
十二、指南更新
指南工作组计划在3年左右时间对本指南进行更新。更新方法按照国际指南更新流程进行[44, 45]。
十三、传播与实施
指南发布后,指南工作组将主要通过以下方式对指南进行传播与推广:(1)在相关学术期刊发表;同期编写指南精简版及详细解读手册;(2)出版与指南相对应的医师版、患者版及基层版,在相关学术会议中进行解读和推广;(3)在国内不同区域、不同学科组织指南推广专场,确保临床医师充分了解并正确应用本指南;(4)通过微信、网络和其他媒体进行推广。
本指南推荐内容的主要特点:(1)系统评价国内外指南和循证医学研究数据,并与国人临床实际情况相结合;(2)提出符合中国国情及临床实践的CTEPH诊断与治疗流程;(3)提出疑诊、确诊、求因和病情评估的诊断策略;(4)强调手术、介入与靶向药物多模式治疗的重要性;(5)重视早期预防、筛查、风险预测、诊治、康复等全流程的随访管理;(6)提出我国CTEPH中心建设标准;(7)强调多学科团队讨论与决策的重要性。
第二部分 流行病学与危险因素
一、流行病学
由于临床认识不足及筛查手段的限制,CTEPH患病率难以准确评估,据欧洲注册研究资料推测,CTEPH的总体年患病率为3.2/100万~50/100万,不同国家、种族间存在差异[46-49]。
目前认为,CTEPH是急性肺血栓栓塞症(pulmonary thromboembolism,PTE)的远期并发症,资料显示,50%~75%的CTEPH患者存在静脉血栓栓塞症(venous thromboembolism,VTE)病史。对急性PTE的随访研究表明,急性PTE后2年的CTEPH发病率为0.1%~11.8%[50-53],不同报道发病率差异较大,与CTEPH诊断相对困难、不同研究PTE患者的入选标准、随访时间及CTEPH检测手段等存在不同有关。国内一项研究对614例急性PTE患者进行随访,结果显示急性PTE后3年CTEPH的累积发病率为1.7%[54]。荟萃分析提示亚洲人急性PTE后CTEPH的发病率高于欧洲人(5.00%比1.96%)[55]。
欧美注册登记研究显示,CTEPH患者确诊的中位年龄为63岁,无性别差异,与我国的数据一致[56-58];而日本的资料显示CTEPH患者女性占80%[59]。我国18个中心593例患者数据表明[60],CTEPH患者1年及3年总体生存率分别为95.2%、84.6%。随着CTEPH诊治方法的进步,患者生存率也逐渐改善。
二、危险因素
作为一种血栓栓塞性疾病,CTEPH发病的可能危险因素包括:(1)既往VTE病史,尤其是复发性VTE、特发性VTE、既往中危或高危急性PTE、诊断急性PTE时首发症状至确诊超过2周、诊断急性PTE时已有慢性血栓的影像学征象、急性PTE治疗不规范、急性PTE治疗3个月仍存在残余血栓等;(2)存在易栓症相关因素,如抗心磷脂抗体或狼疮抗凝物阳性、非O型血(与凝血因子Ⅷ水平升高相关)、脾切除术后、下肢静脉曲张、静脉置管或起搏器慢性感染、心室-心房分流等因素与CTEPH发病可能相关[61]。
第三部分 发病机制与病理生理
一、从急性PTE到慢性血栓栓塞性肺疾病(chronic thromboembolic pulmonary disease,CTEPD)
目前认为,急性PTE患者如未得到及时诊治,或反复发生血栓栓塞,血栓不能完全溶解,未溶解的血栓逐渐机化、纤维瘢痕化,阻塞肺血管床,继而演变成CTEPD[1]。CTEPD是指在3个月以上规范抗凝治疗后,患者仍表现为劳力性呼吸困难等症状,且影像学提示慢性血栓栓塞,包括肺通气灌注(ventilation/perfusion,V/Q)显像提示存在与肺通气不匹配的多个肺叶和(或)肺段分布的灌注缺损,且CT肺动脉造影(computer tomography pulmonary angiography,CTPA)或肺动脉造影显示肺动脉慢性血栓栓塞征象。CTEPD患者可有或无PH,伴有PH者即为CTEPH。慢性血栓常富含胶原纤维,并表现有不同程度的新生血管形成、血管再通,部分见粥样硬化病变。当然,不同部位的慢性血栓病变病理改变存在差异[62, 63]。
二、慢性血栓栓塞与肺血管重塑
除慢性血栓的机械性阻塞外,CTEPH同时存在与动脉性肺动脉高压(pulmonary arterial hypertension,PAH)类似的肺血管重塑,尤其是直径50~500 μm的毛细血管前肺小动脉,包括血管内膜纤维化,增殖性、纤维肌性改变,血管壁增厚。此外,肺静脉和肺泡毛细血管也可产生继发性改变,表现为肺静脉部分阻塞(类似肺静脉闭塞病)、毛细血管不同程度增殖(类似肺毛细血管瘤样增生症的改变)。目前认为,肺血管重塑的发生可能与以下机制有关,一是慢性血栓栓塞导致的肺血流重新分布,非栓塞部位肺动脉血流剪切力增加;二是支气管动脉代偿性扩张,且与栓塞部位远端的肺动静脉之间存在分流,导致栓塞部位的远端血管继发重塑[1,64]。
三、右心功能改变
与PAH类似,CTEPH肺血管阻力增加,右心室后负荷增大,逐渐出现右室肥厚、扩张、功能不全,右房也多有明显扩大。此外,在部分无PH的CTEPD患者中,也发现右心室舒张功能障碍的证据[65]。有研究提示,与PAH患者相比,即使PVR相似,CTEPH患者的右心室适应能力也相对不足[66]。
四、呼吸功能改变
肺动脉狭窄或闭塞导致肺血流灌注缺损,肺通气血流比例失调,产生低氧血症和(或)低碳酸血症。合并胸腔积液时,呼吸困难及低氧血症进一步加重。另外,除心肺功能异常外,CTEPH患者外周组织摄氧水平可有下降,即使在接受手术和介入治疗后,部分患者也可能难以完全逆转[67]。
第四部分 诊断
CTEPH的诊断包括疑诊、确诊、求因及病情评估四个方面,需要通过危险因素、临床表现、实验室检查、影像特征及血流动力学参数等综合判断,本指南诊断流程见图2。
图2 CTEPH诊断流程
一、临床表现
CTEPH最常见的症状为劳力性呼吸困难,其他症状如胸闷、咯血、晕厥和胸痛等[68],CTEPH患者由于支气管动脉代偿性扩张,咯血(4.8%)比PAH(0.6%)患者更常见[69]。对于急性PTE后持续存在或逐渐出现的劳力性呼吸困难患者,应考虑CTEPH的可能[70]。
CTEPH常见体征包括紫绀、颈静脉充盈或怒张,听诊肺动脉瓣区第二心音亢进,三尖瓣区可闻及收缩期杂音。少数患者由于肺动脉血栓不完全堵塞致血管狭窄,肺部可闻及血管杂音。随着右心功能不全的加重,患者可表现为踝部、下肢甚至躯干部位水肿,下肢皮肤色素沉着,少数患者甚至出现下肢皮肤反复溃疡。
二、实验室及辅助检查
(一)血液学检查
血液学检查有助于筛查CTEPH的病因、评估病情严重程度。易栓症(包括遗传性和获得性)相关检查,如蛋白C、蛋白S、抗凝血酶、同型半胱氨酸、抗心磷脂抗体、狼疮抗凝物、抗β2糖蛋白1抗体等,对于血栓形成的病因筛查具有重要价值[11]。
利钠肽(brain natriuretic peptide,BNP)或N-末端利钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)、胆红素、尿酸水平可用于评估病情及指导治疗。动脉血气分析可表现为低氧血症、低碳酸血症等。
(二)心电图
CTEPH心电图表现与其他PH相似,主要表现为V1~V4导联的ST段异常和T波改变、肺性P波、电轴右偏、右室肥厚、顺钟向转位、右束支传导阻滞等,正常心电图并不能排除CTEPH。
(三)胸部X线
CTEPH胸部X线特征包括区域性肺血管纹理稀疏或缺失、局部肺野透亮度增加、局限性肺不张、胸腔积液、肺动脉段凸出、中心肺动脉扩张以及右心房和右心室扩大等[71],但对CTEPH诊断的灵敏度、特异度相对低。
(四)超声心动图
超声心动图是诊断和评估PH的重要检查方法,可以初步筛查PH的可能性,并可初步筛查PH的病因,如先心病、心肌病、瓣膜病等,对CTEPH的鉴别诊断具有价值。常见征象包括主肺动脉及左右肺动脉干增宽、三尖瓣反流峰值速度增加、右心室增大和(或)室壁增厚、室间隔平直、下腔静脉吸气塌陷率降低等[72, 73]。对于血栓位于肺动脉主干的CTEPH患者,超声心动图可能发现相应部位的异常回声。既往存在PTE病史的患者如果活动耐力减退不能用其他原因解释时,若超声心动图没有诊断PH,可进行负荷超声心动图或运动右心导管检查。
(五)肺功能与心肺运动试验(cardio-pulmonary exercise testing,CPET)
肺功能检查有助于筛查引起劳力性呼吸困难的疾病原因,CTEPH患者由于肺血管阻塞、肺小动脉病变以及肺内分流增加等因素,导致通气/血流比例失调,肺功能常出现轻度到中度的弥散功能障碍。
CPET多表现为峰值摄氧量(peak oxygen uptake,peak VO2)下降、呼气末二氧化碳分压(end-tidal partial pressure of carbon dioxide,PETCO2)下降、生理无效腔/潮气量比率(Vd/Vt)增高及二氧化碳通气当量(ventilatory equivalent for carbon dioxide,VE/VCO2)升高等,且PETCO2下降程度较PAH患者更明显[74, 75]。
(六)核素V/Q
CTEPH患者V/Q显像的典型表现为多个呈肺段或亚段分布的灌注缺损,与通气显像不匹配。V/Q显像对CTEPH诊断的灵敏度高达96%~97%[76],如V/Q阴性可基本排除CTEPH诊断,因此,V/Q显像目前被认为是疑诊CTEPH的首选筛查方法,其中,V/Q断层显像,即单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)较平面显像灵敏度更高[77]。临床也可用低剂量CT替代通气显像,该方法假阳性率可能增加。其他疾病也可表现类似CTEPH的V/Q特征,如肺动脉肉瘤、肺动脉炎、纤维素性纵隔炎等,需结合临床及其他影像学检查进行鉴别。
(七)CTPA
CTPA对于明确肺动脉阻塞性病变部位和性质、评估治疗策略以及鉴别其他类型肺血管病变具有重要价值。CTEPH的直接征象包括肺动脉内偏心附壁充盈缺损、肺动脉分支狭窄或闭塞、血管腔内网状影或蹼样征、血管壁不规则等[78];间接征象包括肺动脉增宽、右心室增大与肥厚、肺实质马赛克征、肺梗死灶、支气管动脉等体动脉代偿性扩张、下腔静脉造影剂逆流等[79]。需注意,即使CTPA发现典型慢性血栓征象,如V/Q显像未提示典型的肺灌注缺损,也不能诊断CTEPH,此种情况可见于其他肺血管疾病基础上并发肺动脉原位血栓形成,如先天性心脏病相关PH、大动脉炎、白塞病等。
CTPA对亚段及以下的肺血管病变识别能力欠佳,阴性并不能完全排除CTEPH的诊断。鉴于病变的复杂多样性,利用标准CTPA图像研发基于人工智能的CTEPH识别软件,有望提高临床诊断CTEPH的准确性并协助疗效评估[11]。
近年来,双能CTPA开始在临床应用,可显示CTEPH的肺灌注减低或灌注缺损部位及范围,对远端病变的评估具有重要价值,但目前国内应用尚不普遍[12,80, 81]。
(八)磁共振成像(magnetic resonance imaging,MRI)
MRI是无创评价CTEPH患者的重要手段,尤其是对肺血流灌注和心脏结构功能评价具有重要价值。在肺血管评估方面,MRI结合血管造影技术,可无创性观察肺动脉血流状态,且有助于判断肺血管堵塞病变的性质,如血栓与肿瘤、血管炎等病变的鉴别。在心脏评估方面,MRI可用于评价心脏结构和功能,结合灌注及延迟强化技术,MRI可评估病变损害范围及程度,判断心肌病变性质及活性,辅助CTEPH术前评估[82-84]。
(九)肺动脉造影
肺动脉造影目前仍然是诊断CTEPH的影像学金标准,有助于明确肺动脉栓塞部位、范围和血流灌注情况,是目前评估CTEPH手术或介入治疗适应证不可或缺的手段。肺动脉造影显示血栓征象包括肺动脉内充盈缺损、狭窄或闭塞、管腔内网状充盈缺损、血管迂曲变形等,可表现为肺动脉近端扩张与造影剂滞留,远端肺动脉显影延迟、血流减少或出现无血管区域。根据肺动脉造影,将外周性肺动脉栓塞性病变分为五种类型:环形狭窄、网状病变、次全闭塞、完全闭塞、迂曲病变[85]。
根据肺动脉造影剂充盈和肺静脉血流回流情况,可将肺动脉血流分为4级[86],0级:肺动脉血流显影极差,病变部位无显影或显影极不规则,末梢毛细血管床无显影;1级:肺动脉血流显影受限,病变部位可显影,稍远血管显影延迟,末梢毛细血管床显影不均;2级:肺动脉血流显影良好但肺静脉显影受限,末梢毛细血管床显影不均,肺静脉显影不良或延迟显影;3级:肺动脉和肺静脉血流显影良好,肺动脉无明显的血流受限,肺静脉显影没有明显延迟。
(十)右心导管检查(right heart catheterization,RHC)
RHC是诊断PH的金标准,可获得准确血流动力学和氧动力学参数,包括压力、心输出量以及肺血管阻力,用于确定诊断、评估病情和指导治疗。需注意,CTEPH患者测量PAWP时,应尽可能避免嵌入到肺动脉狭窄或堵塞区域而导致测定PAWP不准确。对于静息状态下超声心动图PH低度可能性的CTEPD者,如果存在不能用其他原因解释的活动耐量减退时,可行运动负荷RHC[11]。
三、诊断策略
(一)疑诊
通过病史、临床表现、心电图、胸部X线或超声心动图等检查,怀疑PH或其他肺血管异常的患者,应注意筛查CTEPH的可能,尤其是对于存在潜在CTEPH危险因素,如抗磷脂综合征等易栓症的疑诊PH患者,更应该提高警惕。
对于有急性PTE或深静脉血栓形成(DVT)病史的患者,如充分抗凝治疗3个月后仍然存在活动后呼吸困难等症状,应筛查CTEPH,建议行超声心动图筛查,如超声心动图为PH中度或高度可能性,则应进一步进行确诊检查[包括CTPA和(或)V/Q显像、RHC及肺动脉造影]以明确CTEPH的诊断;即使无任何症状,如急性PTE患者存在CTEPH危险因素,也建议在抗凝治疗期间密切随访,早期识别CTEPH。
对于诊断急性PTE,但在影像学上并存某些慢性血栓栓塞的征象,和(或)超声心动图提示严重PH征象,需考虑患者为CTEPH基础上发生急性PTE的可能,在按照急性PTE规范抗凝治疗和管理基础上,对这部分患者应密切随访,以早期识别CTEPH。
国际上曾提出CTEPH风险评估模型(Leiden CTEPH预测标准)[87],见表4,总评分>6分,提示CTEPH高度风险。有资料显示,Leiden CTEPH标准预测CTEPH的灵敏度和特异度分别为85%~91%和75%。CTEPH预测评分>6分或有与CTEPH相关症状的患者接受CTEPH排除标准筛查,即评估NT-proBNP是否异常和(或)心电图特征是否存在右心室负荷心电图特征(右束支传导阻滞;V1导联R:S>1伴有R>0.5 mV;QRS电轴向右偏移),如果存在至少一条排除标准异常,则建议行超声心动图筛查。CTEPH预测标准联合排除标准[88, 89],使诊断CTEPH的灵敏度提高至91%,可重复性达96%。
推荐意见1:(1)推荐对所有PH患者进行CTEPH的筛查(1B);(2)对于存在潜在的发病危险因素,如抗磷脂综合征等易栓症的疑诊PH患者,建议筛查CTEPH(2C)。
推荐意见2:(1)对于急性PTE患者,经3个月以上规范抗凝治疗后,如存在CTEPH危险因素或活动后呼吸困难,建议筛查CTEPH(2C);(2)对于急性PTE的患者,如影像学上并存慢性血栓栓塞的征象,和(或)超声心动图提示肺动脉压力明显升高,需警惕CTEPH合并急性PTE,建议密切随访,以早期识别CTEPH(2C)。
(二)确诊
确诊CTEPH需综合临床、影像学与血流动力学数据,如影像学证实存在肺动脉慢性血栓栓塞征象,RHC确诊PH,同时临床评估慢性血栓栓塞是导致PH的主要原因则可做出诊断。
肺动脉慢性血栓栓塞的诊断依据为:在3个月及以上规范抗凝治疗基础上,V/Q显像提示存在与肺通气不匹配的多个肺叶和(或)肺段分布的灌注缺损,且CTPA或肺动脉造影显示肺动脉慢性血栓栓塞征象。3个月及以上的规范抗凝治疗以排除可能并存的急性或亚急性血栓栓塞成分。随着影像学诊断技术的发展,某些患者即使尚未经过充分抗凝治疗,如影像学检查发现典型的慢性血栓栓塞征象,结合病史也可作出慢性血栓栓塞的影像学诊断并启动相应治疗。
超声心动图可以初步筛查是否存在PH,需要通过RHC确诊PH。评估慢性血栓栓塞是导致PH的主要原因,目的是除外其他类型PH基础上合并肺动脉原位血栓形成的情况,如先天性心脏病相关PAH、血管炎等并发肺动脉原位血栓形成,此类情况下,CTPA或MR肺动脉造影发现典型慢性血栓栓塞征象,V/Q显像可无CTEPH的典型肺灌注缺损,不能诊断CTEPH。
推荐意见3:(1)推荐V/Q显像作为CTEPH的首选筛查方法(1B);(2)推荐 RHC 及肺动脉造影作为CTEPH诊断和术前评估检查方法(1C);(3)对于PH患者,即使V/Q提示与通气不匹配的灌注缺损,仍建议行CTPA显像和(或)肺动脉造影等检查,以除外其他类型肺动脉阻塞性疾病(2C)。
推荐意见说明:V/Q显像及CTPA均为CTEPH常用的筛查方法。V/Q显像的灵敏度显著优于CTPA;V/Q显像阴性可有效排除CTEPH,其灵敏度和特异度分别为90%~100%、94%~100%[76,90]。本指南推荐V/Q显像作为CTEPH诊断的首选检查。
(三)求因
由于CTEPH症状缺乏特异性,部分患者甚至较长时间无症状,CTEPH早期诊断至今仍面临重大挑战,认识CTEPH的常见危险因素(参见前文危险因素部分),密切随访和实施全面筛查计划,及时转诊到专业中心,给予早期诊断和特异性治疗非常重要。
(四)病情评估
对于确诊的CTEPH患者,除进行PH相关的功能评价外,尚需评估血栓病变的部位与严重程度,同时判断血栓负荷与血流动力学的匹配性,以完整评估病情,做出治疗决策。
WHO功能分级、六分钟步行距离(six minute walk distance,6MWD)、BNP/NT-proBNP、血流动力学指标等均是PAH危险分层的重要参数。研究显示,上述指标也是影响CTEPH预后的重要因素,但目前尚无适用于CTEPH患者病情严重程度及预后的评估策略。有研究者尝试将针对PAH危险评分应用于不适合肺动脉血栓内膜剥脱术(pulmonary thromboendarterectomy,PEA)手术或术后残余/复发PH的CTEPH患者中,发现上述危险评分对这部分CTEPH患者的预后具有一定预测作用,提示上述针对PAH的危险评分可以尝试应用于这部分CTEPH患者危险分层[91, 92, 93]。国内一项前瞻性多中心的CTEPH队列研究[92]纳入了432例药物治疗的CTEPH患者,建立了一种新的针对药物治疗CTEPH患者危险评估方法,以简化PAH危险分层、肺血管阻力、总胆红素、是否合并肾功能不全四项指标综合评估预后,研究表明该危险评估方法可对药物治疗的CTEPH患者具有良好的预后预测价值。
血栓病变部位主要基于影像学检查,可参考美国加州大学圣地亚哥医学中心(UCSD)团队提出的CTEPH肺动脉病变手术分级:Ⅰ级:血栓病变起始于肺动脉主干;其中ⅠC级为血栓病变导致一侧肺动脉完全闭塞;Ⅱ级:血栓病变起始于叶水平肺动脉或肺动脉基底干;Ⅲ级:血栓病变起始于段水平肺动脉;Ⅳ级:血栓病变起始于亚段肺动脉[94]。对于血栓负荷与血流动力学指标匹配性的评估仍以医师经验为主,尚缺乏客观标准,需结合多种影像学资料综合分析。
推荐意见4:(1)对CTEPH患者,建议采用多项指标评估病情严重程度,包括运动耐量、生物标志物、超声心动图、心脏磁共振及血流动力学指标等(1C)。(2)对于CTEPH患者,建议充分评估血栓病变的部位、严重程度以及血栓负荷与血流动力学指标的匹配性(2C)。
推荐意见说明:目前没有针对CTEPH的预后危险评估模型,对于CTEPH患者特别是不适合PEA手术的患者,采用针对PAH的危险分层策略将有助于评估病情和治疗效果。
第五部分 治疗
CTEPH的治疗包括基础治疗、PEA、经皮肺动脉球囊成形术(balloon pulmonary angioplasty,BPA)和PH靶向药物治疗。治疗方案的选择取决于肺动脉血栓栓塞部位和程度、血流动力学、心肺功能及其他重要脏器功能状况等,建议由呼吸与危重症医学科、心血管内外科、血管介入、影像等多学科专家共同参与制订,治疗流程见图3。
图3 CTEPH治疗流程
一、基础治疗
CTEPH的基础治疗包括氧疗、抗凝、利尿、正性肌力药物与血管活性药物的应用及康复治疗等,同时建议对CTEPH患者接种流感疫苗、肺炎疫苗等预防感染,给予社会和心理支持。对于重症的育龄期女性患者,应避免妊娠,若妊娠期间被确诊为CTEPH,应转至专业的PH中心进行全面评估后制订治疗方案。
(一)氧疗
CTEPH容易并发低氧血症,对于静息未吸氧状态下动脉血氧分压<60 mmHg或外周血氧饱和度<90%的患者应进行长程氧疗,以使动脉血氧分压≥60 mmHg或外周血氧饱和度≥90%。对于合并运动后低氧血症的CTEPH患者,居家氧疗可以改善患者运动耐力、生活质量和心功能[95],建议给予氧疗。
(二)抗凝治疗
抗凝治疗可防止血栓进一步加重,对于CTEPH患者,只要无禁忌证,推荐终生足量抗凝治疗[15]。通常选择口服药物,包括维生素K拮抗剂(vitamin K antagonist,VKA)华法林、口服直接抗凝药物(direct oral anticoagulants,DOACs)。其中华法林临床应用普遍,一般情况下目标国际标准化比值(international normalized ratio,INR)维持在2~3。DOACs服用方便、药物/食物相互作用较少、无需常规监测,近年来在CTEPH中应用越来越多,但尚缺乏充分证据证明DOACs在CTEPH患者中的长期疗效和安全性。近期的一项多中心、随机、单盲、非劣效性研究[96]证实在预防CTEPH患者的肺血流动力学恶化方面,艾多沙班不劣于华法林。在某些特定患者人群中应用DOACs需慎重,如抗磷脂综合征患者应用DOACs血栓复发率高于华法林,因此不推荐应用DOACs[97]。研究表明接受VKA和DOACs抗凝治疗的患者,行PEA手术后的血流动力学和功能改善相当,生存期无差异,大出血事件相当,但DOACs治疗的VTE复发率高于VKA治疗[98]。因此,基于有限的研究证据,对PEA手术治疗后的患者推荐应用华法林而非DOACs。
(三)利尿治疗
CTEPH患者右心负荷增大,易并发右心衰竭,导致液体潴留,出现下肢水肿、肝淤血等,应用利尿剂可改善症状。常用利尿剂包括袢利尿剂(呋塞米、托拉塞米)、醛固酮受体拮抗剂(螺内酯)以及血管加压素V2受体拮抗剂(托伐普坦)等[99, 100]。
(四)正性肌力药物与血管活性药物
低心输出量患者可使用正性肌力药,如地高辛、多巴酚丁胺、米力农、左西孟旦等。对严重低血压的患者可能需要升压治疗以维持器官灌注,如去甲肾上腺素、多巴胺。
如果不合并高血压、冠状动脉粥样硬化性心脏病等左心疾病,不建议应用血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体拮抗剂、β受体阻滞剂、硝酸酯类或伊伐布雷定等药物;因合并症需要应用以上药物者,需密切观察血压、心率等,注意药物间相互作用。
(五)康复治疗
康复治疗有助于减轻CTEPH患者症状,提高运动耐力,改善健康相关的生活质量。建议在临床医师或康复治疗师指导下,对病情相对稳定的CTEPH患者进行低强度、个体化有氧运动训练,内容包括呼吸治疗、哑铃训练、引导行走等。初始训练强度及调整需参考患者血氧饱和度、心率、血压等心肺功能指标和患者主观感受。对于PEA或BPA术后早期康复治疗也有助于患者病情改善[101]。
推荐意见5:(1)对于CTEPH确诊患者,推荐由呼吸与危重症医学科、心血管内外科、血管介入科、影像科等组成的多学科团队共同评估并制订治疗方案(1C);(2)推荐CTEPH患者终生抗凝治疗(1A);对于合并抗磷脂综合征的CTEPH,推荐首选华法林抗凝治疗;(3)建议对病情相对稳定的CTEPH患者进行康复评估,在临床医师或康复治疗师指导下进行康复锻炼;康复训练过程中,监测经皮血氧饱和度和心率(2C)
二、手术治疗
PEA通过手术将导致肺动脉管腔狭窄和(或)闭塞的慢性血栓及增厚内膜剥脱清除,以恢复肺动脉血流灌注,部分CTEPH患者可达临床治愈效果,即患者血流动力学及活动耐力恢复正常[102],因此,对所有CTEPH患者制订治疗方案时,应首先经过多学科团队讨论明确是否可行PEA[1]。CTEPH的慢性血栓以纤维瘢痕组织为主,与增厚的血管内膜无法截然分开,因此,手术是将血栓与增厚内膜一起剥脱,而非单纯血栓切除。
(一)手术方式
手术通常以胸骨正中切口作为入路,通过左/右肺动脉切开,由近及远,以剥脱的方式清除肺动脉近端至远端的病变。由于慢性血栓栓塞性病变通常累及肺动脉近端至远端的分支,PEA手术需尽可能完整地清除远端病变,否则手术治疗效果受到影响。为达到尽可能完整剥脱病变,目前标准的PEA手术需要在深低温停循环下操作,体温降至20 ℃并停循环以保证手术视野清晰[103, 104]。
(二)手术适应证与禁忌证
血栓栓塞的部位和程度是决定手术可行性的主要因素,一般而言,如存在肺动脉主干、叶或段肺动脉水平的栓塞,属于手术可及的近端病变,同时要求影像学评估栓塞程度与血流动力学相匹配[105, 106]。目前认为,同时满足以下条件的CTEPH患者具有手术适应证:(1)栓塞病变手术可及(段及以上水平);(2)栓塞程度与血流动力学匹配,预测手术可使PVR下降>50%;(3)无严重合并症。手术的禁忌证包括:(1)栓塞病变手术部位不可及,即Ⅳ级病变,栓子主要位于亚段水平及以下肺动脉;(2)合并严重的基础疾病,如严重肺功能异常、严重肝肾功能不全等。当然,手术是否可行也取决于医师经验,UCSD的资料显示[107],对于Ⅳ级病变患者,PEA也可显著改善患者临床症状及血流动力学状况,但手术风险相对更高。
影像学评估血栓栓塞病变程度与血流动力学指标是否匹配是影响手术效果的关键因素,而单纯一项影像学检查常低估慢性血栓的严重程度,因此需结合CTPA、V/Q显像及肺动脉造影进行综合评价。同时,恰当的术前评估也取决于医师的技术和经验,建议在有经验的中心进行,对于首家中心评估认为不适合手术治疗的CTEPH患者,建议推荐到第二家更有手术经验的中心进行二次评估[108]。PVR>1 000 dyn·s·cm-5的患者,手术风险相对增加,但血流动力学异常程度并非手术禁忌[103,109],即使PVR>1 500 dyn·s·cm-5,如评估手术可去除大部分栓塞病变,同样适合手术[110]。PEA手术无年龄限制,70岁以上患者同样可通过手术获益,但高龄患者更容易存在其他合并症,手术风险可能增大。
(三)手术效果
国际注册登记研究结果显示,接受PEA的患者症状、血流动力学指标和活动耐力明显改善,PVR从术前700~800 dyn·s·cm-5降至250 dyn·s·cm-5,mPAP从46 mmHg降至26 mmHg,6MWD由362 m增加至459 m,患者症状、活动耐力以及血流动力学均得到显著改善[111, 112]。在有经验的手术中心,PEA术后住院病死率低于5%;接受PEA的CTEPH患者术后1、2和3年生存率分别为93%、91%和89%。
绝大多数患者经PEA治疗血流动力学显著改善,部分患者仍可能存在PH或术后一段时间后再发PH。目前对术后残余PH尚缺乏统一标准,因此,文献报道发生率差异较大,资料显示发生率约5%~35%[102, 103,111-115]。残余PH是围手术期死亡的主要因素,且影响患者长期预后。资料显示,术后mPAP≥38 mmHg、PVR≥425 dyn·s·cm-5与右心衰竭导致的病死率增加显著相关,患者对术后mPAP<30 mmHg耐受良好。PEA术后残余PH患者应进行介入治疗与PH靶向药物治疗的评估[116]。
(四)并发症
PEA手术复杂,术后可能出现多种并发症,如循环衰竭、再灌注肺水肿、残余PH、认知障碍等,手术成功与否涉及很多方面,包括术前评估、手术操作、体外循环、麻醉、术后管理等,因此,手术的成功开展需要一个完整的内外科团队共同协作。有些中心建议对拟行PEA者术前常规放置下腔静脉滤器,但一项国际CTEPH注册登记研究中40%的手术患者放置下腔静脉滤器,并未发现其能改善患者长期预后[111],因此目前并不推荐对拟行PEA者术前常规放置下腔静脉滤器。
推荐意见6:(1)推荐对所有CTEPH患者首先进行PEA手术评估(1A),对于评估适合PEA手术的CTEPH患者,推荐首选PEA治疗(1A);(2)推荐在有经验的医学中心进行PEA手术评估(2C);(3)PEA手术建议在深低温停循环下完成(1C)。
推荐意见说明:对于所有明确的CTEPH患者,均推荐有经验的医学中心进行PEA手术评估,但是由于手术经验的差异,不同中心对于PEA手术的决策会受到客观条件的影响,因此,对于部分患者,可以到更有经验的中心进行再评价。
三、介入治疗
(一)BPA
1. 治疗方式:BPA是通过球囊扩张病变血管的方法改善肺动脉血流,对于不能行PEA手术的CTEPH患者或术后残余/复发PH患者可取得良好的治疗效果[117, 118]。手术入路常选择股静脉,当股静脉闭塞、存在血栓或穿刺困难时,也可选择颈内静脉或贵要静脉入路,导管送入后行肺血流动力学检查和肺动脉造影,送入指引导管对靶血管进行选择性肺动脉造影明确病变类型,采用球囊扩张病变血管,术中采用肺动脉血流分级进行疗效评价。BPA通常需多次治疗方能达到理想的效果,一般每例患者需经过3~8次BPA治疗,每次BPA间隔时间需要个体化决策。
2. 适应证与禁忌证:BPA主要适应证包括:(1)经多学科团队讨论因血栓位于肺动脉远端无法行PEA的CTEPH患者;(2)PEA术后残余或复发PH的CTEPH患者;(3)虽然血栓病变位于近端肺动脉,但因高龄、合并症等情况,经多学科讨论无法行PEA的CTEPH患者。BPA没有绝对禁忌证,以下为BPA的相对禁忌证,临床需权衡手术的获益和风险,包括:(1)严重肾功能不全[119, 120];(2)对比剂过敏;(3)严重的凝血功能障碍、血小板减少[121];(4)感染性疾病急性期;(5)严重心功能不全;(6)未控制的甲状腺功能亢进;(7)右心感染性心内膜炎,右心腔或主肺动脉内占位[122];(8)三尖瓣或肺动脉瓣为机械瓣或生物瓣[123];(9)完全性左束支传导阻滞(有起搏器者除外);(10)3个月内植入起搏器或除颤器;(11)妊娠状态;(12)患者因精神异常、不能平卧等原因无法配合手术等。
3. 治疗效果与并发症:BPA能显著改善CTEPH患者的右心功能,降低肺动脉压力和肺血管阻力,增加6MWD[85,124]。BPA的治疗终点并无定论,mPAP超过30 mmHg与不良预后密切相关,因此一般建议,BPA以尽可能改善患者血流动力学为目标,至少能达到mPAP<30 mmHg为佳,但治疗目标需综合考虑患者年龄、合并症、血管病变特点及患者意愿等因素[125]。
BPA的并发症主要包括肺血管损伤和再灌注肺水肿[29],选择头端较软的导丝、合理选择球囊大小以及提高手术操作技巧可降低BPA相关肺血管损伤的发生率。如果出现咯血,造影明确出血部位后,可采用球囊导管低压充盈后封堵损伤血管近端10~15 min止血,必要时可采用明胶海绵栓塞出血部位。mPAP和PVR越高,再灌注肺水肿发生率越高,采用不同大小球囊分次逐级扩张肺动脉靶病变的BPA策略可减少其发生。术中或术后监护出现血氧饱和度下降,治疗部位新出现湿啰音提示可能发生再灌注肺水肿,常于术后24 h内出现,多数经利尿治疗、氧疗及呼吸支持治疗可恢复。
(二)肺动脉去神经术(pulmonary artery denervation,PADN)
PADN已在第一大类、第二大类PH及CTEPH行PEA术后残余PH等患者中进行了相关临床研究,结果表明可以改善肺血流动力学指标。一项单中心研究显示,25例PEA术后残余PH患者接受PADN治疗后,血流动力学显著改善,mPAP由35 mmHg下降至26 mmHg;但32%患者需在心脏起搏器保驾下完成该手术[126]。PADN手术的安全性、长期疗效需要在更多大样本的临床研究中进行评价[127]。
推荐意见7:(1)经多学科讨论不适合行PEA治疗的CTEPH患者,推荐行BPA治疗(1B);(2)PEA术后残余或复发PH的CTEPH患者,建议行BPA治疗(2C);(3)建议综合患者年龄、合并症、血管病变特点及患者意愿等因素综合评估BPA的治疗终点(2C);(4)建议以mPAP<30 mmHg作为BPA治疗的血流动力学目标(2C)。
四、靶向药物治疗
肺血管重塑是CTEPH的病理学特征之一,因此,多数CTEPH患者也可从PAH靶向药物治疗中获益。
(一)靶向药物治疗适应证
靶向药物治疗主要适宜于以下几种情况:(1)由于远端血栓栓塞性病变而不宜手术治疗的CTEPH;(2)PEA术后残余或复发PH的患者;(3)由于严重合并症或其他病因不适合手术治疗者;(4)对于病变适合手术但存在严重血流动力学异常的CTEPH患者,临床也常应用靶向药物作为手术前的“桥接”治疗,以期改善血流动力学、降低手术风险。此外,对于拟行BPA治疗的患者,药物治疗改善血流动力学后可能降低BPA相关并发症,尤其对于病情严重患者,建议在BPA治疗前应用靶向药物[124,128]。
(二)CTEPH靶向药物种类
1. 利奥西呱:利奥西呱是一种可溶性鸟苷酸环化酶激动剂,其作用不依赖于体内NO水平,可单独或与NO协同提高血浆中的环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)水平,引起血管舒张和抗血管重塑。推荐用法为1 mg,3次/d,监测血压等,如能耐受,每2周增加0.5 mg,3次/d,直至最大耐受剂量2.5 mg,3次/d。CHEST-1研究结果显示,在不能手术或术后残余/复发的CTEPH患者中,利奥西呱治疗16周后显著改善患者6MWD、WHO 功能分级以及血流动力学[129]。延展研究CHEST-2结果显示,在利奥西呱治疗1年时,其长期耐受性和安全性良好,运动和心功能得以持续改善,1年生存率和无临床恶化生存率分别为97%和88%[130]。
2. 曲前列尼尔:前列环素类似物曲前列尼尔可用于治疗不能手术或术后残余/复发CTEPH患者。随机对照试验结果显示,105例不能手术或术后残余/复发CTEPH患者,经过皮下注射曲前列尼尔24周时高剂量组(30 ng·kg-1·min-1)6MWD明显改善,皮下曲前列尼尔可能为WHO Ⅲ或Ⅳ级和不能耐受其他治疗或需要联合治疗的患者提供治疗选择[131]。
3. 其他药物:MERIT-1研究纳入80例WHO功能Ⅱ~Ⅳ级、PVR>400 dyn·s·cm-5、6MWD为150~450 m的CTEPH患者,予马昔腾坦10 mg/d或安慰剂16周,结果显示马昔腾坦组PVR降为基线时73%,而对照组为基线时87.2%,马昔腾坦组较对照组明显改善[132]。关于其他靶向药物,如波生坦[133, 134]、西地那非[135]、依前列醇[136]等,也有小样本研究显示其可改善无法行PEA的CTEPH患者或PEA术后残余PH患者的活动耐力。另外,在CTEPH患者中虽有不同通路之间药物的联合应用报道,但缺乏充分循证医学证据。
推荐意见8:(1)推荐不能行PEA手术的CTEPH患者或术后残余/复发PH患者给予靶向药物治疗(1A);(2)对于血流动力学状态差、手术风险高的CTEPH患者,建议靶向药物作为手术前的“桥接”治疗(2C);(3)对于行BPA介入治疗的CTEPH患者,建议应用PH靶向药物治疗(2C);(4)推荐利奥西呱作为不能手术CTEPH患者或术后残余/复发PH患者的首选药物(1A);(5)WHO功能分级Ⅲ~Ⅳ级CTEPH患者,建议联合曲前列尼尔等其他PH靶向药物(1B)。
推荐意见说明:对于不能手术或术后残余PH患者的药物治疗,目前国内仅利奥西呱获批适应证,其他治疗PH的靶向药物目前在国内尚属于适应证外用药。
五、多模式治疗
CTEPH患者常同时存在近端、远端和微血管病变,PEA、BPA和药物的联合治疗成为解决复杂CTEPH的有效方法。研究显示利奥西呱与BPA联合应用较单一治疗具有更大获益[124]。由于药物的易用性,药物与BPA或PEA的联合应用相对常见。PEA与BPA的联合应用则需要在同时具备手术和介入治疗经验的CTEPH诊治中心进行。PEA联合BPA治疗的几种方式包括:PEA序贯BPA(包括PEA术后紧急BPA)、BPA序贯PEA、PEA同步BPA。
(一)PEA序贯BPA
PEA术后残余/复发PH患者,如有远端病变,可进行BPA治疗,目前临床应用相对较多。可进一步改善患者血流动力学及症状,但需注意手术可能增加后期BPA相关并发症风险;对于PEA术后存在严重残余PH导致循环、氧合难以维持的患者,术后紧急BPA治疗,可改善预后,但由于患者血流动力学不稳定,操作风险高[137]。
(二)BPA序贯PEA
对于复杂病变、血流动力学较差的患者,可先行BPA介入治疗,改善血流动力学后行PEA手术。对于高危(术前高PVR)复杂病变患者,BPA治疗改善血流动力学后可增加手术安全性;但介入治疗对段或亚段水平肺动脉的扩张,可能破坏PEA剥离平面,增加后期PEA操作难度[11]。此外,对于双侧病变不对称的患者,如右肺以近段病变为主、左肺以远端病变为主,可先介入治疗左侧病变,后期以PEA治疗右肺病变[138]。
(三)PEA同步BPA
在PEA手术复温阶段,实施BPA治疗,同步治疗需要在杂交手术室进行,对于双侧肺动脉不均匀病变可能有一定价值,但PEA同步BPA操作复杂,相关风险增加,目前应用较少,需要仔细权衡利弊,且应在经验丰富的CTEPH中心进行[138]。
推荐意见9:对存在复杂病变的CTEPH患者,建议PEA、BPA和药物等多模式治疗(2C)。
六、肺移植与心肺联合移植
由于PEA、BPA、靶向药物等综合治疗对大多数CTEPH患者的疗效确切,目前CTEPH很少需肺移植或心肺联合移植治疗,如经综合治疗无效的终末期患者,可进行肺移植或心肺联合移植评估,但目前关于肺移植与心肺联合移植用于治疗CTEPH的经验有限。
第六部分 CTEPH的多学科团队和中心建设
CTEPH的诊治相对复杂,治疗方案的选择往往取决于接诊医师的团队经验,为改善患者预后,国外相关指南或共识均推荐建立CTEPH多学科诊治团队,包括呼吸与危重症医学科、心血管内外科、血管介入、影像等[94],并在此基础上,成立CTEPH诊治中心,常规对CTEPH患者进行评估与随访,诊治中心应能为患者提供PEA、BPA和药物三种治疗方式,且具备较丰富治疗经验:如PEA手术院内病死率控制在5%以下,每年开展BPA治疗30例或100次以上[1,139]。
推荐意见10:推荐建立CTEPH多学科诊治团队,并在此基础上成立CTEPH诊治中心(1C)。
国内医疗界对CTEPH的诊治起步相对较晚,但近年来发展迅速,BPA治疗逐步开展,PEA手术技术逐渐成熟,已有数家中心在PEA和BPA治疗方面积累较丰富经验,但尚需在此基础上完善CTEPH患者转诊体系,推广CTEPH诊治技术,逐步推进我国CTEPH诊治中心建设。
指南制订成员(按单位名称汉语拼音排序)
指南制订组长:王辰(中国医学科学院北京协和医学院)
顾问:钟南山(广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 呼吸疾病国家重点实验室);程显声(中国医学科学院阜外医院呼吸与肺血管病诊治中心);高润霖(中国医学科学院阜外医院冠心病诊治中心)
外籍顾问:Jason X._J. Yuan(美国加州大学圣地亚哥分校医学院);Lan Zhao(英国帝国理工大学医学院)
统稿专家组:
组长:陈耀龙(兰州大学基础医学院循证医学研究所);杨媛华(首都医科大学附属北京朝阳医院呼吸与危重症医学科);熊长明(中国医学科学院阜外医院呼吸与肺血管病诊治中心);谢万木(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸系统疾病临床医学研究中心);翟振国(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心)
执笔专家组:
组长:杨媛华(首都医科大学附属北京朝阳医院呼吸与危重症医学科);熊长明(中国医学科学院阜外医院呼吸与肺血管病诊治中心)
成员:马壮(北部战区总医院呼吸与危重症医学科)、王琦光(北部战区总医院先心病内科);王迁、赵久良(北京协和医院风湿免疫科);施举红(北京协和医院呼吸与危重症医学科);许小毛(北京医院呼吸与危重症医学科);陈虹(重庆医科大学附属第一医院呼吸与危重症医学科);王健、洪城(广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心 国家呼吸医学中心 呼吸疾病国家重点实验室);胡清华(华中科技大学同济医学院病理生理学系);李发久、李承红(江汉大学附属医院呼吸与危重症医学科);程兆忠(青岛大学附属医院呼吸与危重症医学科);崔晓霈、纪求尚(山东大学齐鲁医院老年科);朱玲(山东省立医院呼吸与危重症医学科);万钧(首都医科大学附属北京安贞医院呼吸与危重症医学科);杨媛华、龚娟妮、杨苏乔(首都医科大学附属北京朝阳医院呼吸与危重症医学科);易群(四川大学华西医院呼吸与危重症医学科);郭璐(四川省人民医院呼吸与危重症医学科);杨振文(天津医科大学总医院心血管内科);王岚、宫素岗、刘锦铭(同济大学附属上海市肺科医院肺循环科);季颖群、华晶(同济大学上海东方医院呼吸与危重症医学科);张云辉、邓峥(云南省第一人民医院呼吸与危重症医学科);马国峰(浙江大学邵逸夫医院呼吸与危重症医学科);柳志红、罗勤、陶新曹(中国医学科学院阜外医院呼吸与肺血管病诊治中心);刘盛(中国医学科学院阜外医院心外科);陈文慧、谢万木、翟振国(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸系统疾病临床医学研究中心),刘敏(中日友好医院放射诊断科),李环(中日友好医院核医学科),张亚军(中日友好医院麻醉科),甄雅南、刘晓鹏、孙光(中日友好医院心血管外科),李爱莉(中日友好医院心脏科)
外审专家组:
组长:胡成平(中南大学湘雅医院呼吸与危重症医学科)
成员:刘蕾(北部战区总医院呼吸与危重症医学科);朱鲜阳、王琦光(北部战区总医院呼吸与危重症医学科心血管内科);张静(北京大学第三医院呼吸与危重症医学科);杜军保(北京大学第一医院儿科);刘双(北京大学国际医院呼吸与危重症医学科);张运剑(北京积水潭医院呼吸与危重症医学科);肖飞(北京医院分子诊断中心);张燕(重庆市人民医院呼吸与危重症医学科);黄玮(重庆医科大学附属第一医院心血管内科);李玉英、吴学玲(第三军医大学附属新桥医院呼吸与危重症医学科);邓朝胜(福建医科大学附属第一医院呼吸与危重症医学科);李圣青(复旦大学附属上海华山医院呼吸与危重症医学科);周达新、管丽华(复旦大学附属中山医院心内科);曹云山(甘肃省人民医院心血管内科);张平、徐汝洪(广东省东莞市人民医院呼吸与危重症医学科);黄奕高、姚桦、张曹进(广东省人民医院心血管内科);刘春丽、张挪富(广州医科大学附属第一医院呼吸与危重症医学科 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心 国家呼吸医学中心);张伟(广州中医药大学第一附属医院呼吸内科);刘维佳(贵州省人民医院呼吸与危重症医学科);朱大岭(哈尔滨医科大学药学院);袁雅冬(河北医科大学第二医院呼吸与危重症医学科);陈刚(河北医科大学第三医院呼吸与危重症医学科);张瑛琪(河北医科大学第一医院呼吸与危重症医学科);毛毅敏(河南科技大学第一附属医院呼吸与危重症医学科);赵丽敏(河南省人民医院呼吸为危重症医学科);戴爱国(湖南省老年医院呼吸与危重症医学科);胡清华(华中科技大学同济医学院附属同济医院呼吸疾病重点实验室);甄国华(华中科技大学同济医学院附属同济医院呼吸与危重症医学科),董春玲、徐伟(吉林大学第二医院呼吸与危重症医学科);解卫平(南京医科大学附属第一医院呼吸与危重症医学科);王宁(空军军医大学唐都医院呼吸与危重症医学科);张艰(空军军医大学西京医院呼吸与危重症医学科);邢西迁(昆明医科大学附属延安医院呼吸与危重症医学科);倪松石(南通大学附属医院呼吸与危重症医学科);徐喜媛(内蒙古医科大学第三附属医院内蒙古包钢医院呼吸与危重症医学科);王佳烈(内蒙古自治区人民医院呼吸与危重症医学科);程兆忠(青岛大学附属医院呼吸与危重症医学科);朱玲(山东省立医院呼吸与危重症医学科);杜永成、张爱珍(山西省人民医院呼吸与危重症医学科);胡晓芸、施熠炜(山西医科大学第一医院呼吸与危重症医学科);沈节艳(上海交通大学医学院附属仁济医院心血管内科);傅应云(深圳市人民医院呼吸与危重症医学科);夏书月(沈阳医学院奉天医院呼吸与危重症医学科);朱光发(首都医科大学附属北京安贞医院呼吸与危重症医学科);杜杰(首都医科大学附属北京安贞医院精准医学中心);孙艺红(首都医科大学附属北京安贞医院心血管内科);顾虹(首都医科大学附属北京安贞医院小儿心脏中心);刘广杰(首都医科大学附属北京同仁医院呼吸与危重症医学科);吴琦(天津市海河医院呼吸与危重症医学科);余鹰(天津医科大学基础医学院);董丽霞(天津医科大学总医院呼吸与危重症医学科);王良兴(温州医学院附属第一医院呼吸与危重症医学科);张刚成(武汉亚洲心脏病医院心血管外科);范粉灵(西安交通大学第一附属医院心血管内科);李满祥(西安交通大学医学院第一附属医院呼吸与危重症医学科);陈颖(新疆维吾尔自治区人民医院呼吸与危重症医学科);杨惠琴(新疆维吾尔自治区中医院呼吸与危重症医学科);刘晖(新疆医科大学第一附属医院呼吸与危重症医学科);罗琴(新疆医科大学附属肿瘤医院呼吸神经内科);潘慧云(浙江大学医学院附属第一医院高级病房);应可净(浙江大学医学院附属邵逸夫医院呼吸与危重症医学科);杨隽(浙江大学医学院基础医学院);程哲、靳建军(郑州大学第一附属医院呼吸与危重症医学科);许启霞(中国科技大学附属安徽省立医院呼吸与危重症医学科);张伟华(中国人民解放军总医院第一医学中心呼吸内科);刘璠(中国医科大学附属第一医院呼吸内科);张坡(中国医科大学附属盛京医院呼吸与危重症医学科);何建国(中国医学科学院阜外医院呼吸与肺血管病诊治中心);吴尚洁(中南大学湘雅二医院呼吸与危重症医学科);李江(中南大学湘雅二医院心血管内科);唐勇军、杨威(中南大学湘雅医院呼吸与危重症医学科);刘鹏(中日友好医院心脏血管外科);任景怡(中日友好医院心脏内科)
证据评价组:
组长:陈耀龙(兰州大学基础医学院循证医学研究所)
成员:王胜锋、梁宝生(北京大学公共卫生学院);罗旭飞(兰州大学基础医学院循证医学研究所);张萌(首都医科大学附属北京安贞医院呼吸与危重症医学科);李宜珊、高倩、张帅、张云霞、张竹(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸系统疾病临床医学研究中心)
绘图组:翟昕怡(北京服装学院视觉传达设计专业插画班);龚娟妮(首都医科大学附属北京朝阳医院);黄强(中日友好医院呼吸中心);李宜珊、田瀚(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸系统疾病临床医学研究中心);夏磊(中日友好医院呼吸中心 呼吸实验研究部)
秘书组:
组长:谢万木(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸系统疾病临床医学研究中心)
成员:万钧、张萌(首都医科大学附属北京安贞医院呼吸与危重症医学科);姚婷、龙泓竹、孔艳华、宋玥波、付守强(国家中西医结合医学中心 中日友好医院中西医结合肺病科);张帅、李宜珊(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸系统疾病临床医学研究中心)
利益冲突
所有作者声明不存在利益冲突
参考文献:
[1]HumbertM, KovacsG, HoeperMM, et al. 2022 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Eur Respir J, 2023, 61(1):2200879[pii]. DOI: 10.1183/13993003.00879-2022.
[2]谢万木, 甄凯元, 张萌, 等. 呼吸科医生对慢性血栓栓塞性肺动脉高压的认知与诊疗现状调查[J]. 中华结核和呼吸杂志, 2020, 43(8):677-680. DOI: 10.3760/cma.j.cn112147-20190912-00626.
[3]中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14):1060-1087. DOI: 10.3760/cma.j.issn.0376-2491.2018.14.007.
[4]中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组, 等. 中国肺动脉高压诊断与治疗指南(2021版)[J]. 中华医学杂志, 2021, 101(1):11-51. DOI: 10.3760/cma.j.cn112137-20201008-02778.
[5]GalièN, McLaughlinVV, RubinLJ, et al. An overview of the 6th World Symposium on Pulmonary Hypertension[J]. Eur Respir J, 2019, 53(1):1802148. DOI: 10.1183/13993003.02148-2018.
[6]World Health Organization. WHO handbook for guideline development[M]. 2nd edit. Geneva: World Health Organization, 2014.
[7]陈耀龙, 杨克虎, 王小钦, 等. 中国制订/修订临床诊疗指南的指导原则(2022版)[J]. 中华医学杂志, 2022, 102(10):697-703. DOI: 10.3760/cma.j.cn112137-20211228-02911.
[8]BrouwersMC, KhoME, BrowmanGP, et al. AGREE Ⅱ: advancing guideline development, reporting and evaluation in health care[J]. CMAJ, 2010, 182(18):E839-E842. DOI: 10.1503/cmaj.090449.
[9]ChenY, YangK, MarušicA, et al. A reporting tool for practice guidelines in health care: the RIGHT statement[J]. Ann Intern Med, 2017, 166(2):128-132. DOI: 10.7326/M16-1565.
[10]SirajuddinA, MirmomenSM, HenryTS, et al. ACR appropriateness criteria® suspected pulmonary hypertension: 2022 Update[J]. J Am Coll Radiol, 2022, 19(11S):S502-S512. DOI: 10.1016/j.jacr.2022.09.018.
[11]de PerrotM, GopalanD, JenkinsD, et al. Evaluation and management of patients with chronic thromboembolic pulmonary hypertension-consensus statement from the ISHLT[J]. J Heart Lung Transplant, 2021, 40(11):1301-1326. DOI: 10.1016/j.healun.2021.07.020.
[12]DelcroixM, TorbickiA, GopalanD, et al. ERS statement on chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2021, 57(6):2002828[pii]. DOI: 10.1183/13993003.02828-2020.
[13]ParkJH, NaJO, LeeJS, et al. 2020 KSC/KATRD guideline for the diagnosis and treatment of pulmonary hypertension: executive summary[J]. Tuberc Respir Dis (Seoul), 2022, 85(1):1-10. DOI: 10.4046/trd.2021.0022.
[14]HiraniN, BrunnerNW, KapasiA, et al. Canadian Cardiovascular Society/Canadian Thoracic Society Position Statement on Pulmonary Hypertension[J]. Can J Cardiol, 2020, 36(7):977-992. DOI: 10.1016/j.cjca.2019.11.041.
[15]KonstantinidesSV, MeyerG, BecattiniC, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS)[J]. Eur Heart J, 2020, 41(4):543-603. DOI: 10.1093/eurheartj/ehz405.
[16]HelmersenD, ProvencherS, HirschAM, et al. Diagnosis of chronic thromboembolic pulmonary hypertension: a Canadian Thoracic Society clinical practice guideline update [J]. Can J Resp Crit Care, 2019, 3(4): 177-198. DOI: 10.1080/24745332.2019.1631663.
[17]KielyDG, LevinD, HassounP, et al. EXPRESS: statement on imaging and pulmonary hypertension from the Pulmonary Vascular Research Institute (PVRI)[J]. Pulm Circ, 2019, 9(3):2045894019841990. DOI: 10.1177/2045894019841990.
[18]GrünigE, EichstaedtC, BarberàJA, et al. ERS statement on exercise training and rehabilitation in patients with severe chronic pulmonary hypertension[J]. Eur Respir J, 2019, 53(2):1800332[pii]. DOI: 10.1183/13993003.00332-2018.
[19]HansmannG, KoestenbergerM, AlastaloTP, et al. 2019 updated consensus statement on the diagnosis and treatment of pediatric pulmonary hypertension: the European Pediatric Pulmonary Vascular Disease Network (EPPVDN), endorsed by AEPC, ESPR and ISHLT[J]. J Heart Lung Transplant, 2019, 38(9):879-901. DOI: 10.1016/j.healun.2019.06.022.
[20]RosenkranzS, GhofraniHA, GrünigE, et al. Cologne consensus conference on pulmonary hypertension-Update 2018[J]. Int J Cardiol, 2018, 272S:1-3. DOI: 10.1016/j.ijcard.2018.09.064.
[21]AugustineDX, Coates-BradshawLD, WillisJ, et al. Echocardiographic assessment of pulmonary hypertension: a guideline protocol from the British Society of Echocardiography[J]. Echo Res Pract, 2018, 5(3):G11-G24. DOI: 10.1530/ERP-17-0071.
[22]FukudaK, DateH, DoiS, et al. Guidelines for the Treatment of Pulmonary Hypertension (JCS 2017/JPCPHS 2017)[J]. Circ J, 2019, 83(4):842-945. DOI: 10.1253/circj.CJ-66-0158.
[23]BarberàJA, RománA, Gómez-SánchezMÁ, et al. Guidelines on the diagnosis and treatment of pulmonary hypertension: summary of recommendations[J]. Arch Bronconeumol (Engl Ed), 2018, 54(4):205-215. DOI: 10.1016/j.arbres.2017.11.014.
[24]SirajuddinA, DonnellyEF, CrabtreeTP, et al. ACR appropriateness criteria(®) suspected pulmonary hypertension[J]. J Am Coll Radiol, 2017, 14(5S):S350-S361. DOI: 10.1016/j.jacr.2017.01.040.
[25]HansmannG, ApitzC, Abdul-KhaliqH, et al. Executive summary. Expert consensus statement on the diagnosis and treatment of paediatric pulmonary hypertension. The European Paediatric Pulmonary Vascular Disease Network, endorsed by ISHLT and DGPK[J]. Heart, 2016, 102Suppl 2:ii86-ii100. DOI: 10.1136/heartjnl-2015-309132.
[26]NICE. Balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension [EB/OL].[2018-04-27].https://www.nice.org.uk/guidance/ipg554.
[27]HemnesAR, KielyDG, CockrillBA, et al. Statement on pregnancy in pulmonary hypertension from the Pulmonary Vascular Research Institute[J]. Pulm Circ, 2015, 5(3):435-465. DOI: 10.1086/682230.
[28]GalièN, HumbertM, VachieryJL, et al. 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT)[J]. Eur Heart J, 2016, 37(1):67-119. DOI: 10.1093/eurheartj/ehv317.
[29]IdreesMM, SaleemiS, AzemMA, et al. Saudi guidelines on the diagnosis and treatment of pulmonary hypertension: 2014 updates[J]. Ann Thorac Med, 2014, 9(Suppl 1):S1-S15. DOI: 10.4103/1817-1737.134006.
[30]KhannaD, GladueH, ChannickR, et al. Recommendations for screening and detection of connective tissue disease-associated pulmonary arterial hypertension[J]. Arthritis Rheum, 2013, 65(12):3194-3201. DOI: 10.1002/art.38172.
[31]FangJC, DeMarcoT, GivertzMM, et al. World Health Organization Pulmonary Hypertension group 2: pulmonary hypertension due to left heart disease in the adult--a summary statement from the Pulmonary Hypertension Council of the International Society for Heart and Lung Transplantation[J]. J Heart Lung Transplant, 2012, 31(9):913-933. DOI: 10.1016/j.healun.2012.06.002.
[32]ReisA, RochaN, BarrosR, et al. Guidelines for the management of pulmonary hypertension patients[J]. Rev Port Pneumol, 2010, 16Suppl 4:S7-S85. DOI: 10.1016/S0873-2159(15)30103-3.
[33]McLaughlinVV, ArcherSL, BadeschDB, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association[J]. J Am Coll Cardiol, 2009, 53(17):1573-1619. DOI: 10.1016/j.jacc.2009.01.004.
[34]中华医学会心血管病学分会肺血管病学组, 中华心血管病杂志编辑委员会. 中国肺高血压诊断和治疗指南2018[J]. 中华心血管病杂志, 2018, 46(12):933-964. DOI: 10.3760/cma.j.issn.0253-3758.2018.12.006.
[35]中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会. 新生儿肺动脉高压诊治专家共识[J]. 中华儿科杂志, 2017, 55(3):163-168. DOI: 10.3760/cma.j.issn.0578-1310.2017.03.002.
[36]中国医师学会心血管内科医师分会. 2015年先天性心脏病相关性肺动脉高压诊治中国专家共识[J]. 中国介入心脏病学杂志, 2015, 23(2):61-69. DOI: 10.3969/j.issn.1004-8812.2015.02.001.
[37]中华医学会儿科学分会心血管学组, 《中华儿科杂志》编辑委员会. 儿童肺高血压诊断与治疗专家共识[J]. 中华儿科杂志, 2015, 53(1):6-16. DOI: 10.3760/cma.j.issn.0578-1310.2015.01.003.
[38]荆志成. 2010年中国肺高血压诊治指南[J]. 中国医学前沿杂志(电子版), 2011, 3(2):62-81. DOI: 10.3969/j.issn.1674-7372.2011.02.016.
[39]SheaBJ, GrimshawJM, WellsGA, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews[J]. BMC Med Res Methodol, 2007, 7:10. DOI: 10.1186/1471-2288-7-10.
[40]HigginsJP, AltmanDG, GøtzschePC, et al. The Cochrane Collaboration′s tool for assessing risk of bias in randomised trials[J]. BMJ, 2011, 343:d5928. DOI: 10.1136/bmj.d5928.
[41]WhitingPF, RutjesAW, WestwoodME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8):529-536. DOI: 10.7326/0003-4819-155-8-201110180-00009.
[42]WellsGA, WellsG, SheaB, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyse[EB/OL].[2018-04-27].https://api.semanticscholar.org/CorpusID:79550924.
[43]陈耀龙, 姚亮, NorrisSusan, 等. GRADE在系统评价中应用的必要性及注意事项[J]. 中国循证医学杂志, 2013, 13(12):1401-1404. DOI: 10.7507/1672-2531.20130240.
[44]VernooijRW, SanabriaAJ, SolàI, et al. Guidance for updating clinical practice guidelines: a systematic review of methodological handbooks[J]. Implement Sci, 2014, 9:3. DOI: 10.1186/1748-5908-9-3.
[45]VernooijRW, Alonso-CoelloP, BrouwersM, et al. Reporting Items for Updated Clinical Guidelines: Checklist for the Reporting of Updated Guidelines (CheckUp)[J]. PLoS Med, 2017, 14(1):e1002207. DOI: 10.1371/journal.pmed.1002207.
[46]Escribano-SubiasP, BlancoI, López-MeseguerM, et al. Survival in pulmonary hypertension in Spain: insights from the Spanish registry[J]. Eur Respir J, 2012, 40(3):596-603. DOI: 10.1183/09031936.00101211.
[47]SkrideA, SablinskisK, LejnieksA, et al. Characteristics and survival data from Latvian pulmonary hypertension registry: comparison of prospective pulmonary hypertension registries in Europe[J]. Pulm Circ, 2018, 8(3):2045894018780521. DOI: 10.1177/2045894018780521.
[48]KigitovicaD, SablinskisM, SablinskisK, et al. Pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension incidence in Latvia in 2018[J]. Eur J Intern Med, 2019, 65:e9-e10. DOI: 10.1016/j.ejim.2019.04.022.
[49]DelcroixM, KerrK, FedulloP. Chronic thromboembolic pulmonary hypertension. epidemiology and risk factors[J]. Ann Am Thorac Soc, 2016, 13Suppl 3:S201-S206. DOI: 10.1513/AnnalsATS.201509-621AS.
[50]GolpeR, Pérez-de-LlanoLA, Castro-AñónO, et al. Right ventricle dysfunction and pulmonary hypertension in hemodynamically stable pulmonary embolism[J]. Respir Med, 2010, 104(9):1370-1376. DOI: 10.1016/j.rmed.2010.03.031.
[51]GuérinL, CouturaudF, ParentF, et al. Prevalence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. Prevalence of CTEPH after pulmonary embolism[J]. Thromb Haemost, 2014, 112(3):598-605. DOI: 10.1160/TH13-07-0538.
[52]SimonneauG, HoeperMM. Evaluation of the incidence of rare diseases: difficulties and uncertainties, the example of chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2017, 49(2):1602522[pii]. DOI: 10.1183/13993003.02522-2016.
[53]Ende-VerhaarYM, CannegieterSC, Vonk NoordegraafA, et al. Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: a contemporary view of the published literature[J]. Eur Respir J, 2017, 49(2):1601792[pii]. DOI: 10.1183/13993003.01792-2016.
[54]YangS, YangY, ZhaiZ, et al. Incidence and risk factors of chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism[J]. J Thorac Dis, 2015, 7(11):1927-1938. DOI: 10.3978/j.issn.2072-1439.2015.11.43.
[55]PangW, ZhangZ, WangZ, et al. Higher incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism in Asians Than in Europeans: a meta-analysis[J]. Front Med (Lausanne), 2021, 8:721294. DOI: 10.3389/fmed.2021.721294.
[56]KrammT, WilkensH, FugeJ, et al. Incidence and characteristics of chronic thromboembolic pulmonary hypertension in Germany[J]. Clin Res Cardiol, 2018, 107(7):548-553. DOI: 10.1007/s00392-018-1215-5.
[57]KerrKM, AugerWR, BenzaRL, et al. Preliminary data from the United States CTEPH Registry [J]. J Heart Lung Transpl, 2017, 36(4Suppl): S19-S20. DOI: 10.1016/j.healun.2017.01.039.
[58]谢万木, 王静, 张帅, 等. 慢性血栓栓塞性肺动脉高压患者的临床特征[J]. 中华医学杂志, 2019, 99(44):3461-3465. DOI: 10.3760/cma.j.issn.0376-2491.2019.44.003.
[59]OgawaA, SatohT, FukudaT, et al. Balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension: results of a multicenter registry[J]. Circ Cardiovasc Qual Outcomes, 2017, 10(11):e004029[pii]. DOI: 10.1161/CIRCOUTCOMES.117.004029.
[60]DengL, QuanR, YangY, et al. Characteristics and long-term survival of patients with chronic thromboembolic pulmonary hypertension in China[J]. Respirology, 2021, 26(2):196-203. DOI: 10.1111/resp.13947.
[61]YuriditskyE, HorowitzJM, LauJF. Chronic thromboembolic pulmonary hypertension and the post-pulmonary embolism (PE) syndrome[J]. Vasc Med, 2023, 28(4):348-360. DOI: 10.1177/1358863X231165105.
[62]QuarckR, WynantsM, VerbekenE, et al. Contribution of inflammation and impaired angiogenesis to the pathobiology of chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2015, 46(2):431-443. DOI: 10.1183/09031936.00009914.
[63]ZabiniD, HeinemannA, ForisV, et al. Comprehensive analysis of inflammatory markers in chronic thromboembolic pulmonary hypertension patients[J]. Eur Respir J, 2014, 44(4):951-962. DOI: 10.1183/09031936.00145013.
[64]KlokFA, CouturaudF, DelcroixM, et al. Diagnosis of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism[J]. Eur Respir J, 2020, 55(6):2000189[pii]. DOI: 10.1183/13993003.00189-2020.
[65]McCabeC, WhitePA, HooleSP, et al. Right ventricular dysfunction in chronic thromboembolic obstruction of the pulmonary artery: a pressure-volume study using the conductance catheter[J]. J Appl Physiol (1985), 2014, 116(4):355-363. DOI: 10.1152/japplphysiol.01123.2013.
[66]QuarckR, NawrotT, MeynsB, et al. C-reactive protein: a new predictor of adverse outcome in pulmonary arterial hypertension[J]. J Am Coll Cardiol, 2009, 53(14):1211-1218. DOI: 10.1016/j.jacc.2008.12.038.
[67]FuZ, TaoX, XieW, et al. Different response of the oxygen pathway in patients with chronic thromboembolic pulmonary hypertension treated with pulmonary endarterectomy versus balloon pulmonary angioplasty[J]. Front Cardiovasc Med, 2022, 9:990207. DOI: 10.3389/fcvm.2022.990207.
[68]Pepke-ZabaJ, DelcroixM, LangI, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry[J]. Circulation, 2011, 124(18):1973-1981. DOI: 10.1161/CIRCULATIONAHA.110.015008.
[69]LangIM, SimonneauG, Pepke-ZabaJW, et al. Factors associated with diagnosis and operability of chronic thromboembolic pulmonary hypertension. A case-control study[J]. Thromb Haemost, 2013, 110(1):83-91. DOI: 10.1160/TH13-02-0097.
[70]CondliffeR, KielyDG, GibbsJS, et al. Prognostic and aetiological factors in chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2009, 33(2):332-338. DOI: 10.1183/09031936.00092008.
[71]Remy-JardinM, RyersonCJ, SchieblerML, et al. Imaging of pulmonary hypertension in adults: a position paper from the Fleischner Society[J]. Eur Respir J, 2021, 57(1):2004455[pii]. DOI: 10.1183/13993003.04455-2020.
[72]RudskiLG, LaiWW, AfilaloJ, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography[J]. J Am Soc Echocardiogr, 2010, 23(7):685-713; quiz 786-788. DOI: 10.1016/j.echo.2010.05.010.
[73]LangRM, BadanoLP, Mor-AviV, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. Eur Heart J Cardiovasc Imaging, 2015, 16(3):233-270. DOI: 10.1093/ehjci/jev014.
[74]ZhaiZ, MurphyK, TigheH, et al. Differences in ventilatory inefficiency between pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension[J]. Chest, 2011, 140(5):1284-1291. DOI: 10.1378/chest.10-3357.
[75]GodinasL, SattlerC, LauEM, et al. Dead-space ventilation is linked to exercise capacity and survival in distal chronic thromboembolic pulmonary hypertension[J]. J Heart Lung Transplant, 2017, 36(11):1234-1242. DOI: 10.1016/j.healun.2017.05.024.
[76]TunariuN, GibbsSJ, WinZ, et al. Ventilation-perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension[J]. J Nucl Med, 2007, 48(5):680-684. DOI: 10.2967/jnumed.106.039438.
[77]SolerX, KerrKM, MarshJJ, et al. Pilot study comparing SPECT perfusion scintigraphy with CT pulmonary angiography in chronic thromboembolic pulmonary hypertension[J]. Respirology, 2012, 17(1):180-184. DOI: 10.1111/j.1440-1843.2011.02061.x.
[78]谢万木, 刘敏, 杨宏伟, 等. 慢性血栓栓塞性肺动脉高压患者CT肺血管造影的特征[J]. 中华医学杂志, 2020, 100(26):2012-2017. DOI: 10.3760/cma.j.cn112137-20200313-00736.
[79]RuggieroA, ScreatonNJ. Imaging of acute and chronic thromboembolic disease: state of the art[J]. Clin Radiol, 2017, 72(5):375-388. DOI: 10.1016/j.crad.2017.02.011.
[80]CaponeC, ValentiniA, SpinilloSL, et al. Radiological differences between chronic thromboembolic pulmonary disease (CTEPD) and chronic thromboembolic pulmonary hypertension (CTEPH)[J]. Eur Radiol, 2021, 31(8):6230-6238. DOI: 10.1007/s00330-020-07556-4.
[81]Si-MohamedSA, ZumbihlL, TurquierS, et al. Lung Dual-Energy CT Perfusion Blood Volume as a Marker of Severity in Chronic Thromboembolic Pulmonary Hypertension[J]. Diagnostics (Basel), 2023, 13(4):769. DOI: 10.3390/diagnostics13040769.
[82]RajaramS, SwiftAJ, TelferA, et al. 3D contrast-enhanced lung perfusion MRI is an effective screening tool for chronic thromboembolic pulmonary hypertension: results from the ASPIRE Registry[J]. Thorax, 2013, 68(7):677-678. DOI: 10.1136/thoraxjnl-2012-203020.
[83]RajaramS, SwiftAJ, CapenerD, et al. Diagnostic accuracy of contrast-enhanced MR angiography and unenhanced proton MR imaging compared with CT pulmonary angiography in chronic thromboembolic pulmonary hypertension[J]. Eur Radiol, 2012, 22(2):310-317. DOI: 10.1007/s00330-011-2252-x.
[84]KreitnerKF, KunzRP, LeyS, et al. Chronic thromboembolic pulmonary hypertension-assessment by magnetic resonance imaging[J]. Eur Radiol, 2007, 17(1):11-21. DOI: 10.1007/s00330-006-0327-x.
[85]KawakamiT, OgawaA, MiyajiK, et al. Novel angiographic classification of each vascular lesion in chronic thromboembolic pulmonary hypertension based on selective angiogram and results of balloon pulmonary angioplasty[J]. Circ Cardiovasc Interv, 2016, 9(10):e003318[pii]. DOI: 10.1161/CIRCINTERVENTIONS.115.003318.
[86]InamiT, KataokaM, ShimuraN, et al. Pulmonary edema predictive scoring index (PEPSI), a new index to predict risk of reperfusion pulmonary edema and improvement of hemodynamics in percutaneous transluminal pulmonary angioplasty[J]. JACC Cardiovasc Interv, 2013, 6(7):725-736. DOI: 10.1016/j.jcin.2013.03.009.
[87]KlokFA, Dzikowska-DiduchO, KostrubiecM, et al. Derivation of a clinical prediction score for chronic thromboembolic pulmonary hypertension after acute pulmonary embolism[J]. J Thromb Haemost, 2016, 14(1):121-128. DOI: 10.1111/jth.13175.
[88]Ende-VerhaarYM, HuismanMV, KlokFA. To screen or not to screen for chronic thromboembolic pulmonary hypertension after acute pulmonary embolism[J]. Thromb Res, 2017, 151:1-7. DOI: 10.1016/j.thromres.2016.12.026.
[89]Ende-VerhaarYM, RuigrokD, BogaardHJ, et al. Sensitivity of a simple noninvasive screening algorithm for chronic thromboembolic pulmonary hypertension after acute pulmonary embolism[J]. TH Open, 2018, 2(1):e89-e95. DOI: 10.1055/s-0038-1636537.
[90]HeJ, FangW, LvB, et al. Diagnosis of chronic thromboembolic pulmonary hypertension: comparison of ventilation/perfusion scanning and multidetector computed tomography pulmonary angiography with pulmonary angiography[J]. Nucl Med Commun, 2012, 33(5):459-463. DOI: 10.1097/MNM.0b013e32835085d9.
[91]BenzaRL, FarberHW, FrostA, et al. REVEAL risk score in patients with chronic thromboembolic pulmonary hypertension receiving riociguat[J]. J Heart Lung Transplant, 2018, 37(7):836-843. DOI: 10.1016/j.healun.2018.02.015.
[92]QuanR, YangY, YangZ, et al. Risk prediction in medically treated chronic thromboembolic pulmonary hypertension[J]. BMC Pulm Med, 2021, 21(1):128. DOI: 10.1186/s12890-021-01495-6.
[93]HumbertM, FarberHW, GhofraniHA, et al. Risk assessment in pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2019, 53(6):1802004. DOI: 10.1183/13993003.02004-2018.
[94]JenkinsD, MadaniM, FadelE, et al. Pulmonary endarterectomy in the management of chronic thromboembolic pulmonary hypertension[J]. Eur Respir Rev, 2017, 26(143):160111. DOI: 10.1183/16000617.0111-2016.
[95]UlrichS, SaxerS, HaslerED, et al. Effect of domiciliary oxygen therapy on exercise capacity and quality of life in patients with pulmonary arterial or chronic thromboembolic pulmonary hypertension: a randomised, placebo-controlled trial[J]. Eur Respir J, 2019, 54(2):1900276[pii]. DOI: 10.1183/13993003.002762019.
[96]HosokawaK, WatanabeH, TaniguchiY, et al. A multicenter, single-blind, randomized, warfarin-controlled trial of edoxaban in patients with chronic thromboembolic pulmonary hypertension: KABUKI Trial[J]. Circulation, 2024, 149(5):406-409. DOI: 10.1161/CIRCULATIONAHA.123.067528.
[97]PengoV, DenasG, ZoppellaroG, et al. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome[J]. Blood, 2018, 132(13):1365-1371. DOI: 10.1182/blood-2018-04-848333.
[98]BunclarkK, NewnhamM, ChiuYD, et al. A multicenter study of anticoagulation in operable chronic thromboembolic pulmonary hypertension[J]. J Thromb Haemost, 2020, 18(1):114-122. DOI: 10.1111/jth.14649.
[99]TamuraY, KimuraM, TakeiM, et al. Oral vasopressin receptor antagonist tolvaptan in right heart failure due to pulmonary hypertension[J]. Eur Respir J, 2015, 46(1):283-286. DOI: 10.1183/09031936.00044915.
[100]赵智慧, 晏露, 柳志红, 等. 托伐普坦治疗肺动脉高压所致右心衰竭患者的有效性及安全性研究[J]. 中国循环杂志, 2019, 34(7):688-692. DOI: 10.3969/j.issn.1000-3614.2019.07.012.
[101]GrünigE, MacKenzieA, PeacockAJ, et al. Standardized exercise training is feasible, safe, and effective in pulmonary arterial and chronic thromboembolic pulmonary hypertension: results from a large European multicentre randomized controlled trial[J]. Eur Heart J, 2021, 42(23):2284-2295. DOI: 10.1093/eurheartj/ehaa696.
[102]HsiehWC, JansaP, HuangWC, et al. Residual pulmonary hypertension after pulmonary endarterectomy: a meta-analysis[J]. J Thorac Cardiovasc Surg, 2018, 156(3):1275-1287. DOI: 10.1016/j.jtcvs.2018.04.110.
[103]MadaniMM, AugerWR, PretoriusV, et al. Pulmonary endarterectomy: recent changes in a single institution′s experience of more than 2, 700 patients[J]. Ann Thorac Surg, 2012, 94(1):97-103; discussion 103. DOI: 10.1016/j.athoracsur.2012.04.004.
[104]LankeitM, KriegV, HobohmL, et al. Pulmonary endarterectomy in chronic thromboembolic pulmonary hypertension[J]. J Heart Lung Transplant, 2017:S1053-2498(17)31877-31876 [pii]. DOI: 10.1016/j.healun.2017.06.011.
[105]KimNH, DelcroixM, JaisX, et al. Chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2019, 53(1):1801915. DOI: 10.1183/13993003.01915-2018.
[106]DelcroixM, TorbickiA, GopalanD, et al. ERS statement on chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2021, 57(6):2002828[pii]. DOI: 10.1183/13993003.02828-2020.
[107]FernandesTM, KimNH, KerrKM, et al. Distal vessel pulmonary thromboendarterectomy: results from a single institution[J]. J Heart Lung Transplant, 2023, 42(8):1112-1119. DOI: 10.1016/j.healun.2023.02.1500.
[108]JenkinsDP, BiedermanA, D′ArminiAM, et al. Operability assessment in CTEPH: lessons from the CHEST-1 study[J]. J Thorac Cardiovasc Surg, 2016, 152(3):669-674.e3. DOI: 10.1016/j.jtcvs.2016.02.062.
[109]de PerrotM, McRaeK, DonahoeL, et al. Pulmonary endarterectomy in severe chronic thromboembolic pulmonary hypertension: the Toronto experience[J]. Ann Cardiothorac Surg, 2022, 11(2):133-142. DOI: 10.21037/acs-2021-pte-14.
[110]谢万木. 慢性肺血栓栓塞症与慢性血栓栓塞性肺动脉高压[J]. 中国实用内科杂志, 2021, 41(6):508-511. DOI: 10.19538/j.nk2021060112.
[111]DelcroixM, LangI, Pepke-ZabaJ, et al. Long-term outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry[J]. Circulation, 2016, 133(9):859-871. DOI: 10.1161/CIRCULATIONAHA.115.016522.
[112]MayerE, JenkinsD, LindnerJ, et al. Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry[J]. J Thorac Cardiovasc Surg, 2011, 141(3):702-710. DOI: 10.1016/j.jtcvs.2010.11.024.
[113]BondermanD, Skoro-SajerN, JakowitschJ, et al. Predictors of outcome in chronic thromboembolic pulmonary hypertension[J]. Circulation, 2007, 115(16):2153-2158. DOI: 10.1161/CIRCULATIONAHA.106.661041.
[114]CondliffeR, KielyDG, GibbsJS, et al. Improved outcomes in medically and surgically treated chronic thromboembolic pulmonary hypertension[J]. Am J Respir Crit Care Med, 2008, 177(10):1122-1127. DOI: 10.1164/rccm.200712-1841OC.
[115]FreedDH, ThomsonBM, BermanM, et al. Survival after pulmonary thromboendarterectomy: effect of residual pulmonary hypertension[J]. J Thorac Cardiovasc Surg, 2011, 141(2):383-387. DOI: 10.1016/j.jtcvs.2009.12.056.
[116]CannonJE, SuL, KielyDG, et al. Dynamic risk stratification of patient long-term outcome after pulmonary endarterectomy: results from the United Kingdom National Cohort[J]. Circulation, 2016, 133(18):1761-1771. DOI: 10.1161/CIRCULATIONAHA.115.019470.
[117]SugimuraK, FukumotoY, SatohK, et al. Percutaneous transluminal pulmonary angioplasty markedly improves pulmonary hemodynamics and long-term prognosis in patients with chronic thromboembolic pulmonary hypertension[J]. Circ J, 2012, 76(2):485-488. DOI: 10.1253/circj.cj-11-1217.
[118]MizoguchiH, OgawaA, MunemasaM, et al. Refined balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension[J]. Circ Cardiovasc Interv, 2012, 5(6):748-755. DOI: 10.1161/CIRCINTERVENTIONS.112.971077.
[119]KimSM, ChaRH, LeeJP, et al. Incidence and outcomes of contrast-induced nephropathy after computed tomography in patients with CKD: a quality improvement report [J]. American journal of kidney diseases: the official journal of the National Kidney Foundation, 2010, 55(6): 1018-1025. DOI: 10.1053/j.ajkd.2009.10.057.
[120]van der MolenAJ, ReimerP, DekkersIA, et al. Post-contrast acute kidney injury-Part 1: definition, clinical features, incidence, role of contrast medium and risk factors: recommendations for updated ESUR Contrast Medium Safety Committee guidelines [J]. Eur Radiol, 2018, 28(7): 2845-2855. DOI: 10.1007/s00330-017-5246-5.
[121]SueokaJ, KataokaM, ShimuraN, et al. Therapeutic efficacy after percutaneous transluminal pulmonary angioplasty in CTEPH with and without clotting disorder according to anti-cardiolipin antibody [J]. Int J Cardiol, 2015, 201: 271-273. DOI: 10.1016/j.ijcard.2015.08.104.
[122]van ThorMCJ, LelyRJ, BraamsNJ, et al. Safety and efficacy of balloon pulmonary angioplasty in chronic thromboembolic pulmonary hypertension in the Netherlands [J]. Netherlands heart journal: monthly journal of the Netherlands Society of Cardiology and the Netherlands Heart Foundation, 2020, 28(2): 81-88. DOI: 10.1007/s12471-019-01352-6.
[123]TzoumasA, PeppasS, SagrisM, et al. Advances in treatment of chronic thromboembolic pulmonary hypertension [J]. Thrombosis research, 2022, 212: 30-37. DOI: 10.1016/j.thromres.2022.02.003.
[124]JaïsX, BrenotP, BouvaistH, et al. Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension (RACE): a multicentre, phase 3, open-label, randomised controlled trial and ancillary follow-up study[J]. Lancet Respir Med, 2022, 10(10):961-971. DOI: 10.1016/S2213-2600(22)00214-4.
[125]KawakamiT, MatsubaraH, ShinkeT, et al. Balloon pulmonary angioplasty versus riociguat in inoperable chronic thromboembolic pulmonary hypertension (MR BPA): an open-label, randomised controlled trial[J]. Lancet Respir Med, 2022, 10(10):949-960. DOI: 10.1016/S2213-2600(22)00171-0.
[126]ChenSL, ZhangFF, XuJ, et al. Pulmonary artery denervation to treat pulmonary arterial hypertension: the single-center, prospective, first-in-man PADN-1 study (first-in-man pulmonary artery denervation for treatment of pulmonary artery hypertension)[J]. J Am Coll Cardiol, 2013, 62(12):1092-1100. DOI: 10.1016/j.jacc.2013.05.075.
[127]OgawaA, MatsubaraH. After the dawn-balloon pulmonary angioplasty for patients with chronic thromboembolic pulmonary hypertension[J]. Circ J, 2018, 82(5):1222-1230. DOI: 10.1253/circj.CJ-18-0258.
[128]WiedenrothCB, GhofraniHA, AdameitM, et al. Sequential treatment with riociguat and balloon pulmonary angioplasty for patients with inoperable chronic thromboembolic pulmonary hypertension[J]. Pulm Circ, 2018, 8(3):2045894018783996. DOI: 10.1177/2045894018783996.
[129]GhofraniHA, D′ArminiAM, GrimmingerF, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension[J]. N Engl J Med, 2013, 369(4):319-329. DOI: 10.1056/NEJMoa1209657.
[130]SimonneauG, D′ArminiAM, GhofraniHA, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension: a long-term extension study (CHEST-2)[J]. Eur Respir J, 2015, 45(5):1293-1302. DOI: 10.1183/09031936.00087114.
[131]Sadushi-KoliciR, JansaP, KopecG, et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): a double-blind, phase 3, randomised controlled trial[J]. Lancet Respir Med, 2019, 7(3):239-248. DOI: 10.1016/S2213-2600(18)30367-9.
[132]GhofraniHA, SimonneauG, D′ArminiAM, et al. Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1): results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study[J]. Lancet Respir Med, 2017, 5(10):785-794. DOI: 10.1016/S2213-2600(17)30305-3.
[133]JaïsX, D′ArminiAM, JansaP, et al. Bosentan for treatment of inoperable chronic thromboembolic pulmonary hypertension: BENEFiT (Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension), a randomized, placebo-controlled trial[J]. J Am Coll Cardiol, 2008, 52(25):2127-2134. DOI: 10.1016/j.jacc.2008.08.059.
[134]ReesinkHJ, SurieS, KloekJJ, et al. Bosentan as a bridge to pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension[J]. J Thorac Cardiovasc Surg, 2010, 139(1):85-91. DOI: 10.1016/j.jtcvs.2009.03.053.
[135]SuntharalingamJ, TreacyCM, DoughtyNJ, et al. Long-term use of sildenafil in inoperable chronic thromboembolic pulmonary hypertension[J]. Chest, 2008, 134(2):229-236. DOI: 10.1378/chest.07-2681.
[136]CabrolS, SouzaR, JaisX, et al. Intravenous epoprostenol in inoperable chronic thromboembolic pulmonary hypertension[J]. J Heart Lung Transplant, 2007, 26(4):357-362. DOI: 10.1016/j.healun.2006.12.014.
[137]CollaudS, BrenotP, MercierO, et al. Rescue balloon pulmonary angioplasty for early failure of pulmonary endarterectomy: The earlier the better?[J]. Int J Cardiol, 2016, 222:39-40. DOI: 10.1016/j.ijcard.2016.07.021.
[138]WiedenrothCB, LiebetrauC, BreitheckerA, et al. Combined pulmonary endarterectomy and balloon pulmonary angioplasty in patients with chronic thromboembolic pulmonary hypertension[J]. J Heart Lung Transplant, 2016, 35(5):591-596. DOI: 10.1016/j.healun.2015.10.030.
[139]JenkinsDP, MadaniM, MayerE, et al. Surgical treatment of chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2013, 41(3):735-742. DOI: 10.1183/09031936.00058112.
通信作者:谢万木,国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院 中日友好医院呼吸中心呼吸与危重症医学科 国家中西医结合医学中心 中日友好医院中西医结合肺病科,北京 100029,Email:xiewanmu@126.com;熊长明,中国医学科学院阜外医院呼吸与肺血管病诊治中心,北京 100037,Email:xiongcm2000@163.com;翟振国,国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院 中日友好医院呼吸中心呼吸与危重症医学科,北京100029,Email:zhaizhenguo2011@126.com;王辰,中国医学科学院北京协和医学院,北京 100730,Email:birm@263.net.
引用本文:中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作组, 全国肺栓塞与肺血管病防治协作组, 等. 慢性血栓栓塞性肺动脉高压诊断与治疗指南(2024版) [J] . 中华医学杂志, 2024, 104(24) : 2200-2221. DOI: 10.3760/cma.j.cn112137-20240116-00117.
本文转载自订阅号「中华医学杂志」
原链接戳:标准与规范 | 慢性血栓栓塞性肺动脉高压诊断与治疗指南(2024版)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


