
摘要
本文报道1例以肺部多发结节伴空洞为主要特征的老年男性病例。患者为73岁老年男性,主因“干咳伴气短3个月”入院,胸部CT示双肺多发不规则团块、结节、斑片影,伴空洞形成,同时合并贫血、肾功能不全,经验性抗感染、抗结核治疗后肺部结节进展、空洞增大。多次检测血ANCA均为阴性。支气管镜下对右肺中叶病变行黏膜活检,可见小片状坏死、局灶肉芽肿结构形成以及血管炎表现,弹力纤维染色在坏死灶中可见残存的血管壁结构。临床诊断ANCA阴性肉芽肿性多血管炎,给予糖皮质激素及环磷酰胺治疗后病灶缩小。
患者男,73岁,因“干咳伴气短3个月”于2022年5月26日入院。患者3个月前无明显诱因开始出现干咳,伴有乏力,活动耐力下降,无发热、盗汗,无皮疹及关节、肌肉酸痛。曾就诊于外院,胸部CT示双肺多发结节影、右肺下叶后基底段肿块伴空洞影。2个月前就诊我科门诊,复查胸部CT提示双肺多发结节、团块影,部分伴空洞形成(图1~3),住院给予超声引导下右肺病变处穿刺活检,病理提示肺组织呈慢性炎伴大片坏死,分子病理结果:PCR-TB(-)。特殊染色:抗酸染色(-),PAS(-),PASM(-)。临床上考虑特殊感染可能性大,肺结核不除外,试验性抗结核治疗3周(异烟肼0.3 g,1次/d;利福平0.45 g,1次/d;乙胺丁醇0.75 g,1次/d)。复查胸部CT提示双肺病灶较前进展(图4~10)。近3个月来患者体重下降近10 kg。既往史:高血压、糖尿病、冠心病病史;发现贫血4个月,口服琥珀酸亚铁、罗沙司他治疗;发现肾功能不全3个月,未治疗。
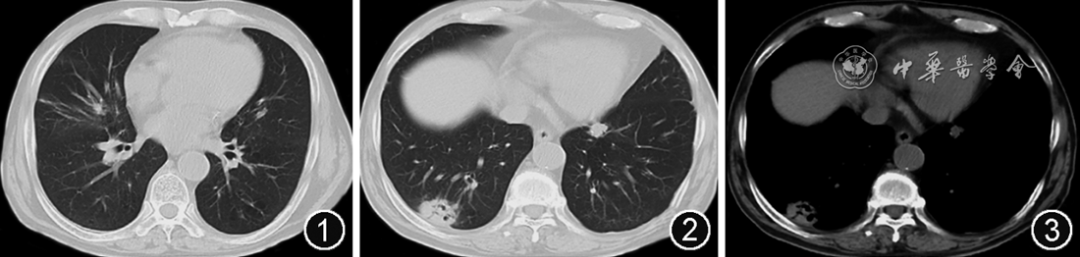
图1~3 2022年3月27日胸部CT可见双肺多发不规则团块、结节、斑片影,右肺下叶肿块影,约38 mm×27 mm,内见空洞,边缘分叶,局部胸膜凹陷
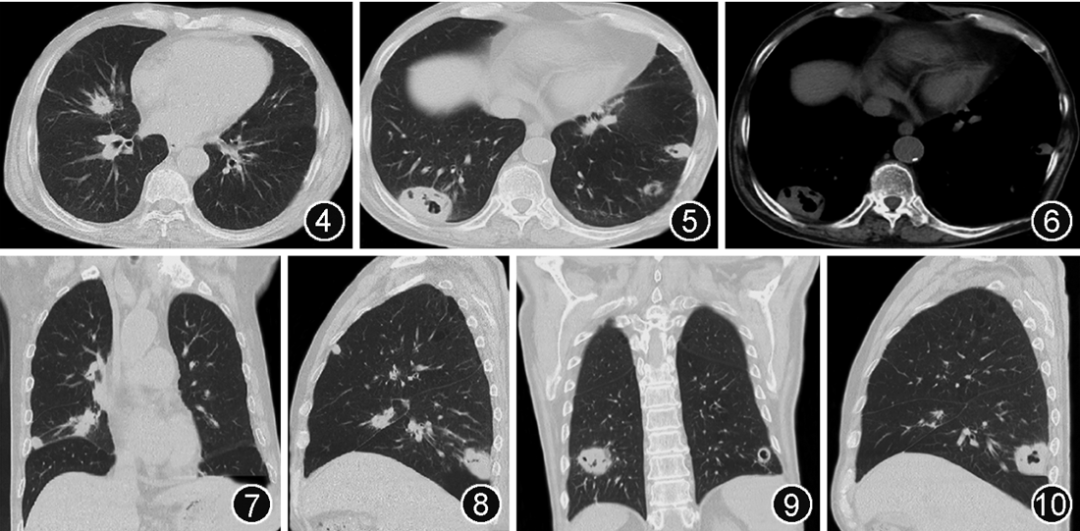
图4~10 2022年5月26日胸部CT可见双肺多发结节影较前增大,部分病灶内新见空洞,空洞较前变大,右肺下叶肿块影,约48 mm×33 mm,内见多发空洞
实验室检查:血红蛋白102 g/L。尿常规:尿糖3+,尿酮体-,尿潜血3+,尿蛋白2+。血生化:尿素17.2 mmol/L,肌酐266 μmol/L,白蛋白28.2 g/L。24 h尿蛋白定量1 252 mg。肿瘤标志物未见异常。ESR为36 mm/1 h;抗核抗体斑点型1∶80;连续两次复查抗中性粒细胞胞质抗体(ANCA)胞质型、ANCA核周型、抗髓性过氧化物酶抗体、抗蛋白酶3抗体均阴性。痰抗酸染色阴性;淋巴细胞培养+干扰素测定阳性。为进一步排查肿瘤性疾病,行全身PET/CT提示双肺多发结节及肿块,部分伴空洞,代谢增高;鼻窦、鼻中隔周围、双肺门、椎旁活跃病灶;鼻咽、咽旁间隙代谢增高灶;考虑肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)不除外(图11)。
行支气管镜检查,镜下见右肺上叶、中叶支气管黏膜弥漫充血水肿,分嵴增厚,致右中叶内侧段开口狭窄接近闭塞,对右中叶外侧段行超声小探头探查可见腔内病灶,分别对右上叶黏膜及右中叶外侧段腔内病变行组织活检(图12)。
病理回报可见小片状坏死,局灶肉芽肿结构形成,可见血管壁内炎细胞浸润,未见明确结核及肿瘤依据,考虑韦格纳肉芽肿(图13)。 抗酸染色(-),弹力纤维(+)。分子病理:荧光PCR-TB(-);原位杂交-EBV-EBER(-)。
至此临床诊断GPA基本成立。
此外,为明确是否合并GPA相关的肾脏损害,行肾脏穿刺活检,病理回报:局灶节段性肾小球硬化症(focal segmental glomerulosclerosis,FSGS)伴亚急性肾小管间质肾病。经与风湿免疫科、肾内科多学科会诊,考虑肉芽肿性多血管炎合并局灶节段性肾小球硬化症。
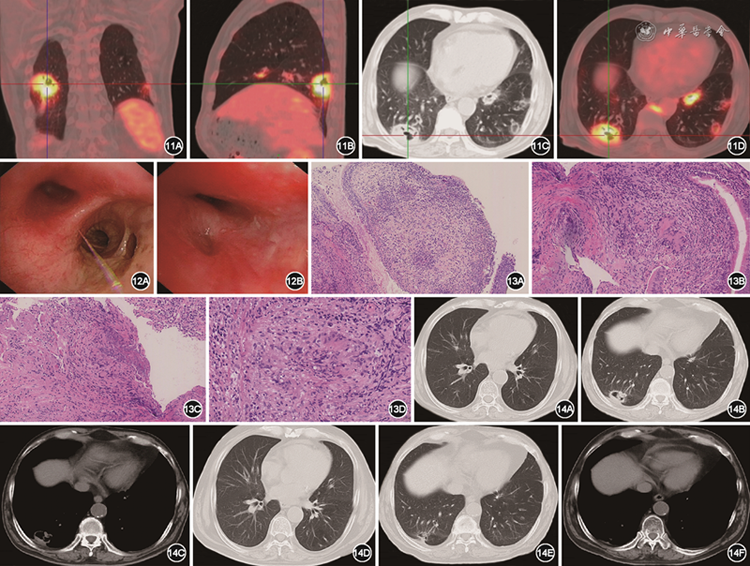
图11 2022年 5月28日PET-CT提示双肺多发结节及肿块,部分伴空洞,右肺下叶肿块影,约48 mm×33 mm,内见多发空洞,摄取增高,SUVmax为7.1
图12 支气管镜下可见右肺中叶支气管黏膜弥漫充血水肿,分嵴增厚(图12A),右中叶内侧段开口狭窄(图12B)
图13 支气管镜下右肺黏膜活检病理结果可见气管黏膜慢性炎,黏膜内炎细胞浸润,局灶黏膜表面坏死(图13A);支气管黏膜内淋巴单核细胞浸润,局灶可见血管壁坏死,其旁可见淋巴细胞及多核组织细胞增生形成肉芽肿结构(图13B);局灶可见凝固型坏死,周围淋巴单核细胞及多核组织细胞增生形成肉芽肿结构,其内可见少量梭形细胞环形分布,似为血管壁结构(图13C);显示肉芽肿结构,中央为坏死,周围多核细胞增生围绕,外周可见少许弹力纤维散在分布(图13D)
图14 激素及免疫抑制剂治疗2个月后胸部CT(2022年7月28日,图14A~C)提示双肺多发结节影较前缩小,右肺下叶肿块影较前缩小,约33 mm×21 mm,内可见空洞,洞壁变薄。激素及免疫抑制剂治疗5个月后胸部CT(2022年10月30日,图14D~F)提示双肺多发小结节基本消失,右肺下叶结节及空洞范围明显缩小
治疗上给予足量糖皮质激素(醋酸泼尼松龙片60 mg,1次/d)口服治疗、免疫抑制剂(环磷酰胺0.4 g,静脉滴注,1次/2周);此后激素逐渐规律减量,并予每月2次环磷酰胺冲击治疗。治疗2个月后复查胸部CT示双肺多发结节影部分较前缩小,右肺下叶肿块影明显缩小,洞壁变薄(图14A~14C)。院外规律门诊随访,治疗5个月,胸部影像学提示病灶明显吸收(图14D~14F)。
讨论
抗中性粒细胞胞质抗体相关性血管炎(ANCA-associated vasculitis,AAV)是与ANCA密切相关的原发性坏死性小血管炎,以寡或无免疫复合物沉积为突出特点。临床表现多样,可有皮肤、耳鼻喉、呼吸道、肾脏及神经等多系统受累,包括以下3种类型:(1)肉芽肿性多血管炎(GPA)是一种系统性、坏死性肉芽肿性血管炎,组织病理学特点可表现为血管炎、局灶性坏死、肉芽肿三联征。常见临床表现包括破坏性鼻窦病变、肺结节和少免疫性肾小球肾炎,还可累及其他系统。胸部影像学特点为“三多一洞”,即多形性、多发性、多变性、空洞形成。患病率为(24~157)/100万人[1]。未经治疗的GPA预计平均生存期为5个月,1年生存率为20%[2]。治疗基于糖皮质激素联合免疫抑制剂,超过80%病例可得到缓解,预后取决于受累脏器与严重程度。(2)显微镜下多血管炎(microscopic polyangiitis,MPA)的组织学特征是系统性非肉芽肿性坏死性血管炎,常表现快速进展性少免疫性肾小球肾炎和肺泡出血,可出现皮肤紫癜、充血性斑丘疹、关节肌痛、发热等多系统病变。胸部影像学特点两肺斑片状阴影、磨玻璃影为主。患病率为(0~66)/100万人。(3)嗜酸细胞性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)组织学特征还包括嗜酸性粒细胞组织浸润。常见的临床表现包括哮喘、外周嗜酸性粒细胞增多和血管外坏死性肉芽肿、外周神经病变。约40%患者产生可检测到的ANCA。患病率为(2~38)/100万人[3]。
ANCA是针对中性粒细胞和单核细胞胞质蛋白的自身抗体,分为3种:胞质型ANCA(cytoplasmic ANCA,cANCA):靶抗原是蛋白酶3(antibodies to proteinase 3,PR3)与GPA 最相关(75%);核周型ANCA(perinuclear ANCA,pANCA):靶抗原是髓过氧化物酶,与MPA(60%)或局限于肾脏的血管炎(80%)更相关。另外,比较少见的类型ANCA阴性的寡免疫复合物性血管炎,临床表现和病理表现都符合AAV,但是ANCA检测阴性。然而,约10%~20%GPA患者是ANCA阴性[4],ANCA阴性GPA往往局限于肾脏的GPA或者严重的全身疾病较少[5]。
目前GPA诊断采用2022年版美国风湿病协会ACR/欧洲抗风湿病联盟EULAR血管炎分类标准[6]:(1)临床标准:①鼻腔出血、溃疡、结痂、充血或堵塞,或鼻中隔缺损/穿孔,记为+3分;②软骨受累(耳或鼻软骨炎症、声音嘶哑或喘鸣、支气管受累或鞍鼻畸形),记为+2分;③传导性或感音神经性听力受损,记为+1分。(2)实验室、影像和活检标准:①c-ANCA或抗PR3阳性,记为+5分;②胸部影像学:肺结节、包块或空洞,记为+2分;③其他影像学检查:鼻腔/鼻窦炎症、实变或积液,或乳突炎,记为+1分;④活检可见肉芽肿、血管外肉芽肿性炎症或巨细胞,记为+2分;⑤活检可见寡免疫复合物肾小球肾炎,记为+1分;⑥p-ANCA或抗MPO阳性,记为-1分;⑦血清嗜酸性粒细胞计数≥1×109/L,记为-4分。确诊标准:得分≥5分可诊断为GPA。
本例患者临床特征如下:(1)老年男性,隐匿起病。呼吸道症状缺乏特征性,全身症状以纳差、消瘦为著。胸部CT提示双肺多发不规则团块、结节、斑片影,伴分叶、空洞、毛刺,经验性抗感染、抗结核治疗后肺部病变仍在进展。(2)肺外脏器病变情况,肾功能损害、贫血、乏力、鼻窦病变等,肾脏受累表现为血尿及大量蛋白尿;PET-CT提示全身多系统受累。(3)肺部黏膜活检病理提示小片状坏死,局灶肉芽肿结构形成,可见血管壁内炎细胞浸润,弹力纤维+。(4)治疗上给予足量激素联合环磷酰胺冲击治疗,复查胸部CT提示肺部病变缩小或吸收。综上所述,从临床特征、影像学变化、病理学及治疗反应来看,尽管c-ANCA多次阴性,本例患者根据以上标准评定为5分,考虑GPA诊断明确。从文献报道来看,对于局限于呼吸道的GPA,ANCA阳性率约60%,伴多系统受累的GPA,ANCA阳性率约90%。与ANCA阳性患者相比,ANCA 阴性患者的鼻旁窦受累较少,但间质纤维化程度较高,呼吸衰竭发生率增高,ANCA 阴性可能与寡免疫型肾小球肾炎存在一定相关性[7]。并且c-ANCA为阴性的患者,可能会在几年后出现阳性结果[8]。
在病理上诊断GPA的三要素:(1)血管炎,即血管壁的纤维素样坏死;(2)局灶性坏死;(3)形成非干酪样肉芽肿(多种细胞浸润的异质性炎性反应,中心存在血管壁纤维素样坏死,周围以巨噬细胞聚集为主)。GPA导致的肾脏损害病理类型可为局灶增生/局灶增生硬化型、增生硬化型和新月体型,最常见新月体肾炎。该患者肾脏病理为局灶节段性肾小球硬化症,这种病理类型在血管炎引起的肾脏病变病理类型中并不常见,虽然患者有糖尿病病史,病理亦不支持糖尿病肾病,故目前该患者的肾脏病变可能并不是GPA的直接受累,但局灶节段性肾小球硬化症使用激素治疗并不矛盾。
本病诊断难点在于起病隐匿、进展缓慢,首次肺脏病变穿刺组织病理未见典型血管炎表现,且ANCA阴性。此外,与GPA相比,特殊感染(如肺结核、肺曲霉病)、肺部肿瘤(肺癌、淋巴瘤等)相对更为常见,在本病例的诊治过程中,我们反复寻找相关的疾病线索,即使在第二次通过支气管镜检查明确病理诊断之后,在随诊过程中密切观察相关指标变化,在经过激素联合环磷酰胺治疗明确有效的基础上,最终确立ANCA阴性GPA的诊断。
总之,对于GPA的诊断,c-ANCA及其PR3阳性的敏感度和特异度较高,但是10%~20%的寡免疫复合物性血管炎缺乏ANCA阳性的证据。对于临床高度怀疑GPA者,ANCA阴性不能排除诊断,应尽快通过合适的方式获得组织病理学诊断,以便及时治疗,改善预后。
参考文献(略)
作者:孙翠宏 李敏 李秋钰 梁瀛 孙永昌 朱翔;单位:北京大学第三医院呼吸与危重医学科;北京大学第三医院病理科
引用本文: 孙翠宏, 李敏, 李秋钰, 等. 中性粒细胞胞质抗体阴性肉芽肿性多血管炎1例 [J] . 中华结核和呼吸杂志, 2024, 47(3) : 240-244. DOI: 10.3760/cma.j.cn112147-20230813-00073.
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【病例报告】中性粒细胞胞质抗体阴性肉芽肿性多血管炎1例
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


