
引言
「咳嗽」这个看似极为普通的症状,却在这位中年女性身上引发了复杂且持久的医学探索。两年来,该患者一直忍受着反复咳嗽的痛苦,影像学显示右下肺及近肺门处「斑片状密度增高影」,但抗细菌、抗结核治疗均无效,这令诊断多次陷入困境。面对不具特异性的临床表现和影像学特征,团队是如何层层剖析最终锁定答案的?面对病因不明的反复咳嗽,实现早诊一直是个临床挑战,但该病例提示我们,严格依循规范的诊疗流程,通过多学科专家团队的临床经验,终可将隐藏极深的「真凶」公布于众。
辗转5家医院求诊,多次病理检查无果……多种抗生素、反复抗结核和激素治疗,症状与影像学均未见好转,求因关卡难破解?
卷宗1
基本资料:女性患者,59岁,山东烟台人,主诉「反复咳嗽2年,发现肺部阴影1年半」于2023年9月19日入住我院呼吸与危重症医学科,2023年10月12日出院,住院共23天。
讲述者:包淑钧
该患者于2021年6月在常规性接种疫苗后即出现「反复咳嗽」症状,后长期服用中药治疗1年无好转。2022年6月15日,患者于烟台某(甲)医院就诊,胸部CT示双肺感染(右肺为著),予头孢哌酮钠舒巴坦抗感染,症状及影像学均无明显好转。
出院后,患者仍长期中药治疗,但咳嗽症状仍反复。
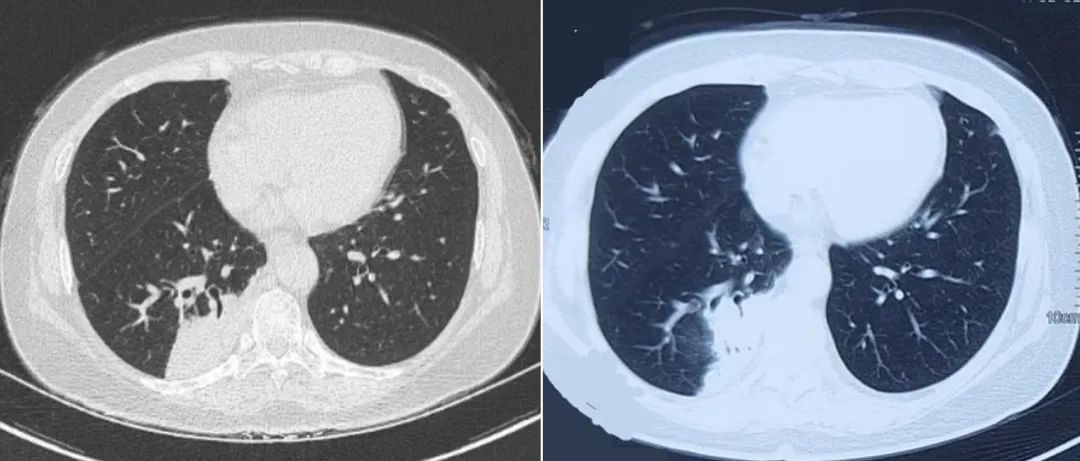
图:胸部CT 2022-6-15(左)和2022-7-11(右)
至2023年4月24日,患者到烟台某(乙)医院就诊,胸部CT提示右下叶大片状密度增高影较前无明显变化,行超声支气管镜提示右肺下叶外基底段探及病变,TBNA病理提示肺泡间隔纤维细胞增生,未查见明确肿瘤细胞。
先后予左氧氟沙星、头孢美唑钠抗感染并联合激素抗炎治疗,症状及影像学均未见明显改善。后予经验性抗结核治疗,患者出现头晕、恶心、视物旋转等不适反应,遂停用抗结核治疗。
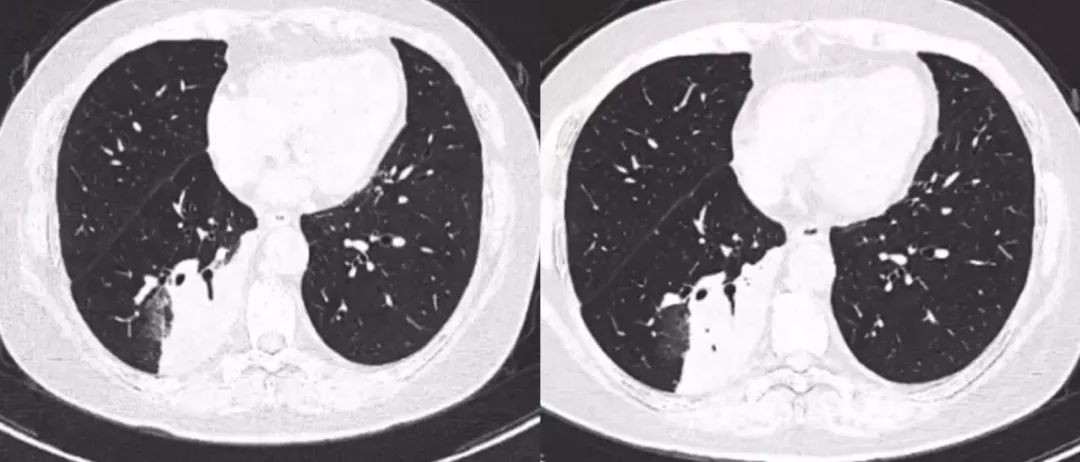
图:胸部CT 2023-4-24(左)和2023-5-9(右)
2023年6月9日,患者又到山东某医院就诊,行PET-CT检查,提示「1.右肺软组织灶并部分代谢增高,建议穿刺活检除外炎症型肺原发淋巴瘤;2.纵隔多发小淋巴结并部分代谢增高,建议定期观察;3.双肺微小结节,代谢未见异常;4.甲状腺术后改变」。
PET-CT胸部具体描述如下:右肺见多发团片状软组织灶,以右肺下叶为著,边缘见磨玻璃密度影,密度欠均匀,内见支气管影,内见一代谢增高灶,最大截面约2.0cmX1.2cm,SUVmax18。双肺另见多发微小结节灶,长径均未及0.5cm,代谢未见异常。左肺见一点状致密灶。双肺见多发纤维条索影。纵隔见多发小淋巴结,部分代谢轻度增高,大者位于上纵隔,短径约0.7cm,SUVmax3.7。双肺门及双侧腋下未见肿大及FDG摄取增高结节。双侧乳腺未见明确FDG摄取分布异常。左室心肌生理性摄取。胸腔内未见积液影。
2023年6月12日,患者来到北京某(甲)医院就诊,右下肺实变灶行穿刺活检,病理提示「送检纤维组织慢性炎,局灶见淋巴细胞聚集」,未见肿瘤证据,当时予罗红霉素、克咳片治疗,咳嗽稍减轻。
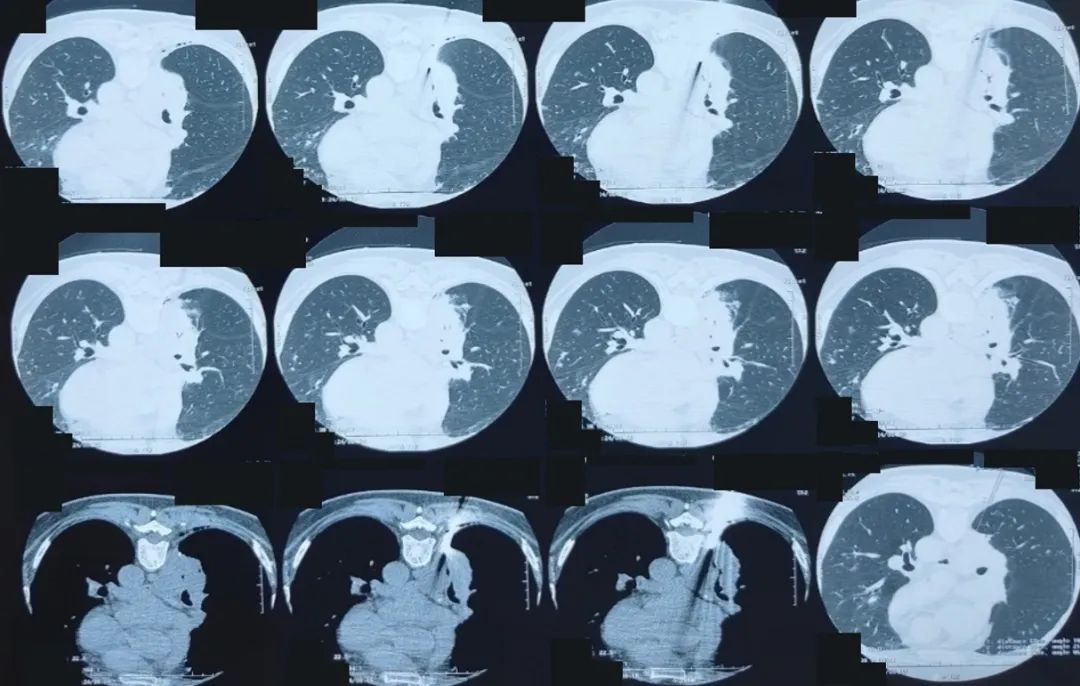
图:胸部CT 2023-6-13(俯卧位行肺穿刺时影像所见)
2023年7月5日,患者又于北京某(乙)医院门诊就诊,予厄他培南抗感染,症状稍缓解。7月11日行胸部CT示「右肺近肺门处及脊柱旁多发斑片、淡片模糊影,部分实变,下叶较重,考虑感染可能性大,双肺多发微结节影,纵隔、肺门小淋巴结,部分钙化」。
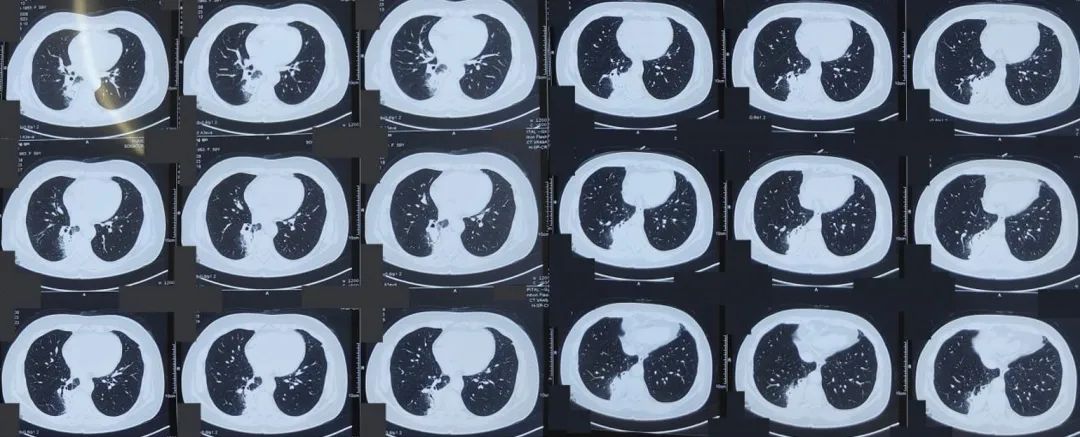
图:胸部CT 2023-7-11
厄他培南抗感染治疗近1月后,该患者于2023年8月14日再次至该医院复诊,复查胸部CT示「右肺近肺门处及脊柱旁多发斑片、淡片模糊影,较前范围略大」,门诊予诊断性抗结核治疗:异烟肼、乙胺丁醇、利奈唑胺、克拉霉素、莫西沙星口服,患者服药后出现乏力不适,症状无明显缓解。
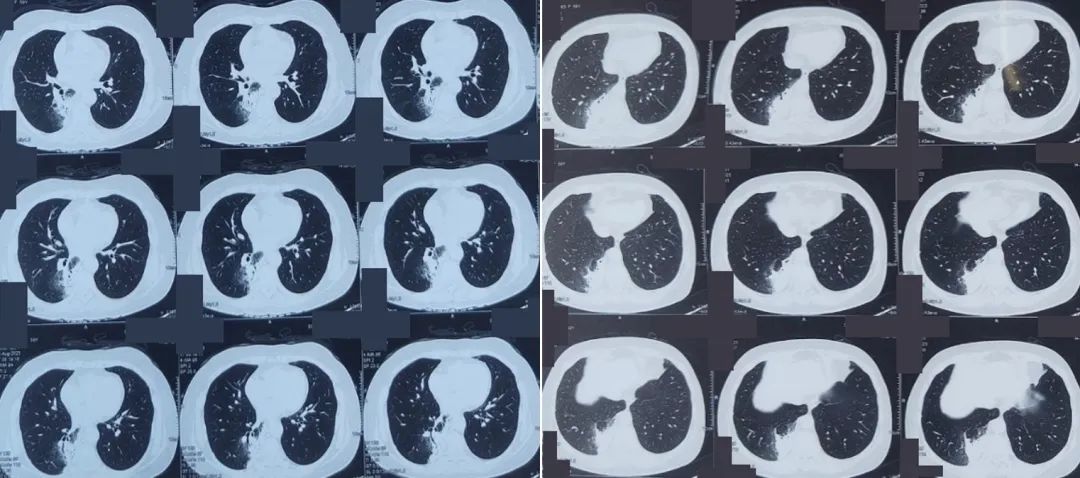
图:胸部CT 2023-8-14
2023年8月29日,患者无明显诱因出现发热,体温最高38.2℃,伴咳嗽加重,咳白痰,当日口服扑热息痛后发热缓解,于当地医院就诊,新冠核酸阴性,予头孢哌酮钠舒巴坦+地塞米松+左氧氟沙星治疗,体温正常,但咳嗽仍未改善。
2023年9月11日,患者再次于北京某(乙)医院就诊,胸部CT基本同前,再次性经验性抗结核治疗并服药至今:异烟肼0.3 qd,乙胺丁醇0.45 qd,利奈唑胺 0.6 qd。
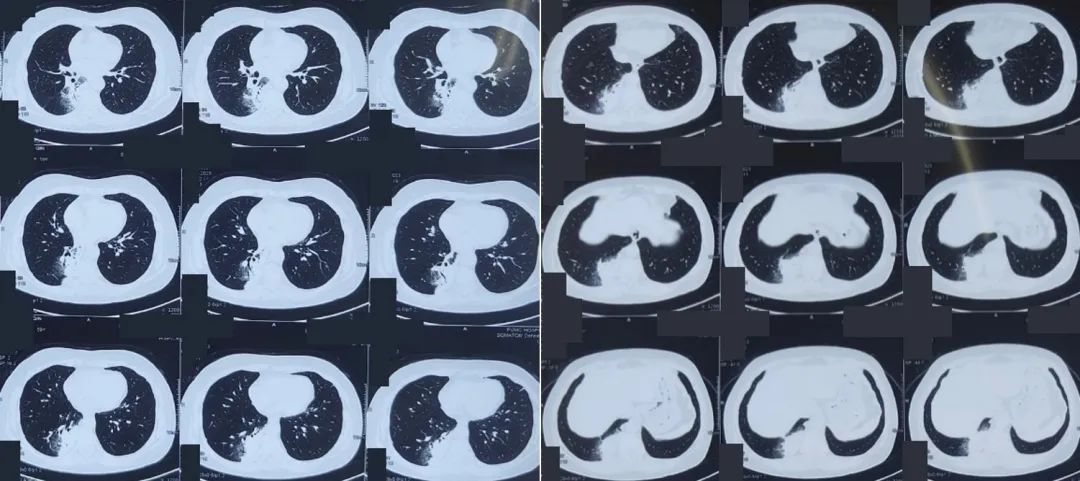
图:胸部CT 2023-9-11
至此,从2021年6月到2023年9月的这2年多时间,患者曲折的就医过程和治疗经过告一段落。患者于2023年9月19日来到我院呼吸科就诊并收住院治疗。
查既往史:该患者平素体质一般,否认「高血压病、糖尿病、冠心病」病史,否认「肝炎、结核」等传染病史,2003、2022年共两次因「甲状腺良性结节」手术治疗,术后口服优甲乐,甲状腺复查各项相关指标无明显异常。
患者出生于原籍,无粉尘、毒物、放射性物质接触史;无疫区接触史;无烟酒嗜好;适龄结婚,配偶及1子均体健,否认家族遗传病史。
入院后首先进行体格检查,请见第2份卷宗:
卷宗2
体格检查:T 36.5℃ ,P 80次/分, R 20次/分, BP 120/70mmHg
神志清楚,全身浅表淋巴结无肿大,双肺可闻及湿啰音、哮鸣音,右肺较左肺明显。心浊音界不大,心率80次/分,律齐,各瓣膜听诊区未闻及病理性杂音。腹平软,无压痛、反跳痛,肝、脾脏肋下未触及,双下肢无水肿。双侧病理征阴性。
实验室检查如下:
【血沉、WBC、N绝对值、CRP】:均在正常范围;
【T-SPOT】:阳性;
【PCT、IL6、内毒素、G试验】:均阴性;
【肿标:NSE、CYFRA211、CEA、CA199、CA125、SCC、铁蛋白】:均在正常范围;
【自身免疫、IgG4】:均阴性;
【常规生化】:总蛋白:61.8g/L ↓、白蛋白:35.9g/L ↓、前白蛋白:387mg/L ↑、尿酸:406umol/L ↑、CK:25U/L ↓;
【糖化血红蛋白】:6.3% ↑;
【凝血功能、T淋巴细胞亚群】:未见明显异常;
【尿液检查】:尿潜血+- 、尿红细胞计数12.8/ul;
影像学及相关病原、部分病理结果回报如下:
【电子气管镜】:右下叶背段管腔轻度狭窄,于右下叶背段行BALF,送检细菌、真菌、抗酸、细胞块。
【BALF细菌、真菌培养及抗酸染色】:均未见异常;
【BALF细胞块】:试做细胞块失败,未见细胞成分;
【超声支气管镜】:超声界面下见右下叶背段开口处下方粘膜下软组织回声影,体积较大,予以TBNA术2次,穿刺抽吸组织送检细胞学涂片、穿刺液常规、mNGS检测及病理学。结论:右下叶背段开口处粘膜下软组织密度影。
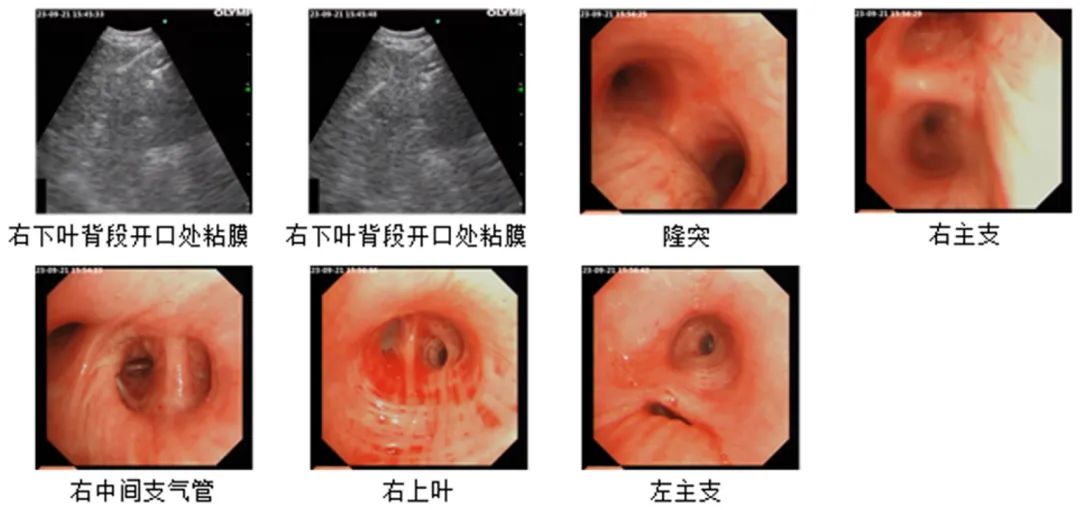
EBUS抽吸组织细胞学涂片未见癌瘤细胞。
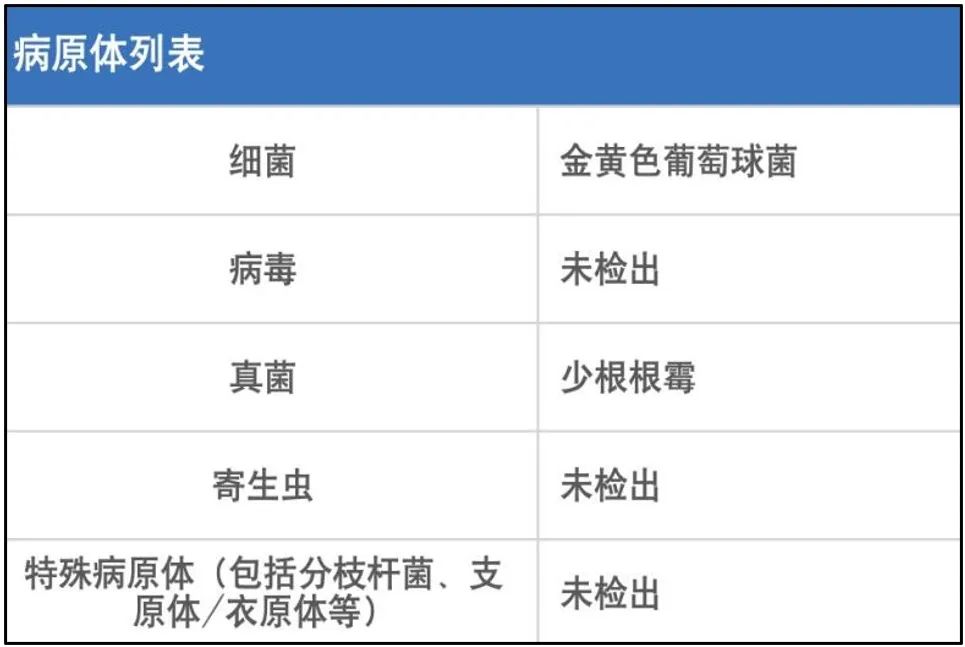
EBUS抽吸组织穿刺液常规显示:外观:无色微浑,比重:量少,李凡特试验(-),红细胞计数:0X10^6/L,白细胞计数:90X10^6/L,中性分叶核43%、淋巴细胞26%、单核细胞31%;EBUS抽吸组织mNGS显示:金黄色葡萄球菌(序列数13),少根根霉(序列数1)。
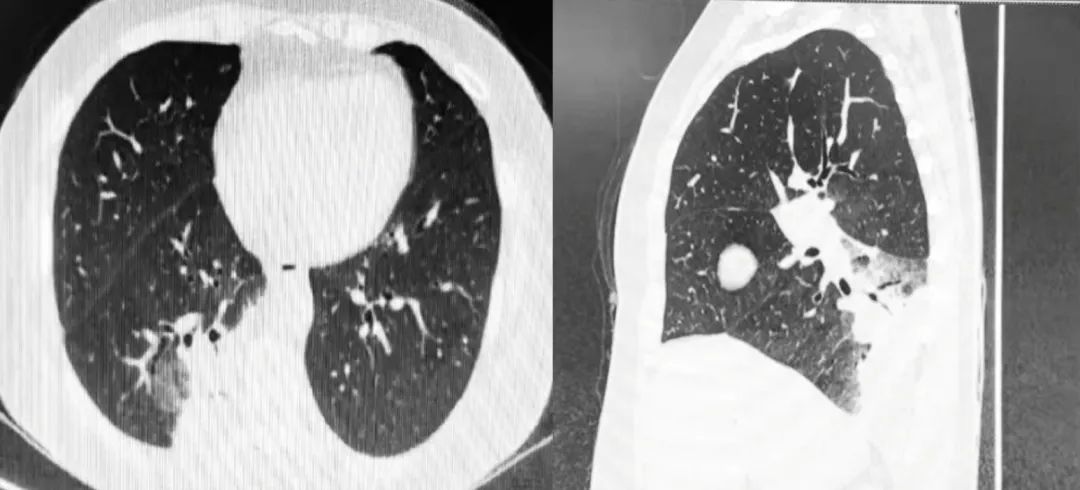
胸部CT平扫+三维
行胸部CT平扫+三维,显示:1、右肺病变(右肺见片状实变影及磨玻璃密度影,右肺下肺为著,边界稍模糊,内可见部分支气管扩张、点状钙化影),考虑炎症可能,建议治疗后复查;2、余双肺小结节,建议年度复查。
肿瘤标志物正常,感染指标和气管镜下获取标本病原学检测未见确切证据……肺部「斑片状密度增高影」是何本质?鉴别诊断方向何在?
讲述者:陈杨
首先对本例患者临床特点进行回顾:1.症状-中年女性,起病隐匿,病程迁延,反复咳嗽为主要症状,伴咳少量白痰,无明显胸闷、气急,无胸痛、咯血等不适,抗感染及抗结核、激素治疗效果欠佳(除厄他培南用药期间略有改善),期间发热一天,口服退热药物后体温恢复正常;2.体征-双肺呼吸音粗,右肺可闻及哮鸣音;3.既往史-甲状腺良性结节手术史;4.辅助检查-① 胸部CT:右下肺及近肺门处多发斑片状密度增高影,边缘伴磨玻璃密度,内可见支气管充气征;② 外院EBUS-TBNA提示肺泡间隔纤维细胞增生,未查见明确肿瘤细胞;经皮肺穿刺:纤维组织慢性炎症,局灶见淋巴细胞聚集;③ 我院右下叶BALF-mNGS:金葡、少根根霉,细胞学未见恶性依据;④ 我院T-SPOT阳性,血沉、CRP、PCT、G试验、自身免疫均在正常范围。
病例特点的核心:中年女性,病程2年余,反复咳嗽为主要表现,多次求医于不同医院,多次病理检查无果,经多种抗生素、多次抗结核甚至激素治疗,症状及影像学始终未见明显好转。肺部CT提示右下肺及近肺门处多发「斑片状密度增高影」,我们以右肺阴影作为关键线索,着手分析,并构建了诊断思路路线图:
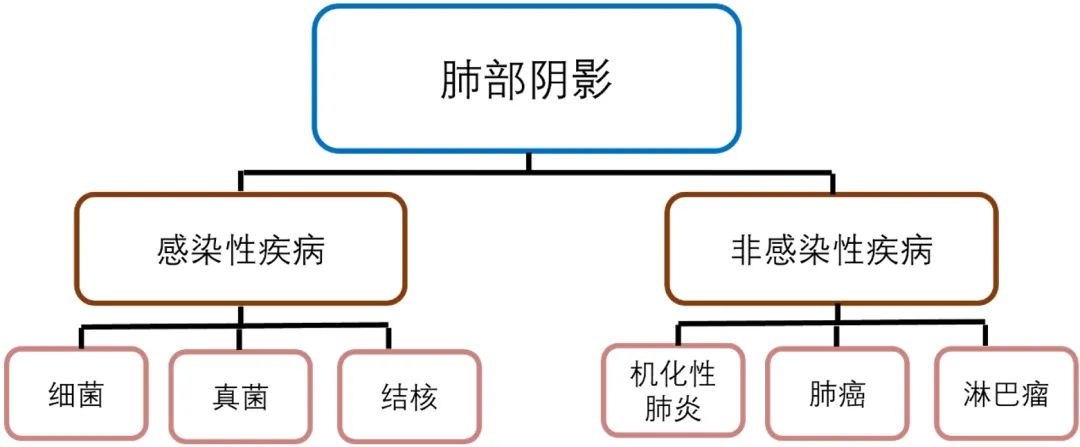
诊断思路路线图
诊断「细菌性肺炎」是否成立?支持点:患者有反复咳嗽,肺部CT示右下肺病灶内可见支气管充气征,既往厄他培南用药期间症状稍有改善。不支持点:无持续发热、黄脓痰等表现,检验指标中无感染相关炎症指标升高,多种抗生素治疗后症状无明显改善,影像学肺部病灶未见明显吸收。
「真菌性肺炎」是否成立?支持点:患者右下叶BALF-mNGS检出「少根根霉」。少根根霉属毛霉,毛霉属真菌有荚膜覆盖,一般不释放抗原,基因检测难检出,因此患者报告少根根霉结果应予以重视;不支持点:毛霉侵袭力强,感染症状多较严重,肺部影像进展快,患者当前病史与上述毛霉感染表现不相符,此外G试验阴性,BALF真菌培养阴性。
前述多家医院已经验性抗结核治疗,效果不佳。但依然要排除「肺结核」的可能性。支持点:患者TSPOT阳性,胸部CT见斑片密度增高影,外院抗痨用药不符合试验性抗痨治疗标准,剂量不充足,目前肺结核不除外;不支持点:患者无免疫缺陷及糖尿病、高血压等慢性疾病,无低热盗汗、消瘦等结核中毒症状,同时多次抗结核治疗效果差,外院右下肺穿刺组肺癌织病理不符合结核坏死性干酪样肉芽肿的表现。
那么会是「机化性肺炎」吗?支持点:患者病程长,迁延不愈,曾行抗细菌、抗结核治疗均无明显好转,除咳嗽咳白痰外无其它不适,EBUS抽吸组织mNGS检测示金葡菌、少根根霉,需考虑机化性肺炎。不支持点:患者病程长,既往激素治疗后症状及影像学均未见明显改善。
尽管极不愿意考虑为恶性肿瘤疾病,但仍需排除是否为「肺癌」?支持点:患者起病隐匿,病程迁延,临床表现无特征性,抗生素及抗结核、激素治疗无效,肺内病灶进展缓慢,与炎症型肺浸润性粘液腺癌相近;不支持点:患者既往无吸烟史,肺癌相关肿标阴性,外院TBNA及经皮肺穿刺结果均未见肿瘤细胞,我院EBUS抽吸组织细胞学涂片仍无肿瘤相关阳性结果。
难道会是「淋巴瘤」?支持点:肺粘膜相关淋巴瘤表现为肺内多发性的结节或实变影,实变影内可见含气支气管影,患者胸部CT右下肺实变影内含支气管充气征,需考虑。不支持点:患者无淋巴瘤典型症状,无浅表淋巴结肿大,病理无相关提示。
正当我们为治疗方向犹豫不决,考虑再次进行右下肺经皮肺穿刺或外科开胸肺活检,以及是否使用激素、是否再次启动抗结核治疗时,我院TNBA术穿刺抽吸的组织病理结果给了我们一个明确的答案。进一步辅助检查回报请见第3份卷宗:
卷宗3
【BALF细胞学】:见少量异型细胞团,请多次送检。
【右肺原发灶穿刺组织】我院:破碎黏膜上皮和细胞碎屑样物少许,以粘液性上皮占优,异型性小,考虑到支气管腺瘤伴不典型增生或者分化好的粘液腺癌二种可能性,穿刺组织可观察细胞有限,待手术大标本进一步明确诊断。免疫组化:1(号片):TTF-1(多数腺上皮-,少数+), Napsin A(-), CK7(+), P53(弱+), Ki-67(偶见个别上皮细胞+), P40(-), CK20(-), Villin(弱+), CDX-2(-), P63(偶见个别阳性细胞)。
【右肺下叶背段开口黏膜下软组织】外送:腺癌(注:倾向粘液腺癌)。免疫组化结果:1号蜡块:CKpan(+),CEA(-),TTF-1(-),Napsin A(-),Ki-67(+,5%),EGFR(-),P53(+),六胺银染色(-)。
这种常伪装成「肺炎」和「良性结节」的癌细胞误诊率高,临床医生如何应对挑战?通过该案例的曲折诊治经历应汲取哪些教训?
讲述者:唐昊
2023年10月6日,根据EBUS-TBNA右肺原发灶穿刺病理结果回报「肺粘液腺癌」,患者后续转至我院胸外科,排除手术禁忌后,于2023年10月8日在全麻下行胸腔镜下右肺中下叶切除术,术顺,术后予补液、预防感染、止血、雾化、化痰等治疗后一般情况可,于2023年10月12日出院。
后续「右肺中叶+下叶」术后病理回报:浸润性粘液腺癌,气腔播散(+),(右胸第9组淋巴结)示:部分为肺组织,有肿瘤累及;部分为淋巴结,未见癌转移(0/3)。(右胸第7组)淋巴结未见癌转移(0/9);(右胸第2、4组)淋巴结未见癌转移(0/3);(右胸第10组)淋巴结未见癌转移(0/5)。
免疫组化:10(号片):Ki67(+,约8%,热点区约70%), TTF-1(-), Napsin A(-), CK7(+), P40(-), P63(-), P53(弱+), SATB2(-), CDX-2(-), MUC-1(+), MUC-2(-), MUC-4(-)。
根据该患者病理,最终明确诊断为肺浸润性粘液腺癌(pulmonary invasive mucinous adenocarcinoma, PIMA)。
浸润性粘液腺癌是浸润性腺癌的变异体,原发于肺脏的情况相对少见,2011年,美国胸科协会(ATS) 和欧洲呼吸协会(ERS)将IMA 定义为腺癌的一种亚型。
文献表明,PIMA多见于女性和非吸烟者[1, 2],与本例患者的情况相符。PIMA沿肺泡壁或支气管壁生长,患者可无明显症状,部分患者主诉痰多,病变累及双肺后可引起呼吸急促,临床症状缺乏特异性,本例患者主要表现为反复咳嗽。PIMA在影像学上可分为孤立型、弥漫型及肺炎型三种类型[3],本例患者为肺炎型。文献资料显示炎症型肺浸润性黏液腺癌CT表现以单肺叶内多病灶多见,病灶特征主要为实变、磨玻璃影、支气管充气征等,Matsui等[4]指出PIMA 主要组织学特征为肿瘤内含有大量粘液,Oda等[5]进一步指出肿瘤细胞分泌的粘液填充肺泡与细小支气管后,可形成充气征。由于PIMA 为相对独立的变异亚型,目前相关报道较少,影像学诊断标准尚未形成共识。
从患者预后角度考虑,PIMA一般预后不佳,浸润性粘液腺癌与肺腺癌的非粘液性鳞状、腺泡和乳头状为主的亚型相比,其预后较差[6],与其他亚型腺癌相比,浸润性粘液腺癌的淋巴结受累和远处转移的发生率较非浸润性粘液腺癌低。CT虽是肺腺癌诊断的重要方法,穿刺活检仍是明确诊断PIMA 的「金标准」,故就诊时完善CT、支气管镜等检查项目,积极取活检确诊,进一步明确病理分型及分子分型,对准确判断患者的病情并尽早实施救治,改善预后、提高生存率有极为重要的作用。PIMA早期可行手术根治性切除,同时对于有明确驱动基因的患者,可以积极的给予靶向治疗,PIMA 驱动基因突变率相对较低,且多表现为KRAS突变,ALK及EGFR少有;无驱动基因的患者,化疗仍可延长患者生存。
在这个病例的讲述和分析中,我团队深刻反思并汲取了宝贵经验。首先,针对那些临床表现和影像学特征难以确诊的肺部阴影患者,我们深知不能仅仅依赖抗感染治疗,而是要时刻评估疗效,抓住时机及早进行深入检查。反复进行病理和病原学检查对于最终确诊、查找病因,并实施及时的对症治疗至关重要。最终依托规范的诊疗流程和专业的专家团队,我们成功实现了迅速而准确的诊断,并及时施行有效治疗,这无疑是能够最终取得良好疗效的关键所在。
主任点评
该患者为中年女性,病程2年余,反复咳嗽为主要表现,肺部阴影待查,多次就诊多家医院病理无果,经多种抗生素及多次抗结核、激素治疗后效果不佳。肺部CT提示右下肺及近肺门处多发斑片状密度增高影,我院再次行TBNA右肺原发灶活检病理最终确诊肺浸润性粘液腺癌,行手术切除后症状好转。由此可见肺粘液腺癌,是一种会伪装成「肺炎」和「良性结节」的癌细胞,炎症型肺浸润性粘液腺癌是一种少见的肺癌,临床表现缺乏特征性,影像学类似肺部感染性病变,反复活检送检病理是必要的,依据规范的诊疗流程和经验丰富的专家团队,无论藏得再深也能及时浮出水面。
参考文献
[1] Lee, H. Y., Cha, M. J., Lee, K. S., Lee, H. Y., Kwon, O. J., Choi, J. Y., Kim, H. K., Choi, Y. S., Kim, J.Shim, Y. M. Prognosis in Resected Invasive Mucinous Adenocarcinomas of the Lung: Related Factors and Comparison with Resected Nonmucinous Adenocarcinomas. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer. 2016;11:1064-73.
[2] Lin, G., Li, H., Kuang, J., Tang, K., Guo, Y., Han, A.Xie, C. Acinar-Predominant Pattern Correlates With Poorer Prognosis in Invasive Mucinous Adenocarcinoma of the Lung. American journal of clinical pathology. 2018;149:373-378.
[3] Shimizu, K., Okita, R., Saisho, S., Maeda, A., Nojima, Y.Nakata, M. Clinicopathological and immunohistochemical features of lung invasive mucinous adenocarcinoma based on computed tomography findings. OncoTargets and therapy. 2017;10:153-163.
[4] Matsui, T., Sakakura, N., Koyama, S., Nakanishi, K., Sasaki, E., Kato, S., Hosoda, W., Murakami, Y., Kuroda, H.Yatabe, Y. Comparison of Surgical Outcomes Between Invasive Mucinous and Non-Mucinous Lung Adenocarcinoma. The Annals of thoracic surgery. 2021;112:1118-1126.
[5] Oda, S., Awai, K., Liu, D., Nakaura, T., Yanaga, Y., Nomori, H.Yamashita, Y. Ground-glass opacities on thin-section helical CT: differentiation between bronchioloalveolar carcinoma and atypical adenomatous hyperplasia. AJR American journal of roentgenology. 2008;190:1363-8.
[6] Mansuet-Lupo, A., Bobbio, A., Blons, H., Becht, E., Ouakrim, H., Didelot, A., Charpentier, M. C., Bain, S., Marmey, B., Bonjour, P., Biton, J., Cremer, I., Dieu-Nosjean, M. C., Sautès-Fridman, C., Régnard, J. F., Laurent-Puig, P., Alifano, M.Damotte, D. The new histologic classification of lung primary adenocarcinoma subtypes is a reliable prognostic marker and identifies tumors with different mutation status: the experience of a French cohort. Chest. 2014;146:633-643.
专家介绍

唐昊
上海长征医院(海军军医大学第二附属医院)呼吸与危重症医学科主任;中华医学会呼吸病学分会 9/10届青委会委员;中国医师协会呼吸医师分会青年委员;上海市医学会呼吸病学分会委员;上海市医学会呼吸病学分会哮喘学组副组长;上海市医师协会呼吸医师分会委员;上海市优秀学术带头人;上海市曙光学者;上海市浦江人才;上海市科技启明星。

陈杨
海军军医大学附属长征医院呼吸与危重症医学科副主任医师,科研助理、临床药物试验专业组秘书;上海市医学会呼吸病学分会青年委员、肺癌学组委员;主持吴阶平医学基金会基础科研专项1项;参与多项国家自然科学基金及上海市、军队课题;发表多篇国内核心、SCI论文;参编多部专科著作。

包淑钧
海军军医大学第二附属医院呼吸与危重症医学科住院医师、硕士,2023级PCCM学员。发表科研论文7篇,其中SCI论文3篇,参与专利研发2项,参与编写专著1部,参与1项国家自然科学基金项目、2项上海市科研项目。
* 文章仅供医疗卫生相关从业者阅读参考
本文完
采写编辑:冬雪凝;责编:Jerry


