
摘要
血小板是介导机体止血凝血的经典细胞,近年来,血小板相关免疫机制和临床研究成为了国内外结核病的研究热点之一。血小板通过参与系统性炎症反应和肺部免疫反应,在结核病中发挥负向调节作用。这主要通过血小板与结核分枝杆菌的直接接触和与免疫细胞的相互作用实现,此外,结核病患者常出现血小板增多症,越来越多的临床研究证明以抗血小板治疗为主的宿主导向疗法在控制结核病方面显示出明显临床获益。血小板抑制可能成为结核病治疗的新策略。本文旨在阐述血小板与结核病相关的病理生理机制和临床研究的进展。
结核病是由结核分枝杆菌(Mycobaterium tuberculosis,MTB)感染引起的主要侵犯人体肺部,亦可累及骨骼、关节、淋巴结等器官组织的慢性传染病,是造成全世界成人死亡的主要传染性原因。世界卫生组织(WHO)发布的《2022年全球结核病报告》指出,2021年全球新发结核病患者1 060万例,共有160万人死于结核病,我国2021年新发结核病患者78万例,在30个结核病高负担国家中,位居第三,占全球发病总数的7.4%[1],全球结核病防控形势不容乐观。目前对MTB感染和免疫致病机制的认识不足,因而抗结核治疗方案仅侧重于杀灭细菌,忽视了宿主免疫反应在结核感染结局中的作用,使得全球耐药问题突出[2]。调节机体免疫应答被认为是治疗结核病特别是耐药结核病的新方向[3]。血小板在外周血中大量存在,数量仅次于红细胞,是参与机体止血凝血的经典细胞,近年来,越来越多的证据证明血小板与结核病相关,血小板相关病理生理机制及临床研究逐渐成为目前国内外结核病的研究热点之一。许多临床研究验证了以抗血小板治疗为主的宿主导向疗法(host-directed therapy,HDT)对结核病短期和长期结局有明显影响。本文就血小板与结核病相关研究进展作一综述。
一、血小板参与结核病发生发展
1.血小板调节结核慢性炎症反应:结核病患者经常发生反应性血小板增多症,血小板绝对数与红细胞沉降率和血清C反应蛋白浓度呈显著正相关关系,提示血小板与机体炎症水平有关[4, 5]。血小板胞内储存丰富的细胞因子、趋化因子、生长因子和抗菌肽[6],这些内含物构成了血小板参与结核感染引起的慢性炎症性反应的物质基础。研究发现,肺组织形成空洞、痰菌量大、淋巴细胞减少的严重结核病患者血浆血小板活化因子(platelet activating factor,PAF)显著升高[7]。PAF通过损伤细菌细胞膜,对牛分枝杆菌和耻垢分枝杆菌的生长具有直接抑制作用[8]。然而动物研究证明PAF不参与肺结核的保护性免疫反应[9]。PAF在MTB感染与免疫致病中的作用有待进一步阐明。与人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者、癌症患者和健康人相比,活动性结核病(active tuberculosis,ATB)患者血浆血小板因子4(platelet factor 4,PF4)水平显著升高,提示血浆PF4可用于结核病的诊断[10]。此外,与ATB患者相比,非结核分枝杆菌(nontuberculous mycobacteria,NTM)感染引起的结核样肺病患者血浆PF4丰度明显降低,提示PF4有助于区分MTB和NTM感染[11]。同时,血浆PF4也可作为监测抗结核治疗反应的标志物[12]。除PAF和PF-4外,结核患者血浆中其他血小板相关细胞因子表达也增加,如促进血小板产生的白介素-6(interleukin-6,IL-6)和巨噬细胞集落刺激因子,以及与血小板活化相关的白介素-1β(interleukin-1β,IL-1β)、巨噬细胞炎性蛋白-1α、趋化因子配体5(Chemokine ligand 5,CCL5)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和血小板衍生的生长因子BB(platelet-derived growth factor-BB,PDGF-BB)等[13, 14]。研究发现PDGF-BB、VEGF、IL-1β、PF4等血小板相关细胞因子可通过放大炎症环境的方式控制结核患者肺部病理损伤的严重程度[15],这些结果提示血小板相关细胞因子参与结核病慢性炎症反应。
2.血小板与结核病肺部免疫反应的关系:血小板参与肺部免疫反应的形成和发展,促进肺结核疾病进展。动物试验表明,血小板可被募集到肺部肉芽肿中,在炎症和组织重塑区域明显聚集[16, 17],耗竭小鼠体内的血小板可显著缩小肺部病变范围,减少坏死性肉芽肿产生,提高小鼠生存率,而通过回输血小板可逆转与血小板耗竭相关的对肺部病理损伤的有益影响[18]。通过对肺结核患者肺部组织进行免疫组织化学分析,发现位于肉芽肿病变周围的血小板与T淋巴细胞和巨噬细胞密切接触[14]。这些结果表明血小板直接参与结核肺部免疫反应。通过对肺结核患者肺部肉芽肿干酪样组织进行基因转录组学分析,发现与正常肺组织相比,肉芽肿中血小板活化相关基因表达显著上调[17]。与肺损伤程度较低的患者相比,肺损伤程度较高的患者的血小板激活途径通路明显富集[19]。有研究观察肺结核患者PET-CT的肺部摄取变化,发现抗结核治疗期间肺部炎症的消退与血小板活化相关基因的下调呈正相关关系[20]。此外,血浆PF4(血小板活化指标)水平与胸部X线检查中肺部病变的程度密切相关[21]。血小板活化与肺部病理损伤程度之间的良好相关性进一步证明了血小板在肺结核中的重要病理生理作用,可能与导致结核病肺部损伤的特定效应机制有关。血小板被激活后可大量释放胞内细胞因子,有研究发现,肺结核患者肺泡灌洗液中血小板相关调控因子(PDGF-BB、P-选择素、CCL5、PF4)升高,与调控肺部炎症和损伤的基质金属蛋白酶(matrix metalloproteinases,MMP)的表达水平密切相关,提示血小板通过驱动宿主的炎症反应与组织降解促进肺部免疫反应发生发展[17]。有研究报道肺泡巨噬细胞PDGF-BB mRNA表达增加,在肺部慢性炎症发展为纤维化的发病机制中至关重要,可以解释未经治疗的肺结核患者肺部慢性炎症向纤维化的进展[22, 23]。而PDGF-BB在血小板α颗粒中丰富表达,血小板也可能通过该机制促进结核病患者肺部炎症反应[6]。此外,血小板可抑制肺内髓系细胞产生活性氧,通过阻碍固有免疫的抗微生物免疫防御功能进一步调节肺免疫反应[17, 18,24]。以上结果表明,活化的血小板主要通过分泌细胞因子和调控肺部免疫细胞功能的方式在MTB感染后的长期肺部免疫反应发生发展和纤维化进展中发挥重要作用。
二、血小板在MTB感染中的作用
(一)血小板内吞MTB直接参与MTB感染
血小板可以直接与MTB相互作用。一项体外研究将血小板与MTB进行共培养,通过透射电子显微镜在血小板的细胞质中发现了MTB,提示血小板能够内化MTB,为进一步证实,研究者用PKH26染色标记的MTB感染血小板后,利用CD41荧光抗体标记血小板,通过流式细胞术检测到血小板内化MTB[16]。同时,有研究者在慢性纤维空洞型肺结核患者外周血涂片中观测到血小板胞内线粒体附近存在MTB[25]。这些结果表明血小板可将MTB吞入胞内,但具体机制不明。宿主防御肽(host defense peptides,HDP)是真核生物固有免疫的一部分,可通过破坏细菌细胞膜完整性以帮助宿主抵御微生物的攻击。通过免疫电子显微镜可检测到HDP与血小板内的MTB细胞壁共定位,表明被内吞的MTB可诱导血小板产生HDP,但并未发现血小板对胞内MTB具有直接杀菌活性。MTB可诱导血小板胞内IL-1β和肿瘤坏死因子(tumor necrosis factor-α,TNF-α)的mRNA表达水平显著升高,也可显著抑制细胞因子如白介素-10(interleukin-10,IL-10)和IL-6的分泌水平[16]。这可能是由于血小板表面含有丰富的Toll样受体(Toll-like receptors,TLR),包括TLR1、TLR2、TLR3、TLR4、TLR6、TLR7、TLR9,能够识别多种病原相关模式分子[26],进而通过核因子-κB的核易位引起抗微生物基因的特异性转录,最终调控下游IL-1、IL-6、IL-8等细胞因子产生[27]。以上结果表明,血小板通过内吞MTB和分泌细胞因子的方式直接参与宿主结核感染免疫网络。
(二)血小板调控免疫细胞间接参与MTB感染(图1)
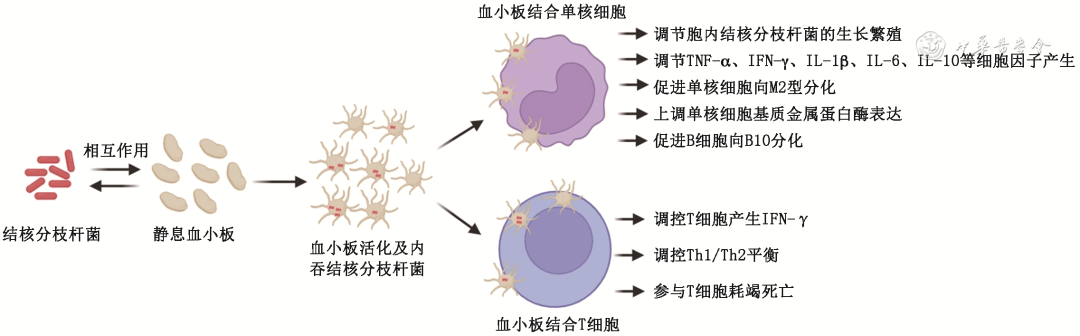
图1 结核分枝杆菌感染期间血小板与单核细胞、血小板与T细胞之间的相互作用模式图
1.血小板与单核细胞:单核细胞作为宿主抗结核感染固有免疫反应中的主要效应细胞,其与血小板的相互作用是驱动肺部免疫反应的重要因素。研究发现,血小板通过分泌PF4抑制巨噬细胞内MTB的生长,从而增强巨噬细胞杀菌活性[14]。相反,有研究表明,血小板能降低单核细胞对胞内MTB的杀伤作用[17]。MTB感染情况下,血小板对单核巨噬细胞杀菌活性的调节作用需要进一步明确。血小板可抑制巨噬细胞产生TNF-α、干扰素-γ(interferon-γ,IFN-γ)、IL-1β、IL-6等促炎性细胞因子,并诱导抑炎性细胞因子IL-10的产生[28]。另一项研究表明,血小板可促进单核细胞分泌IL-1和IL-10,抑制单核细胞衍生趋化因子和白介素-12的分泌[17]。血小板通过调控单核巨噬细胞在结核感染中的细胞因子分泌模式,可以防止过度的组织损伤,但也可能损害结核保护性细胞因子,如IFN-γ和TNF-α的产生。血小板α颗粒富含的PF4可保护单核细胞免于自发凋亡,诱导单核细胞分化为巨噬细胞[24],血小板可能通过该途径诱导单核细胞向M2型巨噬细胞分化,同时上调单核细胞MMP-1和MMP-10的表达和分泌,促进Ⅰ型胶原降解,诱发结核特征性肉芽肿产生[17]。有研究将血小板和巨噬细胞在体外进行共培养,发现在MTB感染情况下,血小板驱动巨噬细胞向结核肉芽肿特征性细胞(上皮样泡沫多形核细胞)分化,有利于MTB潜伏在泡沫细胞内从而逃避宿主免疫攻击[29]。一项斑马鱼体内研究证实MTB感染诱导的血小板活化与巨噬细胞的分化和肉芽肿的形成有关,抗血小板药物有助于减少肉芽肿中的脂质积累和细胞死亡[30],该研究提供了血小板损害宿主应对MTB感染的保护性免疫的新机制,进一步明确了血小板通过调控单核巨噬细胞分化和效应功能参与肺结核肺部免疫反应发生发展。研究发现,结核病患者的外周血血小板-单核细胞聚合体(platelet-monocyte aggregates,PMA)明显增加,与单核细胞膜趋化因子受体5、CD16和PF4的表达增加有关,但与血小板膜表达或可溶性P-选择素的表达增加无关,表明结核感染期间PMA的增加是由单核细胞而非血小板活化引起的[28]。然而,也有研究指出,结核病患者血小板高表达髓系细胞上表达的触发受体样转录本-1,可介导血小板与单核细胞结合形成PMA,并通过增强PMA的IL-1β、IL-6和CD40配体表达,促进B细胞分泌IL-10进而向B10极化,参与结核病感染期间的炎症反应,这可能为治疗结核病提供潜在的靶向策略[31]。以上结果表明,血小板通过分泌细胞因子或与单核细胞直接结合等方式调控单核细胞在结核感染中的免疫表型、分化方向和杀伤能力等免疫特征,诱导单核细胞向促炎方向转化,间接强化结核感染引起的慢性炎症性反应,促进单核细胞引起的肺部基质降解和肉芽肿形成。
2. 血小板与T细胞:T细胞介导的适应性免疫反应对于控制MTB感染至关重要[32]。血小板可调节T细胞分化和效应功能,参与宿主抗结核适应性免疫反应。ATB患者血小板计数与血清中胸腺活化调节趋化因子(一种Th2标志物)水平呈正相关,表明血小板可能是引起ATB患者Th1/Th2失衡的原因[33]。结核患者体内血小板可通过脱颗粒抑制T细胞产生IFN-γ,从而与T-SPOT阴性结果相关[34]。体外活化的血小板也可抑制卡介苗诱导的T淋巴细胞增殖和IFN-γ产生,通过蛋白质组学和单克隆抗体中和研究明确血小板分泌的转化生长因子-β是抑制T细胞反应的重要因素[14]。相应的,多变量分析显示血小板计数是ATB患者CD4细胞和CD8细胞计数下降的独立危险因素[35]。然而,也有研究报道,血小板计数减少可能导致结核特异性抗原ESAT-6刺激引起的分泌IFN-γ的斑点形成细胞(spots forming cells,SFC)减少,血小板分布宽度(platelet distribution width,PDW)升高与结核特异性抗原CFP-10刺激引起的SFC减少有关[36]。这些研究结论的不一致可能与实验设计和检测手段的不同有关。这些研究提示,在MTB感染中,血小板可作用于T细胞,调节其分化潜能和效应分子产生,而血小板与T细胞的表型变化、杀伤能力、细胞增殖以及死亡方式等免疫特征的关系值得进一步研究,以明确血小板在宿主抗结核适应性免疫应答中发挥的具体作用及其机制。
三、血小板在结核病临床诊疗中的应用
1.血小板及相关指标在结核病中的临床应用价值:ATB患者的血小板计数明显高于亚临床结核病患者[37]。抗结核治疗后血小板数下降,与早期痰菌转阴等良好临床转归同步,有助于监测抗结核治疗反应[38, 39, 40]。一些病例报道指出,结核感染也可引起免疫性血小板减少症,多出现在MTB广泛播散引起多发部位感染的患者中,可能由骨髓中组织细胞对血小板的吞噬,或内皮细胞上IL-1的促凝血活性增加引起,抗结核治疗是血小板计数正常化最有效的治疗方法[41, 42, 43, 44]。日本一项针对HIV阴性的成人肺结核住院患者的研究发现,低血小板计数与死亡结局明显相关[45],这可能是因为该研究纳入的住院患者病情较重,血小板严重不足引起。在发展中国家,测量结核病的血液学参数是预测疾病进程和判断预后的一种简单而经济的方法。有研究指出,血小板计数既可作为区分结核病和非结核性肺炎的独立预测因子[46],也可作为结核性脊柱炎的炎症标志物[47]。结核病患者外周血血小板计数升高,对判断病情的活动性及治疗效果具有一定参考价值[48]。此外,血小板平均体积(mean platelet volume,MPV)与机体炎症状况显著相关,可作为判断结核病患者疾病活动的炎症标志物[49]。但也有研究发现肺结核患者的MPV虽然低于健康对照组,但是差异有限,MPV不能反映疾病的严重程度,在肺结核中使用MPV作为炎症标志物似乎并不可靠[50]。ATB患者外周血中血小板数量高,淋巴细胞数量少,导致血小板-淋巴细胞比率(platelet-lymphocyte ratio,PLR)高[14]。高PLR(≥200)与菌阳肺结核患者肺部空洞相关[51]。PLR既可作为鉴别慢性阻塞性肺疾病患者是否感染MTB的有效指标[52],也可作为区分活动性肺结核和泌尿生殖系结核的潜在标志物[53]。然而,一些研究证明PLR与MTB感染和疾病进展并无联系[54, 55]。此外,肺结核患者的PDW和血小板压积增加,可反映急性期反应和疾病活动[5,56]。除结核病外,血小板及其相关指标在肿瘤[57]、皮肌炎[58]、精神障碍疾病[59]中升高,可作为一种机体炎症水平的判断指标,提示血小板作为免疫系统的一部分,在结核病中的数量变化可能并不具备特异性,这需要更多的研究来证实。
2.结核病与抗血小板治疗:大多数肺结核相关缺血性脑卒中患者在诊断为结核病后3个月内发生脑卒中,主要归因于机体强烈的免疫反应促进血小板的活化和高凝状态的发展[60]。结核性脑膜炎患者的血小板异常促进脑梗死发生,并与不良临床结局相关[61]。表明抗血小板治疗可能有助于预防结核病患者急性脑血管疾病发作。阿司匹林是最常用的抗血小板药物,通过不可逆地抑制环氧合酶,在低剂量时显示出强大的抗血栓作用,在高剂量时表现出抗炎活性,作为HDT能有效地加强结核病控制[62]。评估结核性脑膜炎患者服用阿司匹林的临床获益的随机对照研究表明,针对成人患者,阿司匹林耐受性良好,与安慰剂相比,阿司匹林可减少脑卒中,降低病死率[63, 64]。而在儿童患者中,并未在远期并发症(偏瘫和发育异常)发病率和病死率方面显示出显著益处[65]。这可能与儿童免疫系统尚未发育完全,血小板介导的宿主免疫反应不明显有关。除了结核性脑膜炎外,阿司匹林对肺结核患者仍有获益,可显著提高生存率,降低病死率,提高痰阴转率,降低炎症因子分泌,减少空洞数量和体积[66, 67]。除阿司匹林以外,其他抗血小板药物,如吲哚美辛[68]、氟尼酸[69]、双氯芬酸钠[70]、塞来昔布[71]、替罗非班和依替巴肽[30],在动物研究中显示出治疗潜能。这些药物是否具有共同调控信号用作结核病潜在治疗靶点,以及这些药物对结核病患者的临床获益尚不清楚,可作为结核病HDT的未来研究方向。一些抗结核药物,比如氯法齐明可能通过膜失稳相关的机制增强体外血小板活化,这些促血栓活性可能会导致微血管闭塞,加剧已经存在的结核病相关心血管疾病风险[72]。而耐药结核病长程治疗方案的首选药物贝达喹啉可通过干扰磷脂酰肌醇3-激酶选择性抑制二磷酸腺苷介导的血小板活化,这些抗血小板作用可能有助于降低结核病相关心血管疾病的风险[73]。临床上选择抗结核治疗方案时有必要结合患者血小板水平和疾病情况加以考虑。
综上所述,血小板是MTB感染引起的宿主免疫反应的重要组成部分,与结核分枝杆菌感染和结核病致病关系紧密。血小板的相关指标有助于辅助结核病临床诊断和监测治疗效果。抗血小板治疗在限制结核病患者的疾病进展、改善长期预后等方面显示出较好的治疗潜能。血小板抑制可能成为结核病新的治疗靶点,以抗血小板治疗为主的HDT,有望成为作为传统抗结核治疗的补充方案。
参考文献(略)
作者:吴逢英 李远春 姜旭 刘晓清;单位:中国医学科学院北京协和医学院北京协和医院疑难重症及罕见病国家重点实验室感染内科;中国医学科学院北京协和医学院北京协和医院疑难重症及罕见病国家重点实验室医学研究中心
引用本文: 吴逢英, 李远春, 姜旭, 等. 血小板与结核病相关研究进展 [J] . 中华结核和呼吸杂志, 2024, 47(2) : 183-189. DOI: 10.3760/cma.j.cn112147-20230831-00121.
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【综述】血小板与结核病相关研究进展
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


