
摘要
免疫治疗目前已成为驱动基因阴性晚期非小细胞肺癌(NSCLC)一线治疗的标准治疗方案,明显改善了患者预后。然而,对于一线免疫治疗耐药后的评估及治疗方案目前尚缺乏一致性的指南或共识。中国临床肿瘤学会非小细胞肺癌专业委员会组织了肿瘤内科、呼吸内科、胸外科、放疗科、影像科等多学科专家,根据现有循证医学证据,针对驱动基因阴性晚期NSCLC患者一线免疫治疗耐药后的定义与分类、评估标准以及后续治疗策略进行了深入讨论,就原发性和继发性耐药的判定、免疫治疗疗效评估标准的选择、寡进展的判定及治疗策略、广泛进展的治疗策略、免疫治疗再挑战及新型药物临床研究等问题形成相关推荐意见,经过共识会议形成了驱动基因阴性晚期NSCLC一线免疫治疗耐药评估及治疗策略专家共识,旨在为临床实践提供规范化引导。
肺癌是全球范围内发病率第2、死亡率第1的恶性肿瘤[1],我国2020年新发肺癌病例约81.6万,死亡肺癌病例约71.5万[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要病理类型,占比>80%[3]。对于晚期驱动基因阴性的NSCLC,免疫治疗尤其是程序性细胞死亡受体1(programmed cell death receptor 1,PD-1)和程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)抑制剂明显改善了患者预后,5年总生存率达到20%,PD-L1高表达患者中甚至达40%[4],因此免疫治疗已经成为美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南推荐的驱动基因阴性晚期NSCLC一线治疗的标准治疗方案之一,并且在临床实践中成为主流的治疗选择。尽管如此,免疫治疗的多数患者最终仍会出现耐药,然而,目前对于免疫治疗耐药(以下简称免疫耐药)的机制、评估标准以及一线免疫耐药后治疗方案的选择尚缺乏一致性的指南或共识,亟需规范化的引导。在此背景下,中国临床肿瘤学会非小细胞肺癌专委会组织多学科专家针对驱动基因阴性晚期NSCLC一线免疫耐药后的定义与分类、评估标准以及后续治疗策略进行了深入讨论,形成本专家共识,旨在更好地引导临床实践。
第一部分:方法学
本共识由中国临床肿瘤学会非小细胞肺癌专委会发起和组织撰写,参加制订本共识的专家组成员包括了肿瘤内科、呼吸内科、胸外科、放疗科、影像科、病理科等多学科的31位专家,2023年4月15日成立专家组并召开专家共识启动会。专家组组长与执笔作者讨论汇总驱动基因阴性晚期NSCLC患者一线免疫治疗临床实践中面临的重要问题,进行全面的文献检索并梳理已发表的临床研究证据,通过专家组成员讨论会议对临床问题进行充分讨论,对于关键问题进行投票,汇总专家意见及投票结果,最终形成共识推荐内容。
本共识的文献检索数据库包括Pubmed、Embase、中国知网、万方数据和中国生物医学Simomed,英文检索词包括“Non-small cell lung cancer”“immunotherapy resistance”“progression of immunotherapy”“immune checkpoint inhibitor resistance”“negative driver gene”;中文检索词以“非小细胞肺癌”“驱动基因阴性”和“免疫治疗耐药”为主。
本共识根据专家组投票的一致性将推荐等级分为Ⅰ~Ⅳ级,推荐等级见表1。

第二部分:免疫耐药的定义与分类
一、免疫单药治疗耐药
制定免疫治疗耐药后的处理策略首先需要对免疫耐药的类型进行区分,2020年癌症免疫治疗学会(Society for Immunotherapy of Cancer,SITC)免疫耐药工作组制定了抗PD-1/PD-L1治疗耐药的定义,将耐药分为3种类型:原发性耐药,继发性耐药和治疗中断后的进展[5]。原发性耐药指接受≥6周的治疗,对初始治疗缺乏有效反应(疗效评估为进展或稳定),6个月内即出现疾病进展(progressive disease,PD);继发性耐药是指药物暴露时间超过6个月,疗效评估为完全缓解(complete response,CR)、部分缓解(partial response,PR)或稳定(stable disease,SD),6个月后出现的PD。对于原发性耐药和继发性耐药均要求首次评估进展至少4周后再次确认,除非肿瘤生长非常迅速或患者临床状况恶化。对于转移性患者免疫治疗中断后出现的PD分为3种类型,如果患者在PD-1/PD-L1抑制剂治疗期间没有任何临床获益(非CR/PR),工作组认为这些患者应该定义为原发性耐药,并且认为在该人群中进行疗效确认是不必要的。对于曾取得临床获益(PR/CR)的患者,可以根据最后一次给药到PD的间隔时间划分,在最后一次给药后≤12周内出现的PD被定义为继发性耐药,并建议进行影像学确认;对于停止治疗12周后PD的患者,工作组认为再次使用PD-1/PD-L1抑制剂可能会产生潜在的临床获益,因此,此类患者应属于后期进展而非继发性耐药,需要进行免疫重新挑战才能判断是否耐药。然而,对于治疗连续性的要求存在不同观点,2021年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)对于继发性耐药的定义中要求末次抗PD-1/PD-L1治疗后超过6个月PD的患者,需要有再次抗PD-1/PD-L1治疗史[6]。然而以上定义仅针对PD-1/PD-L1免疫单药治疗的患者,目前,以免疫为基础的联合治疗广泛应用,包括免疫与化疗联合、免疫与免疫联合以及免疫与靶向的联合。2023年SITC分别发布了以上免疫联合治疗耐药的定义[7, 8, 9]。
二、免疫治疗联合化疗耐药
免疫联合化疗的耐药同样分为原发性耐药和继发性耐药(或迟发性耐药),原发性耐药是指接受6~8周(或2个周期)的治疗(快速进展的患者不要求暴露时间)并在6个月内出现的PD;继发性耐药或迟发性耐药是指初始治疗6个月以上出现的PD。由于细胞毒性化疗的假进展相对罕见,且为了在后续临床试验中避免不必要的复杂入组标准,因此,免疫联合化疗进展后不需要再次确认。对于转移性患者停止免疫-化疗联合治疗后的耐药,SITC工作组认为因治疗毒性而停止治疗不应包括在耐药定义中,对于除外毒性原因而停止治疗后出现复发的患者,没有确立统一的适用于各种疾病状态的耐药定义[7]。
三、免疫-免疫联合治疗耐药
对于免疫-免疫联合治疗的耐药,SITC工作组同样划分为原发性耐药、继发性耐药和中断治疗后PD。免疫联合治疗的原发性耐药定义为接受至少2周期(或6~12周)的联合治疗,对初始治疗缺乏应答(疗效评估为PD或SD),6个月内出现的PD;继发性耐药定义为联合治疗时间超过6个月,疗效评估为CR/PR/SD,6个月后出现的PD。如果患者临床状况稳定,均要求在至少4周后进行再次影像确认。对于转移性疾病中断治疗后出现的PD,耐药的定义取决于停止治疗后的进展时间。如果患者具备足够的药物暴露时间(即2个周期或6~12周)且在最后一次给药后≤12周出现肿瘤进展,定义为原发性耐药。对于连续给药的免疫检查点抑制剂(双免疫检查点抑制剂),在两种药物最后一次给药后≤12周的PD应被视为对联合用药的耐药。对于诱导方案(即一种药物给药数周期后然后给予单药维持治疗),在最后一次给药后≤12周的PD应定义为对单药治疗的耐药。如果达到CR或PR且停药12周后出现PD,则需要根据再次挑战来评估耐药类型[8]。
四、免疫联合靶向治疗耐药
SITC免疫耐药工作组同样制定了免疫联合靶向治疗原发耐药和继发耐药的定义,这种联合治疗模式包括已获批用于恶性黑色素瘤的BRAF/MEK抑制剂与免疫检查点抑制剂的联合、用于肾癌和子宫内膜癌的血管内皮生长因子(vascular endothelial growth factor,VEGF)受体1酪氨酸激酶抑制剂与免疫检查点抑制剂的联合,以及肝癌中获批的抗血管生成药物贝伐珠单抗与免疫检查点抑制剂的联合。该定义中对药物暴露时间和PD时间的限定与免疫-免疫联合治疗基本一致,不一致的地方在于,免疫联合靶向治疗的患者罕见假进展,因此在按照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1疾病评估进展后不需要再次确认[9]。对于驱动基因阴性晚期NSCLC,尽管免疫联合抗血管生成治疗目前并非指南中推荐的一线标准治疗方案,然而真实世界中这种去化疗的治疗方案对于化疗无法耐受的患者常会应用。因此,该定义对于NSCLC免疫联合抗血管生成治疗耐药的判定同样具有借鉴意义。
区分免疫原发耐药和继发耐药关系着耐药后的治疗决策,目前临床实践中对于继发性耐药的判定尚存在争议,2021年ESMO对于免疫获得性耐药的定义中排除了疗效评估为SD的患者,同时对缓解持续时间不做要求,并且提出应答后出现的进展无需再次影像学确认[6]。此外,在免疫耐药后的临床研究中入组的继发性耐药患者也包含了不同免疫治疗暴露时长,如3个月、2个治疗周期等。因此,对于免疫治疗原发和继发性耐药的定义进行统一有利于临床研究入组人群的一致性和临床实践工作的开展,经专家组讨论后形成以下共识(推荐意见 1和表2)。
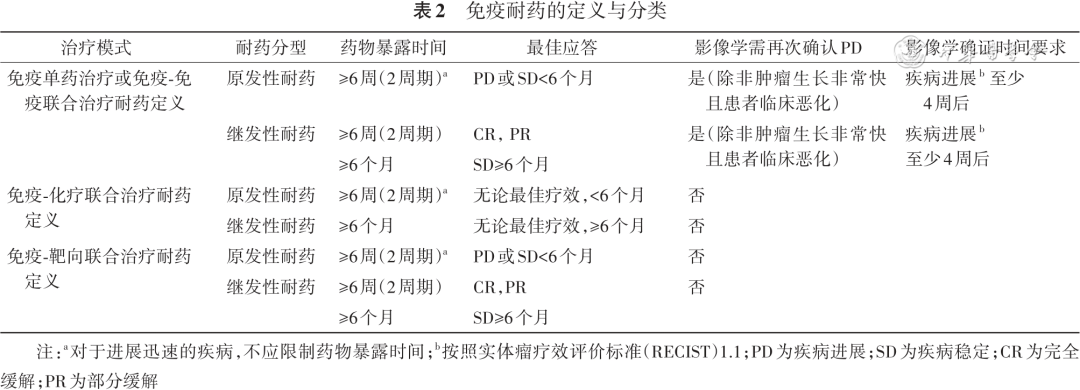
推荐意见1:对于一线免疫治疗获得缓解(按照RECIST 1.1)的患者,继发性耐药的药物暴露时间推荐设为至少2个周期,且无缓解持续时间要求;对于一线免疫治疗疗效评估为SD的患者,继发性耐药的药物暴露时间及病情稳定持续时间推荐设为≥6个月。(推荐等级:Ⅰ级)
第三部分:免疫耐药的机制
免疫耐药的机制涉及肿瘤自身和肿瘤外的多方面因素,目前主要将免疫耐药机制分为三方面:肿瘤内源性机制、肿瘤外源性机制和宿主相关机制[10]。充分了解免疫治疗耐药的主要机制和关键因素有助于预测患者从免疫治疗中获益的潜在可能性大小,判断是否需要停止免疫治疗[11]。
一、内源性机制
肿瘤内源性机制主要是具有免疫调节功能的基因出现原发或获得性突变,如Janus激酶(recombinant janus kinase,JAK)1和JAK2突变,磷酸酶-张力蛋白基因(phosphatase and tensin homolog on chromosome 10,PTEN)缺失介导的胞内磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)激活,丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)通路的改变通过调节干扰素反应和抗原递呈途径导致新抗原的表达、识别减少以及T细胞活化抑制[12-18],β-连环蛋白(β-catenin)、肿瘤蛋白P53(tumor protein 53,TP53)、肝激酶B1(liver kinase B1,LKB1)和髓细胞组织增生致癌基因(myelocytomatosis oncogene,MYC)扩增可能会产生免疫抑制性肿瘤微环境(tumor microenvironment,TME)[19]。有研究显示表皮生长因子受体(epidermal growth factor receptor,EGFR)突变可通过上调PD-L1表达、导致免疫抑制性TME及抑制抗原呈递导致原发性免疫耐药[20-21]。而丝/苏氨酸激酶11(serine/threonine kinase 11,STK11)突变通过负调控哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路并使细胞毒性CD8+T淋巴细胞浸润减少导致免疫抑制性TME[22],有数据显示STK11突变与PD-L1抑制剂度伐利尤单抗的耐药性相关[23]。
二、外源性机制
免疫耐药的肿瘤外源性因素与TME有关。TME是指免疫细胞、基质细胞、内皮细胞和其他非细胞成分组成的高度复杂和动态的局部环境[24]。TME的动态变化常会通过破坏免疫抑制和促炎细胞因子或介质之间的稳态导致髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)、肿瘤相关巨噬细胞、M2巨噬细胞和调节性T细胞等免疫抑制细胞的浸润增加[25-27],比如,肿瘤缺氧诱导的VEGF即会诱导MDSCs的动员和在肿瘤部位的浸润[28]。TME中的免疫效应细胞包括细胞毒性T淋巴细胞、自然杀伤(NK)细胞、树突状细胞的浸润减少和耗竭同样会导致免疫抑制和免疫逃逸[29-30]。
三、宿主相关机制
宿主相关机制是免疫耐药的另一部分因素,研究显示,吸烟史、性别、肥胖与NSCLC患者免疫治疗疗效相关[31-33]。此外,多项研究显示肠道菌群在患者免疫应答中具有重要作用[34-36]。目前已有相关研究通过调整肠道微生物群来克服免疫耐药[37],有望为NSCLC患者克服免疫耐药带来新的手段。
综上所述,免疫治疗耐药的机制非常复杂,且不同患者的耐药机制存在差异,因此在免疫治疗进展后再次行组织学活检有助于明确其耐药机制并探索针对性的处理方案。
第四部分:免疫治疗疗效评价
一、假进展与超进展(hyperprogressive disease,HPD)
判断免疫治疗耐药首先需要明确的疗效评估标准,然而免疫治疗的疗效评估与传统的疗效评估标准存在明显区别。传统的抗肿瘤治疗手段如放化疗、靶向治疗通常可以通过影像学上肿瘤大小的变化直接判断其疗效,目前应用最广泛的是RECIST 1.1版[38]。然而,免疫治疗的应答模式与传统细胞毒性治疗不同,可能会表现出假进展或HPD。假进展最初是在应用细胞毒T淋巴细胞相关抗原4(cytotoxic T-Lymphocyte Antigen 4,CTLA-4)单抗治疗黑色素瘤的研究中证实[39],是指接受免疫治疗期间由于淋巴细胞浸润、水肿和坏死导致肿瘤体积增大或者产生新病灶,并不是真正的肿瘤细胞增殖,因此通过组织活检可以判断是否假进展,然而临床实践中并非所有进展病灶都能够进行组织活检。一项荟萃分析结果提示,在17项研究中的3 402例接受免疫治疗的患者中,假进展的发生率为6.0%,其中NSCLC免疫治疗假进展的发生率为5.0%[40]。HPD是指接受免疫治疗的患者出现肿瘤负荷快速增加、病情迅速恶化的现象,目前HPD报道的发生率为4%~29%[41-43],Champiat等[42]团队明确提出了HPD的概念,后续许多研究进一步补充和完善了HPD的定义,目前比较全面的HPD定义包括三个条件:(1)在免疫治疗中,肿瘤进展时间<2个月;(2)肿瘤负荷相比于基线期增长超过50%;(3)免疫治疗后肿瘤生长速度超过之前速度2倍以上。目前HPD的发生机制尚不明确,并且关于HPD是否是一种真实的现象,是与免疫治疗相关还是仅是肿瘤生长动力学的正常变化,仍然存在相当大的争论[44-45]。由于免疫治疗独特的应答模式,导致传统的RECIST有时不能准确评价接受免疫治疗患者的疗效和生存获益情况,需要制定出针对免疫治疗的疗效评估标准。
二、免疫治疗疗效评价标准的发展
目前,已先后出现了免疫相关疗效评估标准(immune-related response criteria,irRC)[46]、实体瘤免疫相关疗效评估标准(immune-related response evaluation criteria in solid tumors,irRECIST)[47]、实体瘤免疫治疗疗效评估标准(immune response evaluation criteria in solid tumors,iRECIST)[48]、实体瘤免疫治疗修订疗效评估标准(immune-modified response evaluation criteria in solid tumors,imRECIST)[49]等多个免疫治疗疗效评估标准。其中,2017年RECIST工作组发布的iRECIST最为广泛接受,目前在免疫药物临床研究中常作为探索性疗效评估标准。iRECIST标准最突出的改变在于将按照RECIST 1.1标准初次评定的PD视为待证实的PD(unconfirmed progressive disease,iUPD),依据患者的临床情况综合判断是否继续用药,在4~6周后再次评价以确认是否为已证实的PD(confirmed progressive disease,iCPD)。总体上在首次评定iUPD后进行确认的条件有两个:原 iUPD 病灶进一步恶化或未iUPD病灶出现符合RECIST 1.1标准的进展。对于靶病灶,当符合RECIST1.1标准PD时可将其评定为iUPD,再次评价时靶病灶增加≥5 mm则可确认iCPD,即原iUPD病灶进一步恶化;再次评价时非靶病灶或新病灶出现明确进展(RECIST 1.1标准),或又出现其他新病灶则也可确认iCPD,即未iUPD病灶出现符合RECIST1.1标准的进展。对于新病灶,首次评价时只要出现就可评定iUPD。再次评价时,新病灶大小的增加(新靶病灶总和增加≥5 mm或新非靶病灶的任何增加)或出现其他新病灶即可确认iCPD。当iUPD再次评价时肿瘤与基线比发生缩小并达到相应标准,则根据缩小程度评估为免疫CR(iCR),免疫PR(iPR)或免疫疾病稳定(iSD);如果肿瘤大小或范围基本没有变化则继续评估为iUPD。iRECIST标准创新性地提出iUPD概念,在一定程度上可减少患者因假性进展而无法继续从免疫治疗中获益的情况。
三、PET/CT在免疫治疗疗效评价中的应用
尽管iRECIST等标准将免疫疗效评估方案持续改进,但仍未能彻底解决免疫治疗过程中假性进展等特殊应答模式所带来的问题。而基于PET代谢参数的评估方法或许可以带来新的突破。1999年,欧洲癌症治疗研究组织(European Organization for Research and Treatment of Cancer,EORTC)首次提出基于实体瘤代谢反应的PET疗效评估标准[50],之后,Wahl等[51]在EORTC标准基础上提出了实体肿瘤PET/CT疗效评估标准(PET response criteria in solid tumors,PERCIST)。伴随着针对免疫治疗的iRECIST标准出现,以PERCIST标准为基础的PET/CT实体瘤免疫治疗疗效评价标准(immune PET response criteria in solid tumors,iPERCIST)也随即被提出[52],这一标准将PERCIST标准初次评定为代谢相关进展者定义为待确定代谢进展,并需在4~8周内再次评估。该标准现已成为PET/CT评估NSCLC、黑色素瘤等大多数实体肿瘤免疫治疗疗效的主要标准,在2020年中华医学会核医学分会PET学组指定的《免疫检查点抑制剂治疗恶性肿瘤的PET/CT评价专家共识》中获得推荐[53]。
四、循环肿瘤DNA在免疫治疗疗效评价中的应用
许多研究提示检测外周血中的循环肿瘤DNA(circulating tumor DNA,ctDNA)可以反映肿瘤负荷,可能成为免疫检查点抑制剂治疗的预后生物标志物。对黑色素瘤、NSCLC、结肠癌和尿路上皮癌等恶性肿瘤开展的研究表明,连续的ctDNA检测可以识别对免疫治疗有应答的患者,因此,ctDNA评估可能有助于区分免疫治疗的假性进展和真实进展[54-55]。
推荐意见2:推荐按照iRECIST标准评估晚期NSCLC一线免疫治疗疗效。(推荐等级:Ⅰ级)
一线免疫治疗后初次PD(RECIST 1.1标准)的患者,如果临床状态稳定,建议对进展病灶活检以明确是否假进展;对于无法活检证实的患者,建议按照iRECIST标准在至少4周后再次影像学确认,并可通过PET-CT以及肿瘤ctDNA检测协助鉴别假进展或真实进展。
第五部分:晚期NSCLC一线免疫耐药后治疗策略
一、免疫治疗寡进展的治疗策略
目前普遍认为晚期NSCLC是不可根治的,然而寡进展且体力状态评分较好的患者可能受益于对寡进展部位的积极局部治疗。寡进展的定义目前还存在争议,对于进展病灶的数目要求主要基于既往临床研究所设定的阈值或纳入标准,然而不同研究的纳入标准不尽相同,多数是指接受系统治疗的患者≤3个病灶出现进展[56-59]。然而随着放疗、介入等局部治疗手段的进步,进展病灶数目往往并不是局部治疗的限制因素。因此,判断是否为寡进展应依据患者具体的进展部位、数目及是否适用于局部治疗进行综合判断。
推荐意见3:推荐将寡进展定义为进展病灶数目有限且能通过手术、放疗或介入等局部治疗手段达到局部控制。(推荐等级:Ⅱ级)
Schoenfeld等[60]在2022年发表的一项回顾性研究纳入1 536例接受PD-1/PD-L1抑制剂治疗的晚期NSCLC病例,312例(20%)出现了初步治疗应答,其中143例(9%)出现了继发性耐药,继发性耐药患者被分为寡进展(PD≤3个病灶)和系统性进展,其中寡进展比例为56%(80/143)。80例寡进展患者中有57例进行了局部治疗,包括47例放疗、9例手术治疗和1例栓塞治疗,其中56例继续使用原先的PD-1/PD-L1抑制剂。相比于没有进行局部治疗的患者,接受了局部治疗的患者死亡风险降低了52%(HR=0.48,95%CI:0.21~1.10,P=0.04)。对于寡进展的治疗目标之一是根除所有已知的活性病灶,有几种潜在的方式可以实现这一目的,包括放疗、手术或其他非放射治疗消融方法[61]。
(一)放疗
1953年Mole[62]发现通过放射局部组织可以在远离照射部位的组织中引发生物响应,从而提出了放疗“远隔效应”的概念,其机制可能与放疗诱导的免疫反应有关。放射治疗诱导的免疫反应包括DNA损伤引起的免疫反应和发生在TME中的免疫反应,放射治疗创造的免疫微环境有利于免疫检查点抑制剂更有效地消除肿瘤[63]。这为免疫治疗后寡进展患者应用局部放疗联合免疫治疗提供了理论基础。
一项随机多中心Ⅱ期临床研究PEMBRO-RT[64]探索了帕博利珠单抗联合立体定向放疗(stereotactic body radiation therapy,SBRT)(8 Gy×3次)对比帕博利珠单抗单药治疗晚期寡转移NSCLC的疗效与安全性,结果显示联合治疗组的客观缓解率(objective remission rate,ORR)(36%比18%,P=0.07)、中位无进展生存时间(progression-free survival time,PFS)(6.6个月比1.9个月,P=0.19)和中位总生存时间(overall ssurvival,OS)(15.9个月比7.6个月,P=0.16)均有提高,然而总体人群中差异无统计学意义,亚组分析显示PD-L1阴性患者在联合治疗中获益更加显著。另外一项Ⅰ/Ⅱ期临床研究[65]也证实了相似的结论。上述两项研究的汇总分析显示帕博利珠单抗联合放疗具有更显著的ORR(41.7%比19.7%,P=0.004)、中位PFS(mPFS,9.0个月比4.4个月,P=0.045)和中位OS(mOS,19.2个月比8.7个月,P<0.001)[66]。此外,纳武利尤单抗、阿替利珠单抗、伊匹木单抗等免疫检查点抑制剂也证实了联合放疗的疗效及可行性[67-68]。另一项回顾性研究纳入208例经免疫治疗(至少两个周期)至少SD 3个月以上出现进展的Ⅳ期NSCLC患者[69]。其中55.3%(n=115)的患者出现寡进展。局部放疗和继续免疫治疗相结合(n=38,33.0%)是寡进展组最常见的治疗方法,其次是继续免疫治疗和抗血管生成治疗(n=19,16.5%)和仅局部放疗(n=17,14.9%),结果显示,继续免疫治疗+局部放疗可使PFS(12.9比10.0个月,P=0.006)和OS(26.3比18.5个月,P=0.001)显著延长。
然而,对于与免疫治疗联合的情况下,最佳的放疗模式目前仍需讨论。有研究显示,高剂量放疗如SBRT更有助于“远隔效应”的产生,免疫联合SBRT与联合传统放疗相比表现出更高的ORR和PFS[65-66]。而Dewan等[70]的研究显示在CTLA-4单抗联合应用时,低分割(8 Gy×3)方案在诱导免疫渗透和非局域效应方面比单一的消融剂量(20 Gy)更有效。目前关于免疫联合放疗的研究多为回顾性或小样本研究,因此联合免疫时最佳放疗方式尚缺乏明确结论,需要更大规模的Ⅲ期临床研究进一步探索。此外,对于免疫联合放疗尤其是同步治疗时的安全性一直是备受关注的问题,然而越来越多的临床研究数据显示:免疫联合放疗并没有显著增加免疫相关毒性[66]。KEYNOTE-001 Ⅰ期临床研究结果分析显示,行帕博利珠单抗治疗的患者中,既往曾接受放疗的患者相比未经放疗的患者PFS和OS更长,且安全性可接受[71]。一项荟萃分析显示,与非联合治疗相比,免疫联合放疗虽然增加了1~2级免疫相关性肺炎或放射性肺炎的发生率,但未增加严重不良事件的发生率(≥3级)[72]。此外,2022年一项Ⅰ期临床研究显示,在广泛转移的NSCLC患者中,同步使用PD-1单抗:纳武利尤单抗、伊匹木单抗和SBRT的毒性并不比序贯治疗高,而且多部位SBRT的耐受性良好[68]。故目前认为免疫联合放疗安全性可控,但仍需要进一步研究证实。
(二)手术和消融治疗
对于晚期NSCLC患者一线经免疫治疗或免疫联合化疗出现寡进展后,NCCN指南指出对于原发病灶或转移灶的手术切除可作为局部治疗的选择,提高患者生存获益。但目前对于这部分患者二线手术治疗的临床研究比较有限。Joosten等[73]2021年发表的一项小样本回顾性研究,纳入了28例在接受初始治疗后出现寡进展的Ⅳ期NSCLC患者,其中12例患者初始治疗接受了免疫检查点抑制剂单药以及免疫检查点抑制剂联合治疗,患者出现寡进展后接受局部手术治疗,手术部位包含肺部原发病灶或转移灶,从手术日起患者mPFS为7个月(95%CI:6.0~25.0个月),mOS未达到。上海胸科医院一项回顾性研究[74]纳入500例接受免疫治疗的晚期NSCLC患者,该研究采用EORTC共识将PD分为4种模式,即重复性寡进展(repeat oligoprogression,REO)、诱导性寡进展(induced oligoprogression,INO)、新发多发进展(de-novo polyprogression,DNP)和重复性多发进展(repeat polyprogression,REP)。REO指有寡转移病史的患者发生寡病灶进展,INO是有多发转移病史的患者发生寡病灶进展。纳入的患者中401例发生PD,36.2%(145/401)的患者为寡进展,其中26.9%(108/401)患者发生REO,9.2%(37/401)患者出现INO。在免疫治疗耐药后,重复寡进展的患者从局部消融治疗(放疗或手术)中获得了显著的生存优势。相比无局部消融治疗的患者,其mPFS显著延长(6.8比3.3个月,P=0.01);而接受免疫维持治疗没有PFS和OS优势。与无局部消融治疗组相比,诱导寡进展的患者不能从局部消融治疗中获益(mPFS:3.6比5.3 个月,P=0.35;mOS:36.6比45.4个月,P=0.87),但可以从免疫维持治疗中获益(mPFS:6.1比4.1 个月,P=0.03;mOS:45.4比32.3个月,P=0.03)。该研究结果提示晚期NSCLC患者免疫治疗耐药后,局部消融治疗适用于发生重复寡进展的患者,而免疫维持治疗是诱导寡进展患者的最佳治疗方案。
目前应用于肺部肿瘤的消融治疗技术主要包括射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA)、冷冻消融、激光消融。有研究显示热消融治疗可导致肿瘤细胞的缺血和坏死,从而刺激肿瘤相关抗原从癌细胞释放到血液中,也有研究发现RFA和抗PD-1疗法协同增强了T细胞介导的抗肿瘤免疫,并且热消融可以调节免疫微环境、增加抗原呈递、降低细胞毒性T淋巴细胞抑制从而有助于激活抗肿瘤免疫反应[75-76]。目前卡瑞利珠单抗联合冷冻消融(ChiCTR2100047034研究)、冷冻消融(NCT03290677研究)应用于既往免疫治疗耐药的晚期NSCLC的研究正在进行,其临床疗效有待进一步观察。
以上研究提示对于晚期NSCLC接受免疫治疗出现寡进展的患者,继续维持免疫治疗同时联合局部治疗能够给患者带来生存获益。对于局部治疗手段的选择,目前放疗的证据相对较为充分,手术和消融治疗还需要更多研究数据的支持,临床实践中建议通过多学科会诊选择最佳局部治疗手段。
推荐意见4:对于寡进展的患者,如一般状态稳定,建议维持原免疫治疗方案同时联合局部治疗;如一般状态快速恶化,建议调整全身治疗方案。(推荐等级:Ⅰ级)
二、免疫治疗广泛进展的治疗策略
(一)化疗
对于驱动基因阴性晚期NSCLC患者一线经免疫治疗或免疫联合化疗出现全身广泛进展后,二线化疗如多西他赛等是目前NCCN指南和CSCO指南中推荐的标准治疗方案。Park等[77]2018年发表的一项韩国回顾性研究纳入了73例经免疫治疗包括纳武利尤单抗、帕博利珠单抗或度伐利尤单抗等后PD的NSCLC患者,其中二线患者比例13.7%,二线之后的患者比例86.3%,给予含铂双药化疗或单药化疗,ORR为53.4%,mPFS为4.2个月,mOS为8.1个月;2017年MD安德森癌症中心(MD Anderson)进行的另外一项研究分析了28例经纳武利尤单抗、帕博利珠单抗或度伐利尤单抗治疗的NSCLC患者,所有患者均给予三线单药化疗,其中50%患者使用的化疗药物为多西他赛,ORR为39%,mPFS为4.7个月,mOS为9.0个月[78]。2022年世界肺癌大会(World Conference on Lung Cancer,WCLC)会议上Auclin等[79]公布的一项多中心回顾性分析,纳入了143例一线经免疫联合化疗后PD的晚期NSCLC患者,二线分别给予含铂双药化疗再挑战、紫杉醇+/-抗血管生成治疗或其他化疗药物(包括吉西他滨、长春瑞滨或培美曲塞),结果显示二线化疗的患者疾病控制率(disease control rate,DCR)为38%,mOS为8.1个月,其中一线治疗应答超过6个月的患者从二线化疗中获益更加明显,mOS为12.7个月。另外一项2022 WCLC会议上公布的Liu等[80]进行的回顾性研究,纳入了467例既往同步或序贯接受过PD-1/PD-L1抑制剂和含铂双药化疗的晚期NSCLC患者,患者后续接受了紫杉醇单药或紫杉醇联合化疗,结果提示紫杉醇后线治疗的患者mOS为8.9个月。因此,以上研究提示一线免疫耐药或免疫联合化疗耐药的患者,二线化疗仍能给患者带来一定的生存获益。
(二)抗血管生成治疗联合化疗
抗血管生成药物如贝伐珠单抗、安罗替尼等在晚期NSCLC尤其是肺腺癌患者的治疗中具有非常重要的地位,并且基础研究显示TME中的异常血管生成与免疫耐药相关,通过抗血管生成治疗除了可以抑制肿瘤生长外,还可以促进肿瘤血管正常化从而增加TME中免疫效应细胞浸润。因此,许多研究探索了抗血管生成治疗在免疫耐药患者中的应用。
一项回顾性多中心研究中,纳入314例接受紫杉醇联合贝伐珠单抗二线及二线以上治疗晚期NSCLC患者,其中88例(28%)患者为免疫治疗失败的患者,结果显示免疫耐药的患者接受紫杉醇+贝伐珠单抗的mPFS为7.0个月,mOS为13.0个月,ORR为51%,PFS获益和总体缓解率均比未经免疫治疗的患者更优[81]。2022年WCLC会议上公布了一项ALTER-L016和ALTER-L018研究的汇总分析,这两项研究均为多中心、随机、对照、Ⅱ期研究,该汇总分析纳入了73例一线接受免疫治疗失败的晚期NSCLC患者,入组患者经1∶1分组分别给予安罗替尼联合多西他赛对比多西他赛单药治疗,结果显示两组ORR分别为33.33%和12.50%(P=0.048),DCR为93.02%和62.50%(P=0.002),mPFS分别为7.6个月和2.5个月(P<0.001),提示在免疫耐药的晚期NSCLC患者中,安罗替尼联合多西他赛相比单药化疗具有更强的疗效,且研究结果显示安全性仍然可控[82]。除贝伐珠单抗和安罗替尼之外,雷莫西尤单抗也是一种人血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)拮抗剂,它能够特异性地与VEGFR结合,阻断受体与VEGF的结合,从而抑制肿瘤血管生成达到抗肿瘤作用。雷莫西尤单抗已获得国家药品监督管理局(National Medical Products Administration,NMPA)批准上市用于晚期胃或胃食管结合部腺癌二线治疗。Tozuka等[83]进行的一项回顾性研究,纳入99例晚期NSCLC患者,其中39例接受过免疫治疗,所有患者接受多西他赛或多西他赛+雷莫西尤单抗治疗,结果发现在接受免疫治疗的患者中,雷莫西尤单抗+多西他赛≥二线治疗的mPFS为5.9个月,显著优于多西他赛(2.8个月,P=0.03),mOS为19.8个月,有优于多西他赛的趋势(8.6个月,P=0.10)。另外一项回顾性研究,纳入67例一线接受化疗二线接受免疫治疗失败后三线接受雷莫西尤单抗+多西他赛治疗的晚期NSCLC患者,结果发现雷莫西尤单抗+多西他赛三线治疗的ORR为36%,DCR为69%,mPFS为6.8个月,中位缓解持续时间(duration of response,DOR)10.2个月,mOS为11.0个月(自三线起始治疗算)[84]。此外,尼达尼布是一种多靶点的三重抗血管激酶抑制剂,可以阻断VEGFR受体1-3、血小板生长因子受体(platelet-derved growth factor receptor,PDGFR)α/β和成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)激酶活性,目前的适应证主要用于间质性肺疾病。2022年发表的VARGADO研究中C队列观察了肺腺癌患者一线免疫联合化疗治疗进展后二线给予尼达尼布联合多西他赛治疗的疗效,结果显示尼达尼布联合多西他赛的ORR为35%,DCR为68.3%,总体mPFS 4.8个月,mOS为8.1个月,而一线最佳应答为PR且ECOG体力评分0~1分的患者mOS更长达11.2个月[85]。VARGADO研究的B队列入组患者为一线化疗、二线应用免疫治疗后耐药的患者,三线给予尼达尼布联合多西他赛治疗,ORR为50%,DCR 86%,mPFS为6.4个月,mOS为12.1个月[86]。以上研究提示对于晚期NSCLC免疫耐药后患者,化疗联合抗血管生成治疗相比单纯化疗可能获得更好的ORR和PFS,但这些多为回顾性或小样本研究,证据级别相对较低,仍需要Ⅲ期随机对照研究的进一步证实。
推荐意见5:对于广泛进展的患者,如一线接受免疫单药治疗,建议行含铂方案化疗,如一线接受免疫联合化疗,建议行多西他赛单药化疗,同时可以考虑联合抗血管生成治疗。(推荐等级:Ⅱ级)
(三)免疫再挑战联合治疗
免疫再挑战是指既往使用免疫治疗并因任何原因如PD、免疫相关不良反应或临床试验完成既定疗程等终止治疗后重新接受免疫治疗的用药模式[87-88]。目前多数研究证实,因临床决定(如完成既定疗程)而中止首次免疫治疗的晚期NSCLC患者再挑战时仍能给患者带来疾病缓解以及PFS和OS的获益,而因免疫相关不良反应(immune-related adverse events,irAE)中断免疫治疗的患者重新接受免疫治疗并不会带来比停药更多的生存获益,并且需要严密检测irAE的复发[89-90]。本共识聚焦于晚期NSCLC一线免疫耐药,因此主要讨论PD后的免疫再挑战。
对于免疫治疗继发性耐药患者,PD后继续应用免疫治疗能否给患者带来生存获益一直是广受关注的热点问题,目前也有一些研究探讨了免疫治疗继发性耐药后继续应用免疫的疗效。Xu等[69]于2021年发表的一项回顾性研究纳入208例经免疫治疗至少稳定疾病3个月以上(至少两个周期)后出现PD的Ⅳ期NSCLC患者,患者在PD后,接受不同治疗方案,包括继续使用免疫、局部治疗、抗血管治疗以及不同治疗的组合等,结果显示继续使用免疫治疗的患者mOS明显长于暂停免疫治疗的患者(26.3比18.5个月)。
1.免疫再挑战联合化疗:2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议上公布的BTCRC-LUN15-029研究入组了35例既往接受PD-1/PD-L1抑制剂治疗获益(PFS>3个月)的患者,在PD后给予帕博利珠单抗联合后线化疗[吉西他滨 1 000 mg/m2,第1天(d1)、d8或多西他赛 60~75 mg/m2 d1或+培美曲塞 500 mg/m2 d1(仅非鳞状细胞癌)]治疗,主要研究终点mPFS为5.2个月(RECIST 1.1标准),mOS 26.8个月,23.5%的患者疗效评估为PR,53%的患者为SD,与单独化疗的历史对照相比,在免疫治疗临床获益后进展的晚期NSCLC患者给予帕博利珠单抗联合后线化疗与PFS延长相关[91]。
2.免疫再挑战联合抗血管生成治疗:LUNG-MAP S1800A研究是针对Ⅳ期或复发性、既往接受过免疫治疗NSCLC患者的随机Ⅱ期研究,入组了经含铂双药联合/序贯PD-1/PD-L1治疗至少84 d后出现PD的晚期NSCLC患者,随机1∶1入组,分别给予帕博利珠单抗+雷莫西尤单抗或者研究者选择的标准化疗方案[多西他赛+雷莫西尤单抗/多西他赛/吉西他滨/培美曲塞(非鳞癌)],两组患者mOS分别为14.5和11.6个月,与标准治疗方案对比,帕博利珠单抗+雷莫西尤单抗组合显著改善了既往接受过化疗和免疫治疗的晚期NSCLC患者生存时间[92]。另外一项多中心、开放标签、单臂、ⅠB /Ⅱ期临床试验(AIO-TRK-0117)中,对晚期或转移性非鳞状NSCLC患者在以铂类为基础的化疗联用或不联用已获批的免疫检查点抑制剂一线或二线治疗失败后的患者,使用纳武利尤单抗联合尼达尼布进行治疗,主要终点是ⅠB期的安全性和耐受性;第2阶段6个月和9个月的PFS。次要终点包括ORR、OS、DOR以及安全性,包括严重不良事件(serious adverse events,SAEs)和治疗中出现的不良事件(treatment-emergent adverse events,TEAEs)。该研究入组了53例患者,结果显示ORR为11.3%,mPFS为2.5个月,mOS为12.5个月,TEAEs发生率86.8%,其中3级以上TEAEs发生率35.8%,初步结果证实了纳武利尤单抗联合尼达尼布联合治疗的可行性[93]。
COSMIC-021是一项在晚期实体瘤中评价卡博替尼+阿替利珠单抗的多中心ⅠB期研究,该研究队列7中卡博替尼+阿替利珠单抗在既往接受过免疫治疗的晚期NSCLC患者中ORR为19%,表现出令人鼓舞的临床疗效[94]。然而在多中心、随机、开放标签的Ⅲ期CONTACT-01研究中,最终OS分析结果显示,在经PD-1/PD-L1抑制剂和化疗治疗进展的晚期NSCLC患者中,阿替利珠单抗+卡博替尼组与多西他赛组的mOS(10.7比10.5个月)差异无统计学意义(HR=0.88,95%CI:0.68~1.16,P=0.367)[95]。目前还有更多的免疫再挑战联合抗血管生成治疗免疫耐药的临床研究,如帕博利珠单抗联合仑伐替尼(LEAP-008研究)[96]、纳武利尤单抗联合司曲替尼(SAPPHIRE研究)[97]等,随着这些更大型临床研究数据的披露有望给免疫耐药患者带来更多的治疗选择。
3.免疫再挑战的时机:许多患者在一线免疫治疗进展后会接受穿插化疗、靶向治疗或放疗等,这些治疗发生在初次免疫治疗和再挑战之间,也被称为插层治疗。Giaj等[98]进行的一项真实世界研究,纳入10 452例既往接受纳武利尤单抗治疗后中断并进行免疫再挑战的晚期NSCLC患者,再挑战免疫治疗药物为纳武利尤单抗/帕博利珠单抗,根据不同治疗模式将其中的再挑战患者分为恢复组(n=1 127,免疫治疗进展后直接再次使用免疫治疗)和再挑战组(n=390,免疫治疗进展后穿插化疗,化疗进展后再次使用免疫治疗),结果显示再挑战组的患者mOS比恢复组的患者更长(18.1比14.8个月)。Gobbini等[87]进行的一项法国多中心回顾性研究,纳入144例接受免疫再挑战治疗的晚期NSCLC患者,结果同样显示两次免疫治疗之间接受穿插化疗的患者PFS更长(5.8比3.0个月)。因此,免疫再挑战之前接受穿插化疗或许能够给患者带来更多获益。
以上研究提示晚期NSCLC一线免疫耐药后免疫再挑战联合化疗或抗血管生成治疗可能仍能给患者带来生存获益,但是目前循证医学证据级别较低,仍需更多证据支持。
推荐意见6:对于一线免疫治疗继发性耐药患者,目前关于免疫再挑战的临床研究证据不足,优先推荐行化疗等穿插治疗后再行考虑免疫再挑战。(推荐等级:Ⅱ级)
(四)免疫耐药后新型治疗方案的探索
目前针对NSCLC患者免疫耐药还有许多新的方案正在进行临床研究,包括不同免疫检查点抑制剂的联合、抗体偶联药物(antibody-drug conjugate,ADC)、肿瘤疫苗、组蛋白去乙酰化酶抑制剂(Histone deacetylase inhibitors,HDACi)、自体肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)疗法、微生物移植疗法等。
1.不同免疫检查点抑制剂的联合治疗:PD-1/PD-L1抑制剂与新的免疫检查点如CTLA-4、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoglobulin and ITIM domain protein,TIGIT)、淋巴细胞激活基因-3(lymphocyte activation gene-3,LAG-3)、T细胞免疫球蛋白黏蛋白-3(T cell immune globulin mucins-3,TIM-3)等抑制剂的联合或许是克服免疫耐药的一种选择。RECLAIM研究[99]是一项前瞻性Ⅱ期研究,计划纳入30例化疗和抗PD-1治疗后PD的PD-L1低表达(1%~49%)或阴性(<1%)的晚期NSCLC患者,给予PD-1抑制剂(纳武利尤单抗)+CTLA-4抑制剂(伊匹木单抗)+放疗进行治疗,结果在影像可评估的患者中取得33%的ORR,显示在PD-L1低表达或阴性的免疫耐药患者中,PD-1抑制剂+CTLA-4抑制剂+放疗具有良好的抗肿瘤活性。TIGIT是一种免疫调节性检查点受体,最常表达在效应T细胞、调节性T细胞和NK细胞上,通过阻断TIGIT,阻止其与CD112或CD155的结合,可以恢复抗肿瘤免疫。Niu等[100]在一项Ⅰ期临床研究中观察了TIGIT单抗Vibostolimab与帕博利珠单抗联合治疗免疫耐药晚期NSCLC患者的疗效与安全性,结果显示二者联合在免疫耐药NSCLC患者中的ORR为3%。2023年ASCO会议壁报展示的ARTEMIDE-01研究显示,PD-1/TIGIT双抗Rilvegostomig(AZD2936)在免疫检查点抑制剂经治的晚期NSCLC患者中观察到初步疗效,然而ORR也仅3.9%[101]。LAG-3主要表达于生理状态下活化的T、B细胞、NK细胞和树突状细胞(dendritic cells,DCs)上,对T细胞功能具有负性调节作用,在许多实体瘤的TILs上存在LAG-3过表达。迄今为止,已有超过20种抗LAG-3抗体用于肿瘤免疫治疗的临床试验。TACTI-002研究[102]是一项Ⅱ期临床研究,观察了帕博利珠单抗联合eftilagmod alpha(efti)二线治疗免疫耐药NSCLC患者的疗效,结果显示5.6%的患者确认缓解并持续10个月以上,25%患者达到长期(6个月以上)疾病控制,18个月的生存率为36.5%,并且联合用药耐受性良好,未见新的安全性信号,研究数据支持帕博利珠单抗+efti用于PD-1/PD-L1难治性患者的进一步临床研究。在癌症患者中,TIM-3在多数免疫细胞上过表达,包括 CD8+T细胞、CD4+T细胞和NK细胞,其表达导致免疫细胞功能障碍、肿瘤免疫逃逸。体外和体内实验表明,TIM-3的阻断可以增强TME中TILs和NK细胞的细胞毒性以及γ干扰素(IFN-γ)释放。2019年ASCO-SITC会议展示的一项Ⅰ期试验表明,抗TIM-3单抗LY3321367对NSCLC患者的疗效与既往抗PD-1/PD-L1疗效相关,前线PD-1/PD-L1抑制剂治疗有效的NSCLC患者使用LY3321367疗效更优,LY3321367与PD-L1抑制剂联合治疗的患者,ORR 和DCR分别为4%和42%[103]。另外一项Ⅰ期试验(NCT02791334)表明,TIM-3抑制剂(LY3321367)联合抗PD-L1(LY3300054)治疗未损害两种治疗的安全性或耐受性,且结果提示,在未经PD-1/PD-L1抑制剂治疗的微卫星高度不稳定肿瘤患者中取得较高的缓解率(ORR=45%)[104]。
2.ADC药物、肿瘤疫苗等新型治疗手段:2022年ESMO会议上公布的DESTINY-LUNG1研究中探索的T-DXD是一种针对人表皮生长因子受体-2(HER2)的ADC药物,入组患者中65.9%前线接受免疫治疗,T-DXD在HER2过表达或突变患者中观察到初步疗效[105];靶向人滋养细胞表面抗原2(trophoblast cell surface antigen 2,TROP-2)的ADC药物戈沙妥珠单抗对比多西他赛目前正在免疫联合化疗进展的晚期NSCLC患者中开展Ⅲ期临床研究[106]。首个在肺癌Ⅲ期临床研究获得阳性结果的肿瘤疫苗OSE2101,在二线治疗免疫耐药的HLA-A2+NSCLC,mOS为11.1个月,对比二线多西他赛或培美曲塞标准化疗方案的mOS 7.5个月,显示出明显生存获益[107]。一项在晚期NSCLC患者中进行的Ⅰ/ⅠB期研究观察了帕博利珠单抗联合组蛋白去乙酰化酶抑制剂伏立诺他的疗效,结果显示在6例初治患者和24例免疫经治患者中有4例达到PR(ORR=13%),显示出初步的抗肿瘤活性且耐受性良好[108]。而自体TIL疗法[109]、微生物移植[110]等疗法尽管目前临床研究结果多数尚不成熟,但是观察到了令人鼓舞的应用前景。
综上所述,目前针对免疫治疗耐药后的晚期NSCLC,许多新型治疗方案如ADC药物或PD-1/PD-L1抑制剂与其他免疫检查点抑制剂的联合治疗在前期研究中已显示出一定疗效,有望为克服免疫耐药带来新的选择,然而多数尚缺乏Ⅲ期随机对照研究结果等高级别循证医学证据,还需要进行更多的临床研究进一步证实。
推荐意见7:对于驱动基因阴性晚期NSCLC经一线免疫治疗耐药后,除二线标准化疗外,建议患者入组临床研究。(推荐等级:Ⅰ级)
第六部分:总结与展望
免疫检查点抑制剂尤其是PD-1/PD-L1单抗给肺癌的治疗带来了划时代的突破,对于驱动基因阴性的晚期NSCLC患者,目前一线免疫联合化疗或者免疫单药治疗已是标准治疗方案,免疫的长拖尾效应使更多患者可以长期生存。然而,对于一线经免疫治疗后PD的患者,如何优化后线治疗方案目前仍处于探索阶段,本共识专家组对相关的临床研究证据进行了系统梳理和深入讨论,并在多个问题上形成共识,希望为驱动基因阴性晚期NSCLC患者一线免疫治疗耐药后的临床诊疗提供引导。
对于驱动基因阴性晚期NSCLC患者一线免疫耐药后的临床诊疗还有很多问题需要进一步探讨。第一,关于免疫治疗后的HPD现象,目前仍存在争论,并且对于HPD的评估标准目前尚缺乏统一的可操作的评估标准;第二,一线免疫治疗系统性进展后,化疗、化疗联合抗血管生成治疗、免疫再挑战联合化疗或抗血管生成治疗均有开展相关的临床研究,然而二线如何选择才是最佳的治疗方案,目前也缺乏成熟的大型Ⅲ期临床研究证据;第三,对于免疫治疗再挑战是否建议进行穿插治疗以及是否选择不同免疫药物如PD-1/PD-L1抑制剂的切换,这些问题还需要临床研究的探索为我们提供更多的证据,专家组将继续追踪新的研究结果以更新此共识,为驱动基因阴性晚期NSCLC一线免疫耐药后的治疗提供规范化的建议。
本共识不具备强制性,不作为医疗事故鉴定和医学责任认定依据,仅供相关的医护人员参考。
本共识制订专家组成员
组长:周彩存(上海市肺科医院肿瘤科);王洁(中国医学科学院肿瘤医院肿瘤内科);韩宝惠(上海市胸科医院呼吸内科)
顾问:周建英(浙江大学医学院附属第一医院呼吸内科);操乐杰(中国科学技术大学附属第一医院呼吸与危重症科);胡成平(中南大学湘雅医院呼吸与危重症医学科)
发起专家:王启鸣(郑州大学附属肿瘤医院 河南省肿瘤医院内科);褚倩(华中科技大学同济医学院附属同济医院肿瘤科);邬麟(湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院胸部内二科);刘先领(中南大学湘雅二医院肿瘤科)
执笔人:陈海洋(郑州大学附属肿瘤医院 河南省肿瘤医院内科)
成员(按姓氏汉语拼音字母排序):蔡修宇(中山大学肿瘤防治中心肿瘤内科);操乐杰(中国科学技术大学附属第一医院呼吸与危重症科);曹立明(中南大学湘雅医院呼吸内科);陈海洋(郑州大学附属肿瘤医院 河南省肿瘤医院内科);褚倩(华中科技大学同济医学院附属同济医院肿瘤科);段建春(中国医学科学院肿瘤医院 中国医学科学院肿瘤医院山西医院肿瘤内科);葛红(郑州大学附属肿瘤医院 河南省肿瘤医院放疗科);韩宝惠(上海市胸科医院呼吸内科);韩正祥(徐州医科大学附属医院肿瘤科);郝静(山东大学齐鲁医院肿瘤内科);何振(郑州大学附属肿瘤医院 河南省肿瘤医院内科);胡成平(中南大学湘雅医院呼吸与危重症医学科);李杰(山西省肿瘤医院放疗科);李卫华(中国医学科学院肿瘤医院病理科);刘基巍(大连医科大学附属第一医院肿瘤科);刘先领(中南大学湘雅二医院肿瘤科);马芳(中南大学湘雅二医院肿瘤内科);蒲兴祥(湖南省肿瘤医院胸内二科);曲金荣(郑州大学附属肿瘤医院 河南省肿瘤医院医学影像科);涂海燕(广东省人民医院肺内三科);王红民(郑州大学第一附属医院呼吸内科);王洁(中国医学科学院肿瘤医院肿瘤内科);王启鸣(郑州大学附属肿瘤医院 河南省肿瘤医院内科);邬麟(湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院胸部内二科);吴芳(中南大学湘雅二医院肿瘤科);徐禹(武汉大学中南医院肺部肿瘤放化疗科);杨萌(中日友好医院呼吸与危重症医学科);张莉(华中科技大学同济医学院附属同济医院肿瘤科);钟润波(上海市胸科医院呼吸内科);周彩存(上海市肺科医院肿瘤内科);周建英(浙江大学医学院附属第一医院呼吸内科)
利益冲突
所有作者声明不存在利益冲突
参考文献
[1]SungH, FerlayJ, SiegelRL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249. DOI: 10.3322/caac.21660.
[2]CaoW, ChenHD, YuYW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl), 2021, 134(7):783-791. DOI: 10.1097/CM9.0000000000001474.
[3]CuferT, KnezL. Update on systemic therapy of advanced non-small-cell lung cancer[J]. Expert Rev Anticancer Ther, 2014, 14(10):1189-1203. DOI: 10.1586/14737140.2014.940327.
[4]GaronEB, HellmannMD, RizviNA, et al. Five-year overall survival for patients with advanced non‒small-cell lung cancer treated with pembrolizumab: results from the phase Ⅰ KEYNOTE-001 study[J]. J Clin Oncol, 2019, 37(28):2518-2527. DOI: 10.1200/JCO.19.00934.
[5]KlugerHM, TawbiHA, AsciertoML, et al. Defining tumor resistance to PD-1 pathway blockade: recommendations from the first meeting of the SITC Immunotherapy Resistance Taskforce[J]. J Immunother Cancer, 2020, 8(1):e000398. DOI: 10.1136/jitc-2019-000398.
[6]SchoenfeldAJ, AntoniaSJ, AwadMM, et al. Clinical definition of acquired resistance to immunotherapy in patients with metastatic non-small-cell lung cancer[J]. Ann Oncol, 2021, 32(12):1597-1607. DOI: 10.1016/j.annonc.2021.08.2151.
[7]RizviN, AdemuyiwaFO, CaoZA, et al. Society for Immunotherapy of Cancer (SITC) consensus definitions for resistance to combinations of immune checkpoint inhibitors with chemotherapy[J]. J Immunother Cancer, 2023, 11(3):e005920. DOI: 10.1136/jitc-2022-005920.
[8]KlugerH, BarrettJC, GainorJF, et al. Society for Immunotherapy of Cancer (SITC) consensus definitions for resistance to combinations of immune checkpoint inhibitors[J]. J Immunother Cancer, 2023, 11(3):e005921. DOI: 10.1136/jitc-2022-005921.
[9]AtkinsMB, AsciertoPA, FeltquateD, et al. Society for Immunotherapy of Cancer (SITC) consensus definitions for resistance to combinations of immune checkpoint inhibitors with targeted therapies[J]. J Immunother Cancer, 2023, 11(3):e005923. DOI: 10.1136/jitc-2022-005923.
[10]VasanN, BaselgaJ, HymanDM. A view on drug resistance in cancer[J]. Nature, 2019, 575(7782):299-309. DOI: 10.1038/s41586-019-1730-1.
[11]刘延国, 王秀问, 刘联. 晚期非小细胞肺癌免疫治疗应用时长之思辨[J]. 中华医学杂志, 2022, 102(22):1691-1698. DOI: 10.3760/cma.j.cn112137-20211119-02581.
[12]SharmaP, Hu-LieskovanS, WargoJA, et al. Primary, adaptive, and acquired resistance to cancer immunotherapy[J]. Cell, 2017, 168(4):707-723. DOI: 10.1016/j.cell.2017.01.017.
[13]AttiliI, KarachaliouN, BonannoL, et al. STAT3 as a potential immunotherapy biomarker in oncogene-addicted non-small cell lung cancer[J]. Ther Adv Med Oncol, 2018, 10:1758835918763744. DOI: 10.1177/1758835918763744.
[14]PengW, ChenJQ, LiuC, et al. Loss of PTEN promotes resistance to T cell-mediated immunotherapy[J]. Cancer Discov, 2016, 6(2):202-216. DOI: 10.1158/2159-8290.CD-15-0283.
[15]SprangerS, BaoR, GajewskiTF. Melanoma-intrinsic β-catenin signalling prevents anti-tumour immunity[J]. Nature, 2015, 523(7559):231-235. DOI: 10.1038/nature14404.
[16]KarachaliouN, Gonzalez-CaoM, CrespoG, et al. Interferon gamma, an important marker of response to immune checkpoint blockade in non-small cell lung cancer and melanoma patients[J]. Ther Adv Med Oncol, 2018, 10:1758834017749748. DOI: 10.1177/1758834017749748.
[17]QingY, StarkGR. Alternative activation of STAT1 and STAT3 in response to interferon-gamma[J]. J Biol Chem, 2004, 279(40):41679-41685. DOI: 10.1074/jbc.M406413200.
[18]AldeaM, AndreF, MarabelleA, et al. Overcoming resistance to tumor-targeted and immune-targeted therapies[J]. Cancer Discov, 2021, 11(4):874-899. DOI: 10.1158/2159-8290.CD-20-1638.
[19]SprangerS, GajewskiTF. Impact of oncogenic pathways on evasion of antitumour immune responses[J]. Nat Rev Cancer, 2018, 18(3):139-147. DOI: 10.1038/nrc.2017.117.
[20]ZhangN, ZengY, DuW, et al. The EGFR pathway is involved in the regulation of PD-L1 expression via the IL-6/JAK/STAT3 signaling pathway in EGFR-mutated non-small cell lung cancer[J]. Int J Oncol, 2016, 49(4):1360-1368. DOI: 10.3892/ijo.2016.3632.
[21]ChenN, FangW, ZhanJ, et al. Upregulation of PD-L1 by EGFR activation mediates the immune escape in EGFR-driven NSCLC: implication for optional immune targeted therapy for NSCLC patients with EGFR mutation[J]. J Thorac Oncol, 2015, 10(6):910-923. DOI: 10.1097/JTO.0000000000000500.
[22]KoyamaS, AkbayEA, LiYY, et al. STK11/LKB1 deficiency promotes neutrophil recruitment and proinflammatory cytokine production to suppress T-cell activity in the lung tumor microenvironment[J]. Cancer Res, 2016, 76(5):999-1008. DOI: 10.1158/0008-5472.CAN-15-1439.
[23]PoreN, WuS, StandiferN, et al. Resistance to durvalumab and durvalumab plus tremelimumab is associated with functional STK11 mutations in patients with non-small cell lung cancer and is reversed by STAT3 knockdown[J]. Cancer Discov, 2021, 11(11):2828-2845. DOI: 10.1158/2159-8290.CD-20-1543.
[24]GuoT, LiW, CaiX. Applications of single-cell omics to dissect tumor microenvironment[J]. Front Genet, 2020, 11:548719. DOI: 10.3389/fgene.2020.548719.
[25]MeyerC, CagnonL, Costa-NunesCM, et al. Frequencies of circulating MDSC correlate with clinical outcome of melanoma patients treated with ipilimumab[J]. Cancer Immunol Immunother, 2014, 63(3):247-257. DOI: 10.1007/s00262-013-1508-5.
[26]ChanmeeT, OntongP, KonnoK, et al. Tumor-associated macrophages as major players in the tumor microenvironment[J]. Cancers (Basel), 2014, 6(3):1670-1690. DOI: 10.3390/cancers6031670.
[27]ChaudharyB, ElkordE. Regulatory T cells in the tumor microenvironment and cancer progression: role and therapeutic targeting[J]. Vaccines (Basel), 2016, 4(3):28. DOI: 10.3390/vaccines4030028.
[28]HatoT, ZhuAX, DudaDG. Rationally combining anti-VEGF therapy with checkpoint inhibitors in hepatocellular carcinoma[J]. Immunotherapy, 2016, 8(3):299-313. DOI: 10.2217/imt.15.126.
[29]HortonBL, MorganDM, MominN, et al. Lack of CD8(+) T cell effector differentiation during priming mediates checkpoint blockade resistance in non-small cell lung cancer[J]. Sci Immunol, 2021, 6(64):eabi8800. DOI: 10.1126/sciimmunol.abi8800.
[30]JoyceJA, FearonDT. T cell exclusion, immune privilege, and the tumor microenvironment[J]. Science, 2015, 348(6230):74-80. DOI: 10.1126/science.aaa6204.
[31]GovindanR, DingL, GriffithM, et al. Genomic landscape of non-small cell lung cancer in smokers and never-smokers[J]. Cell, 2012, 150(6):1121-1134. DOI: 10.1016/j.cell.2012.08.024.
[32]ConfortiF, PalaL, BagnardiV, et al. Cancer immunotherapy efficacy and patients′ sex: a systematic review and meta-analysis[J]. Lancet Oncol, 2018, 19(6):737-746. DOI: 10.1016/S1470-2045(18)30261-4.
[33]KichenadasseG, MinersJO, MangoniAA, et al. Association between body mass index and overall survival with immune checkpoint inhibitor therapy for advanced non-small cell lung cancer[J]. JAMA Oncol, 2020, 6(4):512-518. DOI: 10.1001/jamaoncol.2019.5241.
[34]JinY, DongH, XiaL, et al. The Diversity of gut microbiome is associated with favorable responses to anti-programmed death 1 immunotherapy in chinese patients with NSCLC[J]. J Thorac Oncol, 2019, 14(8):1378-1389. DOI: 10.1016/j.jtho.2019.04.007.
[35]RoutyB, Le ChatelierE, DerosaL, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J]. Science, 2018, 359(6371):91-97. DOI: 10.1126/science.aan3706.
[36]OsterP, VaillantL, RivaE, et al. Helicobacter pylori infection has a detrimental impact on the efficacy of cancer immunotherapies[J]. Gut, 2022, 71(3):457-466. DOI: 10.1136/gutjnl-2020-323392.
[37]HuangJ, LiuD, WangY, et al. Ginseng polysaccharides alter the gut microbiota and kynurenine/tryptophan ratio, potentiating the antitumour effect of antiprogrammed cell death 1/programmed cell death ligand 1 (anti-PD-1/PD-L1) immunotherapy[J]. Gut, 2022, 71(4):734-745. DOI: 10.1136/gutjnl-2020-321031.
[38]EisenhauerEA, TherasseP, BogaertsJ, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2):228-247. DOI: 10.1016/j.ejca.2008.10.026.
[39]Di GiacomoAM, DanielliR, GuidoboniM, et al. Therapeutic efficacy of ipilimumab, an anti-CTLA-4 monoclonal antibody, in patients with metastatic melanoma unresponsive to prior systemic treatments: clinical and immunological evidence from three patient cases[J]. Cancer Immunol Immunother, 2009, 58(8):1297-1306. DOI: 10.1007/s00262-008-0642-y.
[40]ParkHJ, KimKW, PyoJ, et al. Incidence of pseudoprogression during immune checkpoint inhibitor therapy for solid tumors: a systematic review and meta-analysis[J]. Radiology, 2020, 297(1):87-96. DOI: 10.1148/radiol.2020200443.
[41]FrelautM, du RusquecP, de MouraA, et al. Pseudoprogression and Hyperprogression as New Forms of Response to Immunotherapy[J]. Bio Drugs, 2020, 34(4):463-476. DOI: 10.1007/s40259-020-00425-y.
[42]ChampiatS, FerraraR, MassardC, et al. Hyperprogressive disease: recognizing a novel pattern to improve patient management[J]. Nat Rev Clin Oncol, 2018, 15(12):748-762. DOI: 10.1038/s41571-018-0111-2.
[43]FerraraR, MezquitaL, TexierM, et al. Hyperprogressive disease in patients with advanced non-small cell lung cancer treated with PD-1/PD-L1 inhibitors or with single-agent chemotherapy[J]. JAMA Oncol, 2018, 4(11):1543-1552. DOI: 10.1001/jamaoncol.2018.3676.
[44]PopatS. Hyperprogression with immunotherapy: is it real?[J]. Cancer, 2019, 125(8):1218-1220. DOI: 10.1002/cncr.31997.
[45]KatoS, GoodmanA, WalavalkarV, et al. Hyperprogressors after immunotherapy: analysis of genomic alterations associated with accelerated growth rate[J]. Clin Cancer Res, 2017, 23(15):4242-4250. DOI: 10.1158/1078-0432.CCR-16-3133.
[46]WolchokJD, HoosA, O′DayS, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria[J]. Clin Cancer Res, 2009, 15(23):7412-7420. DOI: 10.1158/1078-0432.CCR-09-1624.
[47]BohnsackOHA, LudajicK. Adaptation of the immune related response criteria: irrecist[J]. Ann Oncol, 2014, 25Suppl 4: S369-S372. DOI: https://doi.org/10.1093/annonc/mdu342.23.
[48]SeymourL, BogaertsJ, PerroneA, et al. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics[J]. Lancet Oncol, 2017, 18(3):e143-e152. DOI: 10.1016/S1470-2045(17)30074-8.
[49]HodiFS, BallingerM, LyonsB, et al. Immune-modified response evaluation criteria in solid tumors (imRECIST): refining guidelines to assess the clinical benefit of cancer immunotherapy[J]. J Clin Oncol, 2018, 36(9):850-858. DOI: 10.1200/JCO.2017.75.1644.
[50]YoungH, BaumR, CremeriusU, et al. Measurement of clinical and subclinical tumour response using [18F]-fluorodeoxyglucose and positron emission tomography: review and 1999 EORTC recommendations. European Organization for Research and Treatment of Cancer (EORTC) PET Study Group[J]. Eur J Cancer, 1999, 35(13):1773-1782. DOI: 10.1016/s0959-8049(99)00229-4.
[51]WahlRL, JaceneH, KasamonY, et al. From RECIST to PERCIST: evolving considerations for PET response criteria in solid tumors[J]. J Nucl Med, 2009, 50Suppl 1(Suppl 1):122S-50S. DOI: 10.2967/jnumed.108.057307.
[52]GoldfarbL, DuchemannB, ChouahniaK, et al. Monitoring anti-PD-1-based immunotherapy in non-small cell lung cancer with FDG PET: introduction of iPERCIST[J]. EJNMMI Res, 2019, 9(1):8. DOI: 10.1186/s13550-019-0473-1.
[53]中华医学会核医学分会PET学组. 免疫检查点抑制剂治疗恶性肿瘤的PET/CT评价专家共识(2020版)[J]. 中华肿瘤杂志, 2020, 42(9):697-705. DOI: 10.3760/cma.j.cn112152-20200623-00590.
[54]LeeJH, LongGV, MenziesAM, et al. Association between circulating tumor DNA and pseudoprogression in patients with metastatic melanoma treated with anti-programmed cell death 1 antibodies[J]. JAMA Oncol, 2018, 4(5):717-721. DOI: 10.1001/jamaoncol.2017.5332.
[55]StadlerJC, BelloumY, DeitertB, et al. Current and future clinical applications of ctDNA in immuno-oncology[J]. Cancer Res, 2022, 82(3):349-358. DOI: 10.1158/0008-5472.CAN-21-1718.
[56]HeoJY, YooSH, SuhKJ, et al. Clinical pattern of failure after a durable response to immune check inhibitors in non-small cell lung cancer patients[J]. Sci Rep, 2021, 11(1):2514. DOI: 10.1038/s41598-021-81666-x.
[57]SchoenfeldAJ, RizviH, BandlamudiC, et al. Clinical and molecular correlates of PD-L1 expression in patients with lung adenocarcinomas[J]. Ann Oncol, 2020, 31(5):599-608. DOI: 10.1016/j.annonc.2020.01.065.
[58]PalmaDA, OlsonR, HarrowS, et al. Stereotactic ablative radiotherapy for the comprehensive treatment of oligometastatic cancers: long-term results of the SABR-COMET phase Ⅱ randomized trial[J]. J Clin Oncol, 2020, 38(25):2830-2838. DOI: 10.1200/JCO.20.00818.
[59]ChalkidouA, MacmillanT, GrzedaMT, et al. Stereotactic ablative body radiotherapy in patients with oligometastatic cancers: a prospective, registry-based, single-arm, observational, evaluation study[J]. Lancet Oncol, 2021, 22(1):98-106. DOI: 10.1016/S1470-2045(20)30537-4.
[60]SchoenfeldAJ, RizviHA, MemonD, et al. Systemic and oligo-acquired resistance to PD-(L)1 blockade in lung cancer[J]. Clin Cancer Res, 2022, 28(17):3797-3803. DOI: 10.1158/1078-0432.CCR-22-0657.
[61]ChangJY, VermaV. Optimize local therapy for oligometastatic and oligoprogressive non-small cell lung cancer to enhance survival[J]. J Natl Compr Canc Netw, 2022, 20(5):531-539. DOI: 10.6004/jnccn.2021.7117.
[62]MoleRH. Whole body irradiation; radiobiology or medicine?[J]. Br J Radiol, 1953, 26(305):234-241. DOI: 10.1259/0007-1285-26-305-234.
[63]SatoH, DemariaS, OhnoT. The role of radiotherapy in the age of immunotherapy[J]. Jpn J Clin Oncol, 2021, 51(4):513-522. DOI: 10.1093/jjco/hyaa268.
[64]TheelenW, PeulenH, LalezariF, et al. Effect of pembrolizumab after stereotactic body radiotherapy vs pembrolizumab alone on tumor response in patients with advanced non-small cell lung cancer: results of the PEMBRO-RT phase 2 randomized clinical trial[J]. JAMA Oncol, 2019, 5(9):1276-1282. DOI: 10.1001/jamaoncol.2019.1478.
[65]WelshJ, MenonH, ChenD, et al. Pembrolizumab with or without radiation therapy for metastatic non-small cell lung cancer: a randomized phase Ⅰ/Ⅱ trial[J]. J Immunother Cancer, 2020, 8(2):e001001. DOI: 10.1136/jitc-2020-001001.
[66]TheelenW, ChenD, VermaV, et al. Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials[J]. Lancet Respir Med, 2021, 9(5):467-475. DOI: 10.1016/S2213-2600(20)30391-X.
[67]HorndalsveenH, AlverTN, DalsgaardAM, et al. Atezolizumab and stereotactic body radiotherapy in patients with advanced non-small cell lung cancer: safety, clinical activity and ctDNA responses-the ComIT-1 trial[J]. Mol Oncol, 2023, 17(3):487-498. DOI: 10.1002/1878-0261.13330.
[68]BestvinaCM, PointerKB, KarrisonT, et al. A phase 1 trial of concurrent or sequential ipilimumab, nivolumab, and stereotactic body radiotherapy in patients with stage Ⅳ NSCLC study[J]. J Thorac Oncol, 2022, 17(1):130-140. DOI: 10.1016/j.jtho.2021.08.019.
[69]XuY, LiH, FanY. Progression patterns, treatment, and prognosis beyond resistance of responders to immunotherapy in advanced non-small cell lung cancer[J]. Front Oncol, 2021, 11:642883. DOI: 10.3389/fonc.2021.642883.
[70]DewanMZ, GallowayAE, KawashimaN, et al. Fractionated but not single-dose radiotherapy induces an immune-mediated abscopal effect when combined with anti-CTLA-4 antibody[J]. Clin Cancer Res, 2009, 15(17):5379-5388. DOI: 10.1158/1078-0432.CCR-09-0265.
[71]ShaverdianN, LisbergAE, BornazyanK, et al. Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial[J]. Lancet Oncol, 2017, 18(7):895-903. DOI: 10.1016/S1470-2045(17)30380-7.
[72]GengY, ZhangQ, FengS, et al. Safety and Efficacy of PD-1/PD-L1 inhibitors combined with radiotherapy in patients with non-small-cell lung cancer: a systematic review and meta-analysis[J]. Cancer Med, 2021, 10(4):1222-1239. DOI: 10.1002/cam4.3718.
[73]JoostenP, de LangenAJ, van der NoortV, et al. The role of surgery in the treatment of oligoprogression after systemic treatment for advanced non-small cell lung cancer[J]. Lung Cancer, 2021, 161:141-151. DOI: 10.1016/j.lungcan.2021.09.019.
[74]XuzhangW, HuangH, YuY, et al. Treatment strategies based on different oligoprogressive patterns after immunotherapy failure in metastatic NSCLC[J]. Ther Adv Med Oncol, 2023, 15:17588359231156387. DOI: 10.1177/17588359231156387.
[75]ShiL, ChenL, WuC, et al. PD-1 Blockade boosts radiofrequency ablation-elicited adaptive immune responses against tumor[J]. Clin Cancer Res, 2016, 22(5):1173-1184. DOI: 10.1158/1078-0432.CCR-15-1352.
[76]TakakiH, CornelisF, KakoY, et al. Thermal ablation and immunomodulation: from preclinical experiments to clinical trials[J]. Diagn Interv Imaging, 2017, 98(9):651-659. DOI: 10.1016/j.diii.2017.04.008.
[77]ParkSE, LeeSH, AhnJS, et al. Increased response rates to salvage chemotherapy administered after PD-1/PD-L1 inhibitors in patients with non-small cell lung cancer[J]. J Thorac Oncol, 2018, 13(1):106-111. DOI: 10.1016/j.jtho.2017.10.011.
[78]SchvartsmanG, PengSA, BisG, et al. Response rates to single-agent chemotherapy after exposure to immune checkpoint inhibitors in advanced non-small cell lung cancer[J]. Lung Cancer, 2017, 112:90-95. DOI: 10.1016/j.lungcan.2017.07.034.
[79]AuclinE, Benitez-MontanezJ, GorriaT, et al. OA07.06 second line treatment outcomes after progression on immunotherapy plus chemotherapy (IO-CT) in advanced non-small cell lung cancer (aNSCLC)[J]. J Thorac Oncol, 2022, 17(9Supplement): S22. DOI: https://doi.org/10.1016/j.jtho.2022.07.043.
[80]LiuS, HuX, ChirovskyD, et al. OA07.04 overall survival in patients with advanced NSCLC receiving taxane-containing regimen after exposure to immunotherapy and platinum-doublet[J]. J Thorac Oncol, 2022, 17(9Supplement): S21. DOI: https://doi.org/10.1016/j.jtho.2022.07.041.
[81]BilgerG, ToffartAC, DarrasonM, et al. Paclitaxel-bevacizumab combination in advanced non-squamous non-small-cell lung cancer (NSCLC): AVATAX, a retrospective multicentric study[J]. Ther Adv Med Oncol, 2022, 14:17588359221099399. DOI: 10.1177/17588359221099399.
[82]WuL, FangY. EP08.02-160 A pooled efficacy and safety analysis of anlotinib plus docetaxel in advanced NSCLC previously treated with immunotherapy[J]. J Thorac Oncol, 2022, 17(9Supplement):S482-S483.DOI: https://doi.org/10.1016/j.jtho.2022.07.843.
[83]TozukaT, KitazonoS, SakamotoH, et al. Addition of ramucirumab enhances docetaxel efficacy in patients who had received anti-PD-1/PD-L1 treatment[J]. Lung Cancer, 2020, 144:71-75. DOI: 10.1016/j.lungcan.2020.04.021.
[84]BruecklWM, ReckM, RittmeyerA, et al. Efficacy of docetaxel plus ramucirumab as palliative third-line therapy following second-line immune-checkpoint- inhibitor treatment in patients with non-small-cell lung cancer stage Ⅳ[J]. Clin Med Insights Oncol, 2020, 14:1179554920951358. DOI: 10.1177/1179554920951358.
[85]GrohéC, WehlerT, DechowT, et al. Nintedanib plus docetaxel after progression on first-line immunochemotherapy in patients with lung adenocarcinoma: cohort C of the non-interventional study, VARGADO[J]. Transl Lung Cancer Res, 2022, 11(10):2010-2021. DOI: 10.21037/tlcr-21-1018.
[86]GrohéC, BlauW, GleiberW, et al. Real-world efficacy of nintedanib plus docetaxel after progression on immune checkpoint inhibitors: results from the ongoing, non-interventional VARGADO study[J]. Clin Oncol (R Coll Radiol), 2022, 34(7):459-468. DOI: 10.1016/j.clon.2021.12.010.
[87]GobbiniE, ToffartAC, PerolM, et al. Immune checkpoint inhibitors rechallenge efficacy in non-small-cell lung cancer patients[J]. Clin Lung Cancer, 2020, 21(5): e497-e510. DOI: 10.1016/j.cllc.2020.04.013.
[88]WatanabeH, KuboT, NinomiyaK, et al. The effect and safety of immune checkpoint inhibitor rechallenge in non-small cell lung cancer[J]. Jpn J Clin Oncol, 2019, 49(8):762-765. DOI: 10.1093/jjco/hyz066.
[89]HerbstRS, GaronEB, KimDW, et al. Long-term outcomes and retreatment among patients with previously treated, programmed death-ligand 1-positive, advanced non-small-cell lung cancer in the KEYNOTE-010 study[J]. J Clin Oncol, 2020, 38(14):1580-1590. DOI: 10.1200/JCO.19.02446.
[90]ShethS, GaoC, MuellerN, et al. Durvalumab activity in previously treated patients who stopped durvalumab without disease progression[J]. J Immunother Cancer, 2020, 8(2):e000650. DOI: 10.1136/jitc-2020-000650.
[91]ShuklaN, AlthouseSK, PerkinsS, et al. A phase Ⅱ trial of chemotherapy plus pembrolizumab in patients with advanced NSCLC previously treated with a PD-1 or PD-L1 inhibitor: big ten cancer research consortium BTCRC-LUN15-029[J]. J Thorac Oncol, 2021, 39(15Suppl): 9073. DOI: 10.1200/JCO.2021.39.15_suppl.9073.
[92]ReckampKL, RedmanMW, DragnevKH, et al. Phase Ⅱ randomized study of ramucirumab and pembrolizumab versus standard of care in advanced non-small-cell lung cancer previously treated with immunotherapy-lung-map S1800A[J]. J Clin Oncol, 2022, 40(21):2295-2306. DOI: 10.1200/JCO.22.00912.
[93]ReckM, SadjadianP, WallerC, et al. P1.15-05 nintedanib in combination with nivolumab in pretreated patients with advanced adenocarcinoma of the lung (AIO-TRK-0117 phase ⅠB/Ⅱ trial) [J]. J Thorac Oncol, 2022, 17(9, Supplement): S121. DOI: https://doi.org/10.1016/j.jtho.2022.07.201.
[94]NealJW, LimFL, FelipE, et al. Cabozantinib in combination with atezolizumab in non-small cell lung cancer (NSCLC) patients previously treated with an immune checkpoint inhibitor: results from cohort 7 of the COSMIC-021 study[J]. J Clin Oncol, 2020, 38(15Suppl): 9610. DOI: 10.1200/JCO.2020.38.15_suppl.9610.
[95]NealJ W, KunduP, TanakaT, et al. CONTACT-01: a phase Ⅲ, randomized study of atezolizumab plus cabozantinib versus docetaxel in patients with metastatic non-small cell lung cancer (mNSCLC) previously treated with PD-L1/PD-1 inhibitors and platinum-containing chemotherapy[J]. J Clin Oncol, 2021, 39(15suppl):TPS9134-TPS. DOI: 10.1200/JCO.2021.39.15_suppl.TPS9134.
[96]LeighlNB, HuiR, Rodríguez-AbreuD, et al. Abstract CT289: Pembrolizumab plus lenvatinib vs docetaxel in patients with previously treated metastatic non-small-cell lung cancer (NSCLC) and PD after platinum-doublet chemotherapy and immunotherapy: Phase 3, randomized, open-label LEAP-008 trial[J]. Cancer Res, 2020, 80(16Suppl): CT289-CT. DOI: https://doi.org/10.1158/1538-7445.AM2020-CT289.
[97]HeK, BerzD, GadgeelSM, et al. MRTX-500 phase 2 trial: sitravatinib with nivolumab in patients with nonsquamous NSCLC progressing on or after checkpoint inhibitor therapy or chemotherapy[J]. J Thorac Oncol, 2023, 18(7):907-921. DOI: 10.1016/j.jtho.2023.02.016.
[98]Giaj LevraM, CottéFE, CorreR, et al. Immunotherapy rechallenge after nivolumab treatment in advanced non-small cell lung cancer in the real-world setting: a national data base analysis[J]. Lung Cancer, 2020, 140:99-106. DOI: 10.1016/j.lungcan.2019.12.017.
[99]BahceI, SchneidersF, HashemiS, et al. 1020P Rescue by radiotherapy and anti-CTLA4/PD-1 after failure of anti-PD-1 therapy in metastatic NSCLC patients: the RECLAIM study[J]. Ann Oncol, 2022, 33: S1021. DOI: https://doi.org/10.1016/j.annonc.2022.07.1146.
[100]NiuJ, Maurice-DrorC, LeeDH, et al. First-in-human phase 1 study of the anti-TIGIT antibody vibostolimab as monotherapy or with pembrolizumab for advanced solid tumors, including non-small-cell lung cancer[J]. Ann Oncol, 2022, 33(2):169-180. DOI: 10.1016/j.annonc.2021.11.002.
[101]BrandãoM, AlvarezEC, FelipE, et al. Safety, pharmacokinetics (PK), pharmacodynamics (PD) and preliminary efficacy of AZD2936, a bispecific antibody targeting PD-1 and TIGIT, in checkpoint inhibitor (CPI)-experienced advanced/metastatic non-small-cell lung cancer (NSCLC): first report of ARTEMIDE-01[J]. J Clin Oncol, 2023, 41(16Suppl): 9050. DOI: 10.1200/JCO.2023.41.16_suppl.9050.
[102]ForsterM, KrebsM, MajemM, et al. EP08.01-109 TACTI-002: a phase Ⅱ study of eftilagimod alpha (soluble LAG-3) & pembrolizumab in 2nd line PD-1/PD-L1 refractory metastatic NSCLC [J]. J Thorac Oncol, 2022, 17(9Supplement): S395. DOI: https://doi.org/10.1016/j.jtho.2022.07.681.
[103]HardingJJ, MorenoV, BangYJ, et al. Blocking TIM-3 in treatment-refractory advanced solid tumors: a phase Ⅰa/b study of LY3321367 with or without an anti-PD-L1 antibody[J]. Clin Cancer Res, 2021, 27(8):2168-2178. DOI: 10.1158/1078-0432.CCR-20-4405.
[104]HollebecqueA, ChungHC, de MiguelMJ, et al. Safety and antitumor activity of α-PD-L1 antibody as monotherapy or in combination with α-TIM-3 antibody in patients with microsatellite instability-high/mismatch repair-deficient tumors[J]. Clin Cancer Res, 2021, 27(23):6393-6404. DOI: 10.1158/1078-0432.CCR-21-0261.
[105]LiBT, SmitEF, GotoY, et al. Trastuzumab deruxtecan in HER2-Mutant non-small-cell lung cancer[J]. N Engl J Med, 2022, 386(3):241-251. DOI: 10.1056/NEJMoa2112431.
[106]GarassinoMC, ReznickD, LiuSY, et al. EVOKE-01: a phase 3 study of sacituzumab govitecan (SG) versus docetaxel in patients with non-small cell lung cancer (NSCLC) progressing on or after platinum-based chemotherapy and checkpoint inhibitors[J]. J Clin Oncol, 2022, 40(16_suppl): TPS9149-TPS. DOI: https://doi.org/10.1200/JCO.2022.40.16_suppl.TPS9149.
[107]FelipE, GiacconeG, DziadziuszkoR, et al. ATALANTE-1 randomized phase Ⅲ trial, OSE 2101 versus standard treatment as second-or third-line in HLA-A2 positive advanced non-small cell lung cancer (NSCLC) patients[J]. J Clin Oncol, 2019, 37(15_suppl): TPS9121-TPS. DOI: https://doi.org/10.1200/JCO.2019.37.15_suppl.TPS9121.
[108]GrayJE, SaltosA, TanvetyanonT, et al. Phase Ⅰ/Ⅰb study of pembrolizumab plus vorinostat in advanced/metastatic non-small cell lung cancer[J]. Clin Cancer Res, 2019, 25(22):6623-6632. DOI: 10.1158/1078-0432.CCR-19-1305.
[109]MassarelliE, SamakogluS, GontcharovaV, et al. Abstract P050: Trial in progress: a phase 2 multicenter study of autologous tumor-infiltrating lymphocyte (TIL, LN-145) cell therapy in patients with metastatic non-small cell lung cancer (mNSCLC) [J]. Mol Cancer Ther, 2021, 20(12_Supplement): P050-P. DOI: https://doi.org/10.1158/1535-7163.TARG-21-P050.
[110]DavarD, DzutsevAK, McCullochJA, et al. Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients[J]. Science, 2021, 371(6529):595-602. DOI: 10.1126/science.abf3363.
通信作者:王启鸣,郑州大学附属肿瘤医院 河南省肿瘤医院内科,郑州 450008,Email:qimingwang1006@126.com;褚倩,华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030,Email:qianchu@tjh.thumbs.edu.cn;邬麟,湖南省肿瘤医院胸部内二科,长沙 410031,Email:wulin-calf@vip.163.com;刘先领,中南大学湘雅二医院肿瘤科,长沙 410012,Email:liuxianling@csu.edu.cn.
引用本文:中国临床肿瘤学会非小细胞肺癌专业委员会. 驱动基因阴性晚期非小细胞肺癌一线免疫治疗耐药评估及治疗策略中国专家共识(2024版) [J] . 中华医学杂志, 2024, 104(6) : 411-426. DOI: 10.3760/cma.j.cn112137-20230927-00589.
本文转载自订阅号「中华医学杂志」(ID:nmjc1915)
原链接戳:标准与规范 | 驱动基因阴性晚期非小细胞肺癌一线免疫治疗耐药评估及治疗策略中国专家共识(2024版)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


