
帚霉/小囊菌属(Scopulariopsis)属粪壳菌纲(Sordariomycetes),小囊菌目(Microascales),小囊菌科(Microascaceae)。多营腐生或弱寄生生活,分布广泛,普遍生存于土壤,也常分离自空气、植物残体、动物粪便、纺织品、乳酪和潮湿的室内环境中。gracilis小囊菌是帚霉/小囊菌属的有性型,是一种罕见致病的机会性真菌,常见于土壤、腐烂的有机物和室内环境中。1962年由Inagaki首次从日本的食物中分离出来,旧称gracilis帚霉,现重新分类并命名为 gracilis小囊菌。在形态学上鉴定为帚霉/小囊菌属的 97例临床菌株中,gracilis小囊菌分离率第2,最常从呼吸道样本中分离出来,大多数被确认为定植。自1962年以来有5例报告为确诊胸腔帚霉/小囊菌感染的病例,患者的中位年龄为52.8岁(27-70岁),全部为男性。美国2例,比利时、印度、法国和中国各1例,其中80%的患者接受了肺移植,60%的患者接受了唑类抗真菌药物预防治疗。帚霉/小囊菌属胸腔感染中最常见的是gracilis小囊菌(3/6,50%),该菌形态学鉴定极易与属内其他种(例如M.cinereus)混淆,必须通过测序进行鉴定,其次是S. brumptii(2/6,33.3%)和S. acremonium(1/6,16.7%)。
迄今为止,世界范围仅报告6例 gracilis小囊菌感染:播散性感染2例、肺部感染2例、足菌肿和角膜炎各1例,其中83.3% 患者有免疫损伤或免疫抑制,66.7%的患者成功治愈,而2例播散感染患者则治疗失败而死亡。现报道我国首例gracilis小囊菌胸腔感染病例如下。
一、入院记录
患者男,70岁,因“喘息4月余,再发加重1天”于2023-4-22入院。2022-12-28外院确诊为新冠肺炎,2023-1-15治愈后出院。2023-1-17咳嗽较前频繁,咳黄脓痰,心慌、喘气加重,平卧位不能缓解,未发热。
胸部CT(图1):右侧气胸,右肺压缩约40%,磨玻璃影弥漫性分布于双肺,尤其是右肺的中叶和下叶。入院后给予胸穿抽气800ml。氧合好转右肺上叶可闻及呼吸音。未进行持续胸腔闭式引流。头孢哌酮/舒巴坦抗感染治疗后患者咳痰、喘息症状好转。复查血常规、CRP逐渐好转,吸氧3L/min SPO2可维持在95%以上。
2023-2-1 患者活动后气短,指脉氧88-95%(吸氧4L/min)波动,立即复查肺CT见右肺组织被压缩约35-38%,右侧液气胸。
2023-2-2下午行右侧胸腔闭式引流术,较多气泡溢出。当晚突然出现畏寒、发热、喘息加重,双肺哮鸣音,SPO2下降需高流量氧疗维持。复查血常规中白细胞、血清CRP明显升高。
2023-2-7痰培养检出鲍曼不动杆菌,予头孢哌酮/舒巴坦4.5g, ivgtt bid(2.1-3.15),预防性口服氟康唑0.2g, bid(2.3-2.16);检出烟曲霉后换用伏立康唑0.2g,q12h(2.13-2.23);联合左氧氟沙星0.4g,ivgtt qd(2.23-3.15)控制感染,持续高流量氧疗配合俯卧位通气治疗,患者未再发热,咳喘症状逐渐好转。
2023-3-3患者胸腔闭式引流液约150ml,黄色微浑浊,胸水先后培养出屎肠球菌和血链球菌,予万古霉素1g,ivgtt q12h(3.4-3.25)抗感染后好转。
2023-4-14带管出院,出院后胸瓶仍持续有气泡溢出,无胸水,未发热,咳喘症状不重,可间断脱氧。
2023-4-22引流处换药时发现缝线处似有松脱,胸壁皮肤与胸管之间缝隙处有气体进出,胸管在位,胸瓶内仍可见气泡溢出。患者仍有活动后喘息,无明显咳嗽、咳痰,无畏寒,无胸痛、胸闷。门诊以“脓胸、气胸”收入院。自发病以来,患者精神、睡眠、饮食尚可,大小便如常,体力下降,体重无明显变化。
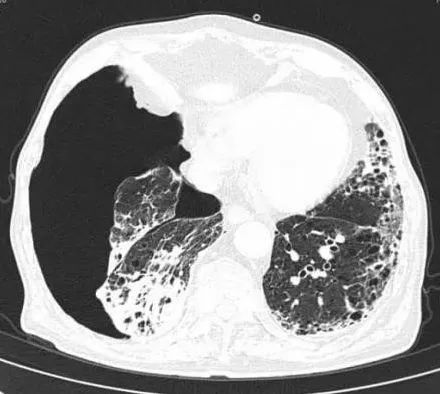
图1示右肺新发气胸,双肺弥漫毛玻璃影
既往史:慢性咳喘病史(2022-12前未诊治),高血压病病史10余年,最高达145/90mmHg,常规服用苯磺酸氨氯地平片5mg/qd、美托洛尔23.75mg/qd ,血压控制良好;肾病综合征病史3月余,目前规律服用胸腺肽肠溶片10mg/tid、α-酮酸片4粒/tid、吲哚布芬片0.1g/qd;近一周发现血糖升高,予以注射诺和锐8-8-8U三餐前,来得时20U 10pm,血糖不稳定。磺胺、青霉素过敏。
体格检查:T:37.6℃,P:92次/分,R:20次/分,BP:142/88mmHg。患者神志清楚,右肺呼吸音低,左肺可闻及湿罗音,余未及明显异常。
门诊及院外辅助检查:血常规淋巴细胞绝对计数(LYM)为0.32×109/L;血清hsCRP 53.5 mg/L、1,3-β-d葡聚糖试验(G试验)32.16 pg/mL、乳酸脱氢酶356U/L、GM试验正常。胸部CT(图2):右侧胸腔内见引流管影,右肺组织被压缩约8%,右侧少许气胸和少量胸腔积液。双肺气肿、肺大泡,部分间质性病变。
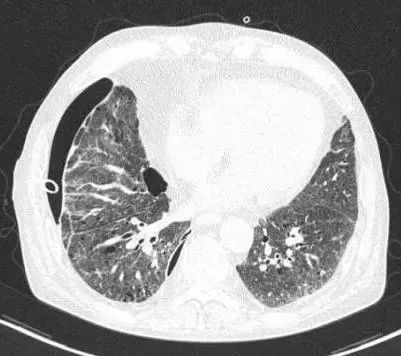
图2右侧胸腔内见引流管影,右肺组织被压缩约8%,少许气胸和少量胸腔积液
二、入院后诊疗经过
【2023-04-28】拔除原胸管,重新更换位置留置胸腔闭式引流管。见多量气泡溢出,可见血性胸水。术后开始拉氧头孢抗感染(4g/d)。
【2023-04-29】 患者咳喘好转,未发热。胸管在位通畅,胸瓶及胸管引流出血性胸水约50ml。双肺呼吸音低,闻及湿罗音。外周血CMV-DNA拷贝数1070/mL,加用更昔洛韦1.8g/d。
【2023-05-02】 患者咳少许黄脓痰,未发热,未诉喘息。胸管处引流出淡黄色浑浊胸水20ml。双肺呼吸音低,闻及少许湿罗音。痰培养出肺炎克雷伯菌,继续拉氧头孢抗感染(4g/d)治疗。胸水真菌荧光染色可见丝状真菌菌丝(图3);胸腔导管(已拔出)及胸水培养有丝状真菌生长。用70%甲酸和α-氰基-4-羟基肉桂酸(HCCA,Sigma‒Aldrich)预处理后,采用基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS,Zybio EXQ2000,中元汇吉生物科技有限公司)鉴定为gracilis小囊菌(图4)。MTB/RIF GeneXpert和IFN-γ体外释放实验检测结果均为阴性。血清和胸腔积液的 G和GM 实验均呈阴性。加用醋酸卡泊芬净0.05g,qd(5.2-6.7)联合口服泊沙康唑肠溶片300mg,qd(5.11-7.15)。
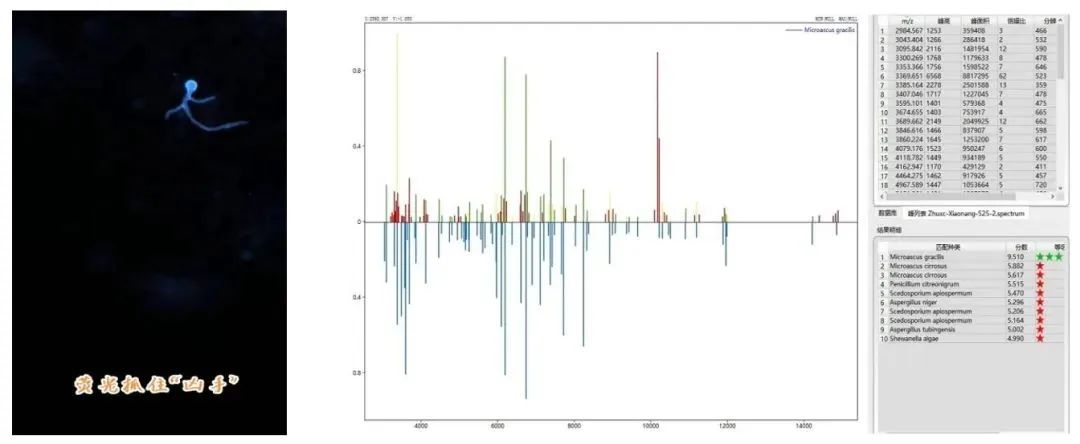
图3胸水荧光白染色(×400) ▲图4 Zybio EXQ2000 MS鉴定结果
【2023-05-04】 患者咳嗽较前好转,未发热,未诉喘息。昨日引流出50ml黄色浑浊胸水。双肺呼吸音低,闻及少许湿罗音。体外真菌药敏(CLSI肉汤稀释法和YearstOne YO10)结果显示较高的MIC值:两性霉素B 4μg/ml,伏立康唑8μg/ml,泊沙康唑> 8μg/ml,伊曲康唑 >16μg/ml,5-氟胞嘧啶>64μg/ml,氟康唑>256μg/ml,棘白菌素类抗真菌药物的最小有效浓度均 >8μg/ml。
【2023-05-08】 咳少许黄白色脓痰,未发热,未诉喘息。引流出黄色浑浊胸水共80ml,无色无味气体约15ml。双肺呼吸音低,闻及少许湿罗音。血常规LYM 0.5×109/L;血清hsCRP 104.2 mg/L。菌株进一步鉴定:沙堡培养基35℃空气培养7天的菌落(图5),生长速度缓慢,局限生长,天鹅绒样,中心呈灰色。小培养后镜下观察(图6)分生孢子梗常不规则分支,大部分呈2-3节,花瓶状或圆柱状,顶部缩窄而基部稍膨大,分生孢子近球形到椭圆形,基部平截,大部分透明到黄褐色,壁薄而光滑,成长链排列,向基性生长。
通过液氮研磨机械破碎菌丝体,然后使用QIAGEN的DNeasy® Plant Kit进行基因组DNA提取,ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')扩增后测序并Blast(No. OR131328),鉴定为gracilis小囊菌。
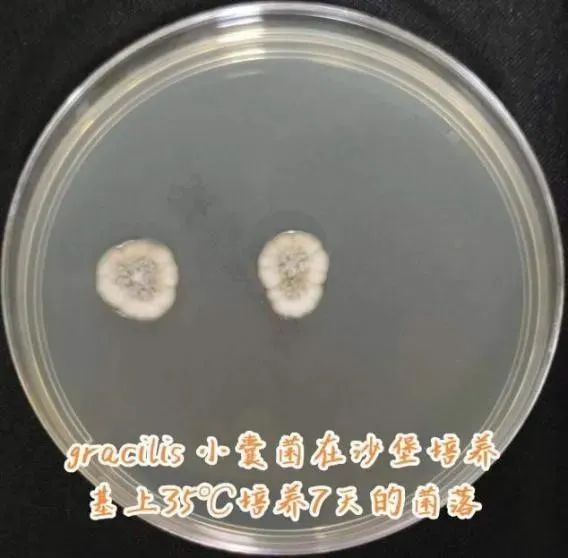
图5 SDA 35℃ 7天的菌落
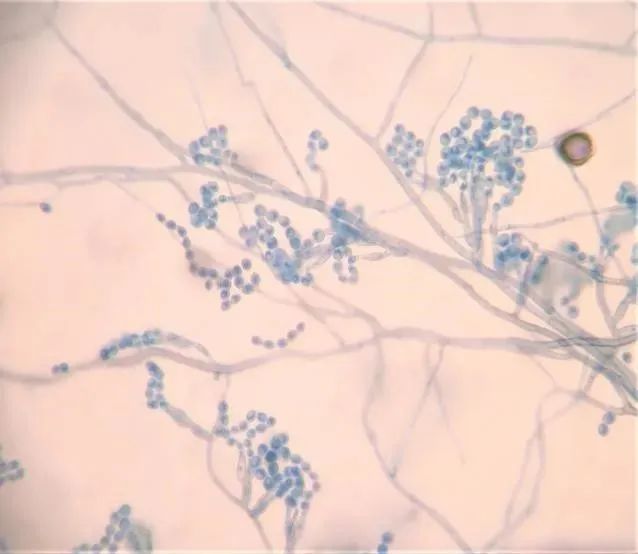
图6 乳酸酚棉蓝染色小培养镜下特征×400
【2023-05-10】 患者咳嗽较前好转,未发热,未诉喘息。双肺呼吸音低,闻及少许湿罗音,BP 139/85mmHg。血气分析考虑I型呼衰,继续吸氧。胸水黄色浑浊,粘蛋白试验阳性。血常规WBC 13.32×109/L,LYM 0.66×109/L;血清hsCRP 101.5 mg/L、铁蛋白1141.0ng/ml、G实验93.13pg/mL;肺泡灌洗液GM实验5.51。外周血淋巴细胞亚群:总T淋巴细胞计数0.448×109/L,辅助/诱导性T淋巴细胞计数0.287×109/L,抑制/细胞毒性T淋巴细胞计数 0.154×109/L。外周血CMV DNA 2589 copies/mL。血清PCT、肝炎病毒、HIV、梅毒、甲乙流感病毒、呼吸道合胞病毒、腺病毒、人鼻病毒、支原体、结核分枝杆菌及耐药基因检测、EBV DNA、结核分枝杆菌DNA均无异常。BALF mNGS结果示烟曲霉、耶氏肺孢子菌、CMV拷贝数高丰度表达。BALF荧光染色见丝状真菌菌丝,培养出烟曲霉。
胸部CT(图7):右侧胸腔内见引流管影,右侧少许气胸,肺组织被压缩小于5%。双肺气肿、肺大泡,部分间质性改变,双肺感染较前明显,右侧少量胸腔积液。加用克林霉素1.2g/d,胸腺法新4.8mg/周,丙种球蛋白400mg/kg/周。
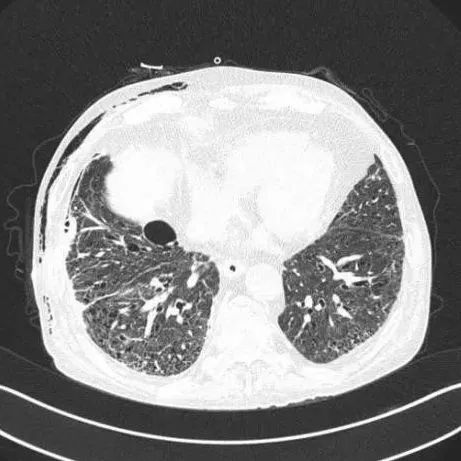
图7 右侧胸腔内见引流管影,少许气胸,肺组织被压缩小于5%
【2023-05-12】 患者晨起一过性畏寒、发热,Tmax39.1℃。引流出黄色稍浑浊胸水约100ml。BP100/60mmHg,双肺呼吸音稍粗,少许湿罗音。BALF培养出烟曲霉。血常规LYM 0.63×109/L,血清hsCRP 125.2 mg/L。
【2023-05-15】 患者咳少许白痰,无喘息,昨日引流出黄色胸水约50ml,未发热。BP130/70mmHg,双肺呼吸音粗,下叶闻及少许湿罗音。血常规LYM 0.69×109/L;血清hsCRP 130 mg/L、G实验82.05 pg/mL、IL-6 76.91 pg/mL、铁蛋白1103.0 ng/ml。外周血淋巴细胞亚群:总T淋巴细胞计数0.485×109/L,辅助/诱导性T淋巴细胞计数0.277×109/L,抑制/细胞毒性T淋巴细胞计数0.203×109/L,CD3+PD-1+(程序性死亡受体-1)T细胞82.4%,CD4+PD-1+ T细胞86.6%。胸水细胞因子:IL-6>5000pg/mL,IL-8>7500pg/mL,IL-1β389pg/mL,TNF-α69.3pg/mL,IL-10 34.5pg/mL;胸水生化:腺苷脱氨酶22.4 U/L,乳酸脱氢酶1207 IU/L,总蛋白24.7g/L,葡萄糖3.1mmol/L。胸水淋巴细胞亚群:CD3+ T细胞计数0.737×109/L,CD4+ T细胞计数 0.355×109/L,CD3+PD-1+ T细胞78.3%,CD4+PD-1+ T细胞75.8%。
【2023-05-22】 患者近2日间断低热,咳痰不畅。BP120/80mmHg,双肺呼吸音粗,双下肺少许湿罗音。血常规LYM 1.04×109/L;血清hsCRP 170.7 mg/L、乳酸脱氢酶376 U/L、IL-6 36.02 pg/mL。
【2023-06-01】 患者未发热,咳白痰。夹闭胸管24小时后复查肺CT,未见气胸。放开胸管引流出淡黄色稍浑浊胸水约5ml。双肺呼吸音稍粗,未闻及啰音。胸腔积液培养未见真菌,拔除胸管。BALF mNGS:肺炎克雷伯菌。加用头孢哌酮/舒巴坦联合左氧氟沙星,继续POS联合CAS抗真菌治疗。血常规LYM 0.81×109/L,血清hsCRP 19.9 mg/L。外周血淋巴细胞亚群:总T淋巴细胞计数0.779×109/L,辅助/诱导性T淋巴细胞计数0.481×109/L,CD3+PD-1+ T细胞28.4%,CD4+PD-1+ T细胞14.2%。胸水淋巴细胞亚群:CD3+ T细胞计数4.866×109/L,CD4+ T细胞计数 2.818×109/L,CD3+PD-1+ T细胞61.7%,CD4+PD-1+ T细胞56.1%。胸水细胞因子:IL-6 510.04pg/mL,IL-8 3408 pg/mL,IL-1β 73.6pg/mL,TNF-α 15.8 pg/mL,IL-10 5.5pg/mL;胸水生化:腺苷脱氨酶 2.5 U/L,乳酸脱氢酶192 IU/L,总蛋白4.0g/L,葡萄糖1.3mmol/L。抗真菌治疗方案调整为口服特比奈芬250mg/d联合泊沙康唑0.3 g/d(6.7-7.7)。
【2023-06-14】 患者咳嗽好转,无喘息,未发热。双肺呼吸音稍低,未闻及啰音。血常规LYM 1.03×109/L,血清hsCRP 7.0 mg/L。胸部CT(图8):双肺感染较前吸收,肺组织被压缩小于3%,双肺气肿、肺大泡,部分间质性改变,右侧少量胸腔积液较前减少。
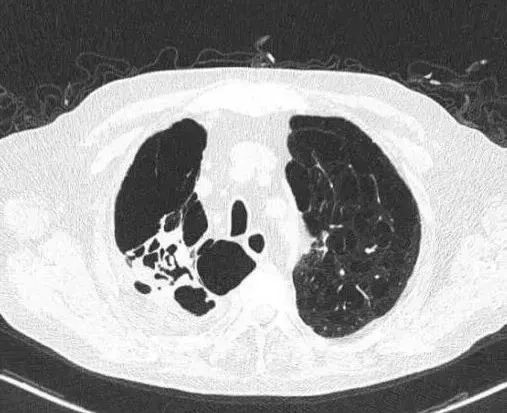
图8双肺感染较前吸收,肺组织被压缩小于3%
【2023-7-8】患者序贯口服特比萘芬联合泊沙康唑抗真菌治疗一个月后停药复诊。自述咳少许白痰,无喘息,未发热,复查痰培养无细菌及真菌生长。其后每月电话随访,自述停用抗真菌药物后无不适。
三、讨论分析
1、感染的诱发因素
1)新冠肺炎后的液气胸导致局部结构改变
自发性液气胸的发生是新冠肺炎后遗症,由小气道破裂引起。新冠肺炎后,患者局部组织出现不可逆损伤,破坏组织屏障功能,为各种微生物感染提供了先决条件。
2)长期使用皮质类固醇激素
gracilis小囊菌常在体外(自然环境)或体内(肺部)定植,作为胸腔帚霉/小囊菌属感染中最具代表性的病原体,极少引起人类致病,在有限的病例中能引起难治性和致死性的播散感染,这种机会性感染主要发生在免疫功能低下的患者中,最严重的感染发生在实体器官移植患者中,尤其是肺移植患者。本例患者长期使用皮质类固醇治疗肾病综合征可能会抑制免疫力,导致机会性感染。
3)使用唑类抗真菌药物预防性治疗
感染病例中有超过60%的患者使用唑类药物进行预防性治疗。抗真菌药物的选择性压力也是导致条件致病真菌感染的原因之一。
4)肺孢子菌肺炎和CMV感染
肺孢子菌肺炎最常发生在免疫功能低下的宿主中,特别是使用皮质类固醇激素和CMV感染。肺孢子菌肺炎合并CMV感染可能导致造血细胞移植(HCT)和实体器官移植(SOT)受体的免疫系统进一步破坏。综合文献分析,所有胸腔感染帚霉/小囊菌属的病例中共有42.9%的SOT患者证实有CMV感染。值得注意的是,该例患者在使用皮质类固醇激素后,出现外周血淋巴细胞数长期在低位波动(图9)。外周血和胸水的流式细胞术分析证实该患者发生淋巴细胞耗竭,可能是因为CMV破坏宿主免疫防御系统,从而导致宿主无法有效控制感染。
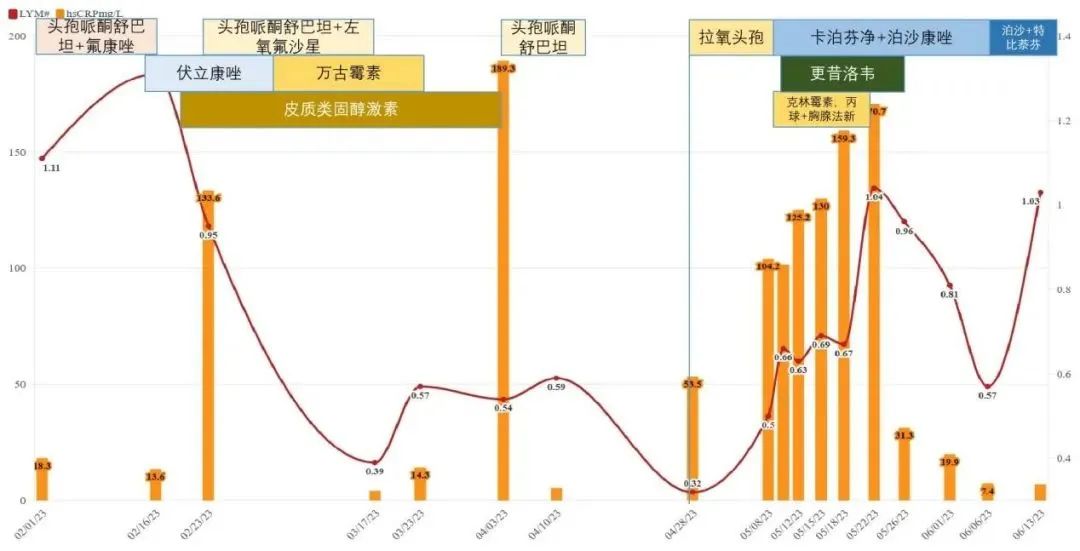
图9 外周血淋巴细胞绝对值与超敏CRP在治疗过程中发生的变化
5)外部环境的污染
帚霉/小囊菌角膜炎是由于角膜移植中供体角膜保存液被污染而导致感染。帚霉/小囊菌肺炎有些是从事农作物加工的免疫正常人通过外伤或吸入性感染,或肺移植供体受污染引起,帚霉/小囊菌通过导管部位的创口进入血管,移植到受体后发生播散感染。
2、立体化治疗
1)抗真菌治疗
由于抗真菌药物对胸膜腔的渗透程度不同,真菌性脓胸的治疗并无标准方案可以参考,而且根据体外药敏结果,目前所有的一线抗真菌药物都对帚霉/小囊菌属有高MIC值,目前缺乏药物作用该类真菌的体内和体外相关性研究,也没有足够的数据将MIC值与临床结果相关联。有学者证实了POS和TEB,POS和CAS或AMB和CAS的组合体外具有协同作用。有机构推荐使用脂质体AMB(3-10 mg/kg/天)联合VRC,或单独使用VRC(静脉注射后口服序贯治疗)。CAS、POS 和 TRB 组合对gracilis小囊菌的FICIs范围为 0.321至0.320,说明体外三药联合对gracilis小囊菌感染有效。
其他治疗方法包括雾化吸入米卡芬净治疗帚霉/小囊菌感染的气管/支气管炎,也有使用手术、抗真菌药物三联疗法和粒细胞集落刺激因子多方法联合的治疗手段。此外,目前处于后期临床开发的奥洛米特类研究性抗真菌药物olorofim(前称F901318)对大多数帚霉/小囊菌菌株表现出良好的体外活性,MIC为0.03 mg/L,MIC090为0.125 mg/L。本例免疫抑制患者最初接受CAS联合POS治疗,当症状和关键生物学指标得到改善时,口服POS联合TRB作为序贯治疗直至痊愈。
2)减少侵袭真菌持续播散能力
对于肺部、眼部、皮肤及皮下组织等局部组织感染,手术清创是必不可少的。而对于各种原因置管患者发生侵袭性感染,需要立即拔除导管或者在远离感染端重新置管。这两种治疗手段的目的就是极大可能减少局部侵袭真菌的感染当量,同时避免通过坏死组织侵袭血管,导致不可逆的血行播散感染。
3)抗病毒和免疫调节治疗
免疫抑制患者在感染的进展期,耗竭的T细胞中PD-1持续升高;当抗病毒联合使用丙种免疫球蛋白和胸腺法新后,外周血及胸水中T细胞数量显著升高,PD-1、IL-6、腺苷脱氨酶、乳酸脱氢酶等指标显著降低,T细胞耗竭状态得到缓解,患者感染症状得到有效控制。
总之,新冠肺炎后液气胸、肾病综合征、类固醇性糖尿病、免疫抑制治疗、唑类药物的预防性使用、耶氏肺孢子菌肺炎、巨细胞病毒血症和留置导管的不正确处置都可能是本例gracilis小囊菌感染的致病因素。幸运的是,该例患者受益于多学科立体化模式的诊疗,包括逆转或减轻诱发因素,早期联合使用抗真菌药物,及时进行抗病毒和免疫调节治疗,有效地阻止这类罕见真菌的播散性感染。随着医疗科技的日新月异,特别是真菌荧光染色技术和MOLDI-TOF MS鉴定技术已经成为微生物工作者必不可少的工具,国产质谱仪海量的数据库资源是快速鉴别这种罕见病原真菌的关键。我们期望通过对本例侵袭性gracilis小囊菌胸腔感染的梳理能对广大临床医生和微生物学专家提供一点思路和启示。
参考文献
1.Sundaralingam A, Banka R, Rahman NM. Management of pleural infection. Pulm Ther. 2021;7(1):59-74.
2.Hassan M, Cargill T, Harriss E, et al. The microbiology of pleural infection in adults: a systematic review. Eur Respir J. 2019;54(3):1900542.
3.Hassan M, Patel S, Sadaka AS, et al. Recent insights into the management of pleural infection. Int J Gen Med. 2021;14:3415-3429.
4.Pérez-Cantero A, Guarro J. Current knowledge on the etiology and epidemiology of Scopulariopsis infections. Med Mycol. 2020;58(2):145-155.
5.Woudenberg JHC, Meijer M, Houbraken J, Samson RA. Scopulariopsis and scopulariopsis-like species from indoor environments. Stud Mycol. 2017;88:1-35.
6.Sandoval-Denis M, Gené J, Sutton DA, et al. Redefining microascus, Scopulariopsis and allied genera. Persoonia. 2016;36:1–36.
7.Sandoval-Denis M, Sutton DA, Fothergill AW, et al. Scopulariopsis, a poorly known opportunistic fungus: spectrum of species in clinical samples and in vitro responses to antifungal drugs. J Clin Microbiol. 2013;51(12):3937-3943.
8.Kumar R, Mishra N. Lung decortication for spontaneous hydropneumothorax in post COVID patients: A case series. Perioper Care Oper Room Manag. 2022;29:100279.
9.Patel VM, Patel SV, Singletary K, Pacheco L. Recurrent hydropneumothorax after COVID-19. Cureus. 2023;15(3):e36208.
10.Yao L, Wan Z, Li R, Yu J. In vitro triple combination of antifungal drugs against clinical Scopulariopsis and Microascus species. Antimicrob Agents Chemother. 2015;59:5040–5043.
11.Ding Y, Steed LL, Batalis N. First reported case of disseminated Microascus gracilis infection in a lung transplant patient. IDCases. 2020; 22:e00984.
12.Wuyts WA, Molzahn H, Maertens J et al. Fatal Scopulariopsis infection in a lung transplant recipient: a case report. J Heart Lung Transplant. 2005;24:2301–2304.
13.Miossec C, Morio F, Lepoivre T et al. Fatal invasive infection with fungemia due to Microascus cirrosus after heart and lung transplantation in a patient with cystic fibrosis. J Clin Microbiol. 2011;49:2743–2747.
14.Shaver CM, Castilho JL, Cohen DN, et al. Fatal Scopulariopsis infection in a lung transplant recipient: lessons of organ procurement. Am J Transplant. 2014;14:2893–2897.
15.Huang L, Chen W, Guo L, et al. Scopulariopsis/Microascus isolation in lung transplant recipients: a report of three cases and a review of the literature. Mycoses. 2019;62(10):883-892.
16.Gao B, Guo L, Zhao L, et al. Case Report of a Successfully Treated Scopulariopsis Infection in a Bilateral Lung Transplant Recipient. Exp Clin Transplant. 2023;21(3):275-278.
17.Paredes K, Capilla J, Mayayo E, Guarro J. Virulence and resistance to antifungal therapies of Scopulariopsis species. Antimicrob Agents Chemother. 2016;60(4):2063-2068.
18.Lamoth F, Chung SJ, Damonti L, Alexander BD. Changing epidemiology of invasive mold infections in patients receiving azole prophylaxis. Clin Infect Dis. 2017;64:1619–1621.
19.Jenks J, Reed SL, Seidel D, et al. Rare mold infections caused by Mucorales, Lomentospora prolificans and Fusarium, San Diego: the role of antifungal combination therapy. Int J Antimicrob Agents. 2018;52:706-712.
20.Apostolopoulou A, Fishman JA. The pathogenesis and diagnosis of Pneumocystis jiroveci pneumonia. J Fungi (Basel). 2022;8(11):1167.doi:10.3390/jof8111167.
21.Gea-Banacloche, J.,Komanduri, K., Carpenter, P., et al. National institutes of health hematopoietic cell transplantation late effects initiative: the immune dysregulation and pathobiology working group report. Biol Blood Marrow Transplant. 2017;23(6),870–881.
22.Swick BL, Reddy SC, Friedrichs A, Stone MS. Disseminated Scopulariopsis–culture is required to distinguish from other disseminated mould infections. J Cutan Pathol. 2010;37(6):687-691.
23.Helander L, Stark M. Fatal Scopulariopsis brumptii in a pediatric immunocompromised host. Fetal Pediatr Pathol. 2017;36(1):82-86.
24.E. J. Wherry. T cell exhaustion. Nature Immunology. 2011;12(12):492-499.
25.Zheng M, Gao Y, Wang G, et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol Immunol. 2020;17(5):533-535.
26.Wilde C, Messina M, Moshiri T, Snape SE, Maharajan S. Interface Scopulariopsis gracilis fungal keratitis following Descemet’s stripping automated endothelial keratoplasty (DSAEK) with a contaminated graft. Int Ophthalmol. 2018;38(5):2211-2217.
27.Sellami A, Boudaya S, Makni F, et al. Disseminated infection by Scopulariopsis brevicaulis. J Mycol Med. 2003;13:203-206.
28.Chen-Scarabelli C, Scarabelli TM. Fungal Endocarditis due to Scopulariopsis. Ann Intern Med. 2003;139(9):W77.
29.Celard M, Dannaoui E, Piens MA, et al. Early Microascus cinereus endocarditis of a prosthetic valve implanted after Staphylococcus aureus endcarditis of the native valve. Clin Infect Dis. 1999;29:691–692.
30.Steinbach WJ, Schell WA, Miller JL, Perfect JR, Martin PL. Scopulariopsis brevicaulis infection in a perdiatric stem-cell transplant patient treated with voriconazole and caspofungin and a review of Scopulariopsis infections in immunocmpromised patients. J Infect. 2004;48:112–116.
31.Skóra M, Bulanda M, Jagielski T. In vitro activities of a wide panel of antifungal drugs against various Scopulariopsis and Microascus species. Antimicrob Agents Chemother. 2015;59:5827–5829.
32.Matsuda T, Koreeda Y, Mataki H, et al. A case of Aspergillus empyema successfully treated with combination therapy of voriconazole and micafungin: excellent penetration of voriconazole and micafungin into pleural fluid. Intern Med. 2010;49(12):1163-1169
33.Salmanton-García J, Koehler P, Kindo A, et al. Needles in a haystack: extremely rare invasive fungal infections reported in FungiScope®-global registry for emerging fungal infections. J Infect. 2020;81:802–815.
34.Cuenca-Estrella M, Gomez-Lopez A, Buitrago MJ, et al. In vitro activities of 10 combinations of antifungal agents against the multiresistant pathogen Scopulariopsis brevicaulis. Antimicrob Agents Chemother 2006;50:2248–2250.
35.Bupha-Intr O, Butters C, Reynolds G, et al. Consensus guidelines for the diagnosis and management of invasive fungal disease due to moulds other than Aspergillus in the haematology/oncology setting, 2021. Intern Med J. 2021;51(Suppl 7):177-219.
36.Los-Arcos I, Berastegui C, Martín-Gómez MT, et al. Nebulized micafungin treatment for Scopulariopsis/Microascus tracheobronchitis in lung transplant recipients. Antimicrob Agents Chemother. 2021;65(6):e02174-20.
37.Ustun C, Huls G, Stewart M, Marr KA. Resistant Microascus cirrosus pneumonia can be treated with a combination of surgery, multiple anti-fungal agents and a growth factor. Mycopathologia. 2006,162(4):299-302.
38.Wiederhold NP, Patterson HP, Sanders CJ, Cañete-Gibas C. Dihydroorotate dehydrogenase inhibitor olorofim has potent in vitro activity against Microascus/Scopulariopsis, Rasamsonia, Penicillium and Talaromyces species. Mycoses. 2023;66(3):242-248.
专家介绍

胡志敏
武汉大学医学硕士,副主任技师。从事感染性疾病的实验室诊断、临床真菌学检验20余年。2014年北京协和医院进修微生物学检验;2016-2017年美国俄亥俄州立大学医学中心和俄亥俄州泛美儿童医院实验诊断中心访问学者。2022年国家卫健委二级实验室骨干人员。中国中西医结合学会检验医学专业委员会感染疾病实验诊断专家委员会委员;湖北省科技厅科研项目评审专家;武汉市医疗事故鉴定专家。主持省市级临床科研项目4项,第一作者发表SCI及北大核心期刊论文20余篇,参编国家级专著4本,国家发明专利1项,曾获得“湖北省优秀本科生毕业论文带教老师”。
作者:胡志敏1 毛莉娜2 邓体瑛3 苏斌涛1 阳义4 董碧麟5 徐清2 杨硕2
单位:1武汉市第一医院检验科微生物室;2武汉市第一医院呼吸与重症医学科;3 武汉市第一医院药学部;4 武汉市第一医院放射影像科;5 皮肤感染和免疫湖北省重点实验室
审校:黄金伟(丽水市人民医院呼吸与危重症医学科)
本文转载自订阅号「京港感染论坛」
原链接戳:【病例讨论】隐匿的“美丽杀手”——1例gracilis小囊菌胸腔感染病例报道
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


