第一次成功的肺癌手术案例(1933年 JAMA)
今天主要站在外科医生的角度谈谈肺癌。1933年,Evarts A. Graham教授对一名患有肺鳞状细胞癌的患者进行了左全肺切除术,并将文章发表在《美国医学会杂志》(JAMA)。Evarts A. Graham教授是非常著名的胸外科医生,这也是世界上第一例应用外科手段治疗肺癌的病例。1933年距离现在已经过去了将近90年,可见那时开展一例肺癌的外科手术是件非常了不起的事情。

Evarts A. Graham教授
做全肺切除术的这个病人存活下来,没有复发,文章发表得也很好。但后来又做了19例全肺切除术,手术结果都不是很成功,文章也没再发表。并且作者本人最终死于肺癌。
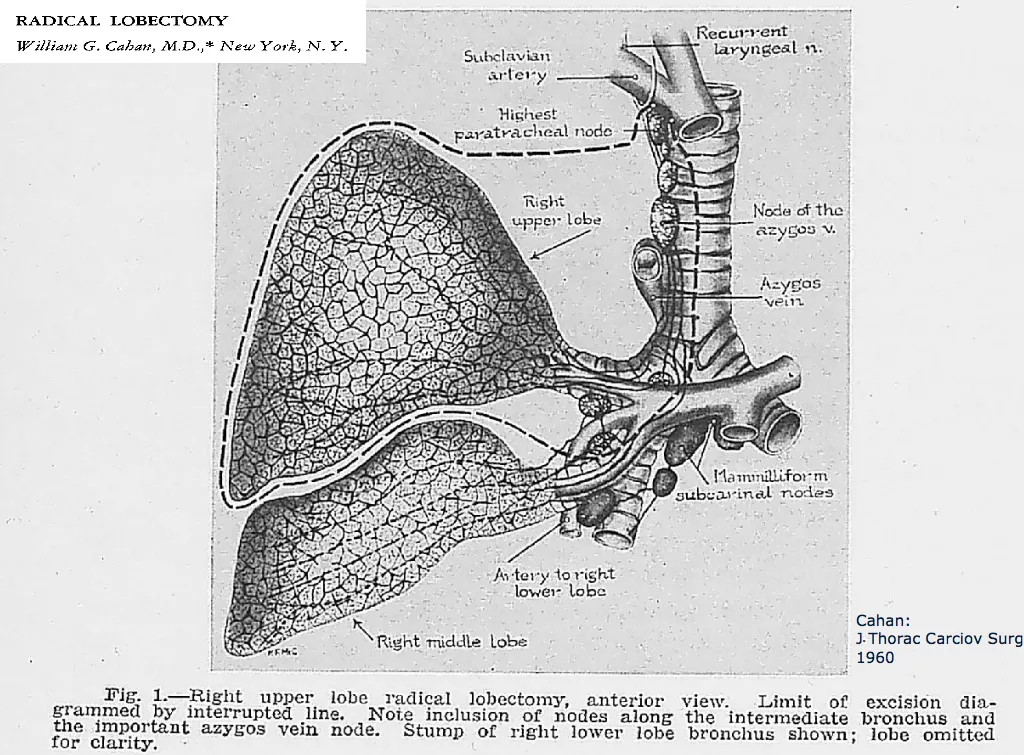
上世纪60年代,手术治疗肺癌已不再行全肺切除术,而是肺叶切除加淋巴结清扫术,全肺切除术已不是最佳选择。
胸腔镜的原理机制
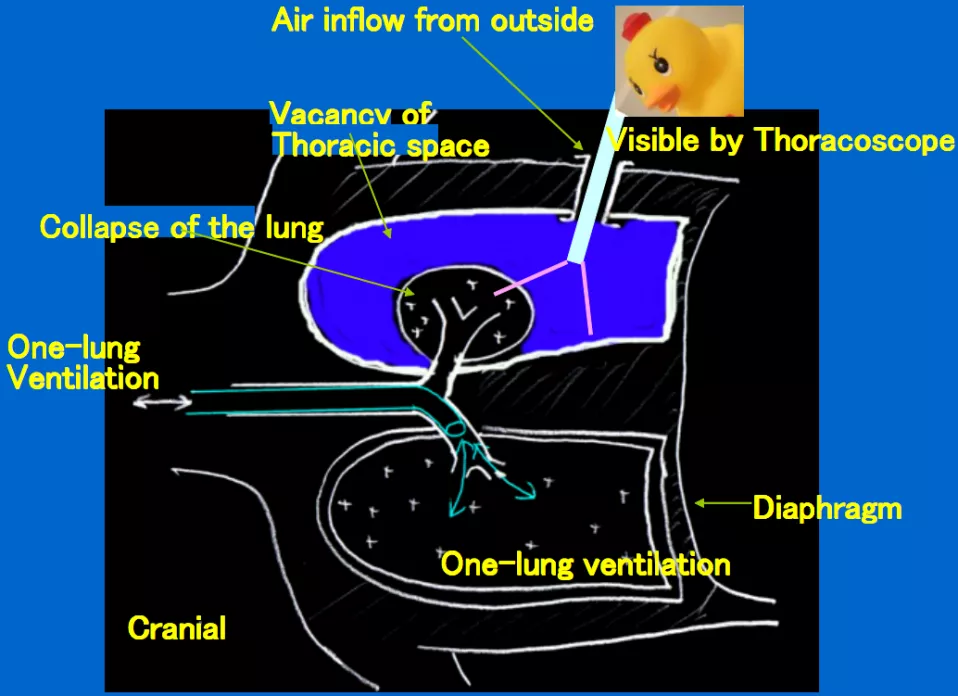
上世纪90年代,开始发展胸腔镜,也称为胸部微创外科手术,实际上准确的概念就是胸腔镜手术。

最早是在胸腔上打四个孔做手术,后来标准的胸腔镜是打三个孔做手术,逐步开展了双孔、单孔胸腔镜技术。现在不论打几个孔,都没有大切口了。
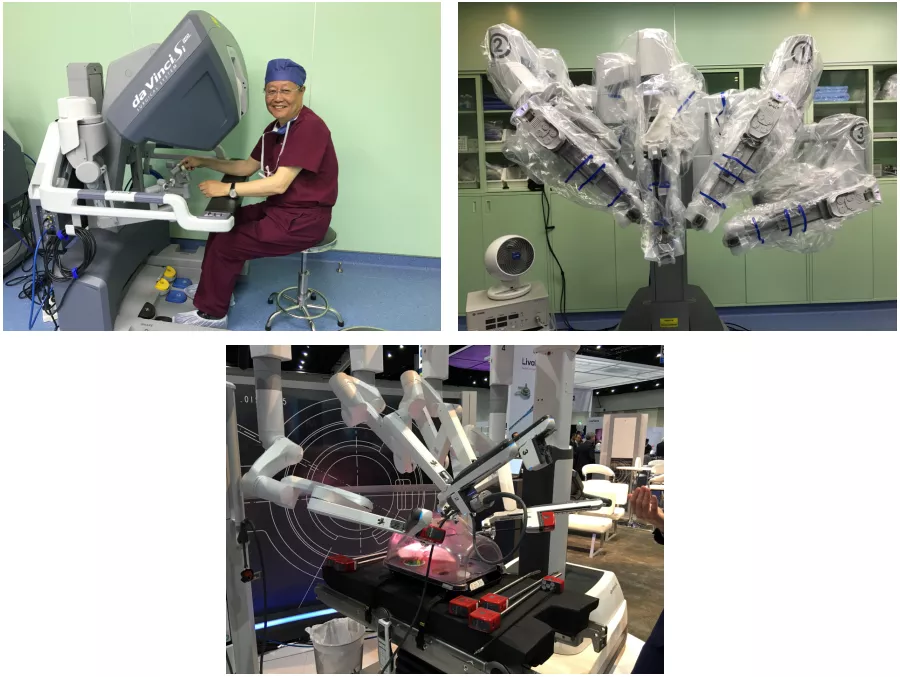
现在又发展了机器人肺癌手术,这种手术还需要打四个孔。
外科手术与科学和艺术
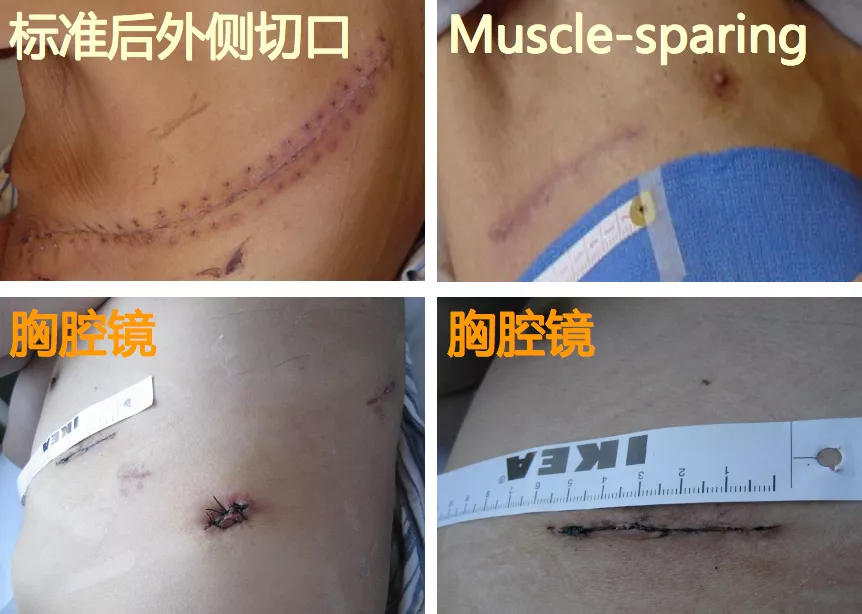
上面的两张图片不是我们做外科手术的图片,现在很难找到这种大切口的图片了,做肺移植都不会有这么大的切口。下面的两张图片是我们科做的手术。现在不管是三个孔还是一个孔,切口都很小,大概3~4cm。所以现在进入了微创时代。
抛开致癌因素来说,我个人认为早期发现肺癌有两大原因。第一,人口老龄化,如果把年龄因素去掉的话,肺癌的增长速度看起来并没那么迅速;第二,CT的普及,在北京做一个胸部CT大概121元。因为薄层CT的普及,我们会发现很多早期肺癌,也就是说发现了许多肺小结节,但是肺小结节绝不等同于肺癌。
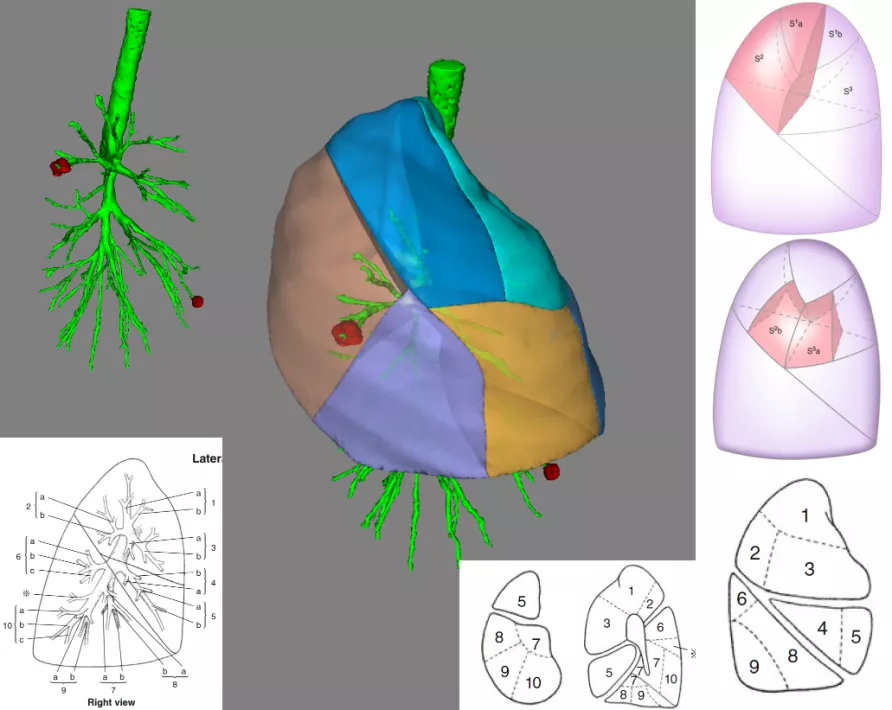
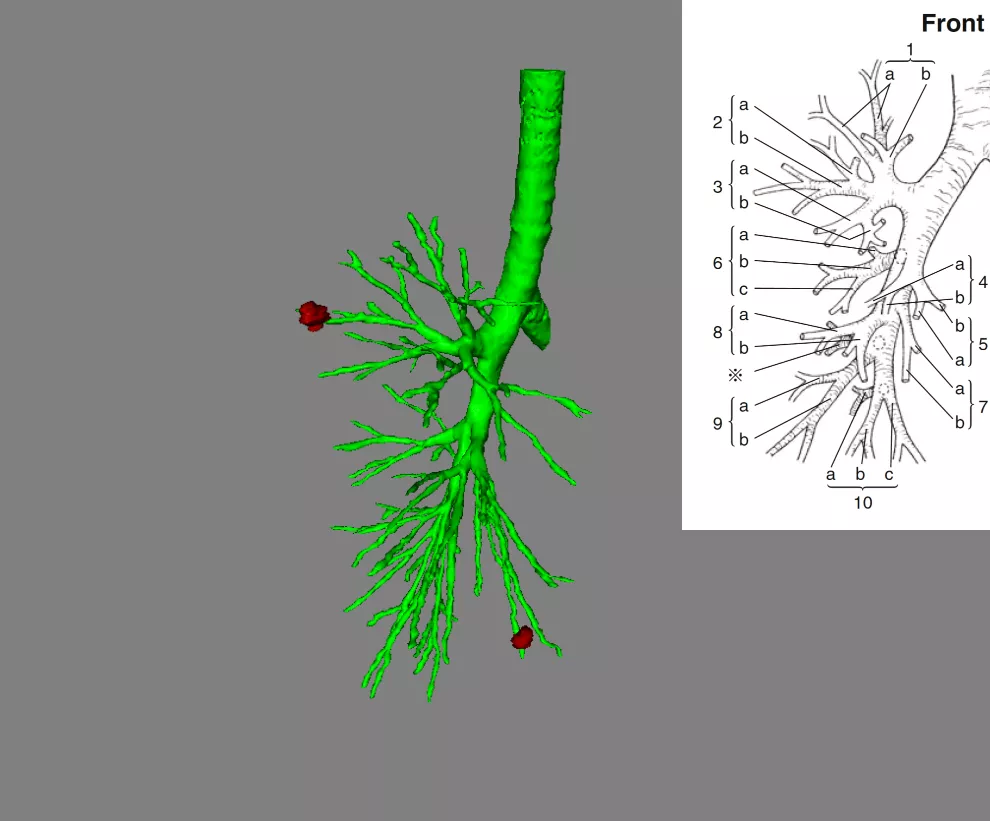
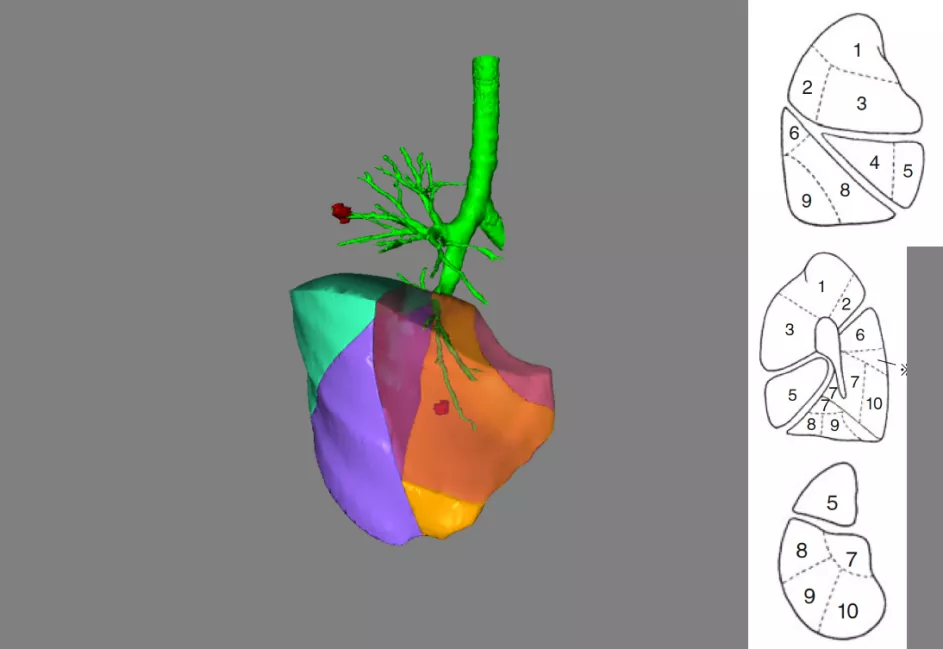
上图所示,现在不但做CT,还能做CT三维成像。通过CT三维成像可以看到小结节位于肺的哪个段。肺癌的外科手术刚开始是全肺切除术,发展到肺叶切除术,再发展到肺段和亚肺段切除术,更加精确切除。如果没有影像学的进步,外科医生是不可能实现的,因为你发现不了这么小的结节,这么早期的肺癌,也不可能通过精确定位找到肺小结节。
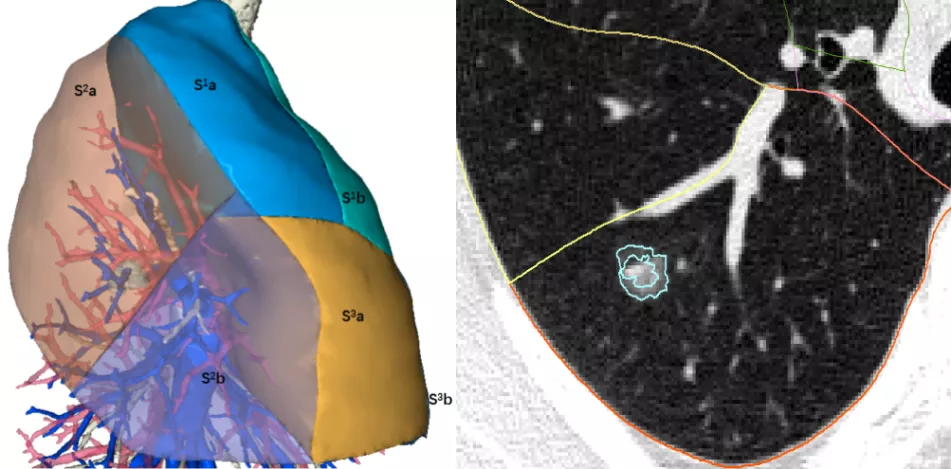
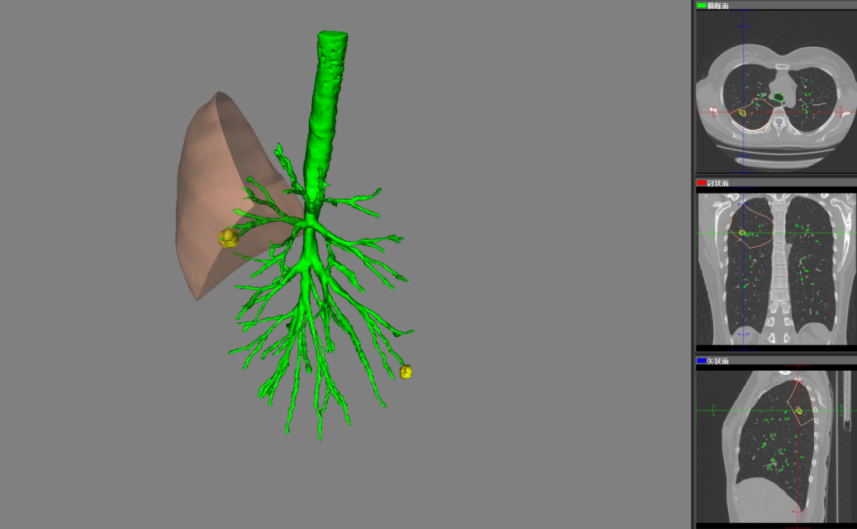
上图所示,在CT上发现一个结节,再精确定位。可以随便剪裁,把气管、血管或者动脉剪掉,用不同的颜色标清不同的肺段,结节的位置也看得很清楚。无论是胸腔镜手术,还是机器人肺癌手术,外科医生就知道准确地切除哪段或者哪个亚段。

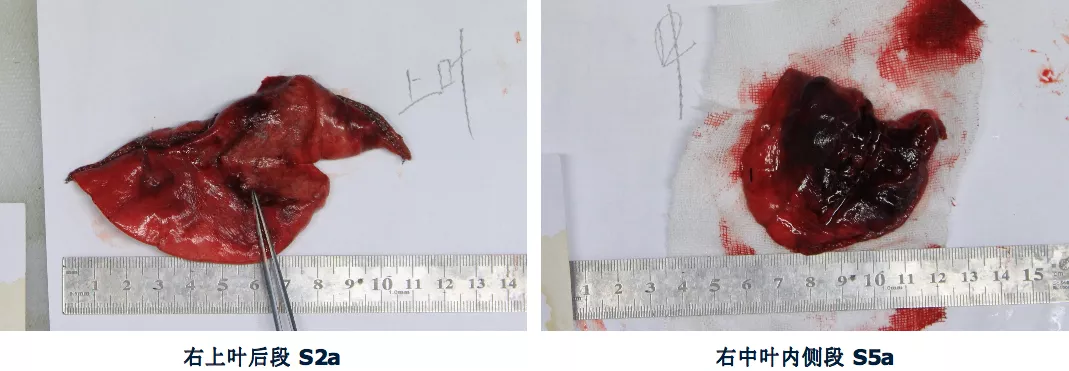
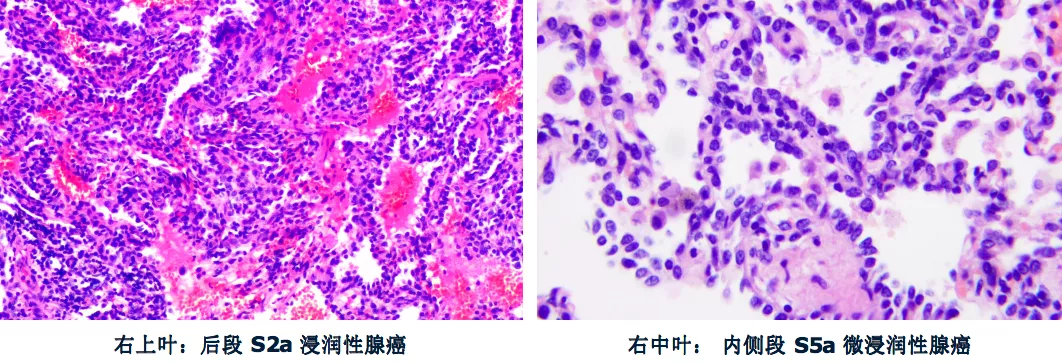
这是手术切除后的标本:
这是为期10年(2001年~2011年)的CT检查照片:
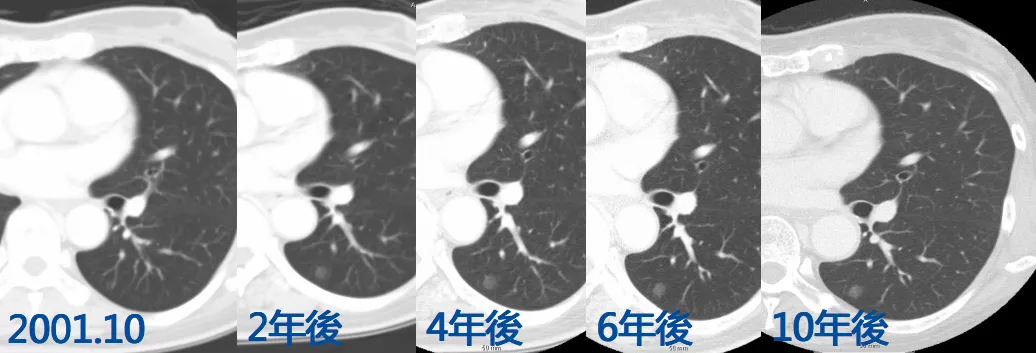
2001年左肺下叶的小结节非常小,10年后稍微长大了一点,手术切除后为腺癌。给大家展示这组图片是因为总有病人询问,像第一张图片的小结节会不会是肺癌,我不能告诉他不是肺癌,但是我可以告诉他这个结节并不可怕。对于是否要做手术切除,如果10年前做手术切除,10年生存率没有问题,现在切除了,往后10年生存率依旧没有问题。由此可以断定这种肺癌是惰性的。
新分类肺腺癌的组织学特点

现在新分类肺腺癌的组织学特点更加详细。比如不典型腺瘤样增生(AAH)、原位癌(AIS)、微浸润腺癌(MIA)这三种肺癌从病理角度来说,发展得非常缓慢。附壁生长为主的浸润性腺癌发展的也比较缓慢。但是实性、微乳头成分高、气腔转移的这三种病理类型出现的话,会比较险恶。
腺瘤样不典型增生 AAH
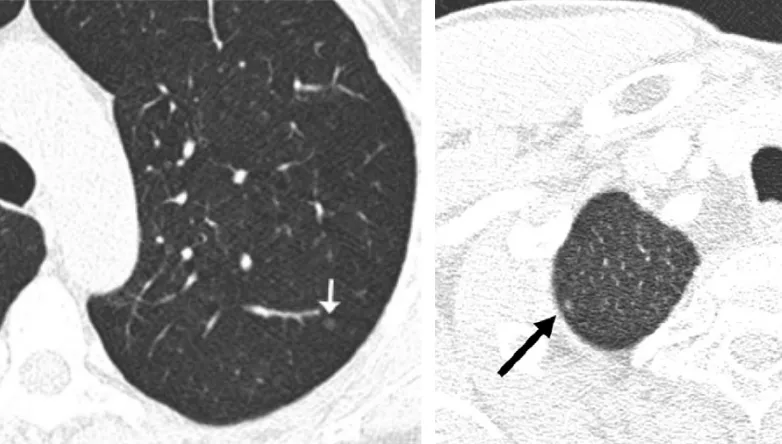
手术切除后病理结果为AAH,现在归类为腺癌,过去我们管它叫癌前病变。
浸润前病变-原位癌AIS
5mm左右纯磨玻璃结节,临近胸膜,病理原位癌。原位癌应用楔形切除术就可以。过去也把原位癌称为癌前病变,其实它也是浸润前病变。
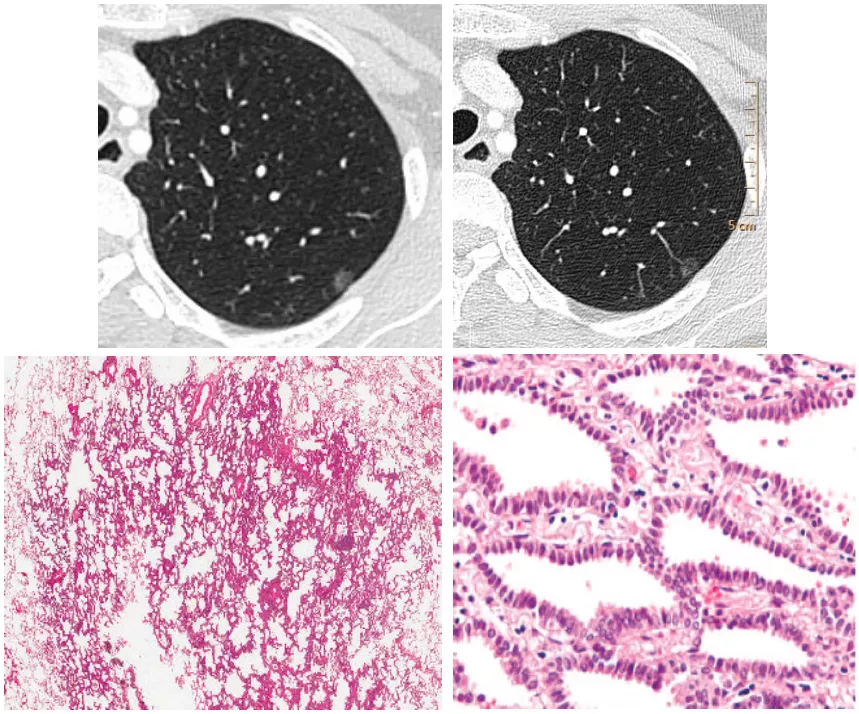
微浸润腺癌-MIA

部分实性磨玻璃结节,中心有实性成分,直径小于5mm。MIA的手术效果非常好,不必做肺叶切除。
浸润性腺癌-Lepidic predominant
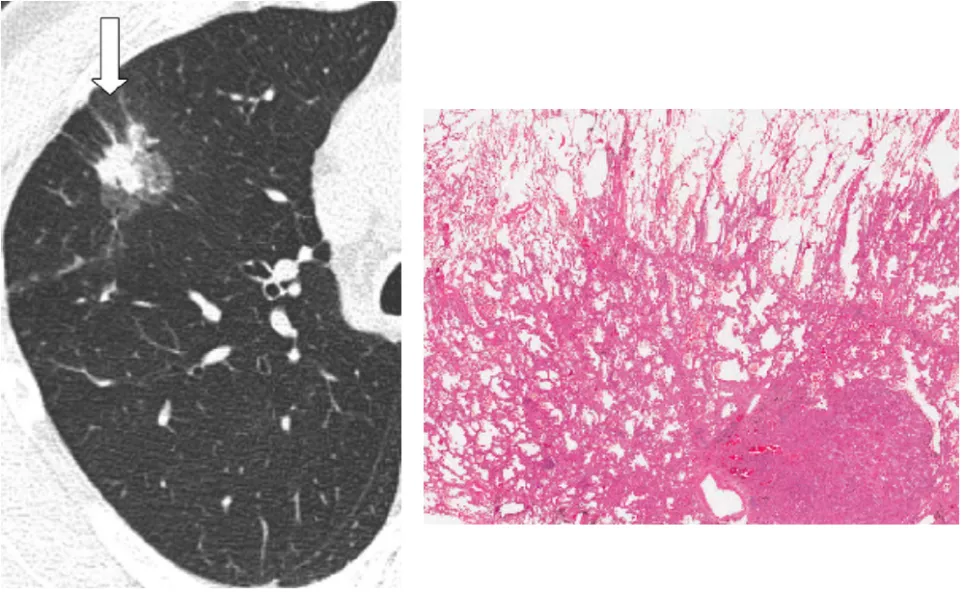
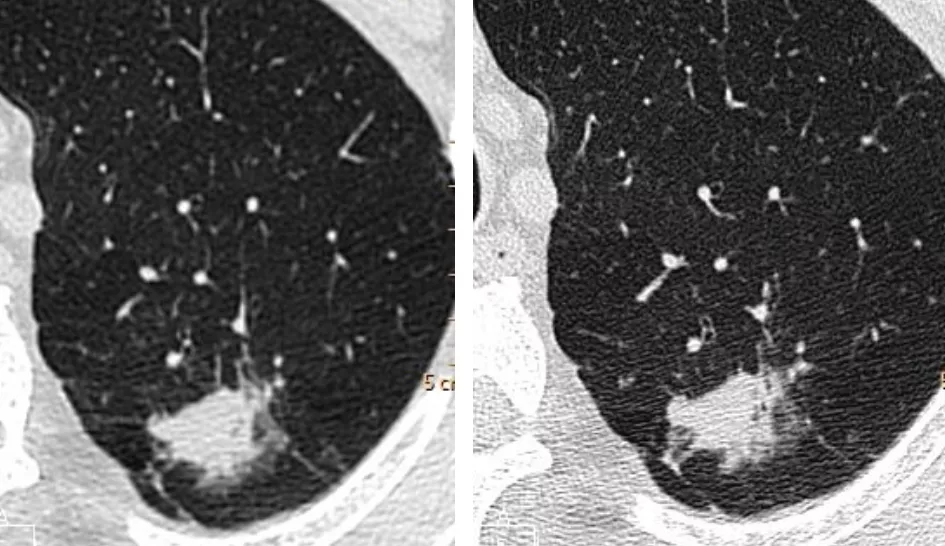
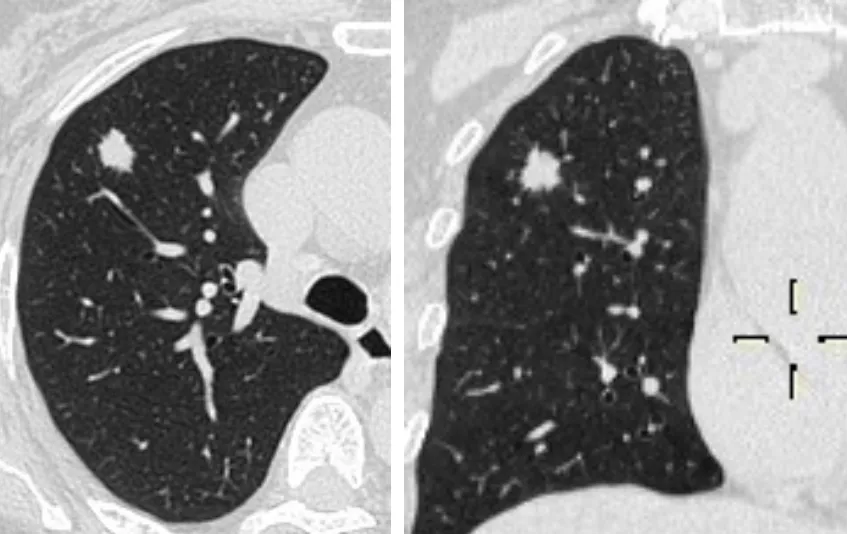
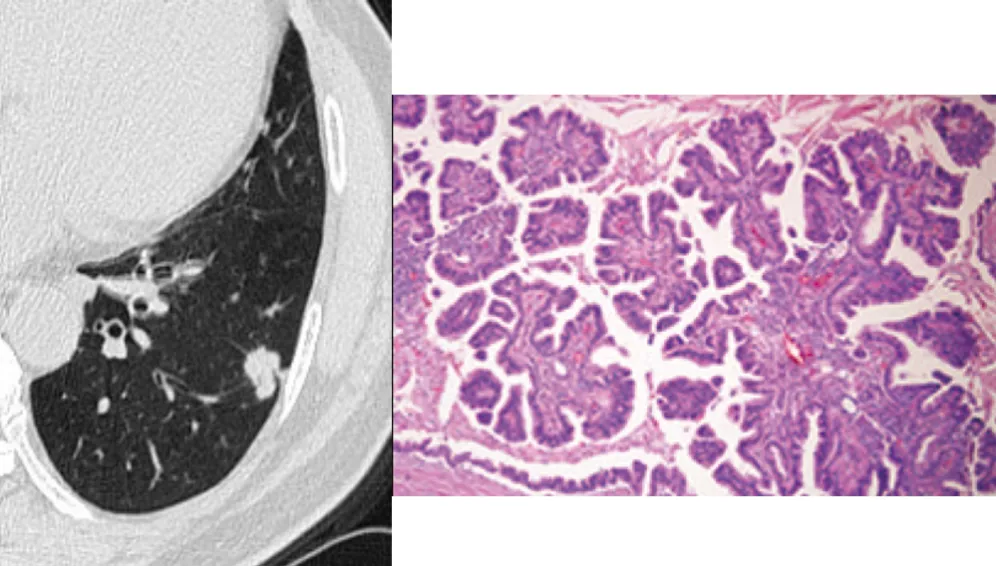
如果是附璧生长为主的浸润癌,手术效果非常好;如果是实性的、微乳头成分高的浸润癌,手术效果不佳。
我们再来看看囊腔

男,51岁,右肺上叶浸润性腺癌,实性结节位于囊腔外部,形态学分型为Ⅰ型。病变边缘见分叶,囊腔内可见分隔。

女,64岁,左肺下叶浸润性腺癌,实性结节位于囊腔内部,形态学分型为Ⅱ型。病变形态不规则,边缘见分叶,囊腔内可见分隔,周围可见胸膜牵拉征。
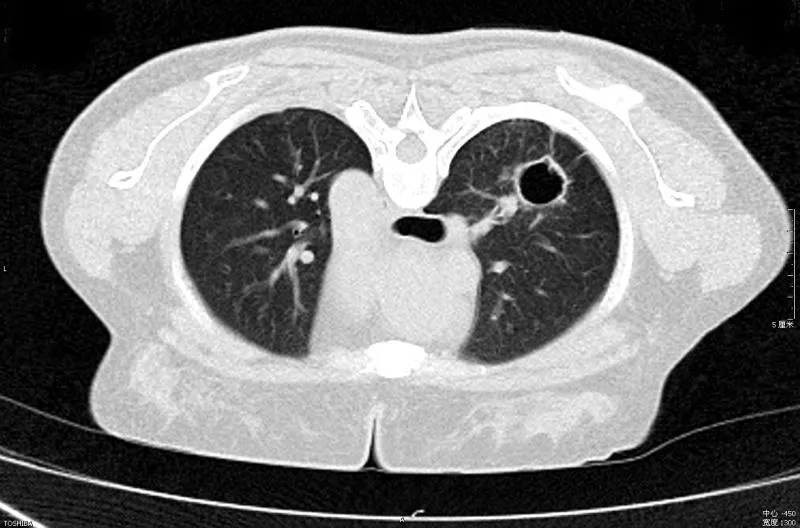
女,55岁,右肺上叶腺癌,囊壁环形增厚,形态学分型为Ⅲ型。病变形态呈类圆形,边缘可见毛刺征。
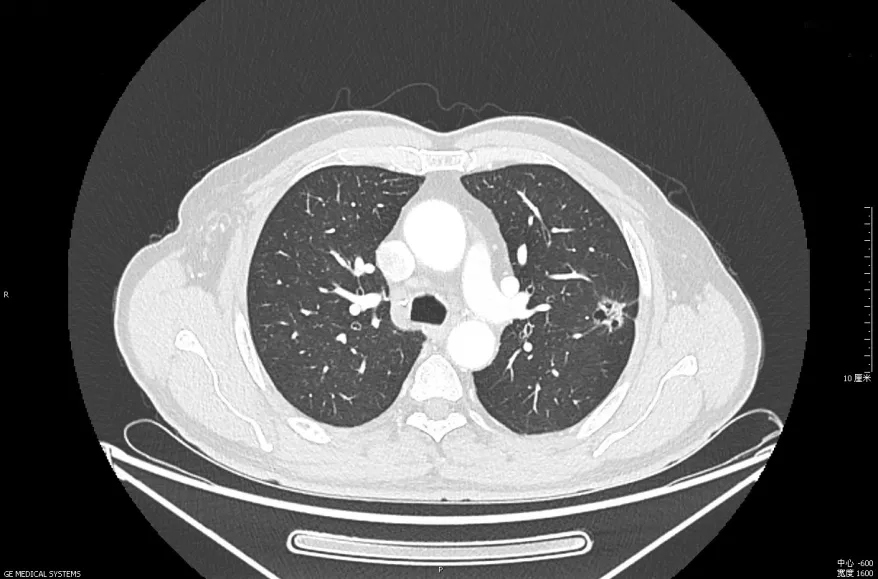
男,65岁,左肺上叶浸润性腺癌,多房囊腔,形态学分型为Ⅳ型。病变形态不规则,边缘可见分叶征及毛刺征,周围可见胸膜牵拉征。大家不要把这些误认为不是肺癌。
薄壁空洞型肺癌的形态学分型
研究结果:
厚壁空洞型腺癌有更大的肿瘤组织、且多为实性。
厚壁空洞型肺腺癌更倾向于实体为主性浸润性腺癌。
薄壁空洞型腺癌有更多的吸烟史、更大的空洞。
薄壁空洞型肺腺癌更倾向于附壁为主型浸润性腺癌。
一名76岁的女性有在右上叶检测到GGN
我们见到的这些小结节,通过影像学甄别怀疑是早期肺癌,还要做全肺切除吗?显然不是,60年代就否定了这种做法。现在NCCN指南并没有否定肺叶切除加淋巴结清扫术,但是一个小病灶一定要做肺叶切除吗?能不能肺段切除?
肺GGN和亚肺叶热点问题
1临床研究——文献
结节大小对NSCLC患者预后的影响:节段切除术作为小范围切除术的作用

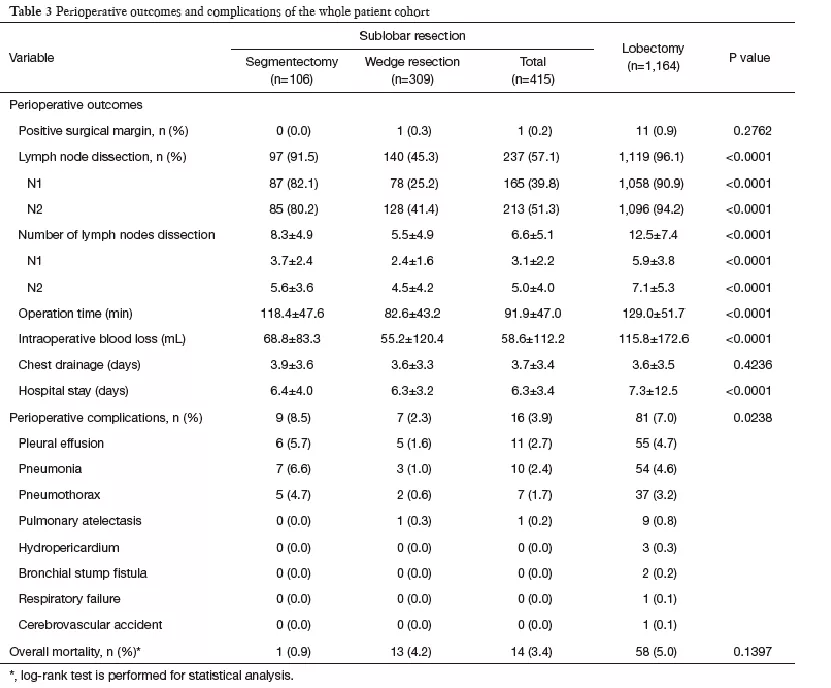
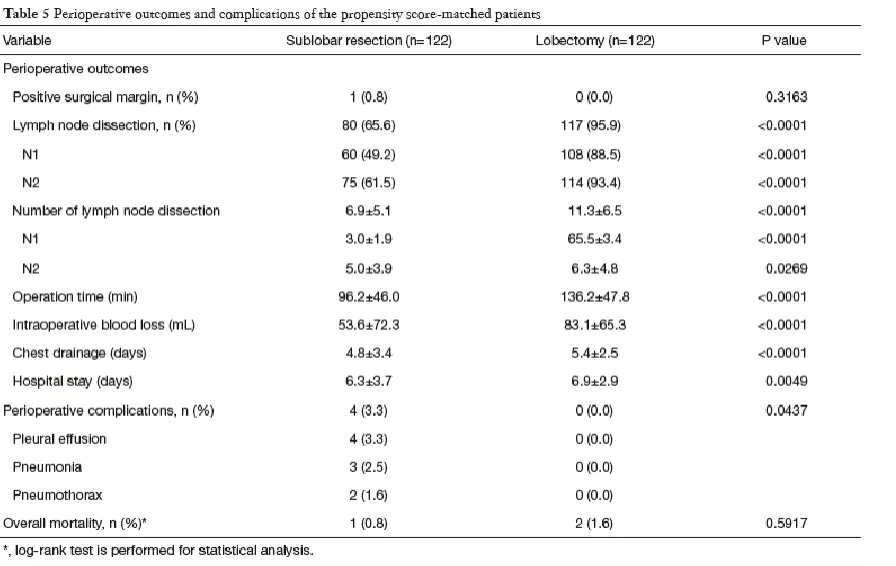
这是日本兵库医学中心的单中心回顾研究,2005年发表在《胸心血管外科杂志》。共1272位患者入组,322例(25.3%)患者进行亚肺叶切除术,即节段切除加线性切除,其余患者行肺叶切除术。因为目前肺叶切除加淋巴结清扫术是一个金标准,但是为什么要有肺段切除和亚肺叶切除,就是外科医生在探讨是不是能减少切除的部位。
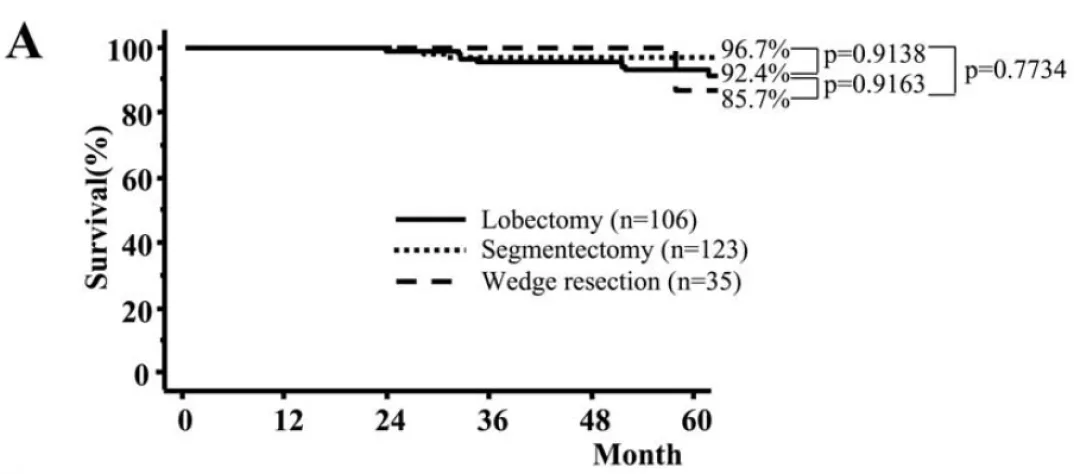
对于直径≤2cm的1期肺癌,肺叶切除、肺段切除和楔形切除的5年生存率差别不大。
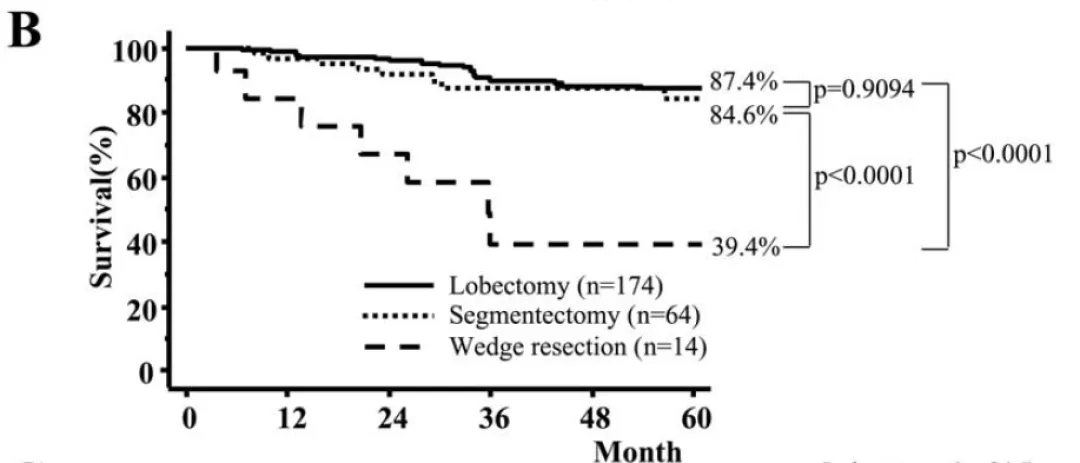
对于直径在2cm~3cm的肿瘤,肺叶切除和肺段切除的5年生存率差不多,但是楔形切除的5年生存率较低。
肺叶切除、节段切除和楔形切除术中NSCLC≤1cm或>1-2cm的患者的手术方法选择

这是国内何建行教授进行的多中心研究,应用SEER数据库,共入组15760位患者,4240(26.9%)位患者接受了亚肺叶切除术。
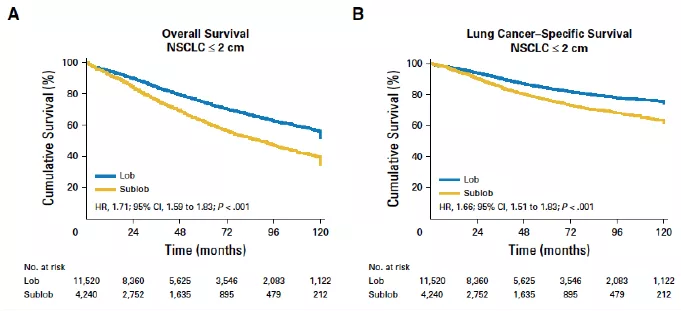
研究发现,对于直径≤2cm的肿瘤,肺叶切除(图中蓝线)比亚肺叶切除(图中黄线)的生存率高。
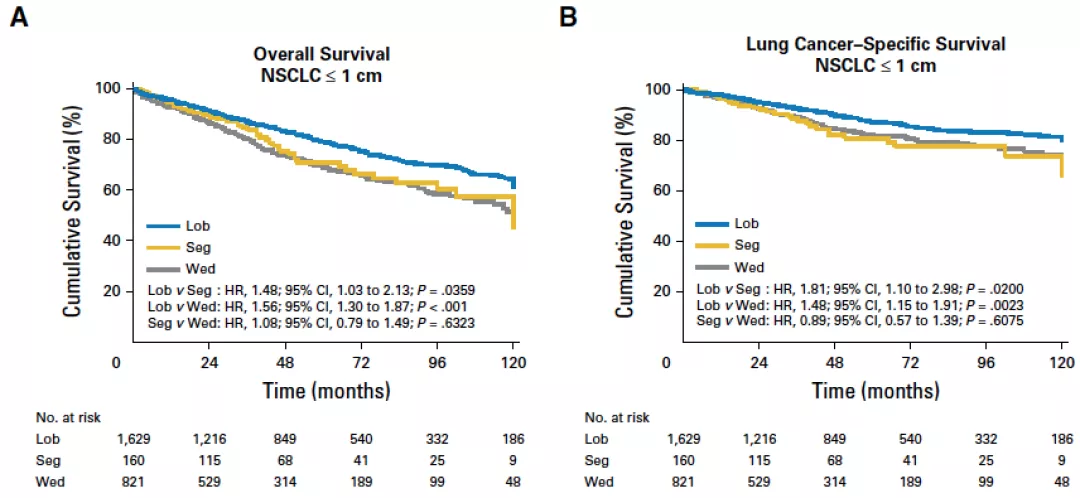
对于直径≤1cm的肿瘤,肺叶切除也比亚肺叶切除的生存率高。
通过SEER数据库研究出来的结果为什么与上述单中心研究结果产生差异?因为这项研究分组之间的标准存在局限性,第一,包括社区医院和学术中心的资料,数据混合;第二,未明确说明纯GGO的信息;第三,未区别主动和被迫做亚肺叶切除术,主动的意思就是指外科医生观察肺结节后准备给病人做亚肺叶切除,被迫的意思是指外科医生想给病人做肺叶切除,但由于年龄因素、肺功能因素不允许,被迫给病人做亚肺叶切除或者肺段切除,所以说在这个资料比较混杂。
根据患者选择,对NSCLC的肺叶切除术与肺段切除术进行系统回顾和荟萃分析

这是一项荟萃分析研究,共38959位患者,分析节段切除术、楔形切除术与肺叶切除术相比较,是主动去做还是被迫去做。研究发现,当肿瘤大小<2cm,主动去做,肺段切除术和肺叶切除术的手术效果差不多。由于肺功能较差或者其他原因,被迫做楔形切除,肺段切除术与肺叶切除术相比效果较差。
一项临床I期NSCLC老年患者的肺叶切除与围手术期预后相关

中日医院和国内10家大型医院进行的一项多中心回顾性队列研究,1579例65岁以上患者入组。亚肺叶切除组:术中出血少、手术时间短、术后并发症发生率低、住院时间短。随访时间较短,短期看,肺叶切除组和亚肺叶切除组无统计学差异。
临床试验小结

刚才总结了肺叶切除、肺段切除或者楔形切除的优劣,但现在还没有弄清楚。问题在于病理学,再深入就是肺癌的生物医学行为的问题,生物医学行为就延伸到基因、分子标志物等方面。
2病理学依据
1)腺癌实性亚型不适合做亚肺叶切除,手术效果不好。大家肯定会存在疑问,我怎么能知道这个亚型是实性的呢?今天我还要详细讲解这个问题。
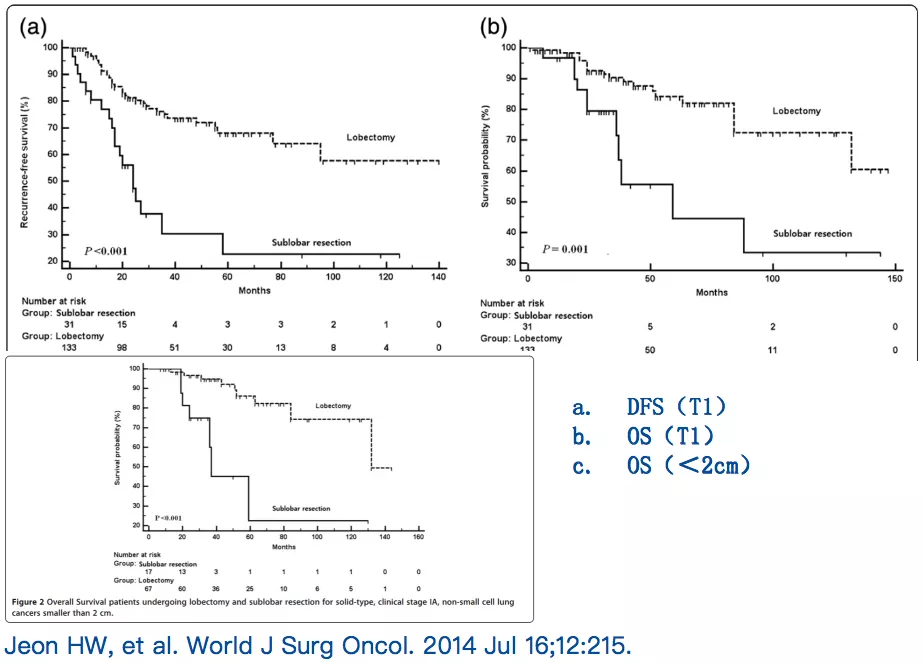
2)存在微乳头亚型不合适做亚肺叶切除,微乳头比例越高,做亚肺叶切除越容易复发。也就是说微乳头比例的高低和复发的高低有关。
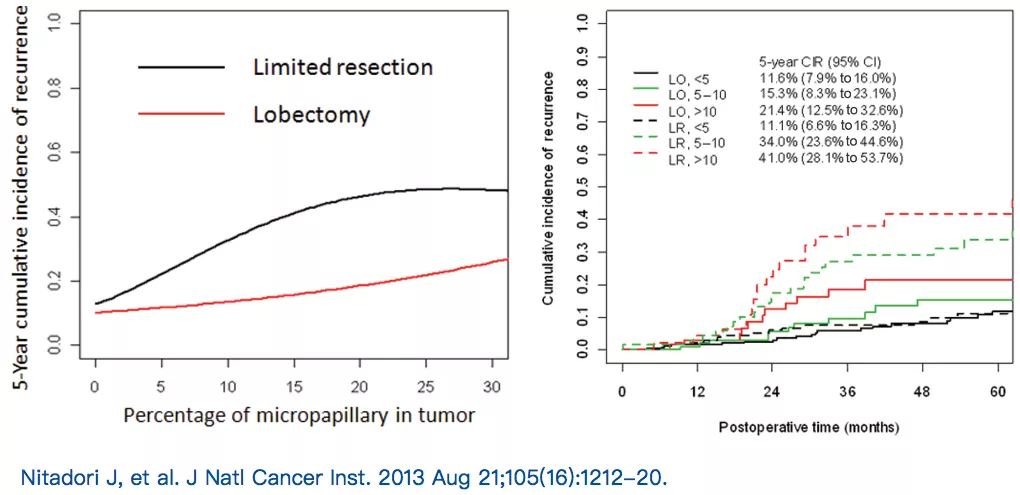
3)存在气腔内播散(STAS)不合适做亚肺叶切除。
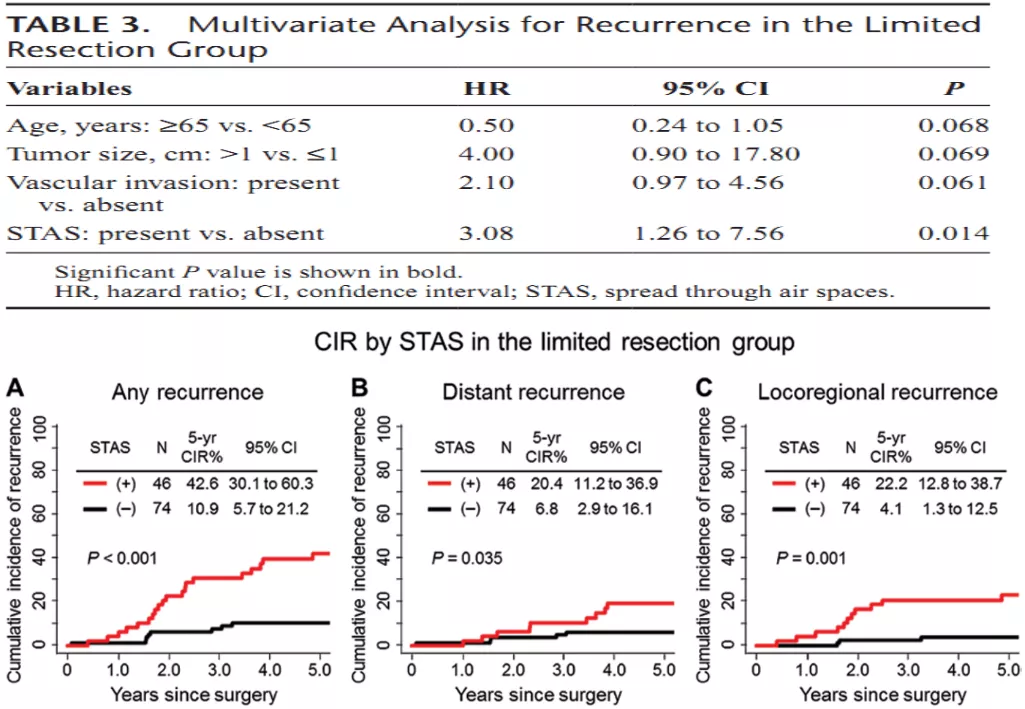

病理依据小结
问题回到原点,上世纪60年代做肺叶切除加淋巴结清扫,这个金标准没有被废除是因为有些病理类型无法做其他类型的手术。适合做亚肺叶切除术:AAH,AIS,MIA;不适合做亚肺叶切除术:实性腺癌,STAS,微乳头型比例高的。还有一些中间地带,以附璧生长为主的腺癌,那就要看大小等因素,在病理上我们会把它这样区分,那么在病理上如何区分呢?
3 NCCN指南(2019)
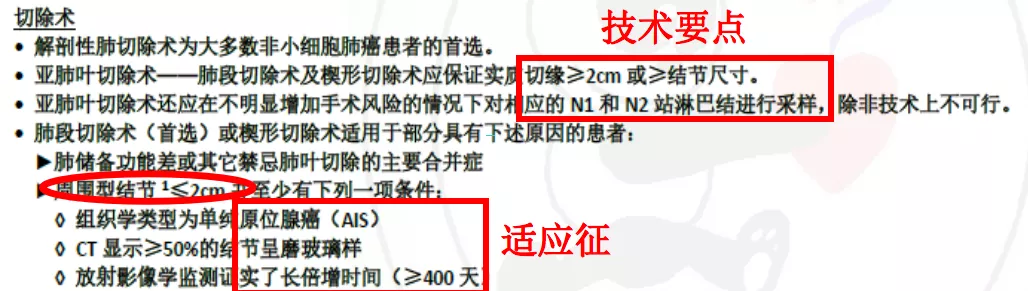
2019年和2020年的NCCN指南没有变化。
4 根据HRCT选择对≤2cm肺癌的手术方式
病理结果无法在术前得知,我们现在可以通过高分辨率CT拿到根据。这是我今天讲的重点内容。
背景
对于术前检查来说,包括血液化验、胸部+上腹部CT等检查。如果都需要做头颅MRI、骨扫描或PET-CT等检查,那就是过度检查。同时要确定手术方式,做肺叶切除或亚肺叶切除,还是做淋巴结清扫或淋巴结采样,都要在术前确定。
一般来说,CT表现为纯GGO或者GGO为主的肺癌,从病理上AIS、MIA比较多,不具有侵袭性,淋巴结转移及远处转移的概率低。
不同影像学特点的cT1a-c患者术前检查是否差异化?手术方式是否差异化?
NSCLC的术前检查
cT1a-c肺癌术前检查方式的选择

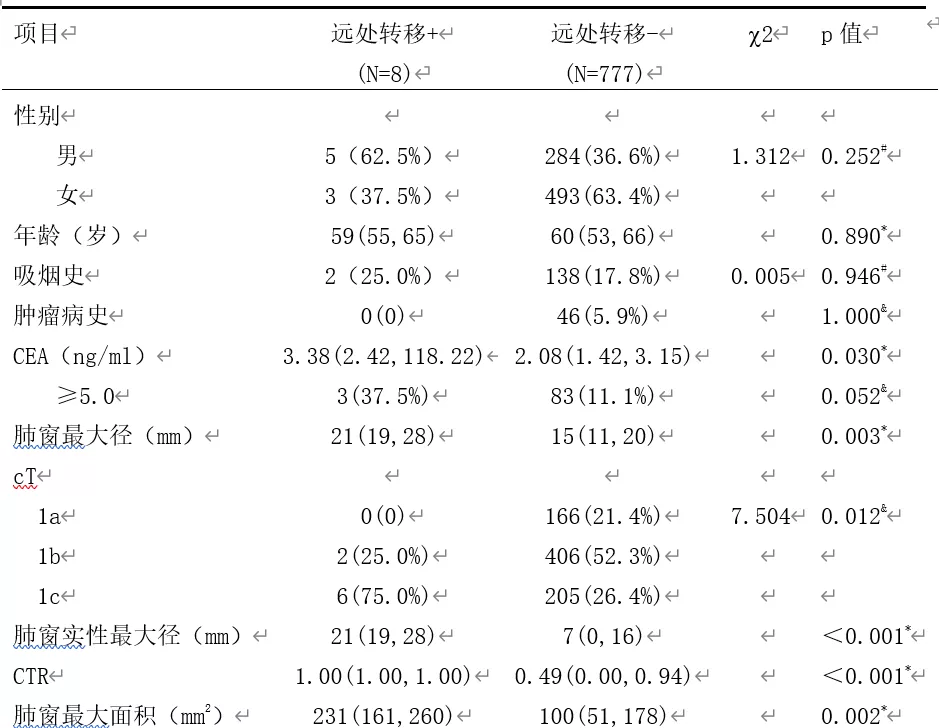
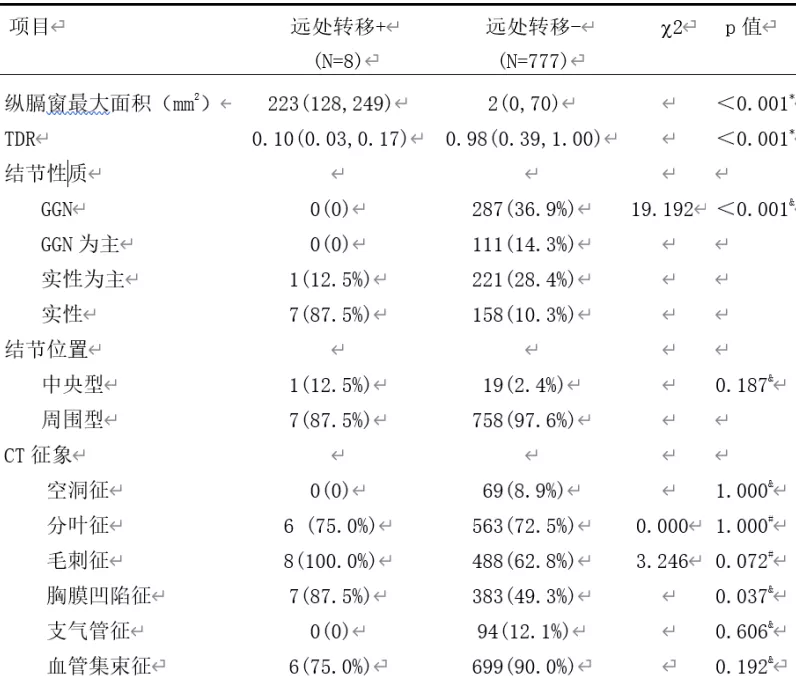
我们科室统计了785例患者。出现远处转移的患者有8例,没有远处转移的有777例,这两种差别在于什么?CTR和肺窗实性最大径存在明显差异,纵膈窗最大面积和TDR(肿瘤消失率)的差距也很大。
因此,纯GGO及GGO为主结节不需要行相关检查除外远处转移,比如头颅MRI、骨扫描或PET-CT等检查。对于纯实性结节来说,包含头颅MRI在内的相关检查除外远处转移。
淋巴结转移规律
评价节段切除术安全性的新观点:cT1N0M0肺腺癌的肺叶和节段淋巴结转移的临床意义
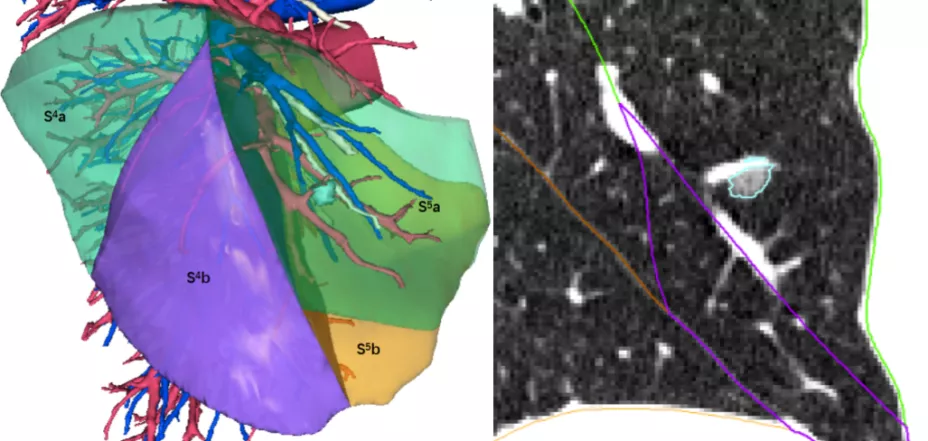
我们科室还做了一项研究,下图所示的结节考虑为早期肺癌,要做肺段切除,如何判断在其他段有没有转移?
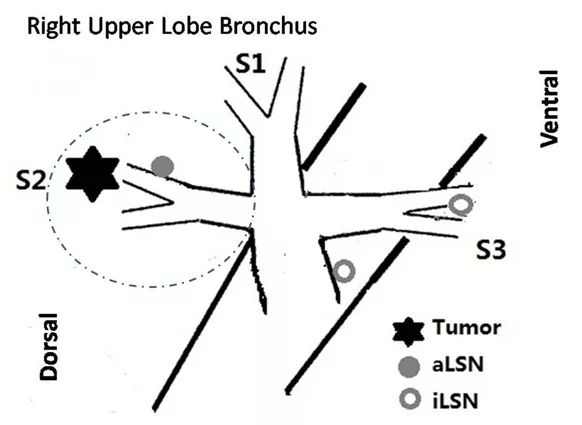

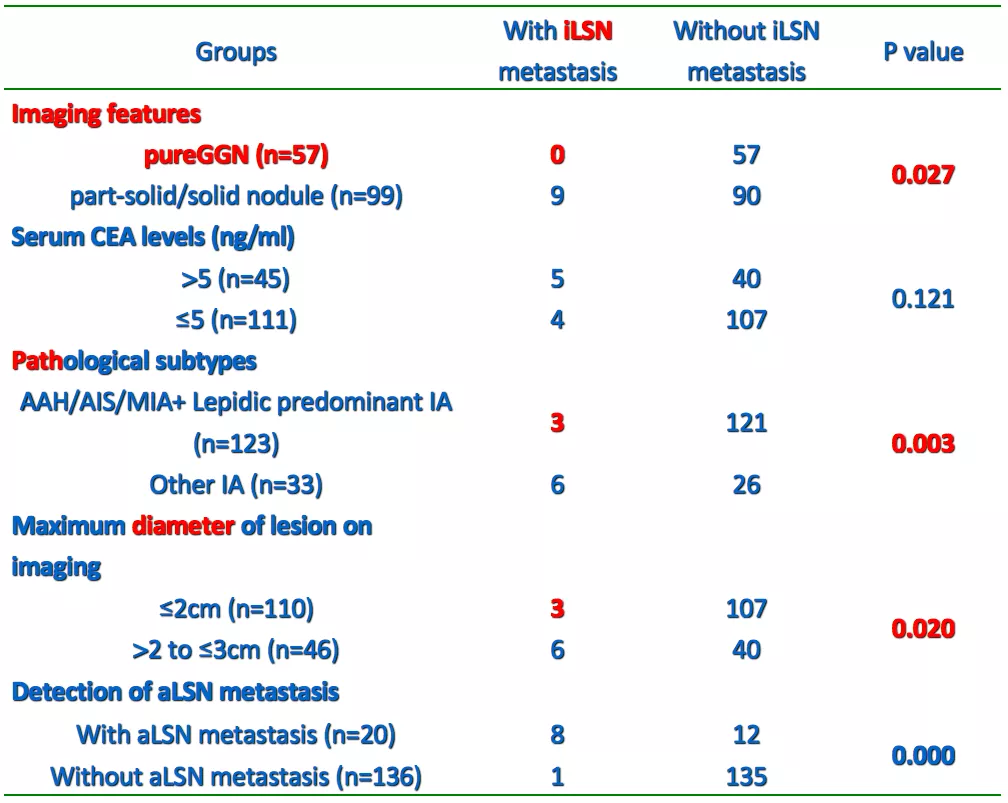
研究发现,纯GGO在其他段没有转移。在部分实性和实性结节中,99例中有9例出现转移。从病理上看,AAH、AIS、MIA以及以附璧生长为主的腺癌在其他段里没有转移。那我们就知道什么样的是应该切段,什么样的不应该切段,应该直接切肺叶。
在这项研究中,还入组了196例患者,纯GGN69例,部分实性结节52例,实性结节75例。pN1% 18.4%;pN2% 8%。研究发现,影像实性成分与淋巴结转移相关。
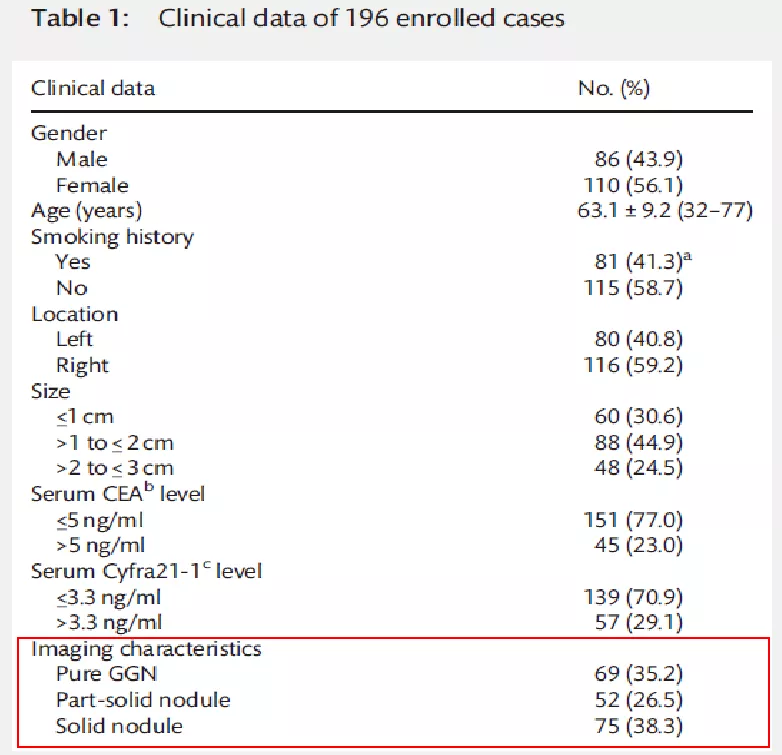
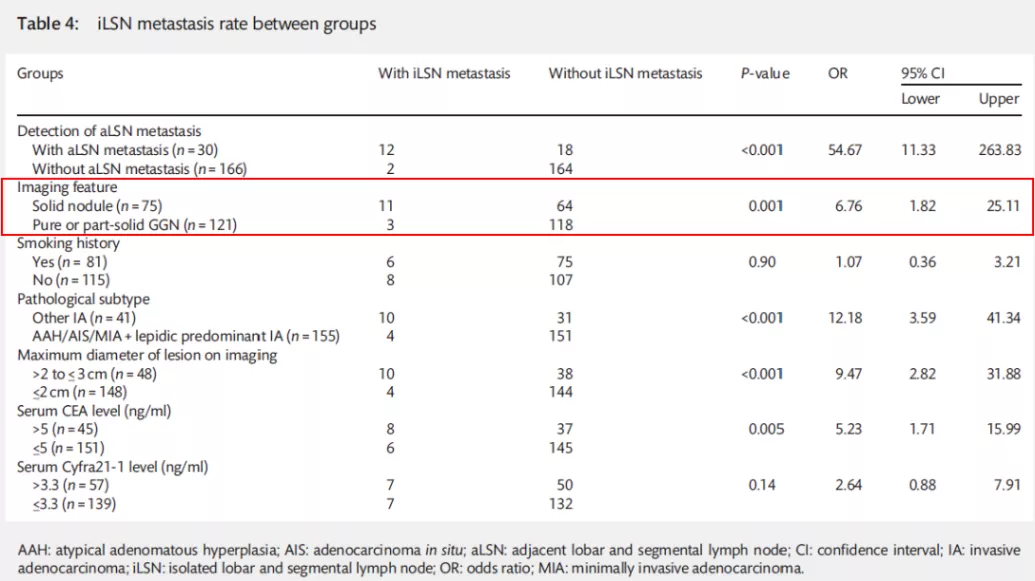
不同影像学特点的cT1a-cN0M0肺腺癌患者淋巴结转移规律分析
入组667例肺腺癌患者,术前分期cT1a-cN0M0。行纵隔淋巴结清扫或采样;术后病理为原发性肺腺癌;有我院胸部HRCT资料。剔除标准:术前胸部CT表现为多原发肺癌;术前检查提示已出现远处转移;术前接受新辅助治疗;术中未进行纵隔淋巴结清扫或采样;术后病理为非腺癌或转移性腺癌。
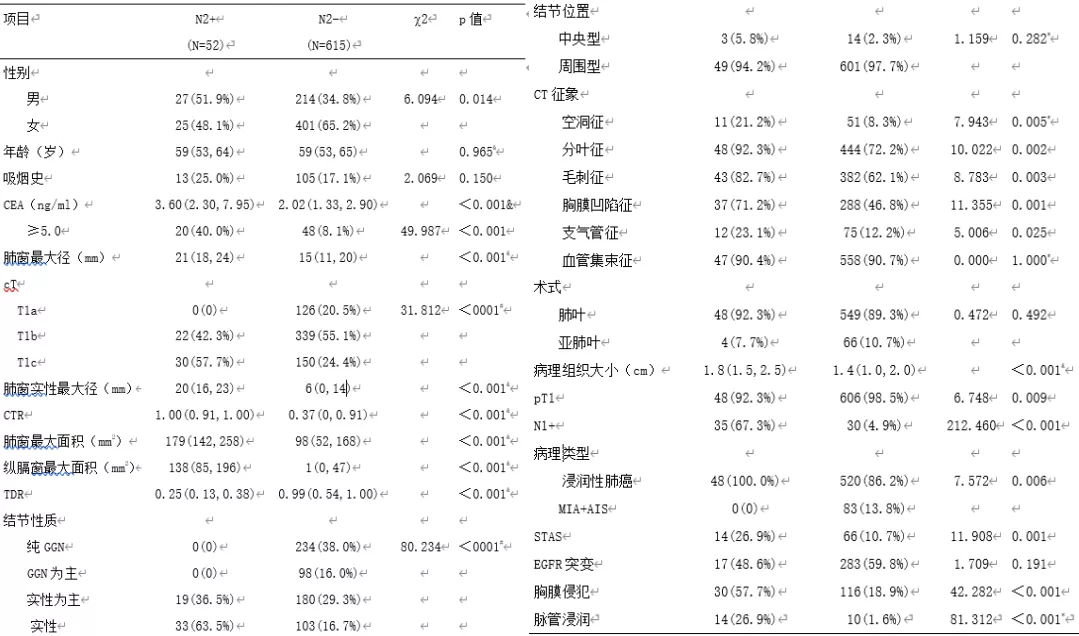
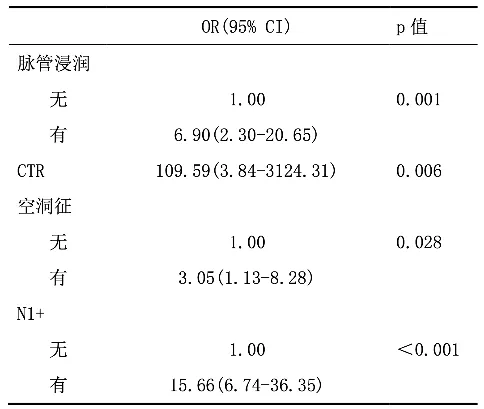
研究发现,纯GGN或GGN成分为主的肺癌纵隔淋巴结不会发生转移,纯GGN、GGN为主患者可以考虑更小范围的淋巴结清扫采样,这或许会成为纵隔淋巴结转移风险较低人群避免常规淋巴结清扫的依据。实性结节需要进行系统性淋巴结清扫采样。这是我们单中心的资料。
手术方式选择
一项多中心回顾性队列研究:临床I期NSCLC老年患者的肺叶切除与围手术期预后相关
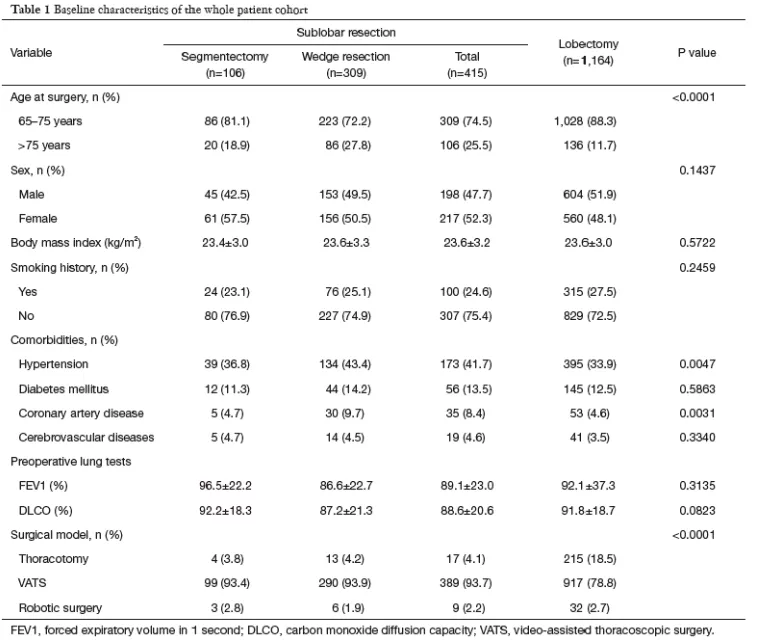
短期来看,65岁患者没有差异。
75岁或以上的临床I期NSCLC患者的切除范围有限:荟萃分析

该分析显示,对于年龄≥75岁的临床I期NSCLC患者,肺叶切除术优于有限切除术,具有更高的肺癌特异性和整体生存率。
NCCN指南推荐:肿瘤直径=2cm;GGN%50%;AIS;肿瘤倍增时间400天。
根据目前公认的GGN分类,将其分为为纯GGN和部分实性GGN。

目前有两个参数来测量GGN的实性比例。实性成分占肿瘤比率(consolidation-to-tumor ratio,CTR)是最常用的参数,定义为肺窗中实性成分大小与结节总大小的比值。肿瘤消失率(tumor disappearance ratio,TDR)定义为纵隔窗实性部分大小和肺窗总肿瘤大小之比的差值。CTR和TDR是不同的概念,大家不要弄混。
磨玻璃影在浸润性肺癌临床分期中的重要性
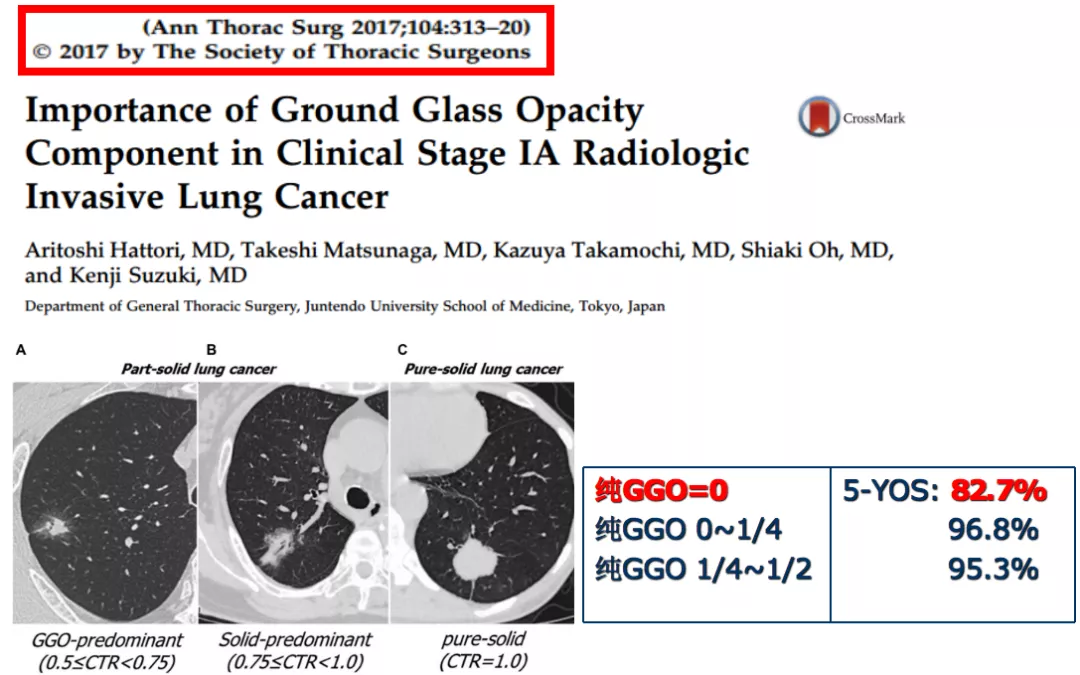
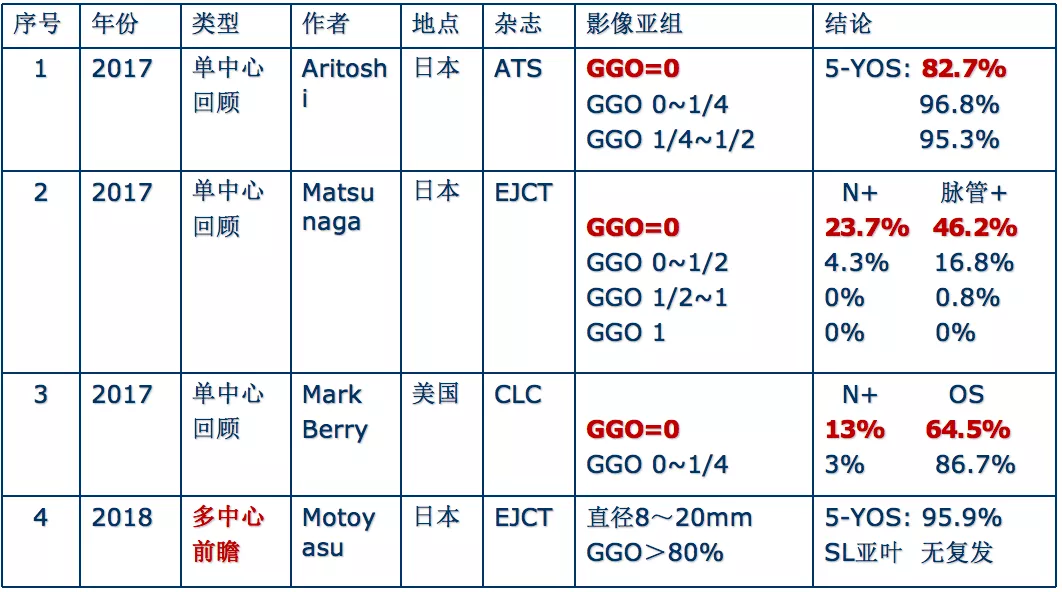
这是2017年一项东京单中心回顾研究,纯GGO=0,也就是实性结节,5年生存率不高。可是纯GGO不论是占1/4还是1/2,5年生存率都比较高。这不是在讲手术切除多少,是通过薄层CT来判断预后和判断要切除多少,这是一个重点。

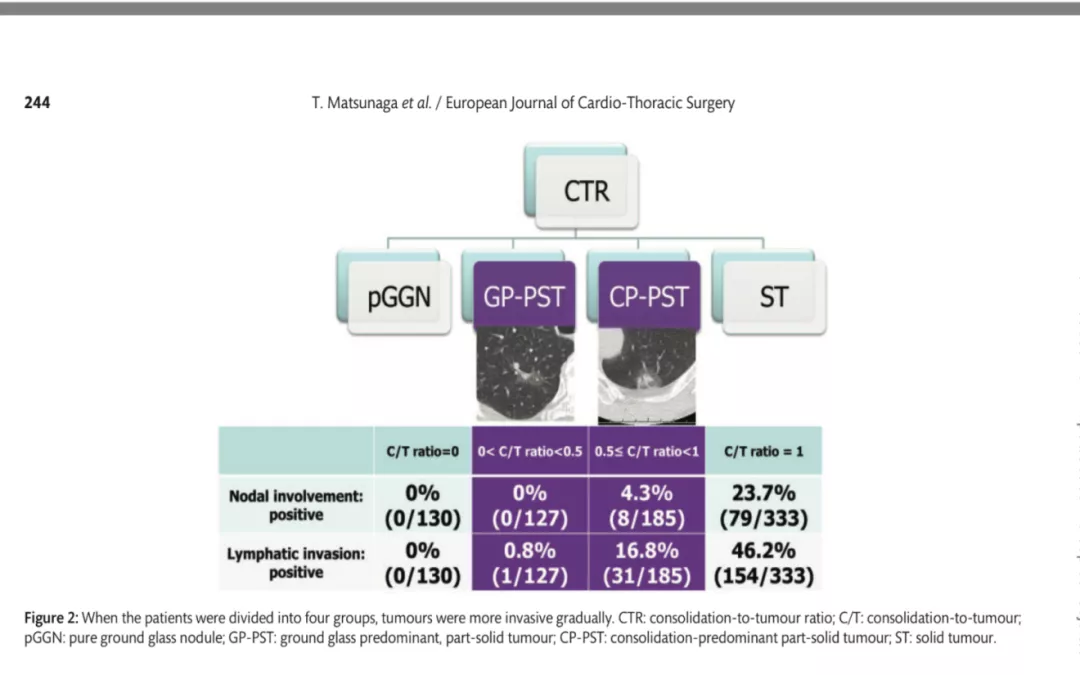
实性结节,淋巴结转移和脉管侵犯比率很高。如果是纯GGO,没有淋巴结转移,没有脉管侵犯;纯GGO在1/2~1之间,没有淋巴结转移,脉管侵犯比率很低。那么,还去给病人做PET-CT、脑核磁吗、骨扫描等检查吗?还给他做肺叶切除吗?可能就不必要了。这就是我们可以通过薄层CT确定。
肺腺癌中即使有很小的磨玻璃成分也能预示更好的生存
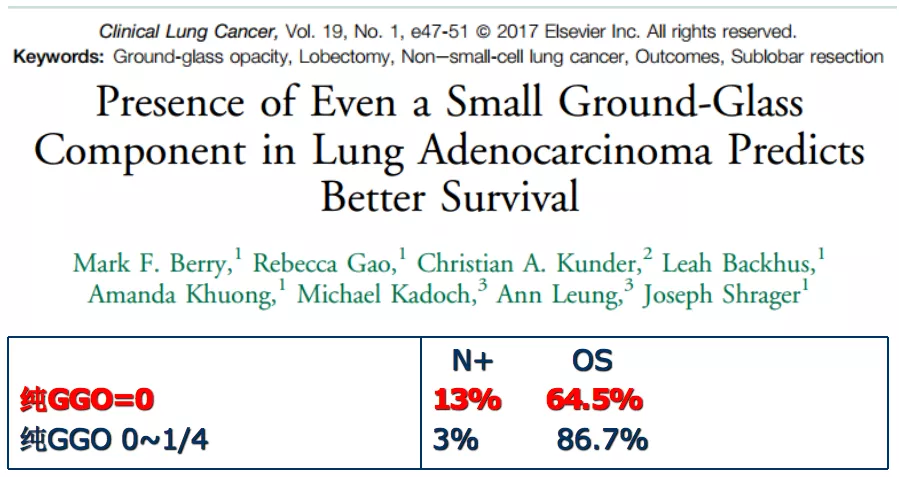
这是2017年美国的一项单中心回顾研究,比较简单,GGO成分越多,淋巴结转移率越低,OS越高。
局限性切除伴磨玻璃结节的肺癌的前瞻性5年随访研究

这是2018年日本仙台的一项多中心前瞻性研究。磨玻璃结节大小8~20mm,纯GGO>80%,病例数不多,共73例患者,5年生存率为95.9%。安全地进行了有限的切除,没有任何复发,并且术后肺功能得到很好的保存。
影像学依据小结
NCCN推荐
肺叶切除:首选。
肺段切除或者楔形切除适用于:周围型结节≤2cm并至少有下列一项条件:AIS;CT显示纯GGO%≥50%;放射影像学倍增时间≥400天。
JCOG0201-1

这是2011年发表的一项日本的前瞻性多中心研究,研究目的是影像特点判断病理有无浸润,选择手术方式。入组811例。纳入分析:cT1N0M0周围型肺癌545例。病理非浸润性癌定义:无淋巴结转移、血管侵犯、淋巴管侵犯。预期结果:特异度97%。

研究结论:影像诊断非浸润性癌的标准 ≤2cm&CTR≤25%。
JCOG0201-2
为了研究影像非浸润性腺癌预后。纳入分析:cT1N0M0周围型肺癌545例。文章在2013年发表。

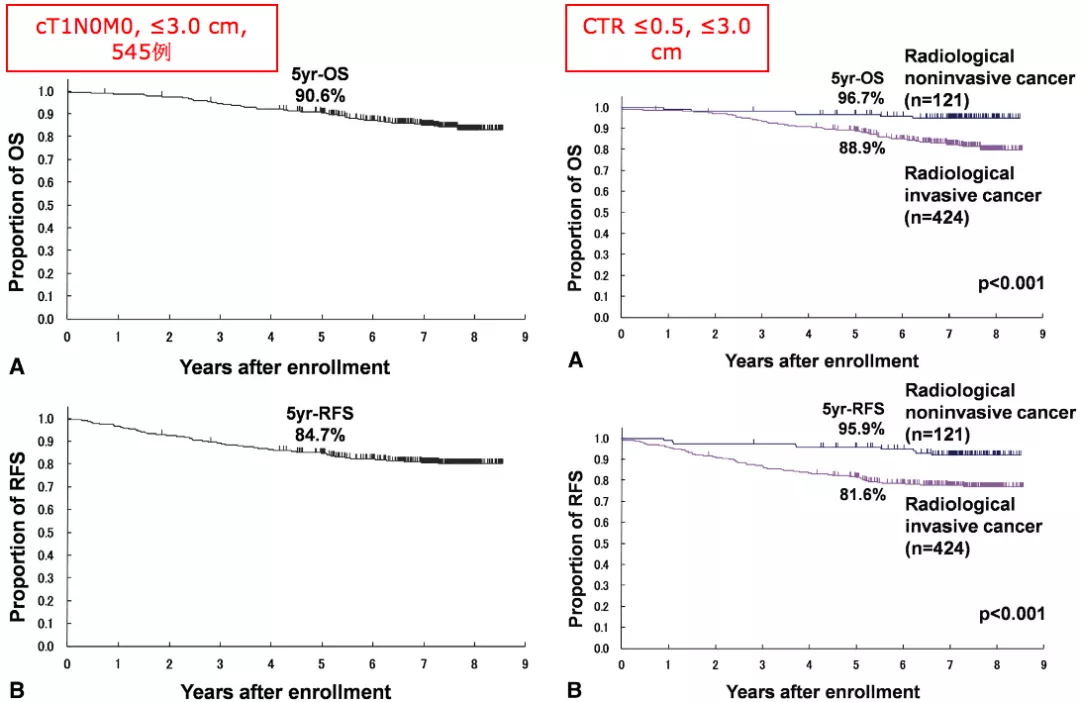
cT1N0M0,≤3cm,5年生存率为90.6%。非浸润性癌症的5年生存率是96.7%,浸润性癌症的5年生存率是88.9%。
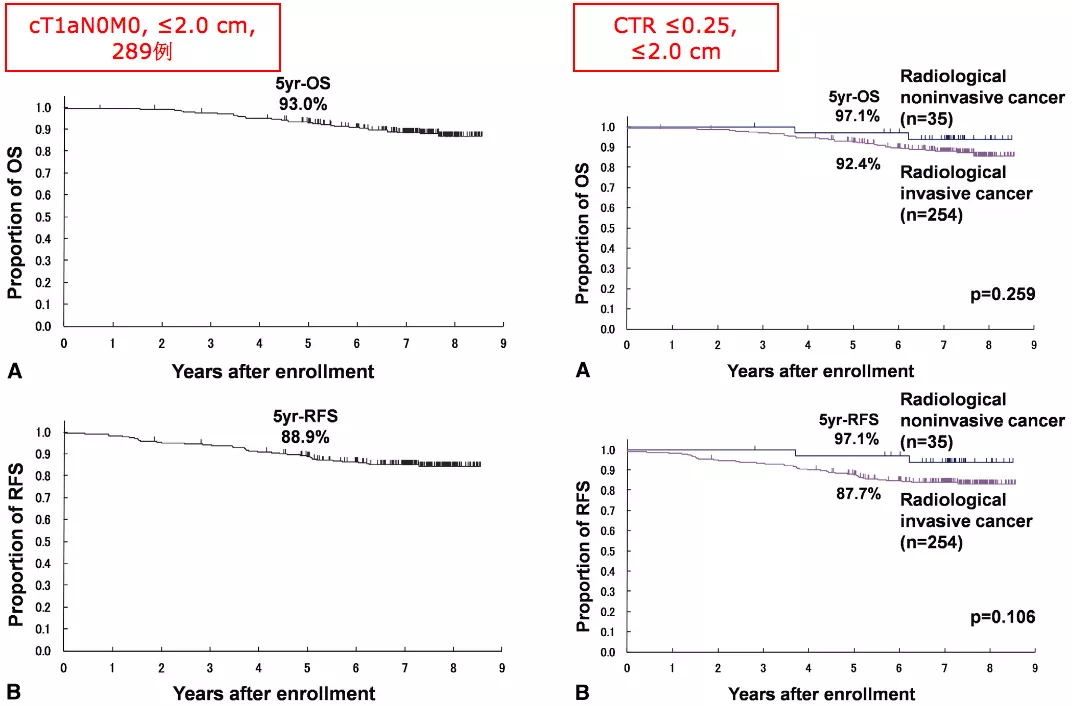
cT1N0M0,≤2cm,也是非浸润性癌症比浸润性癌症的5年生存率高。
JCOG0201-1和JCOG0201-2这两项研究的结论为:≤2cm&CTR≤0.25或者≤3cm&CTR≤0.5,OS大概为97%。
JCOG0802和JCOG0804
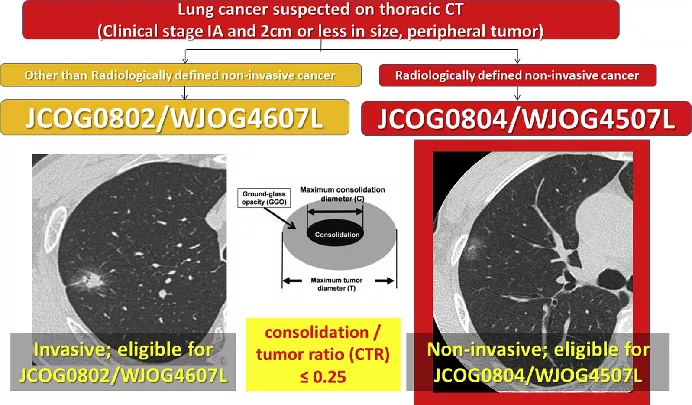

JCOG0802研究有关浸润性肺癌,JCOG0804研究有关非浸润性肺癌。
JCOG0802
前瞻性多中心随机对照研究,CT≤2cm,CTR0.25(前4年);CTR0.5(第5年开始)。肺段vs肺叶,非劣效性实验。

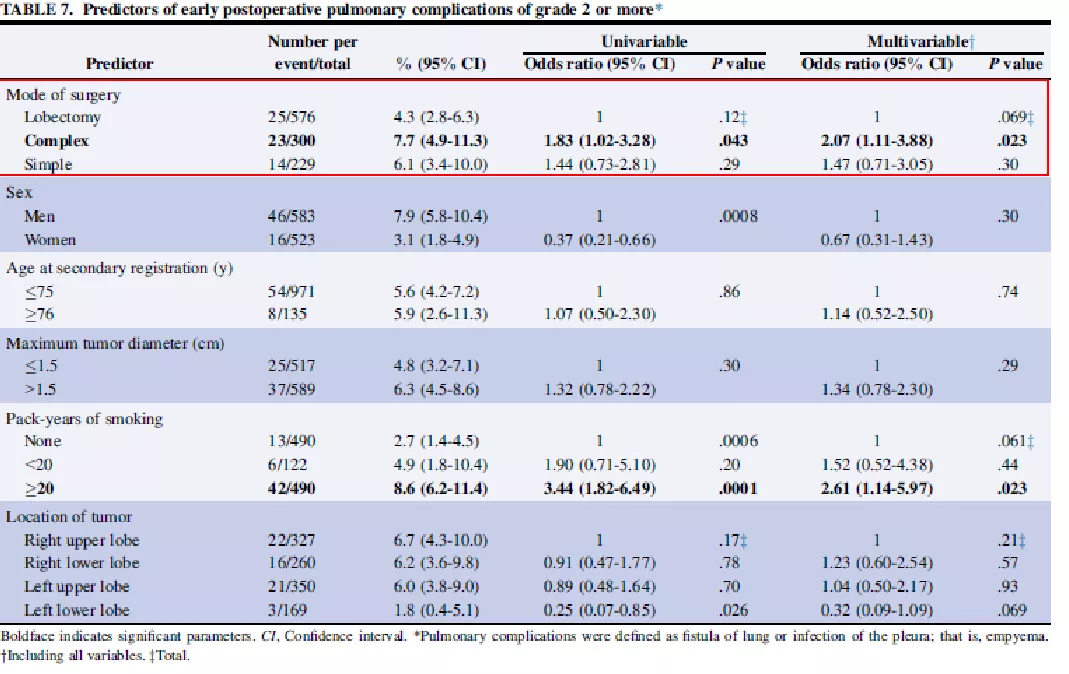
JCOG0802研究发现,在肺段切除中,符合肺段,但有些并发症不好。研究的长期结果还没出来。
JCOG0804
我们非常看好0804研究,这是一项前瞻性单臂研究,入组标准:CT≤20mm,CTR≤0.25,肺段或楔形切除(为主)。入组333例患者:楔形258例,肺段56例;腺癌310例,癌前病变27例,非肿瘤性病变14例。初步结果为≥2级并发症为37.9%,5y DFS 99.7%。最终OS结果还没出来。
我们关注日本这几项研究是因为是前瞻性多中心研究,相对来说更加严谨准确。
专家共识2019版

今年4月,发布了《基于高分辨CT影像学指导≤2cm GGN肺癌手术方式胸外科专家共识(2019版)》。
术前评估
一般认为纯GGO和纯GGO%=75%不具有侵袭性,不发生远处转移,术前纯GGN不推荐行MRI、骨扫描、PETCT等除外远处转移;术前行血液化验、ECG、胸部高分辨ct、肺功能检查。纯GGO%75%和实性结节具有潜在侵袭性,可能会发生淋巴结转移或远处转移,建议术前行头颅MRI、骨扫描、PET-CT等除外远处转移。
手术方式
C/T ratio=25%的肺癌,推荐亚肺叶切除。
如病灶位于周边「优势部位」,即周围型:行肺楔形切除;如病灶位置较深,即中央型,但仍位于某一个肺段内:行肺段切除复合肺段切除联合亚段切除,以保证足够切缘。
手术切缘应符合基本肿瘤学原则,术中需保证切缘距离肿瘤边缘距离2cm或肿瘤最大径,如切缘不足,需行肺叶切除术。
术中淋巴结冰冻病理结果决定是否需要扩大切除及淋巴结清扫。
C/T ratio25%的肺癌,推荐行肺叶切除术。
纯GGO即C/T ratio=0的肺癌生长速度慢,通常手术切除后术后病理为浸润前病变,远期预后好。周围型病灶推荐行楔形切除;中央型病变推荐行肺段切除复合肺段切除联合亚段切除,尽量避免行肺叶切除。
淋巴结切除范围
术中冰冻如为AIS,可不进行淋巴结清扫或采样;对于其他类型非小细胞肺癌,推荐进行系统性淋巴结采样保证术后TNM分期完整性。
年龄
对于心肺功能储备满意的高龄患者参照肿瘤大小以及C/T ratio选择手术方式;对于心肺功能储备较差的高龄患者推荐亚肺叶切除作为首选术式。
青年患者,参照肿瘤大小以及C/T ratio选择手术方式。待0804研究远期效果公布之后,参照JCOG0804研究结果调整C/T ratio。
多原发
同时性多原发肺癌的术前检查,考虑到不能完全除外肺内转移,推荐要行PET-CT和或头颅MRI除外远处转移。
外科手术治疗多原发肺癌原则:首先处理较大病灶或纯GGO%较低病灶,同时兼顾较小病灶或纯GGO%较高病灶。
多原发肺癌位于同一肺叶,推荐行肺叶切除同期切除所有病灶;同侧不同肺叶多原发肺癌:如患者肺功能允许,可采取同期手术,较大病灶或纯GGO%较低病灶所在部位行肺叶切除术,较小病灶或纯GGO%较高病灶采取亚肺叶切除术;或两病灶均采用亚肺叶切除术。
病灶位于两侧肺叶时,如身体状况好,可以同期处理双侧病灶;如同期手术风险较高,推荐优先处理位置靠近肺边缘,手术切除范围较小的病灶,二期手术切除对侧病灶;如患者身体状况不能耐受双侧手术或二期手术,推荐优先处理较大病灶或纯GGO%较低病灶,分期手术间隔不短于2周。
如病灶不能全部切除,推荐切除较大病灶或纯GGO%较低病灶,其他病灶严密观察。
术后病理
术前影像学表现与术后病理表现并不完全一致。术后病理有淋巴血管浸润、胸膜侵犯、术后病理润2cm、STAS为术后复发高危因素;病理新分类为微乳头型预后较差。
如患者已行肺叶切除,即使术后分期为Ia期,建议行术后辅助化疗或术后每三个月复查;如患者接受了亚肺叶切除术,推荐二次手术,行肺叶切除;或直接行术后辅助化疗。
随访
AIS、MIA术后可每年复查一次胸部CT平扫,不必复查头颅MRI、全身骨扫描、PET-CT等。
其他肺腺癌参照NCCN指南,术后病理分期I-II期患者每6个月复查胸部(增强)CT,2-3年后每年复查一次。如有相关症状,建议查头颅MRI、骨扫描或者PET-CT。
5 基础研究
1个病例的思考:3个月转移
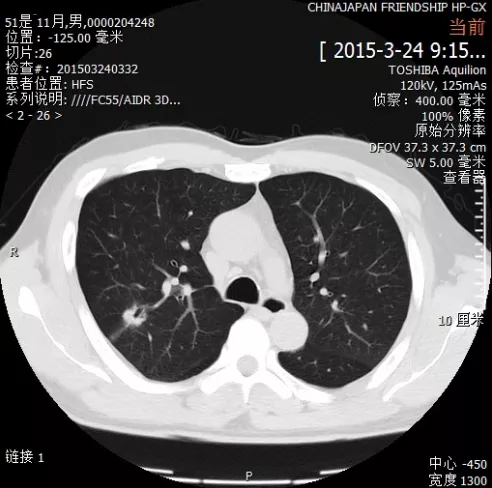
上图所示结节,2015-04-02:右肺上叶切除术+纵隔淋巴结清扫,2015-07-15:锁骨上淋巴结转移,2016-06-06:脑转移。按道理说这是早期肺癌,做手术也很规范,为什么会出现转移呢?因为基因分子生物学出现问题。
对早期肺腺癌的思考
早期肺癌应该切多少?大样本多中心研究能否得出依据?宏观向微观过度?影像学与病理依据?寻找癌的基因分子生物学特性?
EGFR TKIs原发性耐药研究
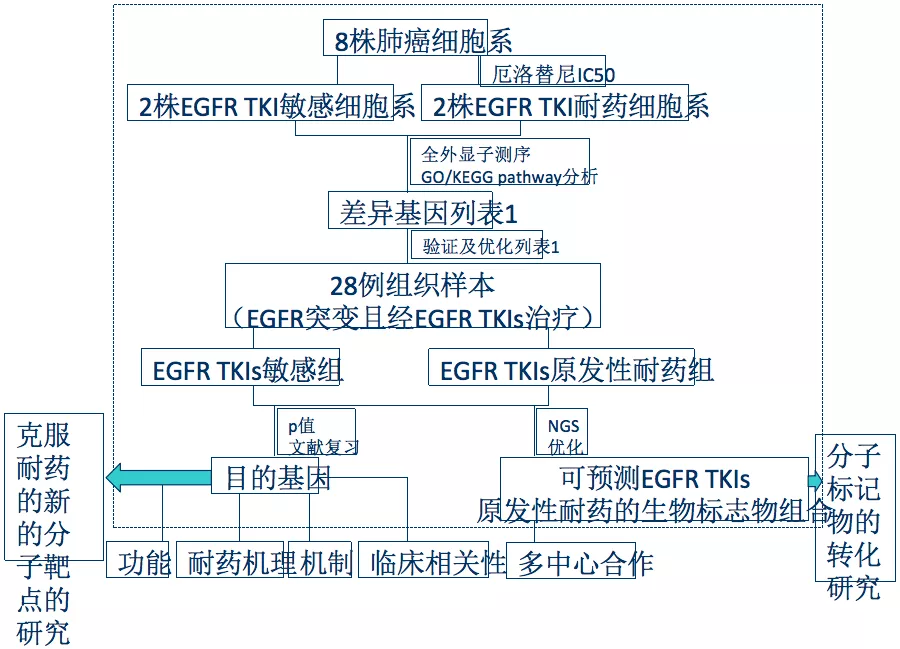
这是我们科室做的研究,已经发表。要解决癌的基因分子生物学的问题。

在研究过程中发现两个原癌基因,ACTL8和ACOT11,促进肺腺癌细胞增殖、克隆、血管生成及迁移。

这也是我们科室做的研究,也已经发表。目的都是在探索。
肿瘤相关抗原自身抗体
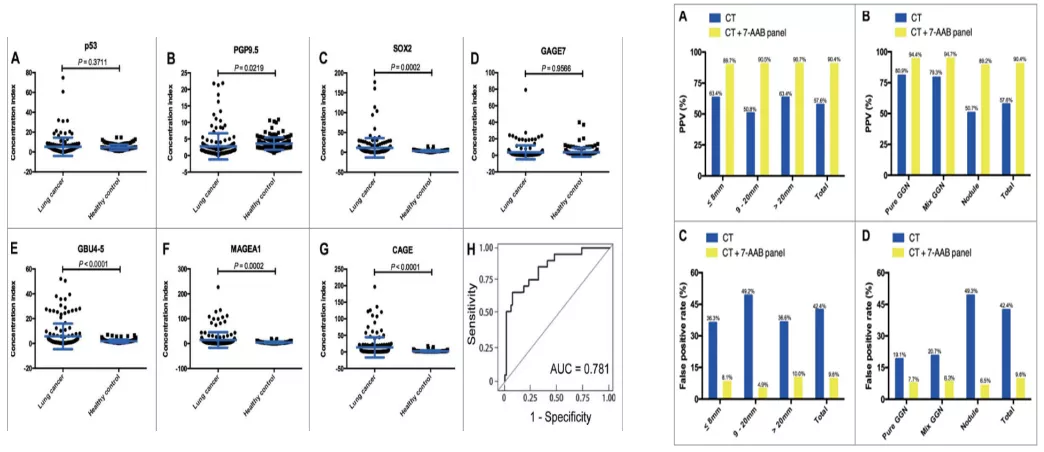
最后介绍一下肿瘤相关抗原自身抗体。大家都知道七种抗体,MAGE A1、SOX2、p53、GAGE 7、PGP9.5、CAGE、GBU4-5指标在I期和II期肺癌患者中具有很高的敏感性(62%和59%),也是我国首个批准的肺小结节血液辅助检测指标。
原来我做过一个打油诗,「未来CT薄又薄,病理诊断直接敲,指尖只吸一滴血,一天只吃一片药。」这四句话的意思就是,我们现在用薄层CT能判断病理诊断,判断手术方式,这是外科大夫要做到的,但是CT还不够薄,将来可能会更好,利用肺癌血液筛查,可以靶向治疗。现在都在逐步实现。
肺癌血液筛查研究项目(ECLS)
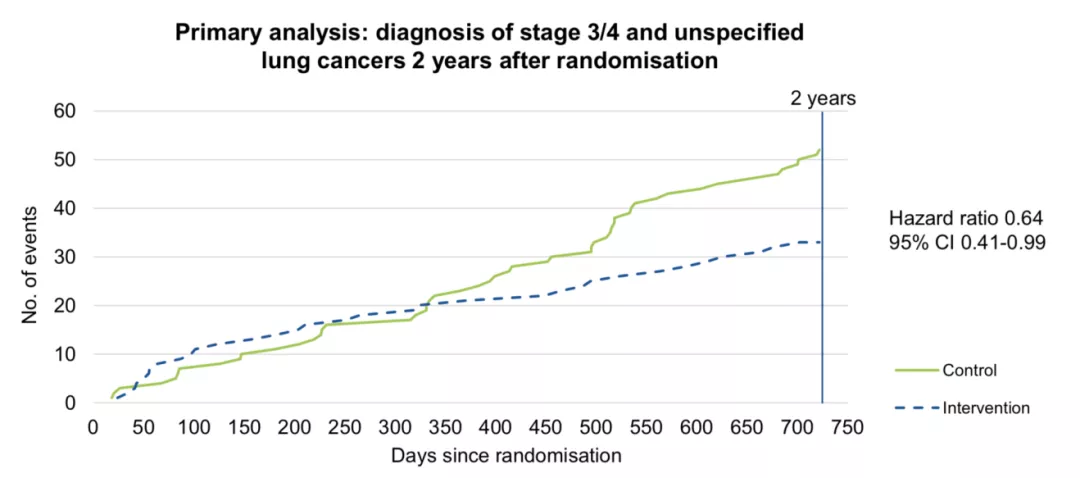
纳入肺癌高危人群,对比2年后干预组(液体活检辅助)与对照组(传统方法)中诊断为III、IV期或未分类肺癌的患者数量的差异;干预组采用含有7种肺癌自身抗体检测方法,对照组采用国家标准的健康检测。
这就是指先用血液筛查,然后再做CT。研究发现,肺癌自身抗体血检联合CT扫描能降低晚期肺癌发生率34%。
中国多中心研究
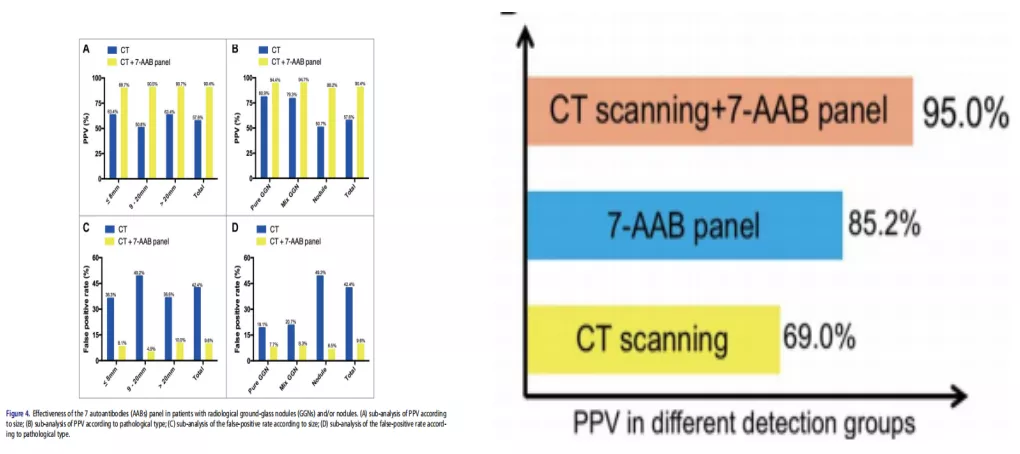
周彩存教授牵头了针对中国人群的肺癌自身抗体分子谱筛查的多中心临床研究:首次确认血清肺癌七种自身抗体谱在肺癌早期诊断中的重要临床应用价值。且七种肺癌相关抗体联合CT辅助肺结节早期诊断,阳性准确率能达到95%。
浙一真实世界研究:自身抗体对肺结节评估的阳性预测值>90%
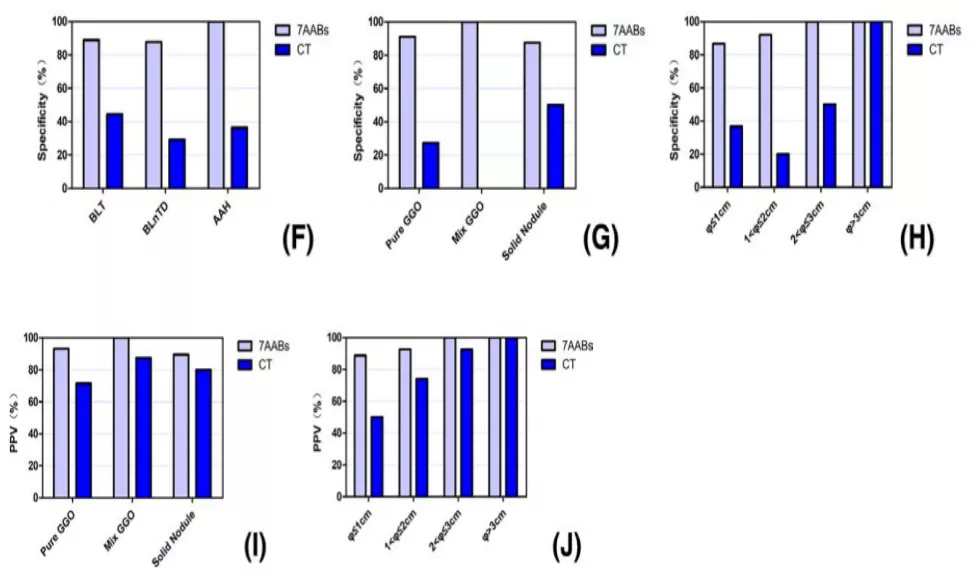
浙大医院胸外科胡坚教授:对门诊268例肺小结节(纯磨玻璃结节206例、混合磨玻璃结节11例、实性结节51例)进行研究:七种自身抗体联合CT的阳性预测值能达到92.7%;特异性能达到90.2%。
多维度科学评估肺结节流程
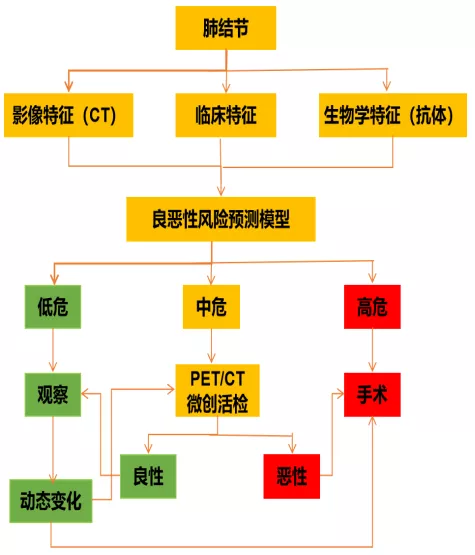
传统影像学,显示的是分子改变的终效应(标),肿瘤自身抗体反映的肿瘤生物活性信号(本),评估的是肺结节恶变趋势。自身抗体是肺癌诊疗「MDT」中的一员,它给临床提供的肿瘤免疫应答信息、分子侵袭状态,能有效减少漏诊与误诊,帮助临床更精准的诊断早期肺癌。
专家介绍

刘德若
医学博士,主任医师,北京大学医学部博士生导师。清华大学博士后导师。中日医院外科教研部主任,北京医学会胸外分会主任委员、中国医促会胸外科分会主任委员。近5年发表SCI论文30篇。曾获省部级科学技术奖两项。国家科技进步二等奖,曾获首都精神文明建设奖,曾获中国科教文卫体全国医德标兵。做胸外科手术上万例。较早在国内开展胸腔镜手术和肺移植手术,所在的团队为全国重点专科,2019年度中国医学科学院全国学科排行榜第7名。
本文由《呼吸界》编辑 大奔 整理。
本文完,感谢杭州凯保罗生物科技有限公司大力支持
排版:Jerry


