一、概述及流行病学
目前,糖尿病是全球性的重大健康问题,它是一组由多种原因所致的、以高血糖为特征的慢性代谢性疾病,根据IDF2019年糖尿病世界地图,全球糖尿病患者超过4.6亿,预计至2045年将增至7亿,患病率增长51%;中国是糖尿病第一大国,糖尿病患者多达1.139亿,糖尿病前期患者达4.934亿。
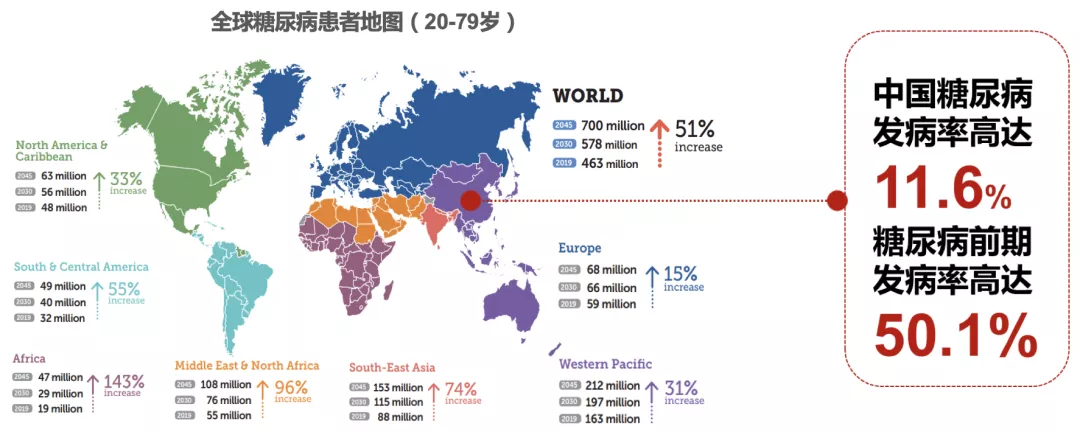
* 图中的数据来自上海交通大学医学院附属瑞金医院宁光院士团队在中国做的大型流行病学调查
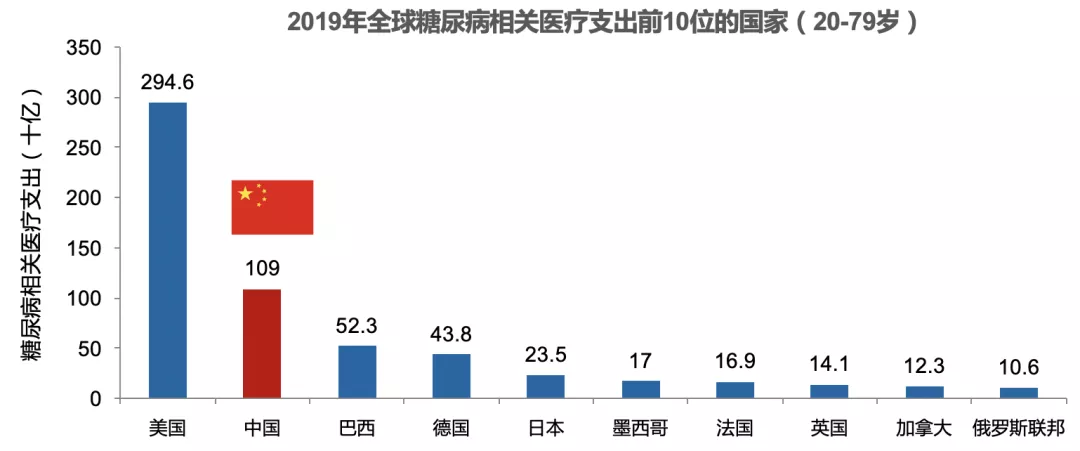
全球糖尿病医疗支出巨大,IDF最新数据显示,全球每年用于糖尿病的医疗支出为7600亿美元,糖尿病患者用于并发症治疗的医疗支出占糖尿病患者直接费用的50%以上。2019年,中国用于糖尿病相关的医疗支出为1090亿美元,仅次于美国,居全球第二。
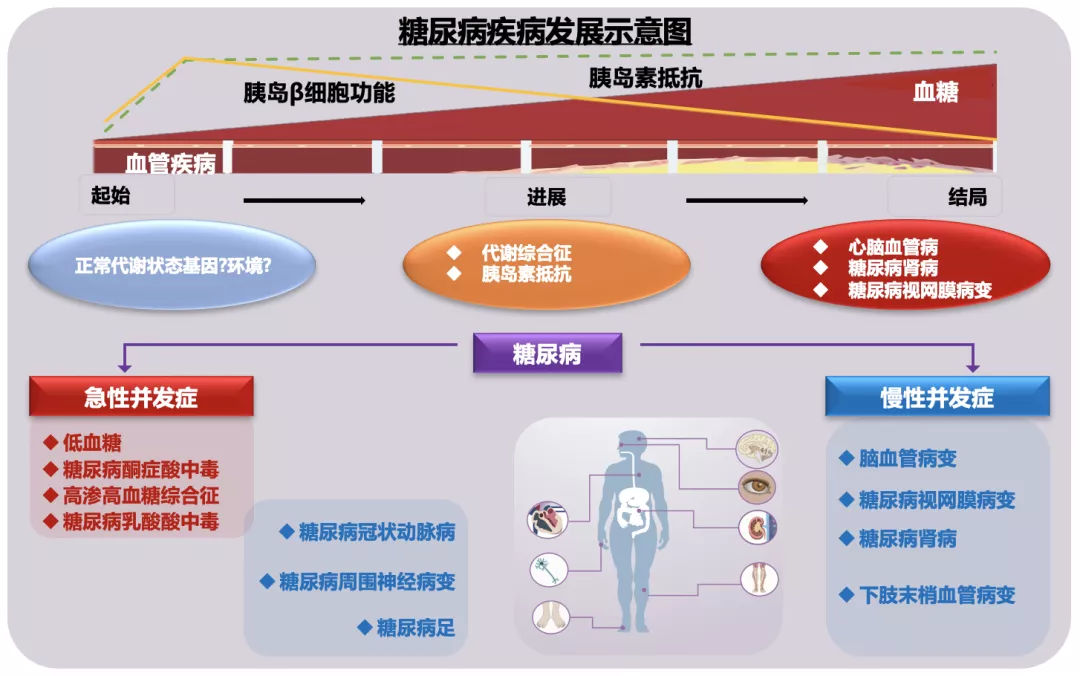
需要注意的是,糖尿病不仅仅是一个内分泌代谢性疾病,随着疾病进展,它常并发多种疾病。
Meta分析显示:糖尿病与皮肤、呼吸道、血液、胃肠道等多种类型感染风险增加相关,肺炎是糖尿病常见并发症,在糖尿病患者中因肺炎导致住院者占26%,在糖尿病晚期直接死亡原因中肺炎占8%。
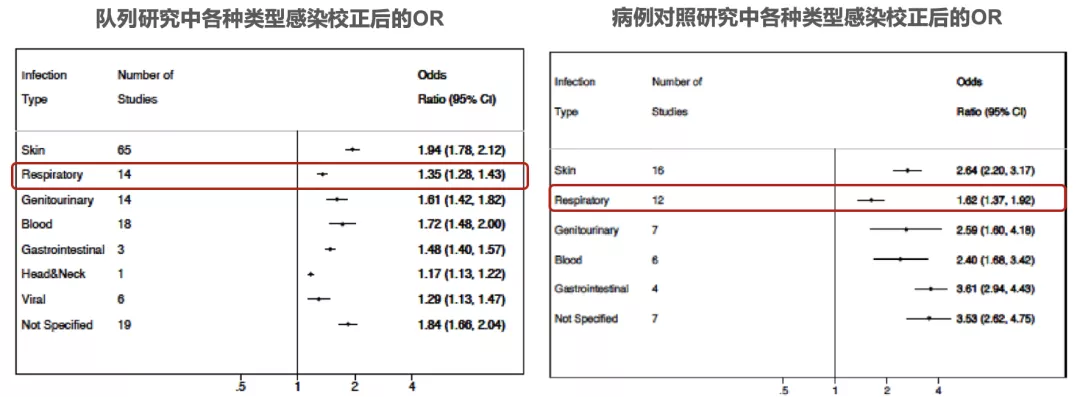
图:(左)队列研究中各种类型感染校正后的OR,(右)病例对照研究中各种类型感染校正后的OR
一项荟萃分析纳入评估成年糖尿病患者感染发生率的345项研究(243项研究是队列研究,102项研究是病例对照研究)进行分析,旨在通过系统回顾和荟萃分析,量化糖尿病与感染风险之间的相关性。
二、糖尿病易感肺炎的机制及高危因素
糖尿病相关感染的病理生理学:
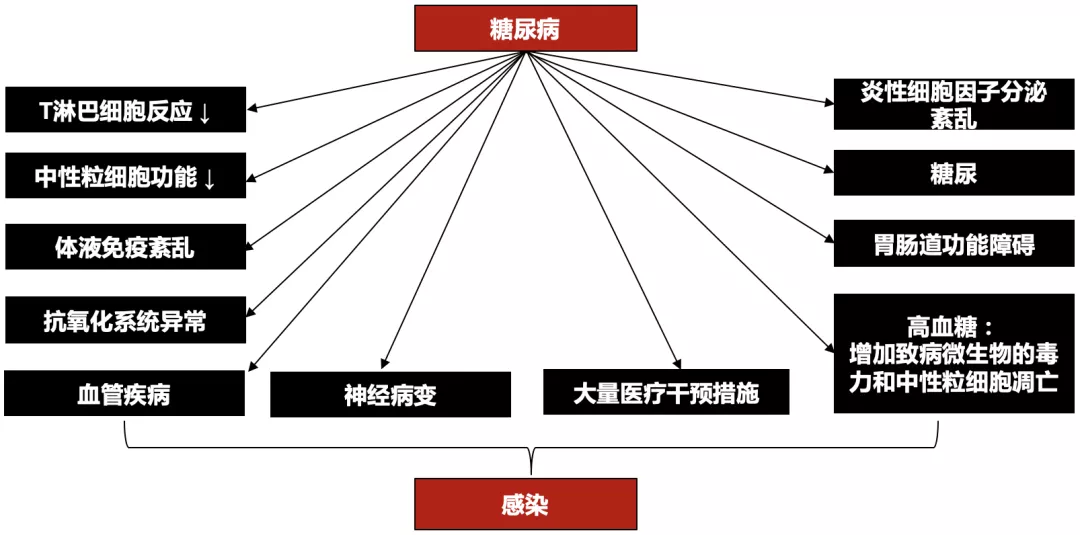
病毒、细菌和真菌都是导致肺炎的重要病原微生物;从一些体外研究发现,糖尿病患者的高糖内环境有利于病原菌定植、繁殖和扩散,使其更易感染肺炎。我们团队在流调中观察发现,在鼻咽部定植的最常见的是金葡菌,而在口咽部,定植肺克的比例高达6%!这也就是为何这两种细菌是糖尿病易感病原体的原因。

此外,高糖环境可使宿主肺泡巨噬细胞杀菌能力下降,防御功能缺陷,如此一来,初始的抗感染能力就下降了。

另外,糖基化终产物显著增加引起患者肺顺应性降低、引起血管内皮损伤,肺通气及弥散功能均受影响,导致病原微生物在肺内易于聚集。
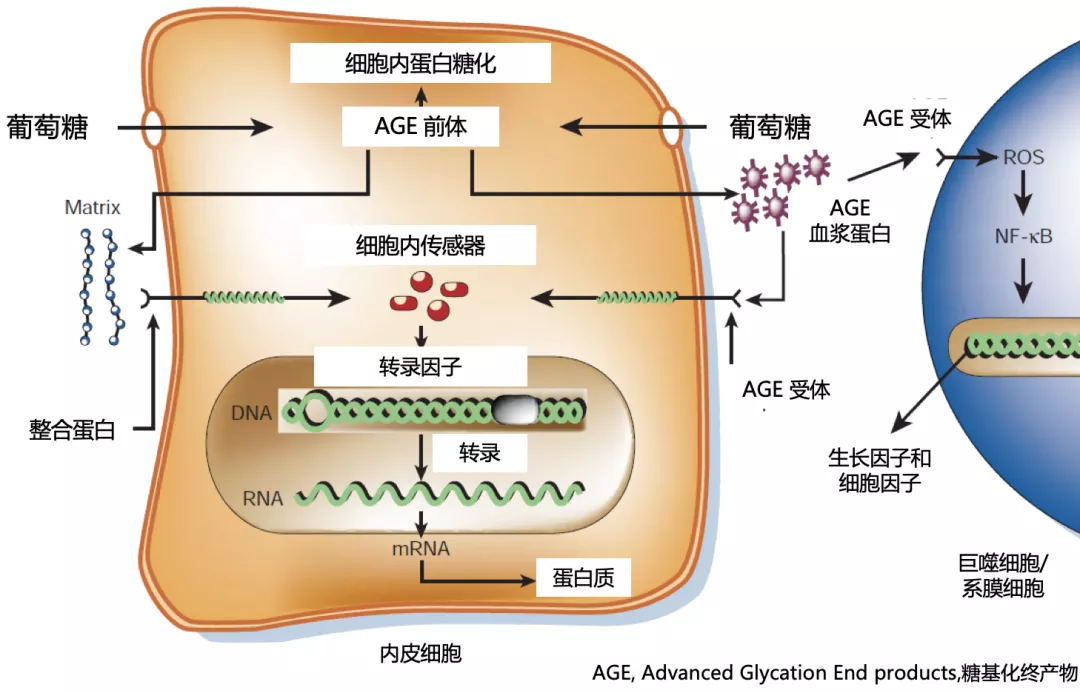
而且,糖尿病患者呼吸道黏液纤毛清除功能减弱,而糖尿病自主神经病变导致副交感神经调节支气管活动张力降低和引起支气管痉挛,导致呼吸道分泌物潴留和病原菌在局部寄殖。
还有胃动力不足、胃食管反流增加的情况,特别是糖尿病合并脑血管病变的时候,误吸风险会显著增加。
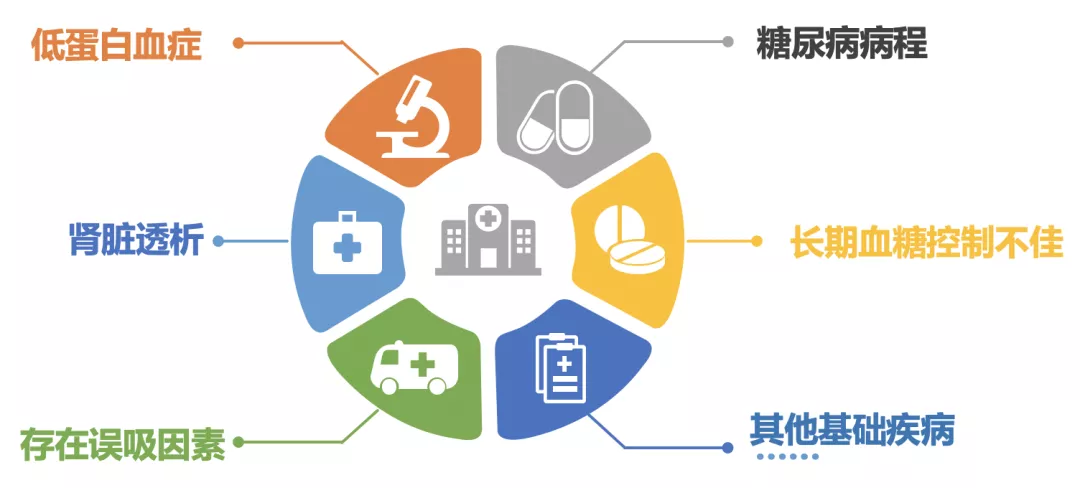
糖尿病合并肺炎的易感因素:
三、糖尿病合并肺炎的诊断路径尤为重要
近年呼吸专家都有一个共识:对于呼吸专科来说,我们首先要有内科基础的沉淀,然后才能做好呼吸医生,因为呼吸系统是个「窗口」,我们临床上经常遇到一些「自身免疫性疾病(肌炎、皮肌炎、SLE、血管炎等)、血液疾病累及肺部而被当作感染性疾病来治疗」的情况,这时鉴别诊断就尤为重要了。
在糖尿病合并肺炎的鉴别诊断方面,首先,我们的临床思维就是:到底是感染性疾病,还是非感染性疾病?第一步需详细询问病史、进行体格检查。
感染性疾病的诊断要点:
临床特征:发热、盗汗、咳嗽伴有脓痰,可有肺实变体征或闻及湿性啰音等。
实验室检查:血白细胞升高(可能是细菌感染)或降低(可能是病毒感染)、中性粒细胞核左移、降钙素原或C-反应蛋白升高等。
影像学表现:对于呼吸科医生来说,读片是很重要的。我们需要识别是否为感染,如果是,是哪种类型的感染?病毒?细菌?真菌?大部分细菌性感染表现为渗出、实变、以叶段分布,可伴有胸腔积液。病毒性感染可表现为间质性渗出,病原学检查有助于做初步鉴别。
当糖尿病患者发热、咳嗽、咳痰等症状伴胸部影像学异常时,除了感染性疾病,我们还有考虑是否为非感染性疾病,如:肺癌、肺栓塞/肺梗死、肺水肿、肺结核、机化性肺炎、过敏性肺泡炎等。同时注意,感染性疾病与非感染性疾病可以合并存在。
糖尿病合并肺炎的鉴别诊断
1 vs. 肺癌
症状:肺癌患者大多无急性感染中毒症状。
实验室检查:外周血白细胞计数可不高。
影像学:当有肿瘤阻塞气道时可出现阻塞性肺炎,经抗菌治疗急性感染灶消退后,肿瘤阴影可逐渐显现,或见肺门淋巴结肿大。
患者在一个叶段反复发生肺炎时,要积极做气管镜。实际上,若经抗生素治疗后肺部炎症不易消散,或暂时消散后可在同一部位再次出现,应密切随访,必要时进一步作CT、MRI、纤维支气管镜等检查。
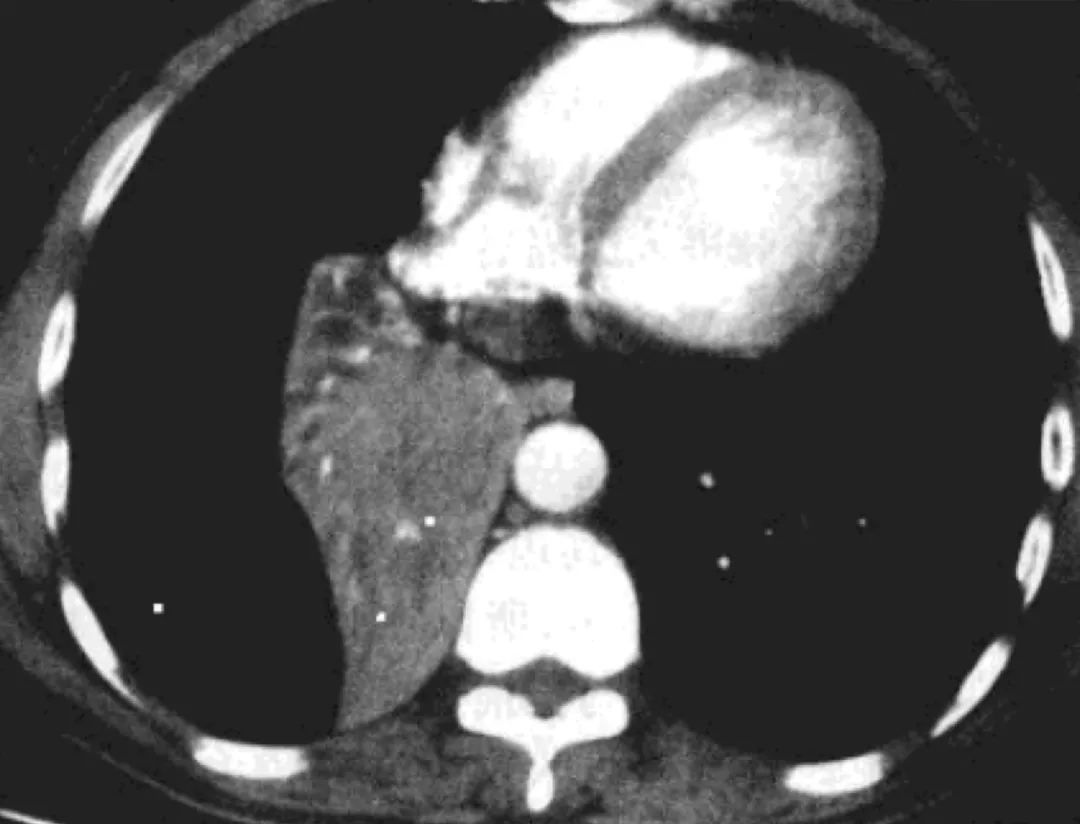
CT:右肺下叶中心型肺癌
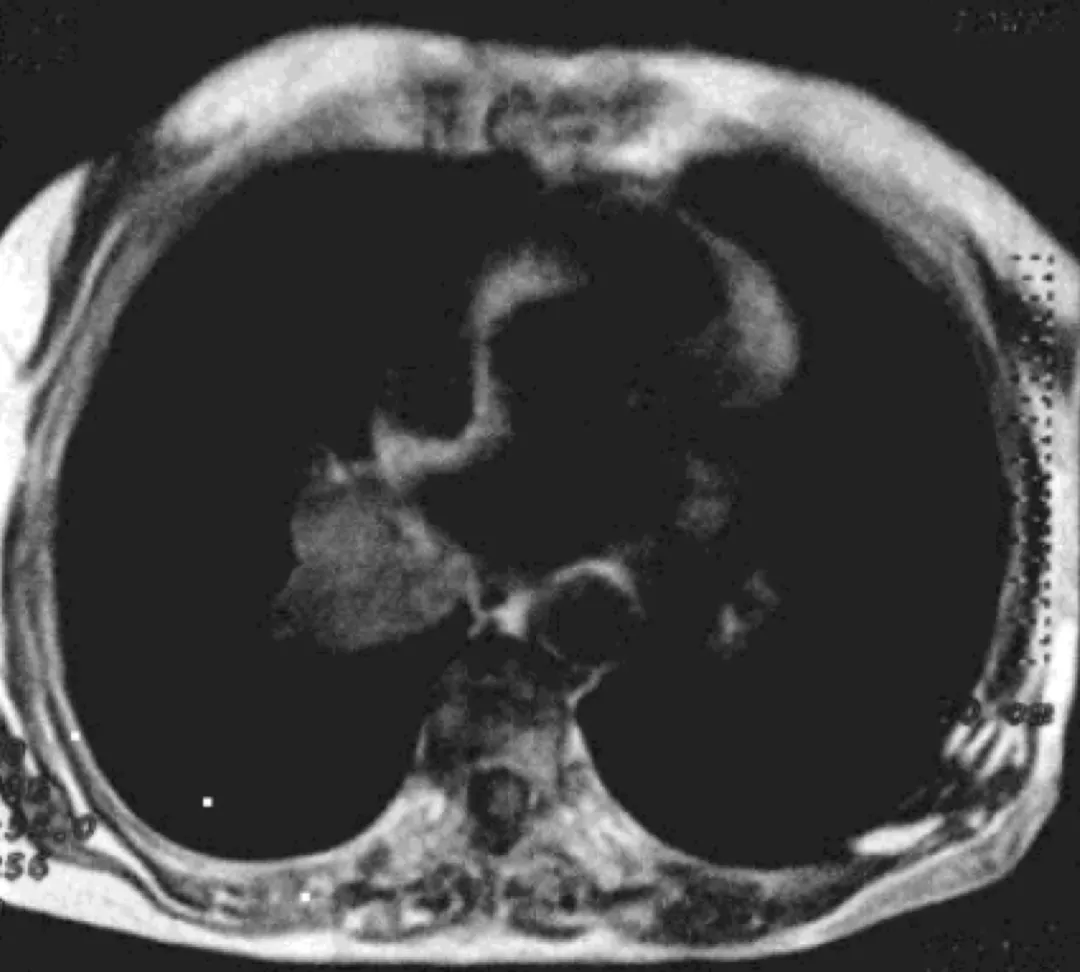
MRI:右肺下叶基底段区可见一不规则形肿块
2 vs. 肺栓塞/肺梗死
症状:肺栓塞可发生咯血、晕厥及呼吸困难,很多患者可能症状并不典型,只有其中一个症状。
影像学:胸片示区域性肺纹理减少,肺梗死时可见尖端指向肺门的楔形阴影。
此外,肺血栓栓塞症有静脉血栓的危险因素,多伴下肢深静脉血栓形成;CT肺动脉造影、D-二聚体、心电图、超声心动图、放射性核素肺通气/灌注扫描、肺动脉造影和MRI等检查有助于鉴别。
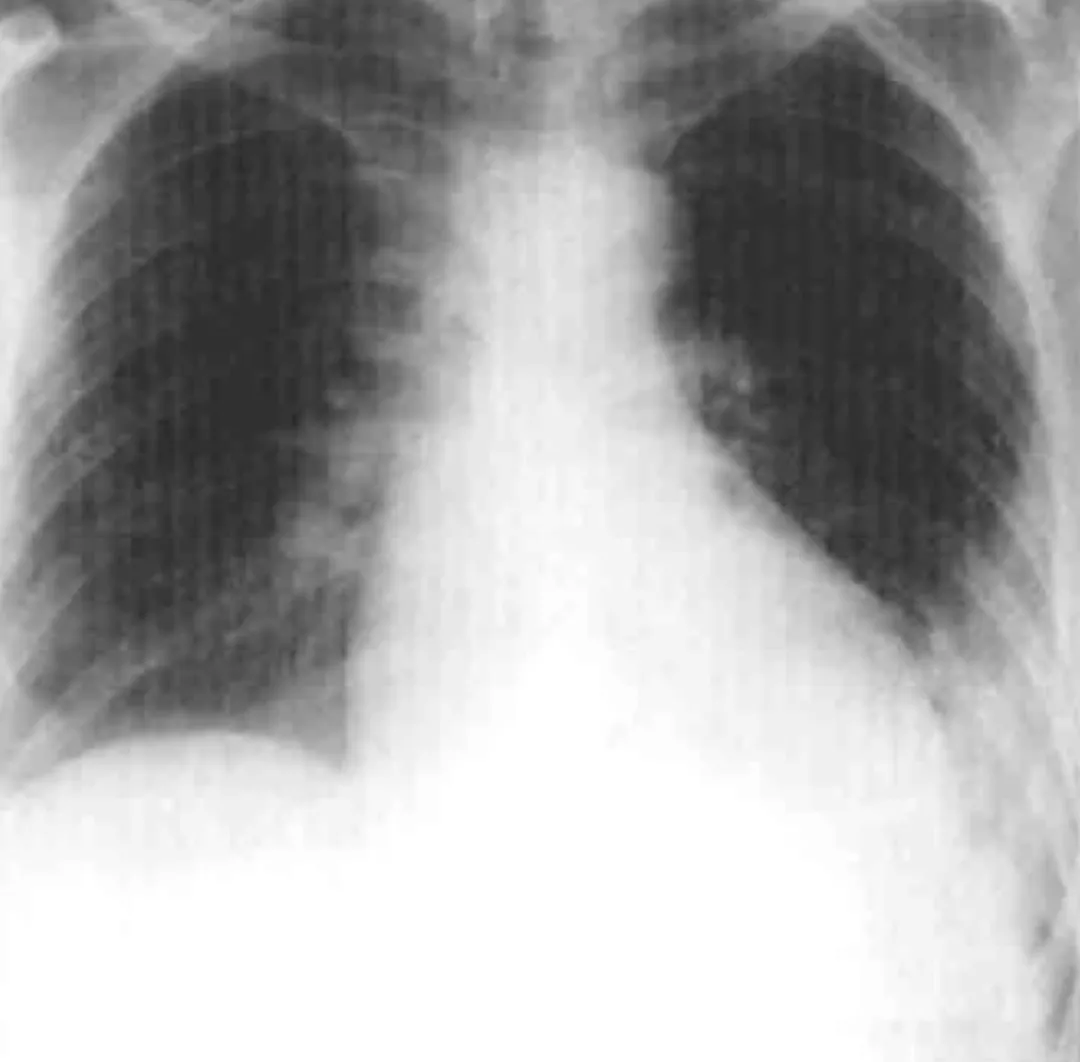
胸片:胸部正位片示左上肺纹理稀疏、纤细

CT肺动脉造影:左下肺动脉内充盈缺损
3 关注特殊病原体肺结核
症状:肺结核多有全身中毒症状,多数表现为反复午后低热,可有倦怠、乏动、夜间盗汗、女性月经不调等。病变急剧进展扩散时可出现高热,呈稽留热或弛张热型。
影像学:胸片上病变多在肺尖或锁骨上下,密度不均匀,新老病灶同时存在,有时可形成空洞。
病原学:痰涂片中可找到结核分枝杆菌,一般抗菌药物治疗效果差。
但糖尿病合并肺结核时结核中毒症状往往比较隐匿,影像学病变部位也不一定在结核好发部位,常有虫蚀样空洞存在。
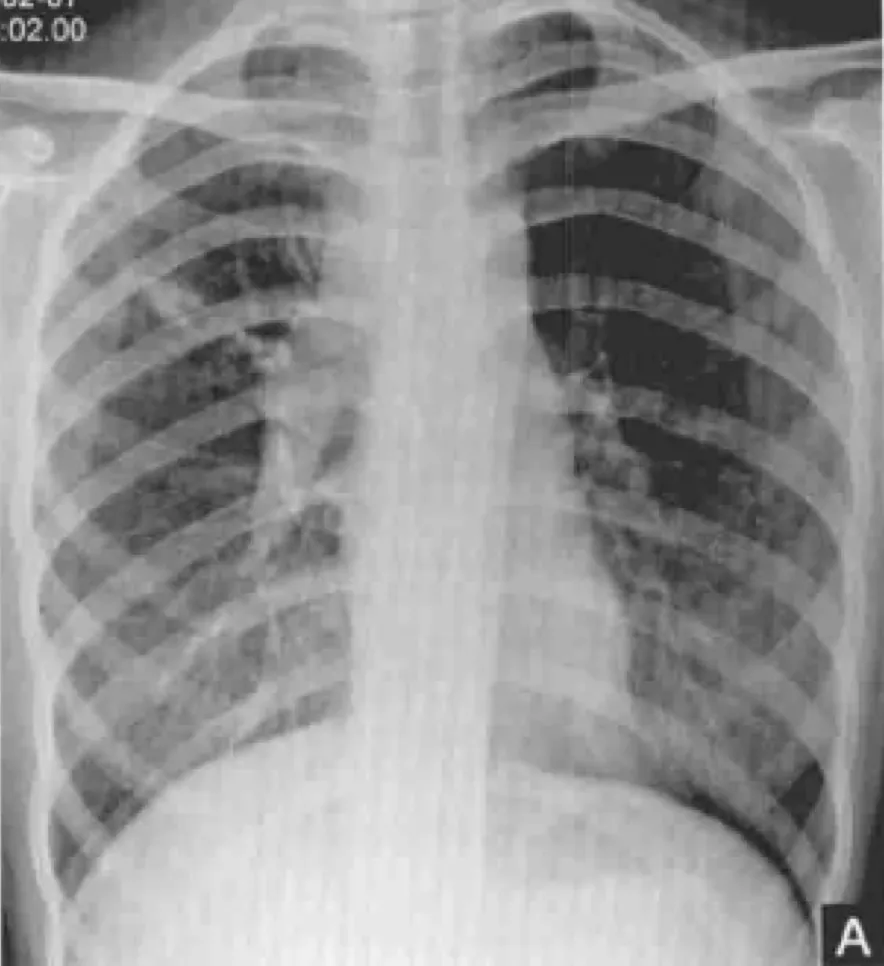
胸片:肺野内不规则结节、边缘锐利

痰液结核分枝杆菌检查:确诊结核病最特异的方法
4 vs. 机化性肺炎
临床表现、影像学、实验室检查、肺功能检查等结果「缺乏特异性」。
对于亚急性起病,临床表现及影像学特征表现为感染性肺炎的患者,抗感染治疗无效而激素治疗效果显著,应考虑机化性肺炎。
肺组织活检和病理学诊断是诊断机化性肺炎的重要依据。

5 vs 其它非感染肺部疾病
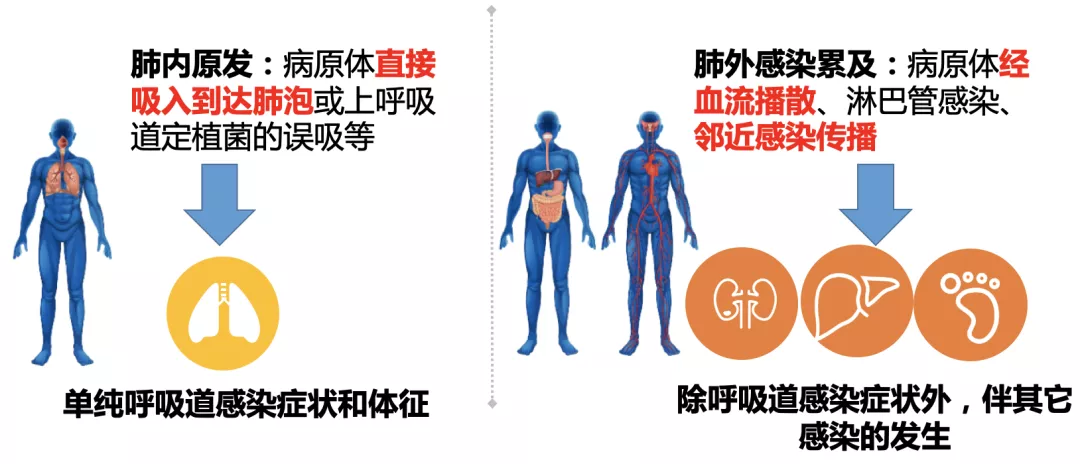
6 是肺内原发感染性病灶,还是肺外感染累及所致?
这一点非常重要,尤其是对于糖尿病患者——血行散播的糖尿病足、皮肤软组织感染;还有非常容易发生的肝脓肿和隔下脓肿,例如,肺炎克雷伯菌感染就非常容易引起肝脓肿和血流感染引起的肺炎。
所以,是肺内原发还是肺外感染累及肺,鉴别感染来源的要点是进行详细的病史询问和体格检查,根据症状和阳性体征选择相应的检查。
肺内原发:病原体直接吸入到达肺泡或上呼吸道定植菌的误吸等,单纯呼吸道感染症状和体征。肺外感染累及:病原体经血流播散、淋巴管感染、邻近感染传播,除呼吸道感染症状外,伴其它感染的发生。
1)血行散播
糖尿病患者出现下列情况之一时,需考虑合并血流感染可能:1、急性高热伴白细胞及中性粒细胞明显增高,不限于单一系统感染;2、新近皮肤、黏膜感染或创伤,有挤压疮疖史;3、呼吸道、泌尿道、胆道等部位感染,经规范抗菌治疗不能控制。
糖尿病患者出现血流感染的诊断:1、浅表器官超声鉴别皮肤软组织感染;2、腹腔脏器超声或CT鉴别深部脏器感染;3、血培养或骨髓培养阳性为其确诊依据。
2)隔下脓肿、肝脓肿
肺脏附近器官感染均可导致肺炎的发生,肺炎克雷伯杆菌、大肠埃希菌是肝脓肿的主要致病菌。糖尿病合并肝脓肿患者发生早期易出现侵袭综合征,包括眼、肺和中枢神经系统是最常见的播散部位,该类患者病情重、病死率高。
四、评估糖尿病合并肺炎的严重程度
评估肺内感染严重程度工具还是我们常见的——糖尿病合并CAP严重程度评估:CRB-65量表、CURB-65量表、PSI量表;糖尿病合并HAP严重程度评估:SOFA/q SOFA量表、APACHE-Ⅱ量表、IBMP-10量表。(CAP:社区获得性肺炎;HAP:医院获得性肺炎)
CRB-65和CURB-65量表:

(CURB:意识障碍,血尿素氮,呼吸频率,血压和年龄;CRB:意识障碍,呼吸频率,血压和年龄)

CURB-65虽然便捷,但对评估糖尿病合并肺炎严重程度不够全面和特异。
五、糖尿病合并肺炎的治疗路径
初始经验性治疗抗感染药物选择的原则
(一)用药前需明确患者病史及临床特点
第一步:首先确定患者发病的场所是社区还是院内。
第二步:根据临床及影像学特征推测最有可能的病原体,并根据患者病情严重度及耐药风险进行分层治疗;覆盖常见病原体兼顾患者基础疾病、器官功能状态、药物的PK/PD(药物代谢动力学/药物效应动力学)特性、药物过敏史等选择恰当的抗感染药物和给药方案。
(二)根据本地区及本医院的病原体分布及耐药特点选择抗感染药物
我国不同地区病原流行病学分布和抗感染药物耐药率差异明显,所以治疗推荐仅仅是原则性的。
我国肺炎患者常见病原菌:社区获得性肺炎:肺炎支原体、肺炎链球菌;医院获得性肺炎/呼吸机相关性肺炎:鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌、大肠埃希菌。
我国肺炎患者耐药情况:249758株分离株中,呼吸道分泌物占40.7%,是主要的标本来源;临床分离菌中甲氧西林耐药菌、万古霉素耐药肠球菌、产ESBL肠杆菌科细菌、碳青霉烯类耐药革兰阴性杆菌等检出率较高,对常用抗菌药物的耐药率也较严重。
(三)抗感染药物选择时的注意事项
选择抗感染药物时还要注意患者糖尿病相关的脏器损害程度,如糖尿病肾病;要注意抗菌药物在肺组织局部的浓度和抗菌活性;注意是否可能与降糖药物产生相互作用,从而导致血药浓度降低或血糖代谢异常等。
(四)初始治疗失败或病情反复时,需要特别关注的点
如果初始治疗失败或病情反复,需要特别关注糖尿病患者是否伴有肺外感染病灶,如皮肤软组织感染(包括糖尿病足)、肺外脓肿(如肝脓肿)或伴发血流感染形成迁徙性病灶;此外还需要关注机会性病原体感染风险增加(如分枝杆菌、军团菌、曲霉、毛霉以及肺孢子菌等)。
(五)呼吸喹诺酮类的使用
在抗菌活性和药代动力学方面能够较好满足社区获得性下呼吸道感染治疗需要的新型喹诺酮,包括:左氧氟沙星、莫西沙星、吉米沙星等。
呼吸喹诺酮类可用于药物过敏或不耐受患者的替代治疗,但需要警惕其可能带来的肺结核诊断的延误及血糖异常波动等问题。
糖尿病合并CAP初始经验性治疗抗感染药物的选择
对于门诊轻症患者,常见病原体为肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、肺炎支原体、肺炎衣原体、流感病毒等,推荐口服给药,①青霉素类/酶抑制剂复合物;②二代、三代头孢菌素;③上述药物联合大环内酯类;④呼吸喹诺酮类;⑤多西环素/米诺环素;⑥流感流行季节考虑口服奥司他韦等。
对于需入院治疗但不必入住ICU的患者,常见病原体为金黄色葡萄球菌、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、肺炎克雷伯菌、厌氧菌、支原体、军团菌、流感病毒、呼吸道合胞病毒等;推荐静脉给药,①青霉素类/酶抑制剂复合物;②三代头孢菌素或其酶抑制剂复合物、头霉素类、氧头孢烯类、厄他培南等;③上述药物单用或联合大环内酯类;④呼吸喹诺酮类;⑤流感流行季节考虑口服奥司他韦等。
对于需入住ICU的患者,常见病原体为肺炎链球菌、军团菌、肺炎克雷伯菌、肠杆菌科菌、金黄色葡萄球菌、厌氧菌、流感病毒、腺病毒等;推荐静脉给药,①青霉素类/酶抑制剂复合物、三代头孢菌素/酶抑制剂复合物、四代头孢、氧头孢烯类、碳青霉烯类等β-内酰胺类联合大环内酯类或呼吸喹诺酮类;②流感流行季节考虑口服奥司他韦等。
特别提醒大家以下几点:
> 糖尿病患者发生重症流感后继发肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌、曲霉菌感染风险增加,需关注混合感染问题
> 糖尿病患者要考虑肠杆菌科细菌感染可能,评估产ESBL肠杆菌科细菌感染的风险
> 有吸入性肺炎风险者需进一步关注吸入风险因素及厌氧菌的药物覆盖
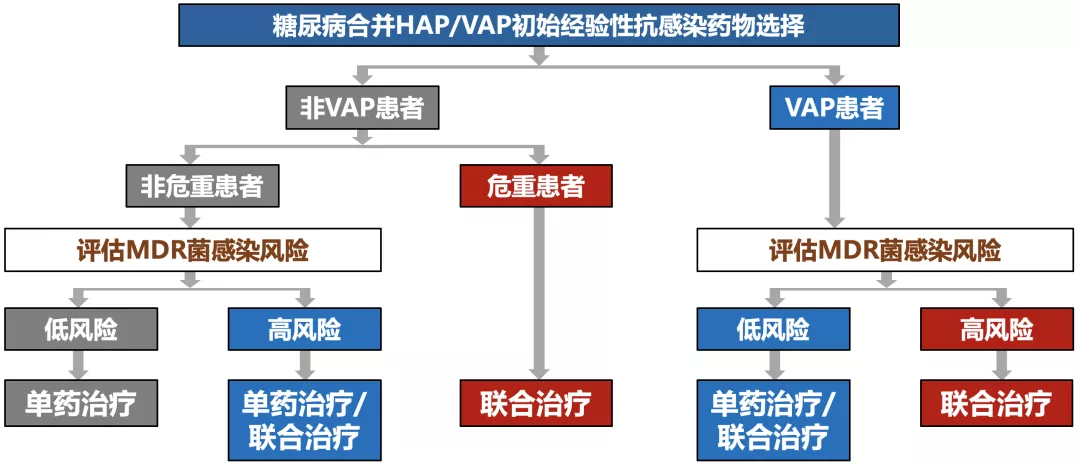
糖尿病合并HAP/ VAP初始经验性抗感染治疗方案选择
注意:
> 根据患者病情严重度及耐药危险因素等参数进行分层治疗
> 糖尿病住院患者尤其要关注长期卧床引起的褥疮等皮肤软组织葡萄球菌感染继发血流感染,导致全身感染播散
> 各种医疗措施增加皮肤黏膜屏障破坏(如气管插管、留置胃管或深静脉导管等)引起肺炎克雷伯菌、念珠菌等内源性感染风险
> 肾脏透析增加MRSA感染风险
糖尿病合并肺炎的目标性抗感染疗程及选择
糖尿病合并肺炎的抗感染疗程一般在7d以上,对于初始抗感染治疗无效、病情危重、泛耐药(XDR)或全耐药(PDR)菌感染、肺脓肿、脓胸或坏死性肺炎者,应酌情延长疗程至14-21d。
注意:
> 需谨慎鉴别区分感染与定植或污染
> 延长疗程,可以考虑静脉抗感染药物序贯为同类的口服药
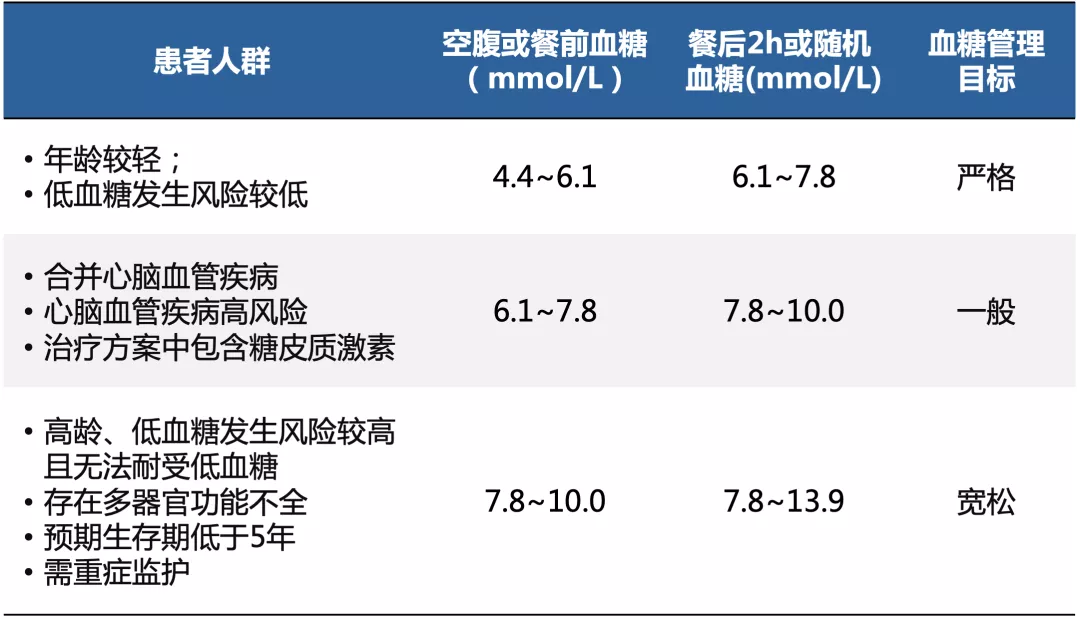
糖尿病合并肺炎患者需设定个体化的血糖管理目标
糖尿病合并肺炎患者血糖管理的主要措施
对于大多数糖尿病合并肺炎患者,胰岛素是控制血糖的首选治疗。
需进行重症监护的患者:推荐采用持续静脉小剂量胰岛素输注,监护期间可根据血糖波动情况随时调整胰岛素剂量;病情稳定拟改用胰岛素皮下注射时,需在停止静脉输注胰岛素前1~2h开始接受皮下胰岛素注射,同时,每日皮下胰岛素注射的总剂量可以在原每日静脉胰岛素注射的总剂量基础上减少约20%~40%。
无需进行重症监护的患者:推荐皮下胰岛素注射治疗,无法正常进食、需肠内或肠外营养的患者,根据不同营养摄入情况制定血糖管理方案。
六、糖尿病合并肺炎的预防
1、接种PPSV23疫苗预防肺炎:2~64岁糖尿病患者应接受PPSV23肺炎球菌疫苗;年龄≥65岁糖尿病患者无论接种史如何,都需要重新接种PPSV23疫苗。
2、葡萄球菌去定植:保持皮肤清洁,加强口腔卫生;采集鼻和咽拭子进行MRSA主动筛查,及时干预。
参考文献
[1] 中国糖尿病防治指南(2004版).
[2] Yongze Li, et al.BMJ. 2020 Apr 28;369:m997.
[3] IDF DIABETES ATLAS. 9th Edition.2019.
[4] https://diabetesatlas.org/en/resources/
[5] Wu T, et al. J Diabetes Investig. 2018 Mar;9(2):244-255.
[6] Abu-Ashour W. et al. BMJ Open Diabetes Res Care. 2017 May 27;5(1):e000336.
[7] Koskela HO, et al. BMJ Open, 2014, 4(8):e005715.DOI: 10.1136/bmjopen⁃2014⁃0057
[8] Casqueiro J et al. Indian J Endocrinol Metab. 2012 Mar;16 Suppl 1:S27-36.
[9] 石小霞, 等. 中国病原微生物学杂志,2018,13(12): 1409-1412.
[10] Sunahara KK, et al. J Leukoc Biol. 2012;91(6):871‐876.
[11] M Brownlee. Nature. 2001 Dec 13;414(6865):813-20.
[12] 邓伟吾. 临床肺科杂志, 2010, 15(7): 903-905.
[13] 糖尿病合并肺炎诊治路径中国专家共识
[14] 李清泉等. 肺脏疾病鉴别诊断学(第2版). 科学出版社
[15] 郭其森. 现代肺癌诊断治疗学.山东科学技术出版社
[16] 檀春玲等. 医学新知杂志 2017;27(3):263-265
[17] 王良兴等. 呼吸系统疾病的检验诊断. 人民卫生出版社
[18] 翟群超等.安徽医学 2016;(9):1176-1178
[19] 彭启容等. 现代医药卫生 2019;35(7):1029-1032
[20] W S Lim, et al. Thorax. 2003 May;58(5):377-82.
[21] M J Fine, et al. N Engl J Med. 1997 Jan 23;336(4):243-50.
[22] 中华医学会呼吸病学分会. 中华结核和呼吸杂志 2016;(4):253-279
[23] J L Vincent, et al. Intensive Care Med. 1996 Jul;22(7):707-10.
[24] Mervyn Singer, et al. JAMA. 2016 Feb 23;315(8):801-10.
[25] W A Knaus, et al. Crit Care Med. 1985 Oct;13(10):818-29.
[26] Mehdi Mirsaeidi, et al. Clin Infect Dis. 2009 Jul 1;49(1):72-7.
专家介绍

周敏
主任医师,正教授,法国居里硏究所博士后;上海交通大学附属瑞金医院呼吸与危重医学科副主任,博士生导师;主要从事慢性气道疾病、肺部感染及肺癌的临床硏究。中华医学会呼吸病分会青年委员及慢阻肺学组委员。中国医师协会呼吸分会慢阻肺委员会委员、政策委员会副主委;上海医学会呼吸病分会委员和慢阻肺学组副组长;发表论文80余篇,SC论著30余篇,包括 LANCET等;主持科技部慢病重大专项1项,国家自然基金3项;获中国医师协会呼吸分会优秀中青年医师奖、上海市科委优秀学科带头人。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢周敏教授的审阅修改!
本文完
未经许可,请勿转载


