
编前语
PCCM疑难病例讨论直播重磅归来!受新冠疫情等因素影响日子里,同行们亲历、见证了呼吸学科的诊疗管理水平的发展变化,其中危重症、疑难病例的救治经验尤其宝贵。在近一年时间里,《呼吸界》后台经常收到过许多读者的留言,他们反复询问PCCM疑难病例讨论直播何时再启,感谢呼吸界同行的信任和厚爱。
10月30日19:00,呼吸领域极高水平的MDT——「PCCM疑难病例讨论」直播在协和医院开讲本季第四期,青年女性反复喘憋、阻塞性通气功能障碍为哪般?
入院情况
女,20岁,2023年3月24日入院。
主诉:咳嗽、呼吸困难10月,发现盆腔占位1月余。
现病史:
2022-05患者无诱因出现咳嗽、喘憋,伴咳少量白粘痰、心悸、乏力,活动后明显加重;无发热。就诊当地医院:查血常规、肝肾功、炎症指标均正常;输血8项、G试验、隐球菌抗原、痰培养(-);总IgE 1639 KU/L;ANA 1:320(胞浆型),余抗核抗体谱、ANCA、Ig3项+补体2项、RF、抗CCP均(-);肺功能:FEV1/FVC 43%,FEV1 0.99L(26.9%),FVC 61%,舒张试验阴性(具体不详)。胸部CT、ECG、超声心动图“未见明显异常”。考虑“支气管哮喘急性加重”,予甲泼尼龙 40mg iv qd×5d、布地奈德福莫特罗吸入+布地奈德雾化、孟鲁司特、左氧氟沙星 0.5g iv qd×8d后症状好转,遂停药出院。出院后患者仍间断咳嗽、胸闷、憋气,中药治疗无显效。
2022-09再次憋气加重,伴咳嗽、咳淡黄色痰,就诊省立医院:查常规化验大致同前,总IgE 1080 KU/L;CRP、ESR、IL-6、PCT、G试验、GM试验(-);过敏原筛查:尘螨类混合sIgE 1级,mx2、m3(-)。胸部CT:“支气管炎改变”;肺功能:大致同前,FeNO 38ppb。考虑“过敏性哮喘(重度)”,予头孢唑肟+左氧氟沙星抗感染、甲泼尼龙 40mg iv qd抗炎(疗程不详)、布地奈德福莫特罗2吸/天,并于09-20、10-14分别予奥马珠单抗300mg治疗后憋气好转,但仍有咳嗽、少量黄痰;09-20出院后每日口服激素2-3片,5日内减停,继续规律吸入布地奈德福莫特罗治疗。
2022-11患者劳累后出现明显喘憋、胸闷,就诊外院:查总IgE 3047 KU/L,G试验 127pg/ml,m3、mx2、GM试验(-)。考虑“支气管哮喘急性发作、变应性支气管肺曲霉病”,予伊曲康唑(0.2g qd)+左氧氟沙星+甲泼尼龙(40mg iv qd)后症状减轻。11-15出院后规律口服泼尼松(25mg qd×7d→20mg qd维持)及伊曲康唑。
2023-02-06患者无诱因突发颈部胀痛、憋气加重,查胸部CT提示纵隔气肿、颈部软组织积气;双肺散在淡片影。查总IgE 365 KU/L,曲霉菌IgG 308.57 AU/ml,余化验未见明显异常。予氧气吸入、哌拉西林他唑巴坦经验性抗感染,将伊曲康唑改为伏立康唑+泼尼松15mg qd。2023-02-15复查胸部CT示纵隔积气较前吸收;但2023-02下旬起患者憋气、咳嗽等症状逐渐加重:稍活动即有明显喘憋,日常活动需轮椅辅助。
2023-03就诊我院呼吸科门诊:查T-IgE 306.0KU/L,ECHO未见异常。肺功能(通气+可逆):FEV1/FVC 29.7%, FEV1 0.37L(10%),吸入支气管扩张剂后FEV1 0.35L(改善-5%),FVC 1.24L(29%)→1.36L(32%)。胸HRCT+腹盆CT平扫:双肺多发支气管扩张,并多发淡片索条影,考虑支扩伴感染可能;颈根部及纵隔多发积气。右侧盆底软组织密度占位,其内少许钙化,性质待定。为进一步诊治收入我院。
自2021-12出现持续性上下唇粘膜齿缘处、舌右缘及右侧颊粘膜白色痛性溃疡;2022-05激素治疗后好转;但2023年3月初上述口腔溃疡再发,伴咽痛。2023-01-23曾有一过性双膝关节严重疼痛,活动受限;2023年3月中旬双手腕关节、近端及远端指间关节疼痛伴晨僵(口服激素0.5片 Qd),否认关节肿胀、活动障碍。轻度口眼干,脱发明显;精神睡眠欠佳,食欲及食量明显下降,二便正常,病来体重下降15kg。
既往史、个人史、月经史、家族史:无殊,生长发育正常,既往体健,否认有毒及刺激性气体吸入史。
入院查体:BP126/87mmHg,HR 80bpm,SpO2 98%@RA,多发口腔粘膜糜烂,周身未见皮疹,未及浅表淋巴结肿大。双肺呼吸音偏低,呼气相延长,轻度哮鸣音,未及湿啰音,心律齐,腹软,无压痛、反跳痛,未触及明显包块,双下肢不肿,各关节无红肿、压痛、活动受限
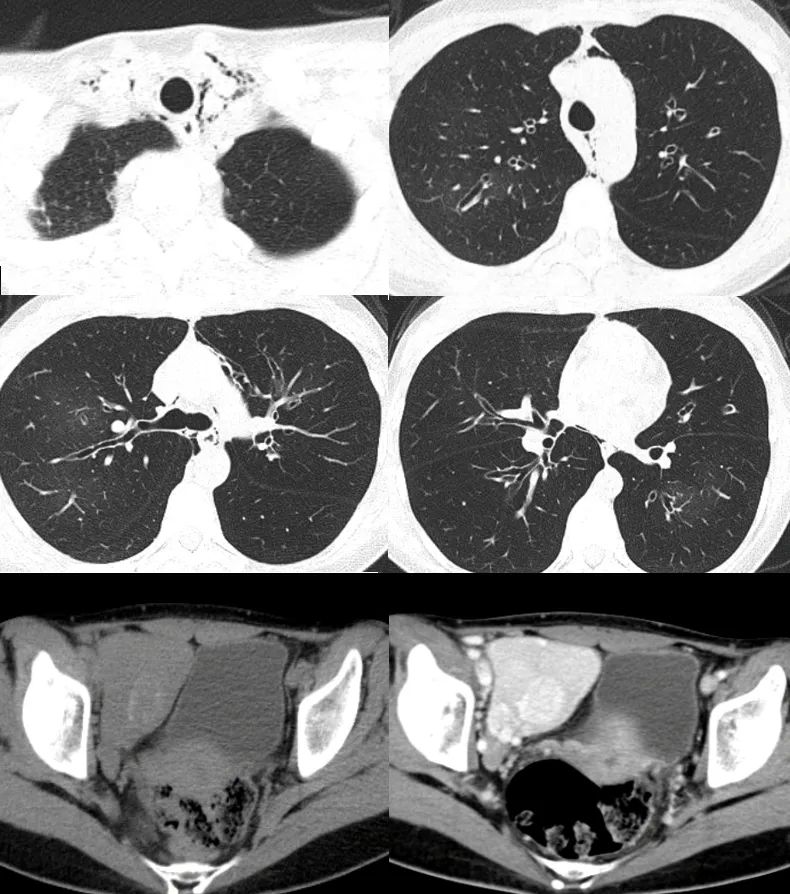
影像学(2023-2):
呼吸与危重症医学科博士研究生石钰洁、临床博士后王梦淇总结病例特点:
-青年女性,慢性病程,逐渐加重
-呼吸系统:
>咳嗽、气短,双肺哮鸣音,极重度阻塞性通气功能障碍,舒张试验阴性
>EOS正常范围,IgE升高,m3、mx2(-),曲霉IgG(+)
>胸部CT可见支气管扩张伴肺过度充气,曾出现纵隔气肿
>激素+支气管扩张剂±抗真菌治疗后症状部分好转
-全身表现:
>反复多发口腔糜烂,激素治疗可好转
>多关节痛,口眼干,脱发,ANA 1:320(胞浆型)
>炎症指标、补体、Ig3项、RF、抗CCP、ANCA(-)
>盆腔占位,增强CT示明显强化,PET SUVmax 6.8,髂血管旁多发淋巴结
互动问题一:初步诊断?
线上投票:结缔组织病肺受累>>闭塞性细支气管炎>ABPA>囊性纤维化>弥漫性泛细支气管炎>复发性多软骨炎
诊断分析
①患者呼吸系统方面存在不可逆性阻塞性通气功能障碍,是否符合支气管哮喘诊断?
PCCM学员张顺医师分析:患者的临床表现与典型支气管哮喘的发作性症状不同,两次支气管舒张试验均为阴性结果,考虑不符合支气管哮喘诊断。
②舒张试验阴性是否可以排除哮喘诊断?
进修医师徐劲松医师分析:舒张试验阴性不能排除哮喘诊断。对于病情较轻、小气道阻塞不严重的哮喘患者,舒张试验可能尚不能达到阳性的标准;对病程较长、病情较重的患者,气道分泌物堵塞管腔,舒张试验结果可能为阴性;此外,如果患者做舒张试验前没有充分停用长期应用的支气管舒张剂,也可能得到阴性结果。
③本例患者是否符合ABPA诊断?
PCCM学员谢怀娅主治医师分析:本例患者不符合典型支气管哮喘的诊断,但存在一些哮喘样的临床症状,影像学可以看到支气管扩张的表现,同时存在总IgE和曲霉IgG升高,这些可以符合ABPA的表现。但患者病程中无嗜酸性粒细胞明显升高,且曲霉特异性IgE为阴性,CT上未看到典型黏液栓表现,不完全支持ABPA的诊断。
④肺部表现是否可能继发于自身免疫性疾病?
风湿免疫科周央中主治医师分析:本例患者为育龄期女性,慢性病程,存在多系统受累表现,病史中有口腔糜烂、关节症状、脱发、轻度口眼干表现,外院ANA为1:320胞浆型阳性,激素治疗似乎是有效的,这些都会让我们考虑是否存在自身免疫性疾病。自身免疫性疾病累及气道相对少见,以类风湿关节炎和干燥综合征较多见,患者Ig3项、ACPA、抗SSA/SSB均为阴性,临床表现不典型,暂不符合诊断。在抗体阴性的自身免疫性疾病中,对于本例患者需要重点考虑的是白塞病,患者病程中存在口腔黏膜糜烂,但非典型口腔溃疡表现;系统性血管炎肺部多表现为动脉瘤、血栓,可有结节或者空洞性病变,少见气道受累。从一元论角度,自身免疫性疾病很少出现盆腔占位,IgG4相关疾病可能形成肿块性病变,也可能累及气道,可以完善IgG4检测,但整体病情非IgG4相关疾病常见表现。可以考虑从盆腔占位的性质入手,尝试获取病理诊断。
⑤陈述分析思路:
主讲人陈茹萱主治医师:
以小气道病变作为诊断切入点,常见的病因包括:
-慢性阻塞性肺疾病:患者为青年女性,无吸烟等危险因素,暂不考虑COPD
-支气管哮喘:患者无典型哮喘表现,对于难治性哮喘样表现,需要考虑是否继发于变应性支气管肺曲霉菌病、嗜酸性肉芽肿性多血管炎等疾病,目前无充分证据支持相关诊断
-各种类型的细支气管炎,其中最符合本例患者病情的类型为闭塞性细支气管炎(BO)。BO相对少见,常继发于器官移植、感染、吸入、免疫病、肿瘤等,从一元论的角度,似乎能将盆腔占位(可疑肿瘤)与肺部病变联系起来。BO可见于副肿瘤性天疱疮(PNP),其机制是自身免疫性T细胞及自身抗体介导的细胞间黏附分子功能障碍。BO的诊断“金标准”为病理检查,但临床上大部分患者可通过结合病史、影像学表现及肺功能结果进行临床诊断,常用的诊断标准为造血干细胞移植后BOS的诊断标准。
入院诊断
闭塞性细支气管炎可能性大
极重度阻塞性通气功能障碍
自发性纵隔气肿
盆腔肿物性质待查
恶性不除外
副肿瘤性天疱疮?
PCCM学员石穿主治医师陈述诊疗计划:入院后重点围绕盆腔占位的性质、BO的病因进行相关检查。
入院后辅助检查:
>ABG@RA: 7.37/44/74/95.6%/24.3
>血常规:WBC 10.26×10^9/L,EOS% 5.3%,EOS# 0.54×10^9/L,HGB 147g/L,PLT 246×10^9/L
>血生化:大致正常
>hsCRP、ESR、Fer、PCT、IL-6/8/10(-), TNF-α 9pg/ml(<8.1)
>IgE 118.0KU/L;mx2、m3(-)
【感染】
>痰真菌培养(合格痰标本):烟曲霉(1-2CFU);G试验、GM试验
>痰细菌培养、抗酸染色、TB/NTM核酸、Xpert(-)
>嗜肺军团菌LP-IgM(+) 2.31S/CO;呼吸道病原体IgM九项、CMV、EBV、T-SPOT.TB(-)
【免疫】
>ANA17项:ANA (+)波形蛋白型1:80;LA、APS抗体谱、ANCA、RF、抗CCP(-)
>天疱疮相关自身抗体:抗BP180、Dsg-1、Dsg-3(-);外送间接免疫荧光(IgG)-鼠膀胱上皮底物(+)1:320棘细胞间
>TB细胞亚群:T8# 838个/μl ↑,余(-);Ig3项+补体、IgG亚类(-)
【肿瘤】
>肿瘤标记物:CA19-9 52.0U/ml,CA125 96.8U/ml,CA242 41.5U/ml,CA72-4 12.7U/ml,CEA/SCCAg/NSE/Cyfra211/proGRP、AFP、βHCG(-) ;
>血清及尿免疫固定电泳、游离轻链未见异常
【肺功能】
>通气:FEV1/FVC 21.15%,FEV1 0.45L(12%),FVC 2.13L(51%)
>对比2023-2通气+可逆:FEV1 0.37L→0.35L,FVC 1.24L→1.36L
>容量:TLC 6.72L (112%),RV 4.89L (312%);RV/TLC 72.85% (265%)
>弥散:DLCOc SB 41%, DLCOc/VA 72%
>FeNO:11ppb
【影像学】
腹盆增强CT正式报告:右侧盆底软组织密度占位,大小约65mm×61mm,其内少许钙化,增强扫描明显强化,周围多发迂曲血管影,右侧髂窝巨大淋巴结增生症(Castleman病)?神经源性肿瘤(副节瘤)?
主讲人陈茹萱主治医师文献复习:
Castleman病是亚洲人群副肿瘤性天疱疮(PNP)最常见的病因,也是PNP继发闭塞性细支气管炎(BO)患者中最常见的原发肿瘤类型。Castleman病是一种淋巴组织增生性疾病,其确诊需要获取病理检查结果,还要结合临床除外感染、肿瘤、自身免疫性疾病。对于受累淋巴结局限于1个淋巴结区的病例,称为单中心型Castleman病,首选治疗手段为手术切除。
目前考虑本例患者为Castleman病继发PNP-BO可能,诊断已有眉目,但治疗方面仍较为棘手。
互动问题二:BO的治疗方法?(多选)
线上投票:吸入支气管扩张剂>全身激素>吸入激素>>JAK抑制剂>托珠单抗>孟鲁斯特>>尼达尼布>吡非尼酮
入院后治疗:
•BO治疗:泼尼松加量至15mg qd;规律吸入ICS+LABA +LAMA及雾化ICS+SABA+SAMA;口服阿奇霉素250mg qod
•肺部感染不除外:军团菌IgM+,予左氧氟沙星0.5g po qd经验性抗感染;住院期间咳绿痰、CRP轻度升高,围术期改用头孢他啶2g iv q12h治疗2周
•气道曲霉感染不除外:痰烟曲霉培养阳性,予伊曲康唑治疗
•对于BO的治疗,发现并治疗背后的病因非常重要,因此入院后积极推动盆腔占位的活检或(和)手术切除,以明确诊断、指导治疗;但BO的病理改变存在纤维化成分,病变可能难以逆转
-瘤体较大、血供丰富、周围毗邻结构复杂,患者肺功能差,手术风险高,经呼吸科全科讨论及多次多科讨论,最终成功完成局麻下盆腔肿物活检(病理提示为Castleman病)及椎管内麻醉下肿物切除,手术病理诊断为混合细胞型Castleman病。
出院诊断
混合细胞型Castleman病
副肿瘤性天疱疮
闭塞性细支气管炎
口腔糜烂
气道烟曲霉感染不除外
出院后随访:
换着出院后继续泼尼松15mg qd(拟维持2-3个月后减量),沙利度胺50mg qn(因头晕、嗜睡明显已停用),阿奇霉素0.25g qod,孟鲁司特10mg qn,ICS+LAMA+LABA吸入,乙酰半胱氨酸、氨溴索化痰,伊曲康唑抗真菌满4周后停用。
出院1-2个月内患者活动耐量较前所有改善,平地行走1500m左右无显著气短,无咳嗽、咳痰,体温正常,口腔糜烂较前减少,饮食改善,复查肺功能大致同前。
2023年6月二次感染新冠后出现喘憋加重,体温正常,SpO2 85%@RA,PaCO2 50mmHg,纵隔气肿有所增多,外院予激素加量后好转,并加用吡非尼酮抗纤维化治疗。
多科发言
病理科王文泽教授解读病理结果:
手术切除标本为多个融合的淋巴结,其内淋巴滤泡结构完整,可见生发中心萎缩、套区扩大呈同心圆状/洋葱片样,滤泡间血管增生、可发生玻璃样变、伸入生发中心形成“棒棒糖”样结构,间区见浆细胞浸润,兼具透明血管型及浆细胞型特点,因此诊断为混合细胞型Castleman病,免疫组化结果也支持Castleman病,未发现淋巴瘤相关表现。需要注意的是诊断Castleman病时建议尽可能切取完整淋巴结送病理,通过穿刺活检标本诊断较为困难;此外,组织病理只是Castleman病诊断标准中的一条,确诊还需要结合整体临床病史。
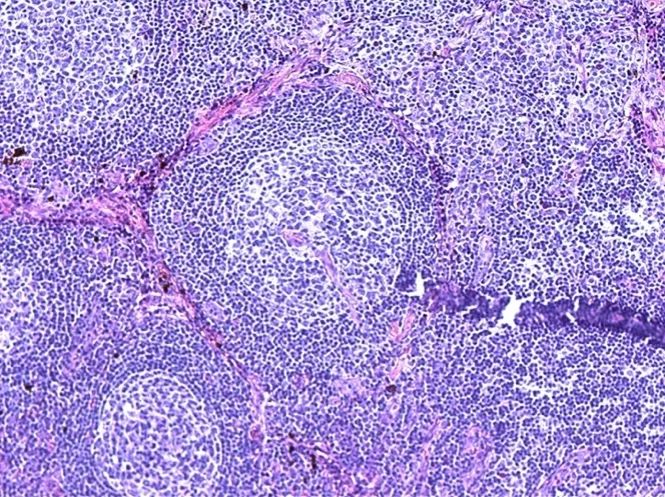
“棒棒糖”样表现
皮肤科曾跃平副教授分享PNP诊治进展:
副肿瘤天疱疮(PNP)在中国人群中最常见的原发肿瘤类型为Castleman病,其他常见病因为慢性淋巴细胞白血病、非霍奇金淋巴瘤、胸腺瘤等。PNP常见的黏膜受累表现为难治性口炎,皮肤受累可表现为多样的皮疹,包括经典的天疱疮样大疱性病变、多形性红斑、苔藓样皮损等。免疫学检查包括直接免疫荧光、间接免疫荧光、ELISA等方法检测自身抗体对于PNP的诊断也很重要。治疗方面主要是寻找并治疗原发病,可以使用糖皮质激素治疗,必要时联合IVIG、利妥昔单抗及传统免疫抑制剂(如MMF)有助于减少激素的用量。出现BO的PNP患者预后较差。
血液科张路教授分享Castleman病诊治进展:
Castleman病是一种高度异质性的疾病,可累及各个系统,可以首诊于各个科室;其肺部表现也具有明显异质性,可直接累及部分表现为肺门或纵隔肿块,或各种类型的DPLD(结节影、网格影、囊状影、实变影等),还可以通过副肿瘤自身免疫的机制间接累及肺部而引起BO。根据我国约40个中心过去20年内的临床资料,900余例单中心型Castleman病(UCD)患者中有大约4%合并了BO。中国Castleman病诊断与治疗专家共识(2021年版)对Castleman病的临床分型和治疗以图表的形式进行了简明扼要的总结,其中UCD的首选治疗手段为手术切除,大部分病变包膜完整、手术切除难度不大,且大部分UCD患者术后可以获得治愈,PNP患者的口腔粘膜及皮肤病变也可得到缓解;但继发BO的UCD患者病例数相对较少,对于这类患者手术是否获益尚不明确,我们观察到一些患者在术后BO病情相对稳定。此外,部分单中心型Castleman病患者可能在手术切除原发灶后才出现BO的表现,因此需要注意病情监测、定期随访。
陈茹萱主治医师汇报BO治疗进展:
BO的治疗策略方面,首选是寻找并治疗原发病因;因为BO相对罕见,目前主要治疗策略参考BOS的治疗方案;对症支持治疗包括氧疗、痰液引流、呼吸康复锻炼、营养支持、预防及治疗感染(常见病原体包括绿脓、曲霉等)等;如保守治疗效果不佳,最终可能需要肺移植。
BOS经典治疗方案为全身糖皮质激素+FAM(氟替卡松+阿奇霉素+孟鲁司特),联合吸入长效支气管扩张剂,可尝试的二线治疗方法包括体外光分离置换、JAK抑制剂(如芦可替尼)、气雾吸入环孢素脂质体、抗纤维化药物治疗、ROCK2抑制剂等。
对于Castleman病继发的PNP-BO,因为有自身抗体参与发病,IVIG可能通过中和致病抗体、发挥免疫调节作用,对于重症患者也可考虑尝试血浆置换、利妥昔单抗等。
呼吸与危重症医学科蔡柏蔷教授、王孟昭教授、许文兵教授、田欣伦教授、徐作军教授、黄慧教授总结:
小气道病变中BO是相对少见、难治的疾病,结合今天的病例系统学习了BO相关的疾病谱以及治疗进展。BO的影像学特点为肺过度充气,可以出现支气管扩张的表现,容易继发感染及病原体定植。对于难治性阻塞性通气功能障碍的患者,除了考虑COPD、哮喘等常见病,还需要早期识别BO,并尽早针对原发病及BO进行规范化治疗。BO对药物治疗反应相对差,尤其在本病症的后期;除了经典的糖皮质激素+FAM方案,多种有希望的新药在临床研究阶段(包括JAK抑制剂、抗纤维化药物等),另外也可积极借鉴相似疾病的治疗进展拓展应用于BO治疗中。本例患者的诊治难点:UCD继发BO是罕见病,原发病灶相关的症状不明显而容易被忽视;另外,该患肺功能明显受损、手术风险高,协和的多学科协作团队充分发挥了优势,经过多次多科讨论,制定了个体化的术前准备及手术方案,最终顺利完成了肿物切除;并结合文献学习,术后给予了规范化治疗而改善其临床表现和预后。
作者介绍

黄慧
北京协和医院呼吸与危重症医学科副主任;主任医师,教授,博士研究生及临床博士后导师。担任中华医学会呼吸病学分会间质病学组委员,中国医师协会呼吸病分会间质性肺病工作委员会委员,中国研究型医院学会呼吸病学专委会副主任委员,《中华结核和呼吸杂志》通讯编委。主要从事结节病、各种弥漫性间质性肺病、特殊肺部感染(如诺卡菌、放线菌等)的临床和基础研究。

陈茹萱
北京协和医院呼吸与危重症医学科;主治医师,北京协和医学院八年制临床医学博士;2019年北京协和医院内科临床博士后出站;2020年担任北京协和医院内科总住院医师;曾至美国加州大学旧金山分校医学中心访学;获“北京协和医院优秀员工”、“内科优秀总住院医师”、“院级优秀住院医师”殊荣;以第一作者在国内外杂志发表多篇论文。
识别下方二维码
进入《呼吸界》直播间观看回放

感谢中青博联对本期
PCCM疑难病例讨论直播的大力支持
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


