
一、病情介绍
一般情况:
患者女性,14岁,因「反复咳嗽咳脓痰6年,进行性加重2个月」于2023年8月15日入住我院RICU。
现病史:
患者6年前无明显诱因出现咳嗽、咳脓痰,于当地医院完善胸部CT提示支气管扩张伴感染,考虑诊断为支气管扩张症(纤毛运动减弱),予抗感染、止咳化痰治疗后好转,此后每因受凉、劳累后症状反复加重。
2023年5月因新型冠状病毒感染后症状加重,咳嗽、咳脓痰,量大,伴发热,最高体温39°C,并出现咯血,自行口服奈玛特韦/利托那韦抗病毒,并于当地医院住院治疗,同时行纤维支气管镜检查,肺泡灌洗液NGS提示铜绿假单胞菌感染;予以「亚胺培南西司他丁钠、阿奇霉素」抗感染、止咳、止血等治疗,效果不佳。转至南京市某医院就诊,入院先后予「美罗培南、奥硝唑、阿奇霉素、多黏菌素、头孢哌酮舒巴坦」抗感染、「氨溴索、乙酰半胱氨酸」化痰、胸腺法新增强免疫力等治疗。
8月3日患者再次出现体温明显升高,最高达38.4C。8月6日复查胸部CT示病灶较前明显进展,考虑气道引流不畅,建议行气管镜下冲洗气道廓清治疗,患者家属协商后要求出院转至我院进一步治疗。8月15日患者于全麻下行纤维支气管镜检查,之后气管插管接呼吸机辅助通气转入RICU。
病程中,患者饮食、睡眠可,大小便正常,近期体重明显滅轻近10 kg。
查体:
体温37.3℃,心率134次/min,呼吸26次/min,血压106/86 mmHg;身高160 cm,体重34 kg,BMI 13.28 kg/m2。营养中等,偏瘦,神志清,精神差,推入病房,坐卧位,对答困难;胸廓对称,无胸壁静脉曲张。两侧呼吸运动对称,肋间隙无增宽。两肺叩诊呈清音,双肺呼吸音粗,可闻及明显湿啰音。双手杵状指,心律齐;腹平坦,腹软,肝、脾肋下未及,无压痛及反跳痛。
辅助检查:
2023年8月6日南京市某医院(胸部CT)示:两肺多发支气管扩张伴感染。
2023年8月11日床边胸片:两肺纹理增多紊乱模糊,两肺弥漫渗出。
2023年8月14日心脏超声:轻中度三尖瓣关闭不全,肺动脉高压。
2023年8月15日下肢静脉(VTE专用):双侧下肢深静脉血流通畅。
入科相关检查:
血气分析:pH 7.32,PaCO2 91 mmHg(↑),PaO2 126 mmHg,K+ 4.6 mmol/L(↑),Na 134 mmol/L(↓),Ca2+ 1.16 mmol/L(↓),Cl- 80 mmol/L(↓),血糖6.30 mmol/L(↑),乳酸0.3 mmol/L(↓),全血剩余碱(BE)17.0 mmol/L(↑),标准碳酸氢盐浓度41 mmol/L(↑),实际碳酸氢盐浓度(cHCO3-)47 mmol/L(↑)。
血常规:白细胞计数23.87↑×109/L,中性粒细胞百分比95.7%(↑),淋巴细胞百分比3.1%(↓),单核细胞百分比1.0%,淋巴细胞计数0.75×109/L(↓),红细胞计数3.58×1012/L(↓),血红蛋白97 g/L(↓),血小板计数324×109/L,C反应蛋白105 mg/L(↑)。
氨基末端B型利钠肽前体527.0 pg/ml(↑)。
血生化:前白蛋白62 mg/L(↓),丙氨酸氨基转移酶8 IU/L,天门冬氨酸氨基转移酶23 IU/L,碱性磷酸酶 104 IU/L(↑),白蛋白30 g/L(↓),尿素3.2 mmol/L,肌酐26 μmol/L(↓)。
淀粉酶+脂肪酶+补体50:淀粉酶227 IU/L(↑),脂肪酶211.2 IU/L(↑),补体50 40.8 U/ml。
床旁胸:两肺弥漫渗出、局部实变,右肺为著(图1)。
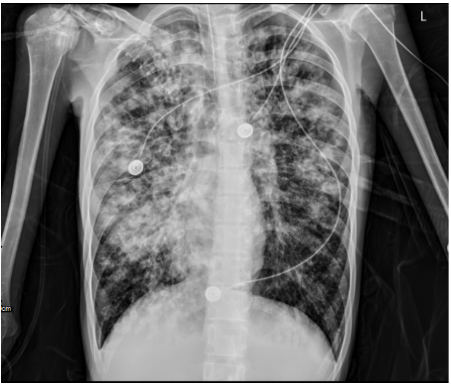
图1 2023年8月15日床边胸部X线片
气管镜检查:镜下见大量黄绿色黏痰,予以吸除后见气道壁明显充血水肿,管腔通畅,未见新生物生长(图2)。
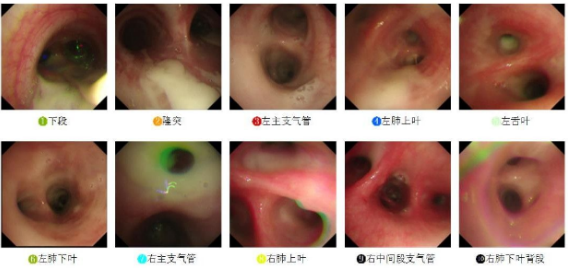
图2 2023年8月15日气管镜检查
初步诊断
①支气管扩张(症);②肺部感染;③营养不良。
二、入科后治疗
一般治疗
心电监护、计24 h出入量、肠内营养支持等。
呼吸支持
气管插管呼吸机辅助通气(AC/PC模式,Pi 20 cmH2O,PEEP 6 cmH2O,FiO2 50%)。
对症治疗
头孢哌酮舒巴坦1.0 g q8h+阿米卡星1.0 g qd静滴,多黏菌素E甲磺酸钠75.00 mg bid雾化抗感染;氨溴索+糜蛋白酶化痰;布地奈德+特布他林+异丙托溴铵雾化;富马酸比索洛尔片口服减慢心室率等治疗。
寻因治疗
患者支扩病因不明,考虑纤毛不动综合征,积极基因检测进一步确诊。
呼吸支持方案调整
8月17日患者意识清楚,呼吸支持降低(PSV模式,PS 12 cmH2O,PEEP 4 cmH2O,FiO2 45%),气管插管下气管镜廓清气道后,评估后拔出气管插管,序贯经鼻高流量吸氧与无创呼吸机辅助通气交替使用。
补充病史
基因检查发现CFTR基因存在2个杂合突变,诊断囊性纤维化(图3)。
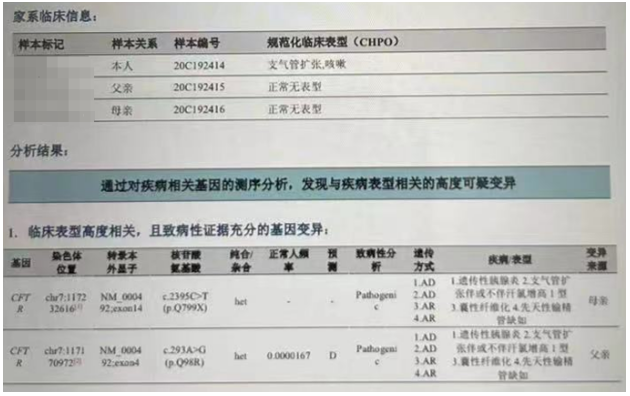
图3 基因检测
由于患者营养状况差,呼吸肌及四肢肌力较差,咳痰能力差,痰液黏稠不易咳出,经口吸痰可见大量黄绿色脓痰;目前仍有间断低热、二氧化碳潴留问题;故调整抗感染方案为头孢他啶阿维巴坦钠+卡泊芬净+黏菌素联合治疗,日间高流量吸氧鼓励咳痰+夜间无创呼吸机辅助通气,同时加强营养支持及康复治疗。
三、康复治疗
气道廓清
(1)气管镜吸引:患者多次行气道分泌物吸引,8月21日局麻经鼻进镜,镜下见双肺主支气管及各叶段、段支气管管腔内大量黄绿色脓痰,予以吸除后气道壁充血水肿。后续待感染控制后,有少量脓痰。此外,每2 h予翻身拍背。
(2)体位引流:以支气管解剖为基础,将身体摆放不同位置,病变部位在上,支气管开口处在下,借助重力并辅以各种有效技术促进气道分泌物的排出。患者前期总体情况较差,所以调节ICU病床使患者呈15°头低脚高体位,每次10~15 min,每天2次。之后患者状态逐渐好转,辅助俯卧式排痰,通过增加通气量借助重力促进下肺痰液的排除(图4)。
图4 (左)头低脚高位,(右)俯卧式排痰
(3)OLE技术:肺内振荡及肺扩张治疗称为OLE治疗,这是一种综合性治疗方式,整合了持续呼气期正压(CPEP)、连续高频振荡(CHFO)循环治疗和雾化药物输送三种原理。该技术操作简单,在CPEP肺扩张治疗以及CHFO痰液松动治疗的同时,提供喷雾治疗,以10 min为一个治疗周期:2.5 min CPEP→2.5 min CHFO → 2.5 min CPEP→2.5 min CHFO。CHFO和CPEP需根据患者耐受情况进行调整机使用时间,并结合高渗盐水雾化治疗以刺激痰液排出;治疗频次为2次/d(图5)。
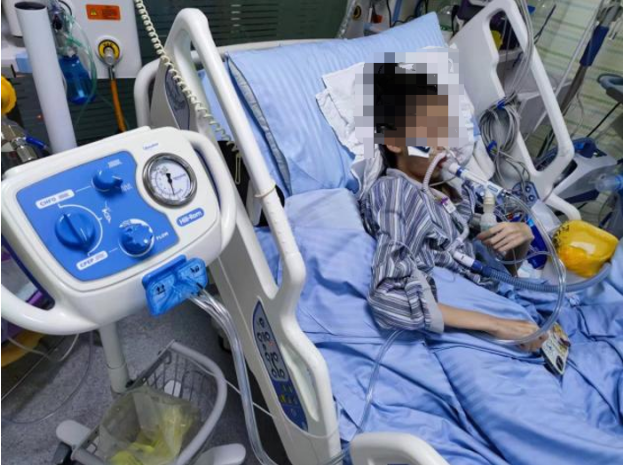
图5 OLE技术治疗
呼吸训练
(1)手法辅助呼吸:随着患者的呼气动作,用手压迫胸廓,使吸气时胸廓扩张,增加吸气量和气流速度,并促进气管内分泌物移动,从而促进残存肺的扩张(图6)。
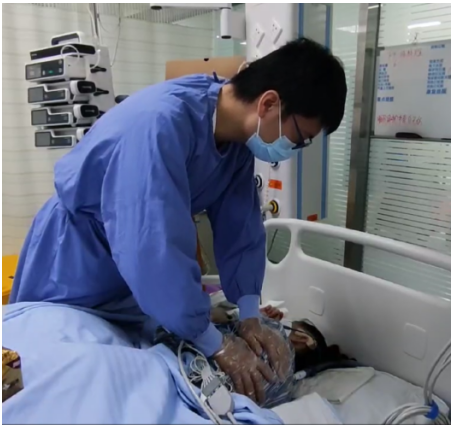
图6 手法辅助呼吸
(2)Acapella:在呼气时可产生一定的正压,防止肺泡塌陷,并产生振荡气流,促进气道内分泌物向大气道移动,以利于气道内痰液清除。操作流程:口含咬嘴缓慢吸气→屏气2~3 s→呼气4~8 s→重复10~20次→咳嗽。患者肌力稍好转时,鼓励患者每天完成4个阶段的锻炼。
四肢训练
(1)上下肢主动运动、抗阻训练。
(2)平衡功能训练:坐站平衡训练及步行训练(图7)。
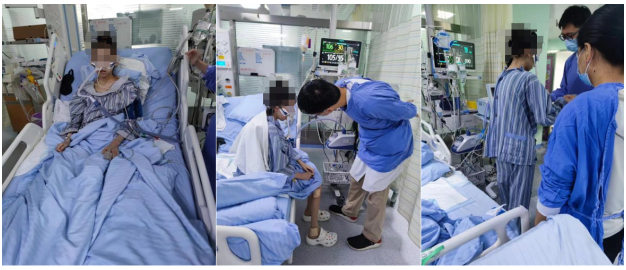
图7 坐站平衡训练及步行训练
8月28日复查胸部X线片:两肺弥漫渗出、局部实变,右肺为著(图8)。

图8 床旁胸部X线片(左为8月28日,右为8月11日)
现患者症状好转,感染指标下降(图9),胸部X线片较前好转,囊性纤维化诊断明确,家属要求转院评估肺移植。
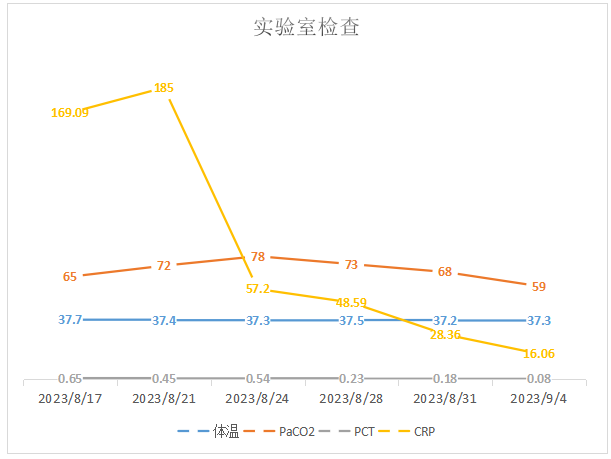
图9 患者体温、PaCO2及炎症指标变化
四、讨论
囊性纤维化
本病例有反复咳嗽咳脓痰病史,同时存在营养不良,影像学显示两肺多发肺扩张伴感染,经基因检测发现存在CFTR基因纯和突变,确诊囊性纤维化。
囊性纤维化(cystic fibrosis,CF)是常见常染色体隐性遗传病之一,在高加索人中相对常见,发病率为1/2000。CF于2018年被列入中国首批罕见病目录,在我国报道较少,目前约有200例;尚无该病基于人群调查的患病率报道,通过基因库数据估测有超过2万名CF患者。CF的发病机制是由囊性纤维化跨膜传导调节因子(CFTR)基因的双等位基因变异导致。CFTR基因突变导致CFTR蛋白的结构或功能障碍,使跨上皮Cl-、HCO3- 转运异常、管腔分泌物变得黏稠。CFTR蛋白通道存在于呼吸系统、消化系统、内分泌系统、生殖系统中,因此CF是一种累及多器官的系统性疾病,临床表现多样,通常具有慢性气道感染、胰腺功能不全、鼻窦炎、不孕症等特征,其中CF患者死亡的主要原因是反复呼吸道感染导致进行性支气管扩张症引起呼吸衰竭。由于CF患者痰液黏稠堵塞气道,后期多以厌氧菌铜绿假单胞菌为主,本病例多次痰培养及肺泡灌洗液培养结果均为铜绿假单胞菌,即使在多种抗生素联合治疗后,培养仍为阳性。
所有疑诊CF的患者推荐汗液Cl-检测和CFTR基因检测,其中,基因检测可以帮助实现早期诊断、早期治疗、减少不良预后;同时也增加了CF新生儿筛查的阳性预测价值,提高生存率。
本例报道基因检测提示患者突变基因分别遗传自其父母,其双亲均只携带其中一个杂合变异。CF患者应采取综合治疗,包括气道廓清、抗炎治疗、控制感染、胰腺功能改善、营养和康复等全方位的管理。随着CF分子诊断技术的进步,CFTR分子治疗也飞速发展,CFTR调节剂疗法的使用也在不断推进。对于终末期肺病CF患者,肺移植仍然是重要治疗选择。
囊性纤维化的物理治疗
CF是一种限制生命的遗传疾病,会影响呼吸、消化等多个系统,其中呼吸衰竭是CF致死致残的主要原因。CF患者会产生黏稠的痰液,长期积聚在肺部会引起反复感染和炎症,最终导致肺功能恶化。所以,CF患者每天都应进行气道廓清,以帮助排出肺部黏液预防和控制感染。物理治疗作为非药物治疗方式之一,是整个治疗周期的关键因素。一项Cochrane系统综述得出结论:气道廓清技术对CF患者的黏液排出具有短期有益影响。
气道清除技术一般包括常规胸部物理治疗、各种呼吸技术(主动呼吸循环技术、自主引流)、体位引流、产生正压的装置(呼气正压疗法)或振动装置(振荡装置)以移动粘液和训练呼吸肌。通常气道廓清(操作前、操作时)结合雾化治疗可以提高黏液的清除效率。
如本例报道中患者使用的OLE技术将CPEP、CHFO循环治疗和雾化三种方式相结合。其中,CPEP通过保持气道开放和扩张预防和治疗肺不张;CHFO使用持续性脉冲式正压松动分泌物,有助于分泌物向大气道转移;并结合雾化治疗帮助最大限度地提高治疗效果。
目前几乎没有证据支持哪一种气道清除技术效果更好,CF患者应根据自身需求选择合适的气道清除技术。此外,应鼓励CF患者在整个生命周期内进行定期的运动训练,包括有氧训练、无氧训练,增强体质和胸部活动能力,保持骨矿物质密度,并减缓肺功能下降的速度。
参考文献
[1] De Boeck K. Cystic fibrosis in the year 2020: A disease with a new face[J]. Acta Paediatr, 2020, 109(5):893-899. doi: 10.1111/apa.15155. Epub 2020 Jan 22. PMID: 31899933.
[2] Chen Q, Shen Y, Zheng J. A review of cystic fibrosis: Basic and clinical aspects[J]. Animal Model Exp Med, 2021, 4(3):220-232. doi: 10.1002/ame2.12180. PMID: 34557648; PMCID: PMC8446696.
[3] Savant A P, McColley S A. Cystic fibrosis year in review 2016[J]. Pediatr Pulmonol, 2017, 52(8):1092-1102. doi: 10.1002/ppul.23747. Epub 2017 Jun 13. PMID: 28608632.
[4] Scotet V, L'Hostis C, Férec C. The Changing Epidemiology of Cystic Fibrosis: Incidence, Survival and Impact of the CFTR Gene Discovery[J]. Genes (Basel), 2020, 11(6):589. doi: 10.3390/genes11060589. PMID: 32466381; PMCID: PMC7348877.
[5] 囊性纤维化诊断与治疗中国专家共识编写组, 中国罕见病联盟呼吸病学分会, 中国支气管扩张症临床诊治与研究联盟. 囊性纤维化诊断与治疗中国专家共识(2023版)[J]. 中华结核和呼吸杂志, 2023, 46(4):352-372. DOI: 10.3760/cma.j.cn112147-20221214-00971
[6] 中华医学会呼吸病学分会, 中国老年保健医学研究会呼吸病学分会, 中国呼吸医师分会呼吸职业发展委员会呼吸治疗师工作组, 等. 机械气道廓清技术临床应用专家共识[J]. 中华结核和呼吸杂志, 2023, 46(9):866-879.DOI:10.3760/cma.j.cn112147-20230531-00280
[7] Warnock L, Gates A. Airway clearance techniques compared to no airway clearance techniques for cystic fibrosis[J]. Cochrane Database Syst Rev, 2023, 4(4):CD001401. doi: 10.1002/14651858.CD001401.pub4. PMID: 37042825; PMCID: PMC10091803.
[8] Wilson LM, Morrison L, Robinson KA. Airway clearance techniques for cystic fibrosis: an overview of Cochrane systematic reviews[J]. Cochrane Database Syst Rev, 2019, 1(1):CD011231. doi: 10.1002/14651858.CD011231.pub2. PMID: 30676656; PMCID: PMC6353051.
[9] Button B M, Wilson C, Dentice R, et al. Physiotherapy for cystic fibrosis in Australia and New Zealand: A clinical practice guideline[J]. Respirology, 2016, 21(4):656-67. doi: 10.1111/resp.12764. Epub 2016 Apr 18. PMID: 27086904; PMCID: PMC4840479.
作者简介

葛晓
上海交通大学医学院附属瑞金医院 呼吸治疗师,毕业于四川大学华西临床医学院呼吸治疗系。主要工作方向为危重症患者的呼吸支持、气道管理、呼吸康复、床边重症超声、床边气管镜等。

冯耘
上海交通大学医学院附属瑞金医院 主任医师、副研究员、硕士研究生导师,就职于上海交通大学医学院附属瑞金医院,美国杜克大学访问学者,中国老年医学会呼吸病学分会呼吸危重症学术委员会委员,上海市医学会呼吸病学专科分会青年委员会委员,上海市医学会呼吸病学专科分会重症学组副组长。曾荣获上海市人才培养计划、上海市优秀专科医师及上海交通大学医学院“九龙医学优秀青年人才奖”。以第一作者及通讯作者发表SCI论文30余篇,第一完成人获得专利2项,参与编写专著3部。

李宁
上海交通大学医学院附属瑞金医院 副主任医师、医学博士、硕士生导师,中国老年学和老年医学学会睡眠科学与技术分会常务委员,中国睡眠研究会睡眠医学教育专业委员会委员,中国医师协会睡眠医学专业委员会青年委员,上海市医学会呼吸病学分会睡眠学组副组长。长期从事呼吸疾病诊断和治疗工作,参编多部专著。主持国家自然科学基金、上海市卫健委课题,参与多项国家级课题及国际多中心研究。

时国朝
上海交通大学医学院附属瑞金医院 主任医师、教授、博士研究生、博士后导师,上海交通大学医学院呼吸病研究所常务副所长,上海交通大学医学院慢性气道疾病诊治中心副主任。中华医学会呼吸病学分会委员,中国医师协会内科医师分会常务委员,中国医师协会呼吸医师分会委员,发表SCI论文60余篇,作为第一完成人荣获上海医学科技奖二等奖。

方洁
上海交通大学医学院附属瑞金医院 副主任药师,卫生部临床药师培训基地抗感染专业带教药师,中华医学会临床药师培训基地带教老师,上海市医学会临床药学分会青年委员,上海市医学会临床药学分会呼吸学组副组长。
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:囊性纤维化患者的康复治疗
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


