
细支气管炎是婴儿中最常见的下呼吸道感染,也是婴儿住院的主要原因。虽然30%至40%的婴儿患有临床细支气管炎,但其严重程度从症状轻微到危及生命不等。其中,约有5%的婴儿需要进行机械通气治疗。然而,传统的风险因素(如早产)不能充分解释细支气管炎严重程度的差异,其病理生理机制仍需阐明。以往,我们对该疾病机制的了解有限,使得在这一庞大患者群体中开发针对性治疗策略的努力收效甚微。表观遗传学(Epigenetics)主要研究基因活动和表达的可遗传变化,其中DNA甲基化(DNA methylation)是一种最常见的表观遗传修饰,涉及到DNA分子上的甲基基团的添加。这些表观遗传修饰可以受到环境因素的影响,并在疾病发生和遗传变异中发挥关键作用。
近日,哈佛大学医学院、麻省总医院朱肇中团队利用35th Multicenter Airway Research Collaboration (MARC-35) 多中心重症细支气管炎婴儿队列为研究对象,采用表观基因组关联研究(epigenome-wide association study)方法,对625名患有重症细支气管炎的婴儿全血样本进行了表观基因组DNA 甲基化高通量测序。研究以DNA 甲基化CpG位点为暴露因素,以婴儿细细支气管炎持续气道正压通气为研究截点,进行了横断面研究的多组学分析(图1)[1]。

图1
本研究有以下发现:
1. 在患重症细支气管炎的婴儿中,其血液内的一些DNA 甲基化胞嘧啶-磷酸-鸟嘌呤(CpG)位点的变化与持续气道正压通气(positive pressure ventilation)的使用有关(图2)
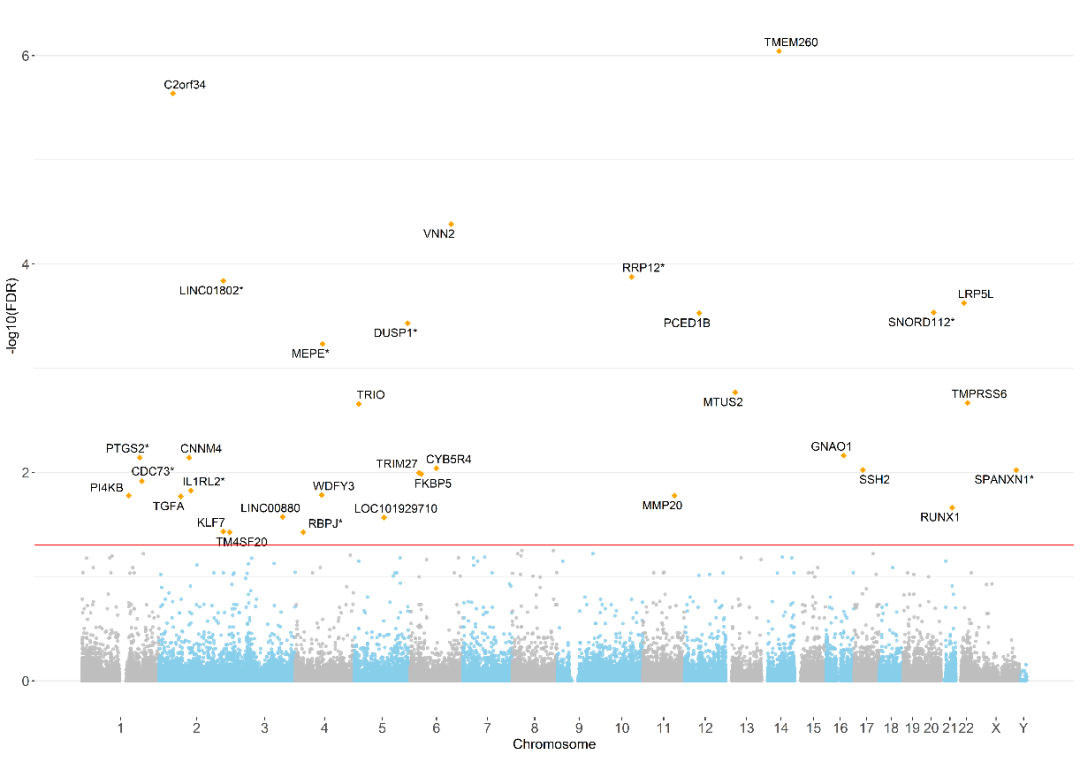
图2
2. 在患重症细支气管炎的婴儿中,其血液中的DNA 甲基化CpG位点会以不同方式影响婴儿细支气管炎。例如,DNA 甲基化CpG位点会与呼吸道合胞病毒(RSV)或鼻病毒(rhinovirus)产生交互作用,并受呼吸道病毒的影响,增加持续气道正压通气的使用风险。并且这些CpG位点与血液中的免疫细胞(例如:T辅助细胞,中性粒细胞等),多种人体组织(例如:肺等)和细胞(例如:小气道上皮细胞,胎儿肺成纤维细胞等),生物通路(例如:白细胞介素1调控的信号传导)显著相关(图3)。
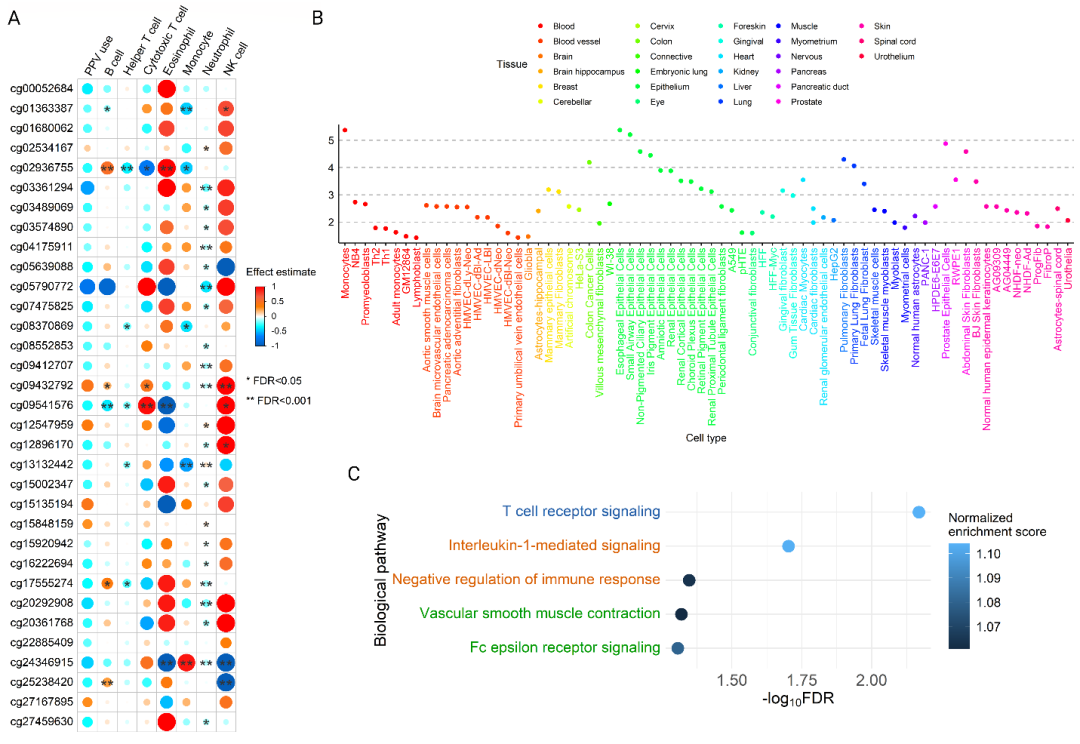
图3
3. 研究团队还发现这些DNA 甲基化CpG位点与呼吸和免疫相关的疾病与特征(例如:哮喘, 总免疫球蛋白E)显著相关(图4)。
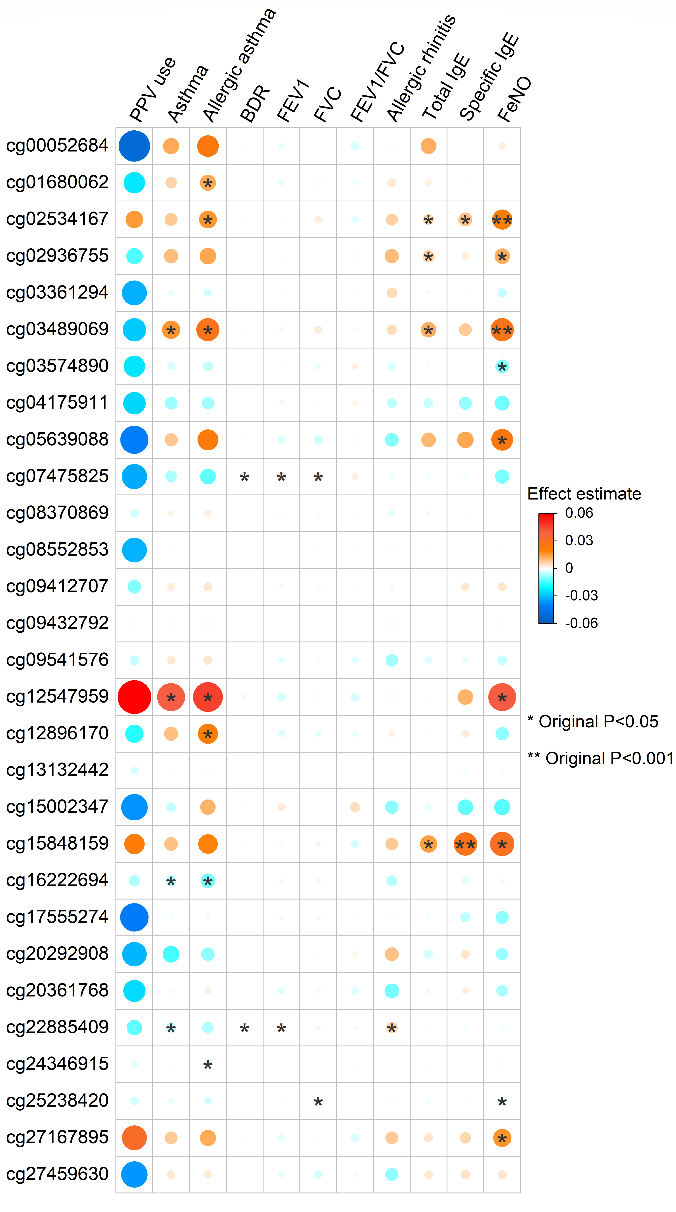
图4
4. 在基于孟德尔随机化分析中,研究团队发现其中4个DNA 甲基化CpG位点与哮喘的发病风险和肺功能的变化显著相关。
近年来,随着呼吸道病毒的流行,婴儿细支气管炎也有着较高的发病率,并且致病机制非常复杂。在婴儿时期,上呼吸道的病毒以及宿主的免疫反应对婴儿细支气管炎的严重程度影响巨大。本研究的意义在于:探索及明确婴儿期病毒感染等风险因素与细支气管炎的严重程度的关系以及DNA 甲基化在其中的调控机制,为今后控制婴儿细支气管炎的严重程度并开发有针对性的治疗策略提供理论依据。
相关研究成果于2023年9月7日以original research article形式发表在Nature Communications [1],团队负责人朱肇中助理教授为此研究的第一及通讯作者。Kohei Hasegawa副教授和梁黎明教授为共同资深作者。该研究由哈佛大学医学院、麻省总医院与哈佛大学陈曾熙公共卫生学院等研究者合作共同完成。研究得到美国国立卫生研究院等机构资助。
Reference
1. Zhu Z, Li Y, Freishtat RJ, Celedón JC, Espinola JA, Harmon B, Hahn A, Camargo CA Jr, Liang L, Hasegawa K, Epigenome-wide association analysis of infant bronchiolitis severity: A multicenter prospective cohort study, Nature Communications, 2023.
本研究第一作者及通讯作者朱肇中现为哈佛大学医学院及麻省总医院助理教授,博士毕业于哈佛大学公共卫生学院。其主要研究方向为呼吸疾病的多组学分析,曾多次以第一作者或第一作者及通讯作者身份在Nature Genetics, Nature Communications, European Respiratory Journal, Journal of Allergy and Clinical Immunology 等杂志上发表呼吸领域的文章。
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


