
摘要
本文报道1例发生于肺的结晶体贮积性组织细胞增生症(crystal-storing histiocytosis,CSH)。患者体检发现肺部肿物,胸部CT示右肺下叶结节影,边缘毛糙,分叶状,增强后见明显强化,邻近胸膜受牵拉。PET-CT示代谢稍高,考虑恶性病变。行右肺下叶楔形切除术。根据病理形态及免疫组织化学(immunohistochemistry,IHC)诊断为CSH。患者术后随访41个月,未提示病灶复发,未提示其他新发疾病。CSH是一种罕见的非肿瘤性组织细胞增生性疾病,以嗜酸性晶体物质在组织细胞胞质内聚集为特征。该疾病往往与淋巴细胞增生性疾病或浆细胞性疾病相关,诊断后需进行全身检查,并建议长期随诊。
CSH是一类罕见的非肿瘤性组织细胞增生性疾病,以嗜酸性晶体物质在组织细胞胞质内聚集为特征。Dogan等[1]综述了80例CSH的临床病理特征,约90%的患者患有潜在的淋巴细胞增生性疾病或浆细胞性疾病,约10%的患者由自身免疫性疾病、感染、代谢紊乱、药物或克罗恩病等引起。CSH根据临床累及部位分为局限性与系统性,前者局限于一个部位或器官,后者累及两个或两个以上的远隔部位或器官[1]。局限性CSH主要发生在头颈部(35%),最常见的部位是眼/眼眶,其次是肺和胸膜(24%)。系统性CSH最常见的部位是骨髓(97%),仅12%累及肺。现报道1例局限性肺CSH,并结合相关文献,探讨其临床病理学特征。
临床资料
患者女,45岁,体检发现肺部肿物。否认高血压、糖尿病、冠心病等慢性病史,否认乙肝结核病史,无吸烟饮酒史。患者病程中无发热、咳嗽、胸闷等不适症状。生命体征正常。血常规白细胞计数3.90×10^9/L,中性粒细胞百分比55.0%,淋巴细胞百分比36%,红细胞计数4.30×10^12/L,血红蛋白139 g/L,血小板计数141×10^9/L。肝肾功能、凝血功能、血脂、电解质等结果均未见异常。胸部CT示右肺下叶结节影,边缘毛糙,呈分叶状,大小约24 mm×23 mm,增强后见明显强化,邻近胸膜受牵拉(图1)。PET-CT示右肺下叶占位,代谢稍高,SUVmax2.6,首先考虑恶性病变可能。全身淋巴结无肿大。胸外科行右肺下叶楔形切除术。追问病史,患者10年半前曾行甲状腺乳头状癌手术,7年前曾行纵隔胸腺肿物切除术及左肺下叶楔形肺切除术,纵隔病灶大小90 mm×50 mm×40 mm,肺内病灶大小18 mm×15 mm×10 mm,当时纵隔及肺内病灶均诊断为「黄色肉芽肿」,7年前手术前胸部CT见图2。
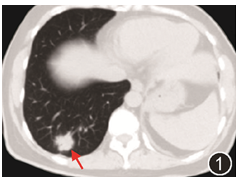
图1 胸部CT示右肺下叶结节影(红色箭头),结节边缘毛糙,呈分叶状,大小24 mm×23 mm,邻近胸膜受牵拉
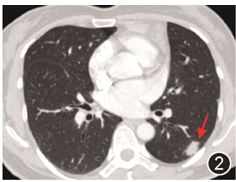
图2 7年前胸部CT示左肺下叶结节影(红色箭头)
手术标本病理学检查结果:肿块大小26 mm×23 mm×20 mm,紧邻脏层胸膜,切面灰白灰红,实性,质中偏韧,边界欠清。镜检:肿块主要由梭形及多角形组织细胞构成,细胞胞质丰富、嗜酸性,类似横纹肌细胞,细胞核圆形、卵圆形,居中,部分细胞核内可见小核仁(图3)。数字切片放大800倍显示组织细胞胞质内充满菱形、棒状结晶体样物质(图4)。
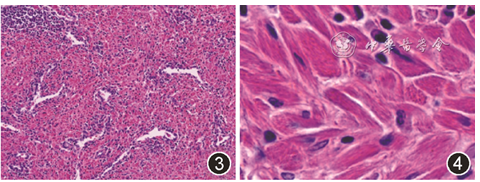
图3 病灶由大量梭形、多角形细胞构成,细胞胞质丰富,嗜酸性 HE染色 低倍放大
图4 嗜酸性组织细胞胞质内可见结晶体样物质 HE染色 高倍放大
病灶内散在少量成熟的淋巴细胞及浆细胞浸润,并有少数淋巴滤泡形成。免疫组织化学:嗜酸性组织细胞表达CD68(图5)、CD163、κ(图6)、λ(图7)、IgG(图8)、IgM、IgA,ki67低表达(<1%),不表达AE1/AE3、CK7、TTF-1、IgD、IgE、SMA、Desmin、MyoD1、Myoglobin、S-100、CD1a、Langerin、CD56和CD138。复习患者7年前纵隔及肺内病灶的HE切片,形态与本次手术标本一致,嗜酸性组织细胞也表达CD68。最终病理诊断:肺结晶体贮积性组织细胞增生症。手术后随访41个月,未提示病灶复发,亦无其他新发疾病,患者无病生存。
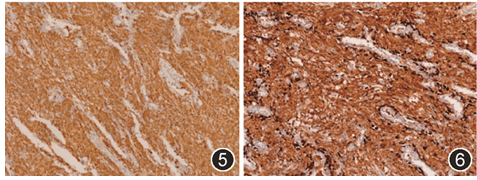
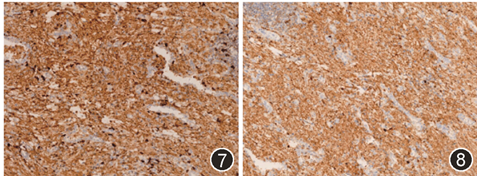
图5 嗜酸性组织细胞CD68阳性 IHC染色 低倍放大
图6 嗜酸性组织细胞κ阳性 IHC染色 低倍放大
图7 嗜酸性组织细胞λ阳性 IHC染色 低倍放大
图8 嗜酸性组织细胞IgG阳性 IHC染色 低倍放大
讨论
肺CSH少见,以「lung」和「crystal-storing histiocytosis」为关键词在PubMed 数据库,对1996年1月1日至2022年10月31日的文献进行检索,获取19篇英文文献,收录19例肺CSH患者;以「肺」和「结晶体」为关键词在万方数据库,未检索到肺CSH相关文献。本文报道1例肺局限性CSH,加上文献报道的19例[2 - 17]共20例,其中男7例,女13例,年龄38~89岁,中位年龄60岁。多数患者无临床症状,少数患者出现咳嗽咳痰,胸痛,发热,呼吸困难等非特异性症状。20例中11例为单发性,5例为多发性,其余4例文中未提及单发还是多发,病灶大小8~52 mm。14例曾经有或者同时伴有淋巴细胞增生性或浆细胞性疾病,其中7例为边缘区淋巴瘤,2例为意义不明的单克隆丙种球蛋白病,2例为浆细胞瘤,1例为多发性骨髓瘤,1例为淋巴浆细胞淋巴瘤,1例为弥漫性大B细胞淋巴瘤,这些患者中部分还患有肿瘤性疾病、间质性肺疾病或抗磷脂综合征。5例患者与慢性炎症或自身免疫性疾病相关,包括干燥综合征,类风湿关节炎,肺脓肿,肺结核及石棉暴露。本例患者10年前曾有甲状腺乳头状癌病史,无淋巴细胞增生性或浆细胞性疾病。
肺CSH影像学表现为单发或多发的结节影,术前影像学检查常提示为肺癌,少数结节可呈囊性或伴钙化[14]。组织病理形态特点为嗜酸性上皮样组织细胞呈片分布,细胞内含嗜酸性结晶体。电镜观察结晶体可见于组织细胞和浆细胞胞质内及溶酶体内,形态具有多样性。IHC标记嗜酸性组织细胞表达CD68。组织细胞内的免疫球蛋白可能是任何类型,与淋巴细胞增生性或浆细胞性疾病相关的CSH中免疫球蛋白主要是IgMκ型[9]。20例中14例伴淋巴细胞增生性或浆细胞性疾病的肺CSH,轻链类型也主要为κ型。而6例不伴淋巴细胞增生性或浆细胞性疾病的肺CSH,主要为多克隆免疫球蛋白沉积,轻链类型仅1例为κ型,其余5例为κ与λ型。本文报道病例IHC标记显示组织细胞IgG、IgM、IgA及κ、λ均为阳性表达,提示为多克隆免疫球蛋白沉积。
CSH确切的发病机制尚不完全清楚。免疫球蛋白产生过剩是可能的机制之一[18]。另外,一些CSH病例的轻链序列分析表明,免疫球蛋白结构中的内在因素改变可能导致其在细胞内积累。如Lebeau等[19]提出由氨基酸序列异常引起的构象改变,促进蛋白质结晶形成或不利于其在溶酶体内降解或两种因素兼有,可能是CSH发病机制的关键因素。Kanagal-Shamanna等[20]提出免疫球蛋白构型的改变和(或)组织细胞处理免疫球蛋白能力缺陷,可能是其在组织细胞内过量积累的原因。虽然CSH中的免疫球蛋白可能是任何一种类型及任何轻链类型,但与淋巴瘤相关的CSH中免疫球蛋白类型主要是IgMκ型[6]。CSH结晶发生更多地与κ轻链有关,而不是与特定的重链有关,可能是由于κ轻链与λ轻链相比,可溶性较低,并且在溶酶体酸性条件下能够抵抗酶的降解[14]。
CSH的临床治疗主要是针对其淋巴细胞增生性或浆细胞性疾病的治疗。对于实性结节型CSH手术切除是较好的选择[12]。本文总结的20例肺CSH中,15例有随访资料,随访时间3个月~11.2年,1例手术后10年复发,本病例也为复发病例,距上次手术时间7年,3例死亡,死因分别为心肌梗死、多器官功能衰竭及间质性肺炎急性加重,其余10例随访4个月~9年,均无复发。
综上所述,肺CSH是一种罕见的组织细胞增生性疾病,诊断主要依靠嗜酸性组织细胞胞质内克隆性免疫球蛋白晶体的存在以及IHC标记CD68阳性。一旦诊断该疾病,则需要进行全身系统性评估,并进行长期随访,以排除合并或有潜在淋巴细胞增生性或浆细胞性疾病的可能性。
参考文献(略)
作者:陈晓炎 雷正瑶 薄佳琪 王顺利 易祥华;单位:上海交通大学医学院附属瑞金医院病理科;同济大学附属同济医院病理科
引用本文: 陈晓炎, 雷正瑶, 薄佳琪, 等. 肺结晶体贮积性组织细胞增生症1例 [J] . 中华结核和呼吸杂志, 2023, 46(6) : 595-598. DOI: 10.3760/cma.j.cn112147-20220817-00693.
本文转载自订阅号「中华结核和呼吸杂志」(ID:cmjlung)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


