
一、临床资料
一般情况
患者男性,44岁。主因「咳嗽伴活动后气短10 d,加重伴发热4 d」于2016年2月10日入住我院呼吸科。
现病史
患者2016年1月30日第二次淋巴瘤化疗后(使用依托泊苷、环磷酰胺、长春新碱,具体使用剂量和方法不详)出现咳嗽、活动后气短,不伴咳痰、胸闷、气短、发热、胸痛、咯血等症状,未予诊治。2月6日自觉咳嗽、气短症状加重,少量活动即感明显气短,就诊于山西省肿瘤医院,行胸部CT示双肺多发斑片状阴影,考虑「肺部感染」,静脉滴注亚胺培南西司他丁钠、利奈唑胺、卡泊芬净抗感染治疗,咳嗽、气短症状未见好转,期间间断出现发热,体温最高达38℃,无畏寒、寒战、咳痰等症状,体温可自行降至正常。为求进一步诊治转入我院呼吸与危重症医学科。患者自发病以来,精神、食欲、睡眠差,大小便正常,体重无明显变化。
既往史
2015年9月患者无明显诱因出现右颈部淋巴结肿大,给予抗感染治疗半月余未见好转。2015年12月于山西省肿瘤医院确诊为「血管免疫母细胞性T细胞淋巴瘤」,并予依托泊苷、环磷酰胺、长春新碱化疗1次。否认高血压、心脏病、糖尿病病史,否认肝炎、结核、疟疾病史,无手术、外伤及输血史,无食物、药物过敏史。
入院查体
T 36℃,P 84次/min,R 21次/min,BP 90/75 mmHg,神志清楚,口唇无发绀,球结膜无充血水肿,颈静脉无充盈,双肺呼吸音粗,双肺底可闻及少许湿啰音,未闻及干啰音,心率84次/min,律齐,各瓣膜未闻及病理性杂音。腹软,无压痛及反跳痛,肝脾肋下未触及,双下肢无水肿。
入院时辅助检查
胸部CT(2016年2月6日)示双肺多发斑片状阴影(图1)。血常规(2016年2月9日,外院):WBC 21×10^9/L,PLT 423×10^9/L,NEU% 81%。血气分析(2016年2月10日,吸氧3 L/min):pH 7.43,PaO2 68 mmHg,PaCO2 37 mmHg,SaO2 98%,PaO2/FiO2 297 mmHg。
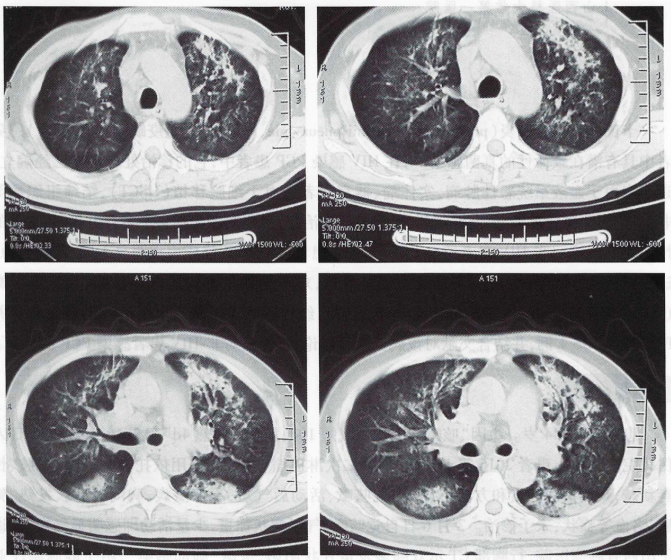
图1 2016年2月6日胸部CT:双肺多发斑片状阴影
二、诊治经过
入院后继续给予经验性亚胺培南西司他丁钠、利奈唑胺、卡泊芬净抗感染,持续鼻导管吸氧,支持、对症等治疗。留取痰培养+药敏试验、血培养+药敏试验、痰涂片找结核杆菌等检查,积极寻找病原学证据。患者自觉咳嗽、气短症状较入院时略减轻,体温恢复正常,一般情况好转。
2月14日调整抗感染方案为头孢哌酮舒巴坦+莫西沙星+卡泊芬净。
2月15日复查。血常规:WBC 15.5×10^9/L,RBC 3.75×10^9/L,Hb 107 g/L,PLT 368×10^9/L,NEU 13.3×10^9/L,NEU% 86.1%。血生化:ALT 4 U/L,AST 9 U/L,ALB 27.6 g/L,Cre 51.1 μmol/L;ESR 20 mm/h;NT-proBNP 540 ng/L;血气分析(FiO2 37%)pH 7.455,PaCO2 35.8 mmHg,PaO2 62.1 mmHg,SaO2 92.8%,PaO2/FiO2 168 mmHg,痰涂片抗酸染色未见异常。
2月15日患者气短症状突然较前加重,咳嗽、胸闷、气短明显,端坐呼吸。调整吸氧方式为储氧面罩吸氧,氧流量10 L/min,复查胸部CT提示以肺门为中心的双侧肺弥漫性磨玻璃及实变影(图2),病灶较2月6日明显加重。复查血气分析(储氧面罩吸氧,氧流量10 L/min):pH 7.518,PaCO2 30.8 mmHg,PaO2 49.3 mmHg,SaO2 86.4%,PaO2/FiO2 149 mmHg。

图2 2016年2月15日胸部CT:肺门为中心的双侧肺弥漫性磨玻璃及实变影
2月16日患者气短症状较前进行性加重,烦躁不安,储氧面罩吸氧15 L/min,SpO2 75%左右,尝试无创呼吸机辅助呼吸,患者不能耐受,并出现神志恍惚,随之意识不清。2016年2月17日凌晨予行气管插管有创机械通气,SpO2波动在65%~85%之间。血气分析(FiO2 100%):pH 7.32,PaCO2 52 mmHg,PaO2 47 mmHg,SaO2 79%,PaO2/FiO2 47 mmHg。复查血常规:WBC 28.5×10^9/L,RBC 4.04×10^9/L,Hb 116 g/L,PLT 218×10^9/L,NEU 25.3×10^9/L,NEU% 88.7%,LYM% 2.3%。淋巴细胞亚群:B淋巴细胞(CD3-CD19+)百分比0.0%,T辅助淋巴细胞(CD3+CD4+)百分比7.0%,T抑制淋巴细胞(CD3+CD8+)百分比15.2%,NK细胞(CD3-CD16+56+)42.4%。
患者病情进行性加重,氧合持续恶化,提示前期抗感染效果差,考虑可能与自身免疫功能受损或未覆盖致病菌有关。患者淋巴瘤化疗后免疫功能受损,合并细菌、真菌、病毒混合感染可能性均较大。结合影像学特点,PJP不能除外,予行床旁气管镜肺泡灌洗并吉姆萨染色,完善G试验、GM试验、巨细胞病毒检测等检查,同时调整抗感染方案为美罗培南+莫西沙星+卡泊芬净+更昔洛韦+复方磺胺甲噁唑(每次3片,q6h),予甲泼尼龙40 mg静脉滴注bid,人血免疫球蛋白25 g/d;患者血白蛋白低,对症补充人血白蛋白。患者烦躁不安,予咪达唑仑+瑞芬太尼镇静镇痛,去甲肾上腺素维持血压。
2月19日患者机械通气下氧合较18日改善,体温最高38.8℃,复查血气分析(FiO2 70%):pH 7.355,PaCO2 44.7 mmHg,PaO2 69.4 mmHg,SaO2 93.8%,PaO2/FiO2 99.1 mmHg。复查血常规:WBC 12.9×10^9/L,RBC 3.70×10^9/L,Hb 108 g/L,PLT 156×10^9/L,NEU 9.92×10^9/L,NEU% 76.9%,LYM 1.44×10^9/L,LYM% 11.2%。病原体IgM检测:嗜肺军团菌、肺炎支原体、Q热立克次体、肺炎衣原体、腺病毒、呼吸道合胞病毒、甲型流感病毒、乙型流感病毒、副流感病毒均为阴性。
2月19日痰培养结果示:肺炎克雷伯菌,对亚胺培南、美罗培南、头孢哌酮舒巴坦、左氧氟沙星、米诺环素等敏感。当日复查床旁胸片示向心性弥漫扩散的实变影(图3),较前略有好转;肺泡灌洗液吉姆萨染色回报肺孢子菌,PJP PCR阳性。抗感染方案调整为头孢哌酮舒巴坦+卡泊芬净+复方磺胺甲噁唑(每次3片,q6h)。甲泼尼龙40 mg静脉滴注bid。

图3 2016年2月19日胸部X线片:向心性弥漫扩散的实变影
2月20日复查血气分析(FiO2 40%):pH 7.44,PaCO2 41 mmHg,PaO2 88 mmHg,SaO2 97%,PaO2/FiO2 220 mmHg,HCO3- 27.8 mmol/L;巨细胞病毒DNA定量检测示500拷贝/ml(阴性)。
2月21日复查血常规:WBC 8.1×10^9/L,RBC 3.34×10^9/L,Hb 99 g/L,PLT 126×10^9/L,NEU 7.06×10^9/L,NEU% 87.1%,LYM% 7.2%;G试验测值652.7 pg/ml(阳性),GM试验测值0.014(阴性)。
经治疗,患者病情逐渐稳定,体温恢复正常,痰量减少,颜色逐渐由黄变白,氧合进一步改善,血压逐渐稳定并停用血管活性药物,逐渐减少镇静、镇痛药物使用。
2月22日甲泼尼龙40 mg静脉滴注调整为每日1次。
2月29日停用头孢哌酮舒巴坦,并拔除气管插管,给予导管吸氧。
3月3日复查床旁胸部X线片提示双肺病灶逐渐吸收好转(图4)。

图4 2016年3月3日胸部X线片:双肺少许斑片状阴影
3月3日停用卡泊芬净、复方磺胺甲噁唑、甲泼尼龙。
3月16日复查胸部CT:双肺少许磨玻璃密度及索条阴影,较2月15日病灶明显吸收(图5)。3月18日患者后好转出院。
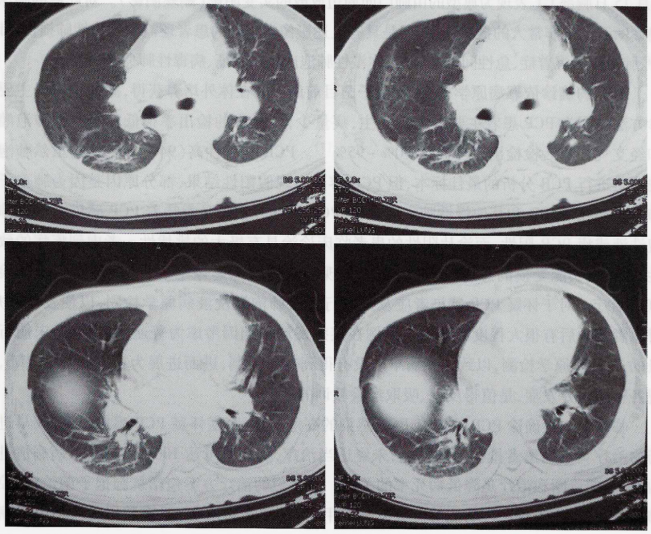
图5 2016年3月16日胸部CT:双肺少许磨玻璃影及斑片状索条影
三、讨论
肺孢子菌肺炎是由耶氏肺孢子菌(pneumocystis jiroveci,PJ)引起的一种机会性真菌感染,自1942年首次报道人体感染以来,发病率逐渐上升,主要见于获得性免疫缺陷综合征(HIV)患者。近年来,由于器官移植、化疗、激素及细胞毒性药物的广泛应用,非HIV患者PJP的发病率明显增高,病死率高达30%~60%,而HIV患者罹患PJP的病死率为10%~20%。PJP的临床表现没有特异性,主要表现为发热、干咳、进行性呼吸困难。PJP患者肺部体征较少,体征与病情严重程度不成比例是该病的典型临床特点。
非HIV患者感染PJ大概需要1周时间,由发热、干咳进展到呼吸衰竭,而HIV PJP患者病情呈逐渐发展的过程,约2周至2个月由发热、干咳进展到呼吸衰竭。临床表现的不同主要是由于宿主对PJ免疫反应不同所致。30%的非HIV PJP患者常合并细菌、病毒和真菌感染。本病例早期主要表现为咳嗽、活动后气短及间断发热,随着病情进展,出现严重呼吸困难,后期出现咳黄痰、WBC升高,考虑为PJP合并肺炎克雷伯菌感染所致。
PJP患者的胸部CT多表现为双肺对称的磨玻璃影、实变影、马赛克征、碎石路征等征象。本病例2月15日胸部CT表现为典型的由肺门向周边放散的实变阴影(蝴蝶阴影),这对此后的临床明确诊断起到了非常大的提示作用,但具有上述影像学表现的患者仍需与药物性肺损伤、肺水肿、肺泡蛋白沉积症、急性间质性肺炎、弥漫性肺泡出血综合征、病毒性肺炎等相鉴别。
PJP的确诊依靠病原学检查,PJ目前尚不能在体外培养获得,涂片检查是主要的确诊方法。因为PJP患者主要以干咳为主,痰量少,痰标本的检出率很低。支气管肺泡灌洗和经支气管肺活检检出率高达90%~95%。PCR敏感性高(94%~100%),虽然肺泡灌洗液是进行PCR分析的最佳标本,但PCR容易出现假阳性结果,部分原因是PJP容易在慢阻肺和其他慢性肺疾病患者定植,PCR阳性并不总是意味着PJ感染。对于肺泡灌洗液或痰PCR阳性而涂片阴性的患者,临床诊治具有极大挑战。
考虑疾病的致命性,当免疫功能受损患者出现临床表现和典型胸部影像学表现时,足以开始经验性PJP治疗。对于怀疑PJP应及早进行痰或肺泡灌洗液病原学检测,以便及早治疗,这对患者的预后有很大程度的影响。本病例在疾病发展早期因考虑为普通细菌感染,未能行积极的病原学检测,以致在疾病早期没有得到有效控制,进而发展为重症肺炎、ARDS,出现各种严重并发症,这值得反思并吸取经验教训。
临床上一旦确诊PJP或有PJP高危因素高度怀疑PJP,均应及早进行药物治疗。本病患者抵抗力非常差,未经适当治疗,病死率可达100%。由于本病进展迅速,早期诊断和治疗是降低病死率的关键,理想的治疗方案包括抗PJ治疗、控制肺部炎症反应、重建免疫功能等。
复方磺胺甲噁唑是磺胺甲噁唑和甲氧嘧啶的复合制剂,通过干扰叶酸代谢,杀灭PJ,无论对于HIV还是非HIV PJP患者,复方磺胺甲噁唑都是一线治疗药物。其不良反应通常出现在治疗的第6~14天,约40%的患者可出现中性粒细胞减少,25%出现皮疹,30%出现发热,10%出现肝肾功能异常、骨髓抑制,使用期间应严密监测患者的肝肾功能。
对于HIV PJP患者,复方磺胺甲噁唑的推荐疗程为3周,非HIV PJP患者疗程为2周,当机体存在严重免疫抑制、高PJP负荷量或临床症状改善较缓慢时,考虑可以适当延长疗程。本例患者使用复方磺胺甲噁唑15 d,临床和胸部影像学改善效果明显。对于部分复方磺胺甲噁唑过敏、不能耐受或耐药疗效不佳的患者,还可选择喷他脒或克林霉素联合伯氨喹等治疗,但安全性及疗效仍有待进一步观察。
卡泊芬净是一种抑制真菌细胞壁合成的棘白菌素类抗真菌药物,在动物实验中发现其具有抗PJP的作用,毒性低、不良反应小是其特征。本病例起病初期使用卡泊芬净可能为早期症状改善的原因。在后期气管插管后给予复方磺胺甲噁唑+卡泊芬净+甲泼尼龙+免疫球蛋白治疗,是患者病情迅速好转、症状明显改善的主要原因。对于HIV PJP患者,强烈推荐使用皮质激素。如果HIV PJP患者PaO2<70 mmHg(中-重度)时,推荐使用皮质激素进行治疗,以抑制PJ引起的肺内严重免疫炎症反应,可以显著降低呼吸衰竭的发生率及病死率,但其最佳剂量和疗程有待确立。非HIV PJP患者目前的研究结果矛盾、不一致,存在争议,不推荐常规使用激素,可以根据患者的具体情况选择。
总之,PJP是免疫抑制患者最常见的感染性疾病之一,早期进行病原学检测,明确诊断及时治疗,是降低病死率、改善预后的主要措施。由于我们早期做了肺泡灌洗液和PCR检查,发现了PJP PCR阳性,这对精准治疗起到了至关重要的作用。PJP患者自身抵抗力差,合并细菌、病毒等感染的可能性也较大,需引起临床重视。
四、专家点评
PJP是由PJ引起的一种机会性真菌感染,主要见于获得性免疫缺陷综合征、器官移植及肿瘤放化疗患者,发病率逐年上升,目前已是上述患者首要的死亡原因。此病临床表现缺乏特异性,病原学诊断困难,其临床体征与严重程度往往不平行。早期发现、早期诊断,并给予及时有效的治疗,对降低此病的病死率具有重要意义。本病例有淋巴瘤的疾病基础,且进行了2个周期的化疗,存在严重的免疫抑制。早期表现为发热、干咳、呼吸困难,与一般的肺部重症感染无明显区别,但经积极的「重拳猛击」抗感染效果差,感染仍在迅速进展,此时结合典型的以肺门为中心的肺实变阴影,应考虑为少见病原菌感染可能,结合患者的既往病史情况,PJP应成为此时的主要诊断方向。后经积极气管镜肺泡灌洗液行吉姆萨染色明确了PJP的病原学诊断。PJP的主要确诊方法是通过对诱导痰、支气管肺泡灌洗液或各种肺活检标本进行特殊染色,直接观察病原体。PJP染色方法很多,主要有吉姆萨染色法、哥氏银染色法等。另外,此病例通过积极有效的抗PJ治疗,患者临床表现及影像学改善情况均充满「戏剧性」,疾病很快得到控制。虽然PJP进展很快,预后非常凶险,但当能及早正确诊断,并给予有效的治疗后,疾病亦可以出现非常快且明显的改善。
参考文献
[1] Sepkowitz K A. Opportunistic infections in patients with and patients without acquired immunodeficiency syndrome[J]. Clin Infect Dis, 2002, 34(8):1098-1107.
[2] Caldero'n E J, Gutie'rrez-Rivero S, Durand-Joly I, et al. Pneumocystis infection in humans :diagnosis and treatment[j]. Expert Rev Anti Infect Ther, 2010, 8(6):683-701.
[3] Bienvenu A L, Traore K, Plekhanova I, et al. Pneumocystis pneumonia suspected cases in 604 non-HIV and HIV patients[J]. Int J Infect Dis, 2016, 46:11-17.
[4] Li M C, Lee N Y, Lee C C, et al. Pneumocystis jiroveci pneumonia in immunocompromised patients: delayed diagnosis and poor outcomes in non-HIV-infected individuals[J]. J Microbiol Immunol Infect, 2014, 47(1):42-47.
[5] Thomas C F Jr, Limper A H. Pneumocystis pneumonia[J]. N Engl J Med, 2004, 350(24):2487-2498.
[6] Limper A H, Offord K P, Smith T F, et al. Pneumocystis carini pneumonia.Differences in lung parasite numberand inflammation in patients with and without AIDS[J]. Am Rev Respir Dis, 1989, 140(5):1204-1209.
[7] Gilroy S A, Bennett N J. Pneumocystis pneumonia[J]. Semin Respir Crit Care Med, 2011, 32(6):775-782.
[8] Morris A, Lundgren J D, Masur H, et al. Current epidemiology of pneumocystis pneumonia[J]. Emerg Infect Dis, 2004, 10(10):1713-1720.
[9] Carmona E M, Limper A H. Update on the diagnosis and treatment of Pneumocystis pneumonia[J]. Ther Adv RespilDis, 2011, 5(1):41-59.
[10] Fisk M, Sage E K, Edwards S G, et al. Outcome from treatment of Pneumocystis jirovecii pneumonia with co-trimoxazole[J]. Int J STD AIDS, 2009, 20(9):652-653.
[11] Helweg-Larsen J, Benfield T, Atzori C, et al. Clinical efficacy of first-and second -line treatments for HlV-associatedPneumocystis jirovecil pneumonia: a tri-centre cohort study[J]. J Antimicrob Chemother, 2009, 64(6):1282-1290.
[12] Miller R F, Huang L, Walzer P D. Pneumocystis pneumonia associated with human immunodeficiency virus[J]. Clin Chest Med, 2013, 34(2):229-241.
作者:李爱民,张潍,刘志宏;单位:山西医科大学第一医院呼吸与危重症医学科
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:淋巴瘤合并肺孢子菌肺炎致ARDS
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


