
摘要
类器官是将组织细胞通过3D培养形成的一种能高度模拟体内生理病理状态的组织培养物,有助于研究体内组织器官发生发育过程中细胞时间和空间维度的变化,探究各种危险因素导致细胞功能及通讯的改变,发现潜在的治疗靶点。本文综述肺泡类器官的培养、鉴定方法,及在肺纤维化、慢性阻塞性肺疾病及病毒性肺炎等常见呼吸疾病中的应用研究进展,分析讨论肺泡类器官使用的局限性和未来主要的应用方向。
类器官技术是一种新型三维(three-dimensions,3D)细胞培养技术,通过在体外培养诱导多能干细胞(induced pluripotent stem cells,iPSC)、胚胎干细胞(embryonic stem cells,ESC)或成体干细胞(adult stem cells,ASC)进行分裂与分化,形成与其来源的特定组织或器官相似的体外模型,该体外模型即为类器官。近年来类器官技术呈飞跃式发展趋势,目前已经成功建立肺、气道、肠道、胃、肾脏、大脑等类器官模型[ 1 ],类器官不仅能高度模拟体内细胞生长环境,保持细胞生长的空间结构,而且能更好地代表来源组织器官的生理功能和生物学特性[ 2 ],有助于深入研究各种分子和信号通路对器官形成过程在不同时期的作用[ 3 ]。
在多种肺部疾病的发生发展过程中,伴随着肺泡结构不同程度的病变,如慢性阻塞性肺疾病(简称慢阻肺)、特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)以及近年来波及全球的新型冠状病毒感染性肺炎(简称新冠肺炎)等。传统的体内外实验模型能够一定程度上还原人体肺泡结构的变化情况,但生物学特性仍有许多不同,利用新型模型模拟人体肺泡层面更为真实的变化情况迫在眉睫。肺泡类器官是指肺干细胞3D支持培养下形成的类似于肺泡细胞类型和结构的培养物,该类器官表达肺泡上皮细胞标志物且包含部分肺间充质细胞。目前针对肺泡类器官的不同处理已在多种涉及肺泡病变的肺部疾病有了广泛研究进展[ 4 , 5 , 6 ]。
一、肺泡类器官培养体系
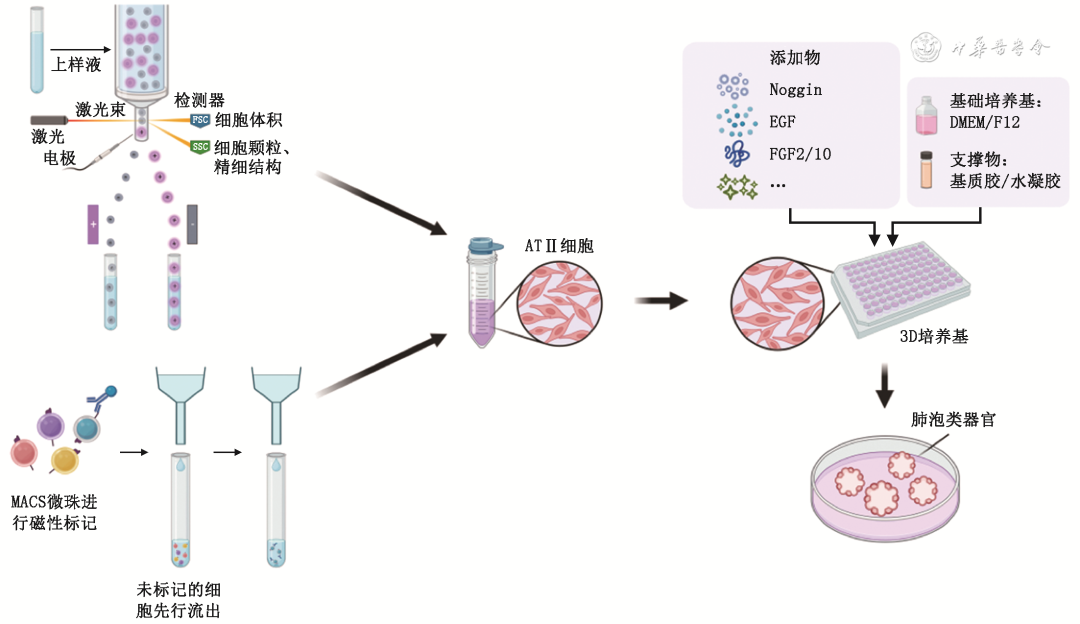
肺泡类器官的培养基于Ⅱ型肺泡上皮细胞(type Ⅱ alveolar cells,ATⅡ)所具有的多能干细胞特性。ATⅡ主要通过流式细胞分选技术(flow cytometry sorting,FCS)[ 7 , 8 ]和磁珠分选法获取。
除了ATⅡ本身之外,肺泡类器官的培养体系还需要添加其他共培养细胞或细胞因子。最初使用的有PDGFRα+成纤维细胞[ 7 , 8 , 9 , 10 ]等。现多在类器官基础培养基中添加有利于ATⅡ增殖及分化的细胞因子,最常使用的基础培养基为DMEM/F12,添加的细胞因子主要有成纤维细胞生长因子(fibroblast growth factor,FGF)2和10、表皮生长因子(epidermal growth factor,EGF)、Noggin、R-spondin-1、Y-27632、CHIR 99021、SB 431542等[ 11 , 12 ],具体添加的种类以及用量需要根据培养目的进行相应调整。
肺泡类器官3D结构的形成需要一定的支撑体系,目前使用最为广泛的为基质胶[ 13 ]。除基质胶以外,近期有文献报道了一种使用透明质酸水凝胶培养肺泡类器官的方法,该方式能够有效减少肺泡类器官大小及结构的不均一性[ 14 ],未来有潜力成为基质胶的替代品。
目前肺泡类器官的培养体系仍在不断更新迭代,对不同细胞因子和支撑物等研究越来越多,随着研究的不断深入和技术的不断革新,肺泡类器官作为一种理想的新型模型在肺部疾病的探索征途上扮演着越来越重要的角色( 图1 )。
二、肺泡类器官的优越性
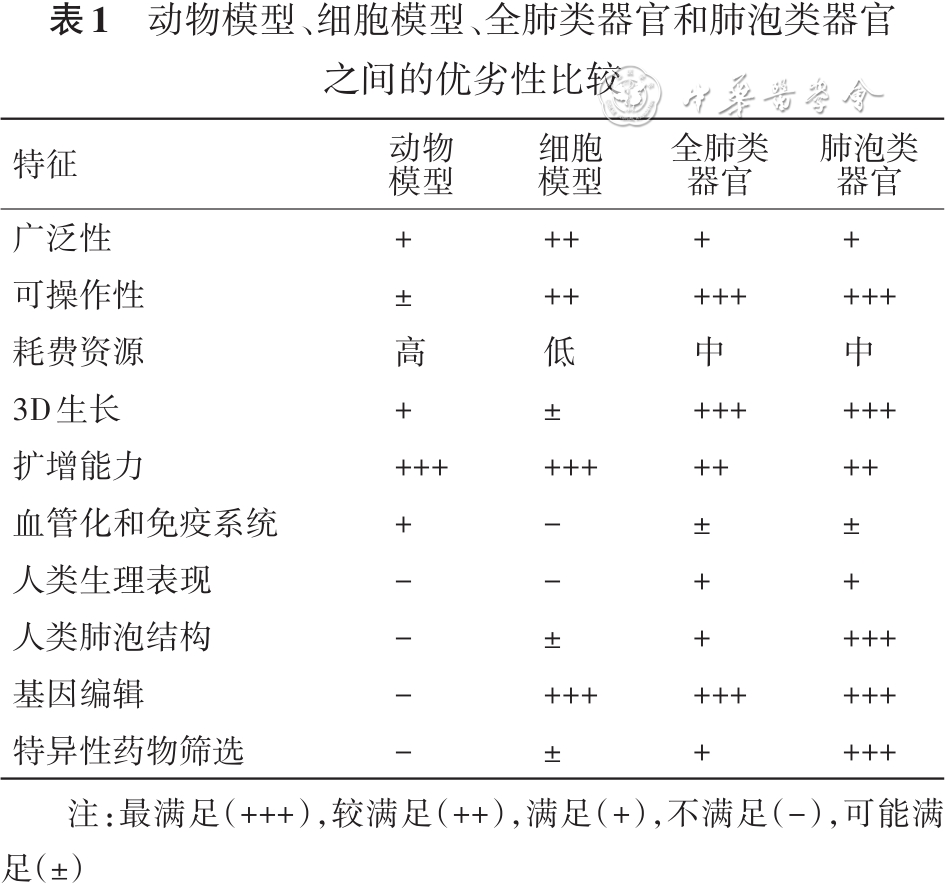
传统的实验方案主要通过体外培养各种肺部细胞并给予一定条件刺激、构建动物疾病模型等模拟人体各种肺部疾病开展研究,然而体外细胞培养与体内环境仍有较大区别,相对于组织及器官层面细胞培养不能很好地反映体内多因素对疾病发生发展的潜在影响。动物模型能够在部分程度上还原疾病在人体内的表现和作用机制,然而不同种类的动物在肺部结构上与人体存在部分差异,如人体气道远端分支于肺泡气体交换生态位交织形成呼吸道细支气管,小鼠中却缺乏这种结构[ 15 ]。
利用类器官构建肺部疾病模型在一定层面上克服了传统体内外模型的不足之处,其培养来源细胞可通过多种途径从人体分离获得,在短期内即可培养出大量类器官结构[ 16 ]。类器官适用于研究多种肺部细胞间的相互作用,从整体的层面反映疾病因素所导致的多种细胞机制变化[ 17 ]。肺泡类器官在正常生理中有助于探索人体内肺泡结构发生发育过程中肺泡细胞时间维度的变化,如何实现肺泡结构的重建是肺再生的研究重点之一;在病理层面探究各种危险因素导致肺泡细胞功能及通讯的改变有助于发现潜在的治疗靶点。因此,肺泡类器官作为新型工具在涉及肺泡病变的疾病研究中存在广泛的优越性( 表1 )。
三、肺泡类器官在常见肺疾病中的应用研究进展
1. 肺纤维化:肺纤维化是一种慢性的、进行性发展且预后不佳的致死性间质性肺疾病,其中最严重以及最常见的一种为特发性肺纤维化。IPF的发病机制基于最初的肺泡上皮损伤,随后表现为成纤维细胞、肌成纤维细胞过度增生和细胞外基质(extracellular matrix,ECM)过度积累,进而破坏了肺的正常生理结构以及功能[ 18 , 19 ]。运用类器官技术在IPF的相关研究近年来不断增加( 表2 )。

最初的类器官IPF模型主要包含肺泡上皮细胞、间充质细胞以及各种肺部其他细胞。Wilkinson等[ 20 ]首次利用包含肺泡上皮细胞的肺类器官建立体外IPF模型。在功能化的藻酸盐珠周围搭建包括间充质细胞、肺泡上皮细胞等多种细胞构建人iPSC(human iPSC,hPSC)来源的肺类器官,用TGF-β处理之后发现能够生成高水平Ⅰ型胶原以及a-SMA的局部斑块,类似于IPF患者中的成纤维细胞病灶。与此不同的是,Surolia等[ 21 ]通过手术活检获得正常人和IPF患者的部分肺组织后提取细胞悬液制备成肺球样类器官,包含了ATⅡ(SFTPC+)、肌成纤维细胞(a-SMA)等细胞,在来源于IPF患者的类器官观察到明显的侵袭性肌成纤维细胞区域,与正常组相比细胞外基质蛋白表达具有差异性,这种构建方法更利于针对不同患者进行个性化治疗方案的设计。
Hermansky-Pudlak综合征(Hermansky-Pudlak syndrome,HPS)是一种常染色体隐性疾病,绝大多数患者表现出类似于IPF的临床病变,Strikoudis等[ 22 ]将包含大量ATⅡ以及少量间充质的hPSC运用CRISPR/Cas9技术使多个HPS基因发生移码突变后进行特定培养,产生了具备纤维化表型的类器官,从而提供了一个新的研究模型以更好地确定IPF的发病机制。Suezawa等[ 23 ]采用FCS将hPSC分选出SFTPC+细胞后,对衍生的肺泡类器官给予BLM刺激,在该模型中观察到ATⅡ、ATⅡ-ATⅠ中间状态细胞发生衰老、成纤维细胞激活、类器官整体收缩和细胞外基质的积累,类似于IPF中的纤维生成。
肺泡类器官IPF模型的构建目前通过给予致纤维化因子或药物,以及特定基因突变诱导产生类似于体内外实验模型的表型,为IPF的研究扩展出一条新的道路,然而多种处理方式所产生的类器官病变仍存在部分差异,且涉及机制具有不同之处,因此围绕研究内容选择合适的处理方式尤为重要。
2. 慢阻肺:慢阻肺是一种可预防可治疗,以持续存在的呼吸道症状和气流受限为特征的常见疾病[ 24 ]。在中国,目前接近有1亿人患有不同程度的慢阻肺,因其死亡的人数在单病种致死排序中排到了第三位[ 25 ]。随着病情进展,慢阻肺患者肺泡上皮细胞修复功能的进行性障碍促进了肺气肿的发生和发展,因此寻找合适的肺再生方法尤为重要。其中,运用类器官模拟慢阻肺模型研究肺泡上皮细胞的转分化机制近年来被广泛认可并采纳( 表2 )。
由于吸烟是促进慢阻肺发生发展最主要的危险因素,因此常给予香烟烟雾(cigarette smoke,CS)以及香烟提取物(cigarette smoke extract,CSE)刺激分别构建疾病的体内体外模型。在一项将小鼠长期暴露于CS模拟慢阻肺的研究中,使用离体肺泡类器官模型来探索一种被称为“序列相似成员13A家族”(family with sequence similarity 13 member A,FAM13A)的基因的作用,肺泡类器官由熏烟处理的FAM13A+/+和FAM13A-/-小鼠产生。结果显示,FAM13A的缺失与ATⅡ的增殖分化以及肺泡类器官生长趋势增加有关,暴露于CS中时,FAM13A缺失会上调ATⅡ中WNT的激活,并且相比FAM13A+/+小鼠发育出更多的肺泡类器官[ 26 ]。另一项研究中,通过体外3D培养原代小鼠ATⅡ构建肺泡类器官,给予不同浓度的CSE刺激一定时间后,发现达到CSE毒性浓度之前,增加CSE浓度能够激活ATⅡ细胞的干细胞功能,包括诱导其更快速的增殖和分化,增强对凋亡的抵抗力,形成体积更大、数量更多的肺泡类器官[ 27 ]。空气污染也是促使慢阻肺进展的重要因素,Yu等[ 28 ]将PM2.5加入在肺泡类器官的生长培养基以及分化培养基中,发现PM2.5处理后引起了肺泡类器官的损伤,ATⅡ的增殖水平升高但修复功能受损,ATⅠ与ATⅡ的比值明显下降,表明抑制了ATⅡ细胞进入转分化的过程。Wu等[ 29 ]使用不同浓度柴油废气颗粒(diesel exhaust particles,DEP)连续处理小鼠以及人肺泡类器官14 d后,发现类器官的体积及数量均显著减少,且与Wnt/β-catenin信号通路的下调有关。
由于慢阻肺致病因素的复杂性,体内外有多种造模方式,然而具有局限性。给予肺泡类器官各种有害颗粒提取物处理后得到的结果与大多数体内外疾病模型具有一致性,且能更直观地展现肺泡上皮细胞的慢性演变,因此有望被广泛应用于慢阻肺发病过程及肺再生的机制研究。
3. 新冠病毒感染及肺炎:新冠病毒肺炎是由严重急性呼吸综合征冠状病毒2型引起的呼吸道感染性疾病,至今仍在全球范围内不断蔓延[ 30 ]。截至2023年1月22日,全球报告确诊病例超过6.64亿例,死亡病例超过670万例[ 31 ]。部分患者感染新冠病毒后会引起弥漫性的肺泡损伤,进而导致严重的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[ 32 ],为了解其具体的发病机制,近年来国内外学者们利用肺泡类器官创建了多种体外病毒感染模型以深入研究( 表2 )。
最初开发的类器官模型用于药物筛选。Han等[ 33 ]将hPSCs培养成包含ATⅡ的肺类器官后,利用其表达ACE2的特性使培养物感染新冠病毒后进行转录组测序分析,发现多种趋化因子和细胞因子有较高的表达水平,且几乎没有I/Ⅲ型干扰素(interferon,IFN)信号的表达,这与新冠病毒肺部感染的患者观察到的情况类似,使用伊马替尼和霉酚酸能够减缓病毒对类器官的感染。同年7月,Salahudeen等[ 34 ]采用去除ECM悬浮培养的方法,培养出外层为肺泡上皮细胞的类器官球体,免疫荧光结果显示ACE2定位于类器官外表面的细胞膜,用新冠病毒感染后发现肺泡类器官中约10%的SPTPC+细胞有明显的新冠病毒核衣壳蛋白表达,证明ATⅡ能够直接被病毒所感染。Katsura等[ 35 ]确定了成人肺泡干细胞长期扩张和分化的条件后,构建了可被新冠病毒直接感染的肺泡类器官,发现感染后的类器官与新冠病毒感染后的肺部特征相似,如IFN介导的炎症反应出现、表面活性蛋白的缺失和细胞凋亡,此外用低剂量IFN预处理肺泡类器官观察到病毒复制的减少,表明其对新冠病毒的预防作用。Pei等[ 36 ]也证明了新冠病毒可以感染肺泡类器官中一类特定亚群的ATⅡ,转录组测序结果显示在病毒感染后脂质代谢过程下调,此外还发现瑞德西韦可有效抑制新冠病毒在类器官中的复制。
上述多项研究已共同证明新冠病毒感染肺泡类器官的体外模型已成功构建,在已有的动物、细胞模型基础上,为后续肺泡上皮病变机制研究、抗病毒药物筛选提供了一种新型且有效的工具。未来可聚焦于病毒感染肺泡类器官后结合转录组学、代谢组学等多组学联合分析,探索不同毒株所引起肺泡病变所具有的差异性。
四、展望
类器官技术的出现有效地填补了体外模拟人类器官在疾病状态变化方面的空白。随着类器官培养技术的发展,在多种涉及肺泡病变的肺部疾病中,包括IPF、慢阻肺以及新冠病毒引起的肺部感染,研究人员可通过直接分离患者或疾病模型体内的肺泡干细胞后培养成类器官,辅以CRISPR/Cas9技术构建合适的疾病模型;也可对正常状态的肺泡类器官给予致病因子、药物或病毒进行刺激,以模拟这些致病因素对肺泡类器官结构和功能的影响。
目前应用肺泡类器官为疾病在肺泡结构层面所产生的病理生理变化、发病机制和相关信号通路提供了新的研究方法,有助于针对各疾病的相应靶点筛选有效药物从而进一步推进临床试验研究。不只于肺泡类器官,随着各种类器官的培养条件不断成熟化、标准化,这种新型体外培养模型将被越来越多的研究人员所掌握并运用在基础研究中;在临床诊疗中,未来针对不同的患者提取病变部位具有干细胞活性的成体细胞,培养对应的类器官结构后制定个性化治疗方案,有望成为更安全、更有效的一种策略。
参考文献(略)
作者:孔维国 林欣 朱俊豪 林泽强 朱思源 张子丽 卢文菊;单位:广州医科大学附属第一医院呼吸疾病国家重点实验室 国家呼吸医学中心 广州呼吸健康研究院;广州医科大学
引用本文: 孔维国, 林欣, 朱俊豪, 等. 肺泡类器官在常见肺疾病中的应用研究进展[J]. 中华结核和呼吸杂志, 2023, 46(8): 829-834. DOI: 10.3760/cma.j.cn112147-20230501-00207.
本文转载自订阅号「中华结核和呼吸杂志」(ID:cmjlung)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


