
链霉菌(Streptomyces),隶属链霉菌目(Streptomycetales),链霉菌亚目(Streptomycineae),链霉菌科(Streptomycetaceae),为土壤微生物群的重要组成部分,广泛存在于湖泊、海洋和海洋等环境中。链霉菌属是放线菌门中最大的一个属,截止至2023年2月,链霉菌科在原核生物标准命名名录(List of Prokaryotic names with Standing in Nomenclature, LPSN)中收录的有效发表并正确命名的物种数为732个[3]。
一、概述
链霉菌自1916年由Waksman和Henrici从土壤中发现后,于1943年提出建立链霉菌科[1]。随着分子生物学工具的发展,Stackebrandt等[2]在1997年通过16S rRNA相似性及DNA-DNA杂交的结果构建了链霉菌的系统发育树,这标志着链霉菌分子分类时期的开始,并建议将链霉菌科提升为放线菌纲中的一个亚目,命名为链霉菌亚目。2012年发布的《伯杰氏系统细菌学手册》(Bergey’s Manual of Systematic Bacteriology)中Kämpfer等将链霉菌亚目正式划分为链霉菌目[3]。
链霉菌具有特征性的形态特点,其为革兰氏阳性需氧菌,可产生各种水溶性或脂溶性色素,有发育良好的分枝菌丝,菌丝纤细,横隔稀疏,分化为营养菌丝(又称基内菌丝)、气生菌丝。气生菌丝成熟后发育为孢子丝,孢子丝可呈直立、螺旋状、轮生等多种形态,可裂生大量分生孢子进行播撒(图1)。
1940–1970年之间的近30年被称为「抗生素发现的黄金时代」,在此期间研究人员从土壤链霉菌中发现了大量沿用至今的抗生素,如链霉素、红霉素、四环素、卡那霉素、土霉素等[4]。有趣的是,大约三分之二的天然抗生素是由放线菌产生,其中约75%的抗生素由链霉菌属产生,链霉菌为人类医疗做出了巨大的贡献。链霉菌目前主要运用于抗生素、抗肿瘤制剂和免疫抑制剂的生产研究中[5],作为最具代表性的放线菌之一,是研究人员长期关注的重要功能类群。
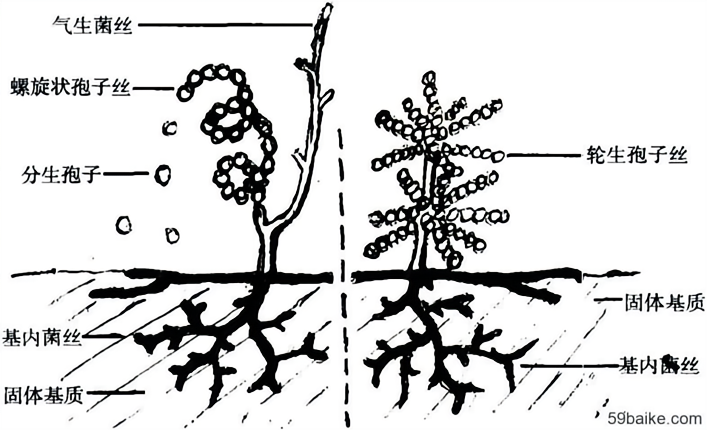
图1 链霉菌形态结构的模式
二、灰色链霉菌的培养特点
链霉菌属的主要代表是能产生链霉素的灰色链霉菌,其在标本中呈现革兰氏阳性的细长,不规则分枝的丝状体(图2)。
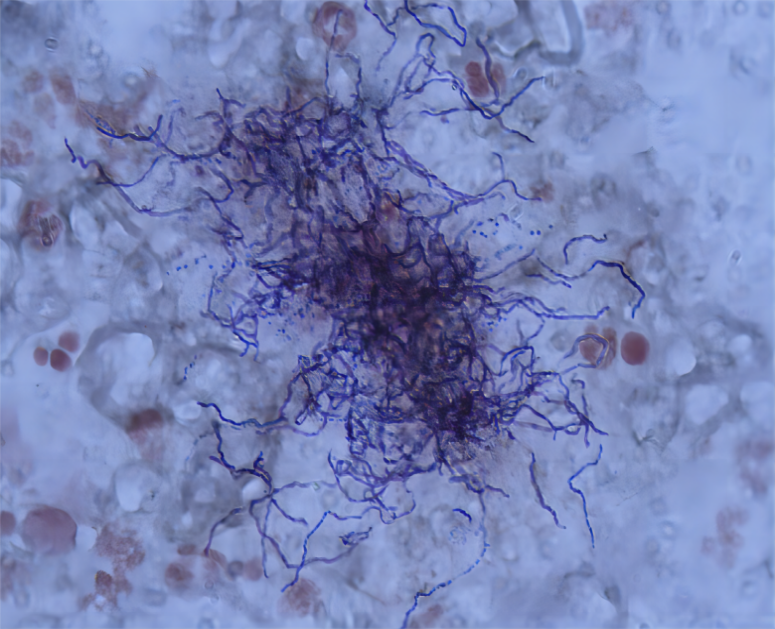
图2 链霉菌在标本中的形态
灰色链霉菌生长缓慢,在血平板37℃可缓慢生长。培养初期菌落干燥不透明,表面粗糙,边缘不整齐,菌落陷入琼脂内,不易挑起,形成「噬琼脂」现象。随着时间的延长,菌落变大,中心凸起,逐渐形成菊花状或放射状,并产生色素和溶血环,有剧烈的土腥味。
灰色链霉菌菌落不易散开,革兰染色可见革兰阳性杆菌,有细长的不规则分枝状菌丝。该菌抗酸染色和弱抗酸染色结果为阴性(图3)。
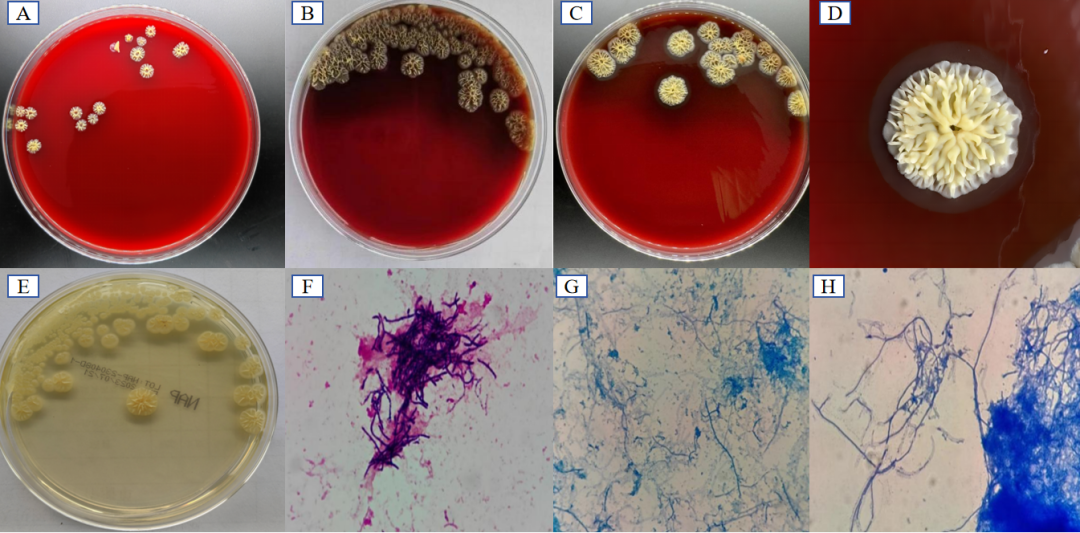
图3 灰色链霉菌培养特性
注:A:血平板,37℃,3d,菌落呈黄色、菊花状、放射状,轻微「噬琼脂」;B:血平板,37℃,5d,菌落产生色素C:血平板,37℃,7d,菌落开始出现透明溶血;D:血平板,37℃,7d,可见明显透明溶血环;E:血平板,37℃,5天,菌落为黄色;F:菌落革兰染色(100×);G:弱抗酸染色(100×);H:抗酸染色(100×)。
三、链霉菌与诺卡菌的鉴别
相较与链霉菌属,诺卡菌的生长同样缓慢,在血平板室温或37℃可缓慢生长,45℃时亦可生长。菌落大小不等,致密干燥,凸起,表面有皱褶,颗粒状,不溶血,而链霉菌明显溶血。菌落陷入琼脂内,呈现「噬琼脂」现象。不同种类可产生不同色素,,但大部分主要以白色菌落为主,如北京诺卡菌菌落呈白色(图4A),皮疽诺卡菌菌落为黄色,需与链霉菌相鉴别(图4B、C)。诺卡菌镜下为革兰阳性杆菌,有细长的分枝菌丝,亦或同时有杆状或球状存在,丝状体呈粗细不等的串珠状。菌体着色不均,有颗粒感,弱抗酸染色阳性(链霉菌弱抗酸染色阴性),抗酸染色阴性(图4D-F)。链霉菌还需与冢村菌属、红球菌属、戈登菌属和嗜皮菌属作鉴别(表1)。
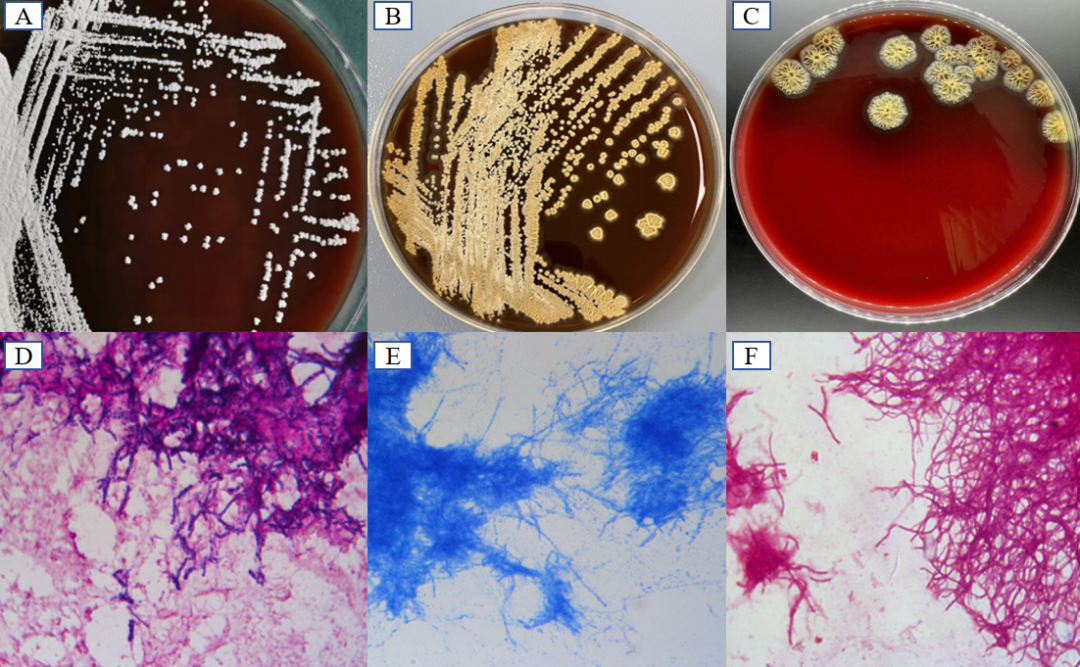
图4 诺卡菌培养特性
注:A:北京诺卡菌,37℃,7天,白色菌落;B:皮疽诺卡菌,37℃,7天 ,黄色菌落;C:灰色链霉菌,黄色菌落;D:革兰染色阳性,染色不均一性明显,呈颗粒状(100×);E:抗酸染色阴性,菌体可见颗粒(100×);F:弱抗酸染色,阳性(100×)。
表1 链霉菌属与其他菌属鉴别要点
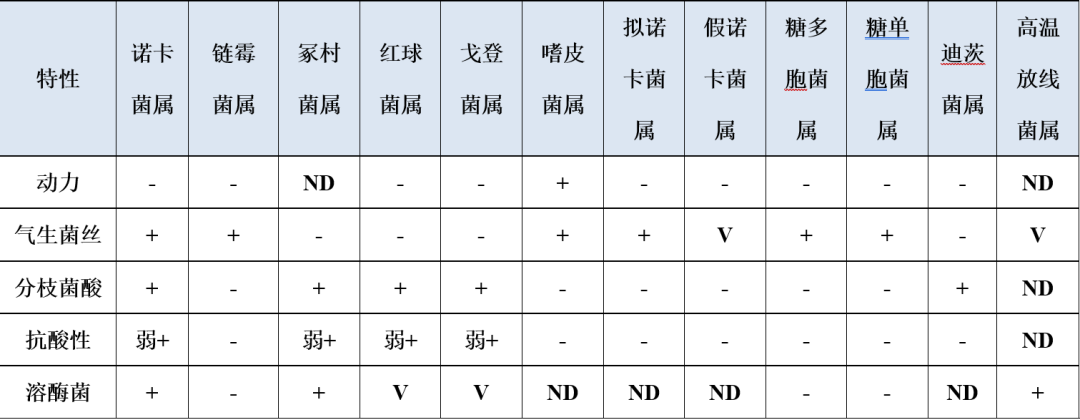
注:+,90%以上菌株阳性;-,90%以上菌株阴性;V,11%-18%菌株阳性;ND,无资料
四、链霉菌与其它菌属的鉴别
Lechevalier在1976年提出以化学分类研究与形态特征相结合用于区分链霉菌属,可作为链霉菌定属的标准[6]。根据酪氨酸、黄嘌呤、次黄嘌呤、脲酶、乳糖、木糖、硝酸盐等生化反应特点,可大致对链霉菌属进行区分(表2)。
表2 链霉菌属内鉴别要点[7]
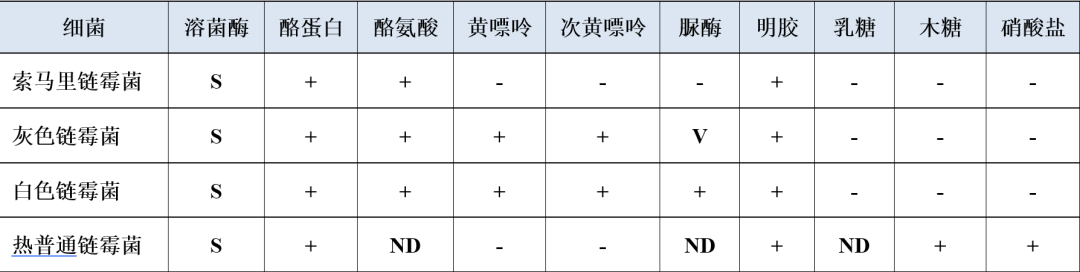
注:+,90%以上菌株阳性;-,90%以上菌株阴性;V,11%-18%菌株阳性;ND,无资料
五、临床意义
链霉菌为土壤中常见的腐生菌[8],可从呼吸道标本、耳道分泌物和创面分泌物分离出,但只有少数病例报道与感染相关。链霉菌可引起足菌肿,为一种慢性肉芽肿性皮下炎症性疾病,最常见的致病菌为索马里链霉菌,感染最常累及足部,可侵犯手和身体其他部位,临床表现为足部皮肤破裂和窦道形成、慢性化脓性生长及具有肿瘤样结节形成 [9]。在已报道的病例中,常见于机体免疫功能低下患者,如瓣膜置换术后[10]、晚期恶性肿瘤[11]、艾滋病[12]、克罗恩病[13]或其他需要免疫抑制剂治疗的严重疾病,链霉菌可导致皮肤脓肿、发热、关节炎、肺炎、菌血症和脓毒血症等。但近年来也有报道免疫功能正常的患者肺部感染链霉菌的案例[14],由此可见,链霉菌为一种潜在的病原体。
因此,对于临床分离的链霉菌,如何排除污染,确认其为致病菌,仍需要微生物工作者加以判断。对于临床有感染症状的患者,有菌部位标本分离出的链霉菌,我们需查看原始标本接种的平板是否为纯培养的链霉菌,原始标本涂片结果是否可见分枝状菌丝(革兰、抗酸和弱抗酸染色),然后结合形态学特点,综合考虑其是否为致病菌。若确定为致病菌,可借助形态学鉴定、质谱鉴定[15]和分子手段(16S rDNA测序、宏基因组测序等)等方法,助力链霉菌的准确鉴定。
六、链霉菌感染的治疗
对于链霉菌感染的治疗,目前尚无统一的治疗标准和路径,而且链霉菌的体外药敏尚无参考折点,治疗通常是参考诺卡菌感染相关的数据。McNeil MM[16]对37株灰色链霉菌进行体外药敏试验,结果显示最有效的药物是多西环素、红霉素、亚胺培南、米诺环素和氨基糖苷类药物,而对复方磺胺甲恶唑(TMP-SMX)、氨苄西林、头孢噻肟和环丙沙星的耐药率较高。笔者参照CLSI M45 A3少见菌药敏推荐中诺卡菌及其它需氧放线菌进行体外药敏试验,显示阿米卡星、头孢曲松、克拉霉素、亚胺培南、利奈唑胺、米诺环素、妥布霉素敏感,复方新诺明和环丙沙星耐药,结果与McNeil MM等学者的研究结果基本一致[16]。Nasher[17]对10株索马里链霉菌的体外药敏结果研究表明利福平、红霉素、妥布霉素、夫西地酸和硫酸链霉素为敏感率较高的抗菌药物,而甲氧苄氨嘧啶出现高耐药率。由此可见,部分链霉菌会表现出复方磺胺甲恶唑(TMP-SMX)和甲氧苄氨嘧啶的高耐药率,对于临床上分离到的链霉菌,若治疗统一参考诺卡菌的话,可能到导致抗感染治疗的失败,因为TMP-SMX常用来治疗诺卡菌的感染。
链霉菌生长缓慢,抗感染需要足够的疗程。2015年报告首例灰色链霉菌引起的颈面部足菌肿,患者经静脉注射青霉素8周后,病变消退[18]。24岁的男性库欣综合征患者,胸腔积液培养为链霉菌,患者使用广谱抗生素后抗感染效果欠佳,随后改用克拉霉素6个月好转[19]。2007年一例免疫功能正常的52岁妇女,由链霉菌引起的左下叶肺炎,经多西环素治疗6个月后感染完全消失[14]。因此,对于链霉菌引起的感染,抗感染需要足够的疗程,而且在条件允许的情况下,尽可能开展体外药敏试验,从而为临床提供诊疗依据。
七、小结
链霉菌为环境中常见的腐生菌,在培养基上菌落呈现菊花状或放射状,并产生色素和溶血环,有剧烈的土腥味,形成「噬琼脂」现象。链霉菌不易引起人类致病,但对于免疫功能低下和免疫缺陷患者,需警惕其引起的侵袭性感染。对于临床中到的链霉菌是否为感染,还需结合标本来源(是否为无菌部位)、原始标本涂片结果、原始标本接种后平板生长情况和患者的临床表现综合判断。再者,临床上部分链霉菌会表现出复方磺胺甲恶唑(TMP-SMX)和甲氧苄氨嘧啶的高耐药率,不推荐TMP-SMX作为治疗链霉菌的首选药物。
参考文献
1.Waksman SA, Henrici AT. The Nomenclature and Classification of the Actinomycetes. J Bacteriol. 1943 Oct; 46(4): 337-341.
2.Wellington EM, Stackebrandt E, Sanders D, et al. Taxonomic status of Kitasatosporia, and proposed unification with Streptomyces on the basis of phenotypic and 16S rRNA analysis and emendation of Streptomyces Waksman and Henrici 1943, 339AL. Int J Syst Bacteriol. 1992 Jan; 42(1): 156-160.
3.董雷, 韩嘉瑞, 李帅, 等. 链霉菌最新研究进展[J]. 微生物学报, 2023, 63(5): 1815-1832.
4.Procopio RE, Silva IR, Martins MK, et al. Antibiotics produced by Streptomyces. Braz J Infect Dis 2012, 16(5): 466-471.
5.Bentley SD, Chater KF, Cerdeno-Tarraga AM, et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 2002 May 9; 417(6885): 141-147.
6.Pine L, Boone CJ. Comparative cell wall analyses of morphological forms within the genus Actinomyces. J Bacteriol. 1967 Oct; 94(4): 875-883.
7.周庭银,章强强,临床微生物学诊断与图解(第四版)[M],上海:上海科学技术出版社,2017: 274.
8.Zheng J, Zhang X, Xin Y, et al. Streptomyces yaanensis sp. nov., isolated from soil. Int J Syst Evol Microbiol. 2013 Dec; 63(Pt 12): 4719-4723.
9.E Favre, G Fleuridas, L Baril, et al. Streptomyces somaliensis mycetoma with craniofacial involvement, Rev Stomatol Chir Maxillofac, 1998 Jun; 99(2):70-74.
10.Mossad SB, Tomford JW, Stewart R, et al. Case report of Streptomyces endocarditis of a prosthetic aortic valve. J Clin Microbiol. 1995 Dec; 33(12): 3335-337.
11.Kapadia M, Rolston KV, Han XY. Invasive Streptomyces infections: six cases and literature review. Am J Clin Pathol. 2007 Apr;127(4):619-624.
12.Caron F, Borsa-Lebas F, Boiron P, et al. Streptomyces sp. as a cause of nodular pneumonia in an HIV infected patient. Med Microbiol Lett 1:297-303.
13.Ekkelenkamp MB, de Jong W, Hustinx W, Thijsen S (2004) Streptomyces thermovulgaris bacteremia in a Crohn's disease patient. Emerg Infect Dis 10:1883–1885.
14.Diamantis P, Kofteridis, Sofia, et al. Streptomyces pneumonia in an immunocompetent patient: a case report and literature review[J].Diagnostic microbiology and infectious disease, 2007, 59(4): 459-462.
15.Loucif L, Bendjama E, Gacemi-Kirane D, et al. Rapid identification of Streptomyces isolates by MALDI-TOF MS. Microbiol Research. 2014 Dec;169(12): 940-947.
16.McNeil MM, Brown JM, Jarvis WR, et al. Comparison of species distribution and antimicrobial susceptibility of aerobic actinomycetes from clinical specimens. Rev Infect Dis. 1990 Sep-Oct; 12(5):778-783.
17.Nasher MA, Hay RJ, Mahgoub ES, et al. In vitro studies of antibiotic sensitivities of Streptomyces somaliensis--a cause of human actinomycetoma. Trans R Soc Trop Med Hyg. 1989 Mar-Apr; 83(2): 265-268.
18.Chander J, Singla N, Handa U. Human cervicofacial mycetoma caused by Streptomyces griseus: First case report. J Microbiol Immunol Infect. 2015 Dec; 48(6): 703-705.
19.Ataiekhorasgani M, Jafaripozve N, Zaerin O. Streptomyces infection in Cushing syndrome: A case report and literature review. Advanced Biomedical Research. 2014 Jan 9; 3:26.
作者简介

陈敏
广东省江门市新会区中医院检验科 主管技师。从事临床微生物检验工作十年,目前在广东省人民医院检验科进修。

林淳
广东省广州市荔湾区人民医院检验科 主管检验技师。从事临床检验工作13年,PCR组组长,现主要负责实验室质量管理,目前在广东省人民医院检验科微生物组进修。

袁凯旋
广东省人民医院检验科临床微生物组 主管技师;华南真菌感染精准诊疗与经济学研究联盟秘书;广东省药学会第一届临床微生物专家委员会委员;广东省人民医院检验科进修生管理员、微生物组教学管理员。从事临床微生物检验多年,较擅长真菌感染的实验室诊断及分子鉴定,以第一作者/通讯作者发表国内外论文多篇,带教进修生和实习生论文多篇。主要研究方向:临床病原真菌研究。
作者:陈敏1,2,林淳1,3;指导:袁凯旋1;单位:1广东省人民医院检验科;1江门市新会区中医院检验科 ;3广州市荔湾区人民医院检验科;审校:王占伟(北京大学人民医院)
本文转载自订阅号「京港感染论坛」(ID:PIDMIC)
原链接戳:【慧眼识菌】浅谈“链霉菌”
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


