
一、病史简介
男性,36岁,安徽人,2023-06-26入中山医院感染病科。
主诉:发热20天,发现肺阴影5天、全身结节2天。
现病史:
2023-06-06出现发热,Tmax 38.5℃,伴全身酸痛、头痛,咳嗽,偶咳少量黄痰,自测新冠病毒抗原阳性,服布洛芬、阿莫西林近2周,咳嗽咳痰好转,仍有发热,06-20测新冠病毒抗原转阴。
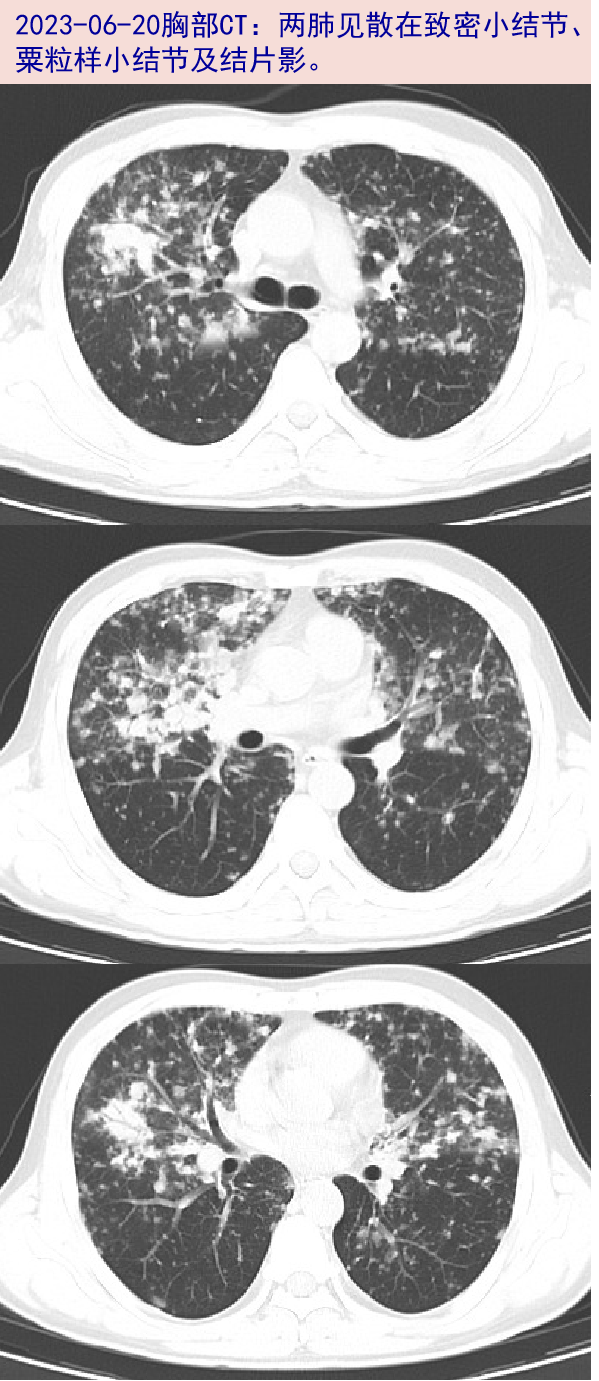
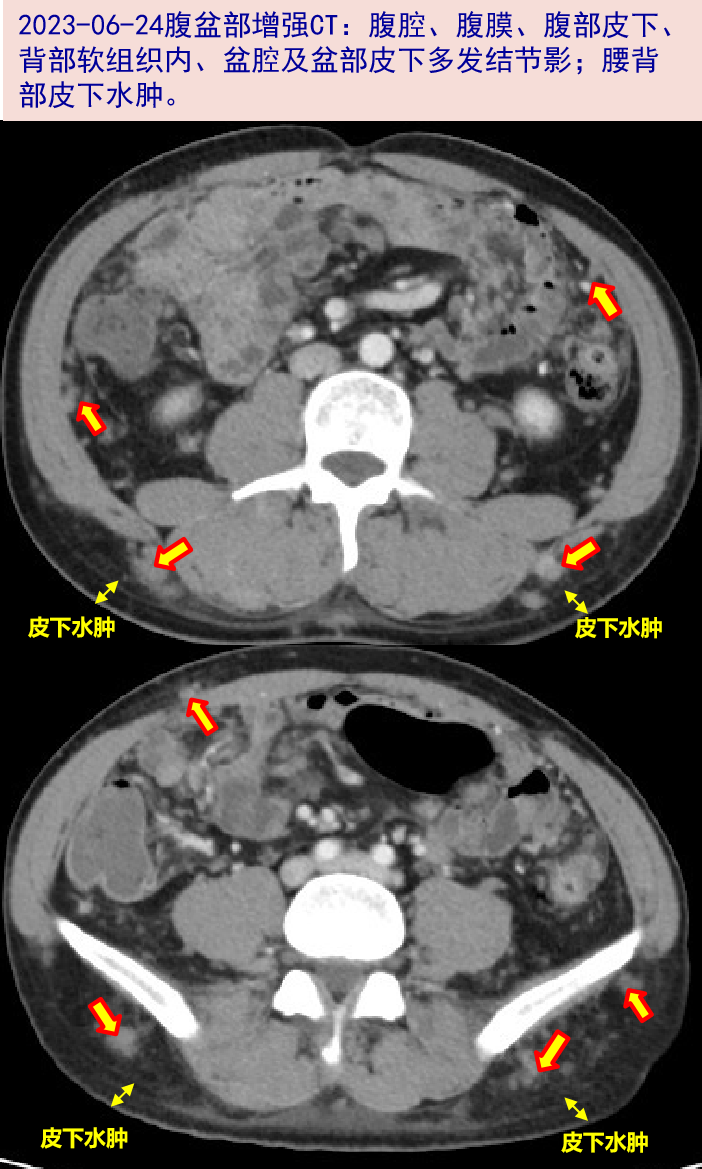
2023-06-20就诊我院,查WBC:6.25X10^9/L,N:85.3%,L:0.3X10^9/L;hsCRP:22.6mg/L;D-二聚体:2.27mg/L;T-SPOT.TB:A/B 0/0(0/245);新冠病毒核酸阴性;胸部CT:两肺见散在致密小结节、粟粒样小结节及结片影;心膈角多发稍大淋巴结。予左氧氟沙星0.5g qd抗感染。2023-06-24腹盆部增强CT:腹腔、腹膜、腹部皮下、背部软组织内、盆腔及盆部皮下多发结节影,转移可能;腰背部皮下水肿。仍有发热,体温波动在37.0~38.0℃。
2023-06-26为明确发热原因、肺部阴影及全身广泛结节性质收入中山医院感染病科。
病程中,精神、胃纳、睡眠稍差,二便无殊,体重无明显改变。
既往史:2016年起出现反复头晕、右下肢僵硬及乏力,2018年确诊多发性硬化,后共发作3~4次,发作时激素冲击,缓解期仍有右下肢活动不利,1年前停用硫唑嘌呤、甲泼尼龙减量至8mg qd维持,2月前因行白内障手术自行停用激素。否认高血压、糖尿病、心脏病病史。
二、入院检查( 2023-06-26)
【体格检查】
T:37.8℃,P:112次/分,R:20次/分,BP:125/88mmHg
神清,精神可,全身皮肤及巩膜无黄染,双侧腋下及腹股沟区可触及肿大淋巴结,腹壁、腰背部皮下可触及多发稍大结节,质中,活动度可,无压痛;两肺呼吸音清,未闻及干湿啰音;心律齐,各瓣膜区未闻及病理性杂音;腹平软,无压痛及反跳痛;双下肢无水肿。
【实验室检查】
血常规:WBC:4.97X10^9/L,N:90%,Hb:128g/L,PLT:271X10^9/L。
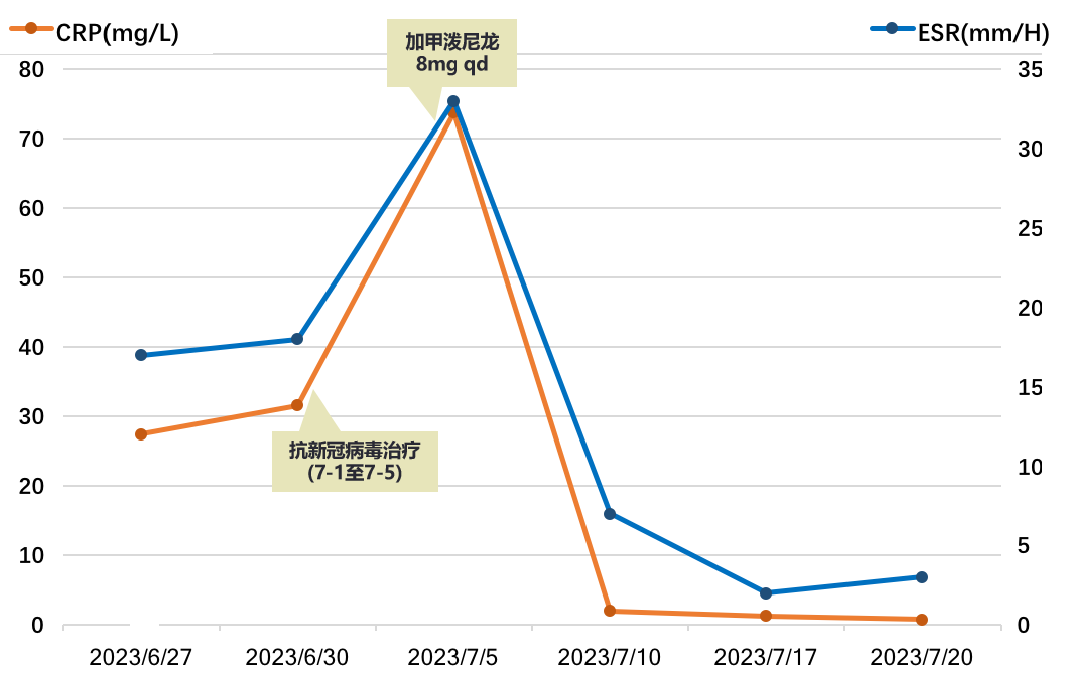
炎症标志物:CRP:27.5mg/L,ESR:17mm/H,PCT:0.09ng/mL。
尿常规:无殊;粪常规:隐血+。
动脉血气分析:PH:7.44,PCO2:39mmHg,PaO2:76mmHg。
肝肾功能:LDH:415 U/L。
出凝血功能:D-二聚体:1.86mg/L。
G试验、GM试验、血隐球菌荚膜抗原、CMV-DNA、EBV-DNA、新冠病毒核酸、甲乙流及呼吸道合胞病毒核酸均阴性。
免疫球蛋白:IgG:5.67g/L,IgA:0.9g/L,IgM:0.21g/L,IgE、IgG4正常范围。
细胞免疫:淋巴细胞总数:276cells/μL,CD4+T细胞计数:170cells/uL。
ACE阴性;甲状腺功能、自身抗体、肿瘤标志物均正常。
【辅助检查】
心电图:窦性心动过速(HR 106bpm)。
心超:静息状态下未见异常。
三、临床分析
病史特点:患者青年男性,亚急性病程,主要表现为发热、全身多处无痛性淋巴结肿大及广泛结节;外周血中性粒细胞、CRP轻度升高,WBC、ESR、PCT不高;影像学示两肺、腹盆腔、腹膜、腹盆部皮下及腰背部软组织内结节。病程早期合并新冠病毒感染,抗原转阴后仍有发热,抗感染(阿莫西林、左氧氟沙星)效果不佳。既往多发性硬化病史,长期服用免疫抑制剂及激素。鉴别诊断考虑如下:
1、恶性肿瘤:青年男性,主要表现为发热、全身广泛无痛性淋巴结肿大及结节,影像学示病变范围较广,但炎症指标仅轻度升高,呼吸道症状亦不严重,LDH升高,需考虑恶性肿瘤,尤其是以浸润性病变为特征的血液系统肿瘤可能,可进一步完善浅表淋巴结、皮下结节或肺组织活检送病理检查以明确诊断。
2、低毒力病原体感染:患者多发性硬化病史长期服用免疫抑制剂及激素,有免疫抑制基础,本次亚急性起病,全身广泛部位受累,需考虑低毒力病原体播散性感染可能,如结核、非结核分枝杆菌、诺卡菌、真菌(隐球菌、马尔尼菲篮状菌)等,门诊查T-SPOT.TB阴性,结核感染的可能性相对较小。可行支气管镜肺泡灌洗、肺穿刺活检、浅表淋巴结或皮下结节病灶活检,标本行包括抗酸/弱抗酸染色在内的涂片检查、普通细菌培养(延长培养时间)、分枝杆菌和真菌培养,mNGS及组织病理学检查等以鉴别。
3、结节病:患者一般情况尚可,炎症标志物仅中性粒细胞、CRP稍有升高,多处(胸内、双侧腋下、腹股沟区)淋巴结肿大,两肺弥漫、腹盆腔、全身多处肌间隙及皮下结节,但入院后查ACE正常范围,不完全支持结节病。可行病灶组织活检送病理及病原学检查,以明确或排除诊断。
四、进一步检查、诊治过程和治疗反应
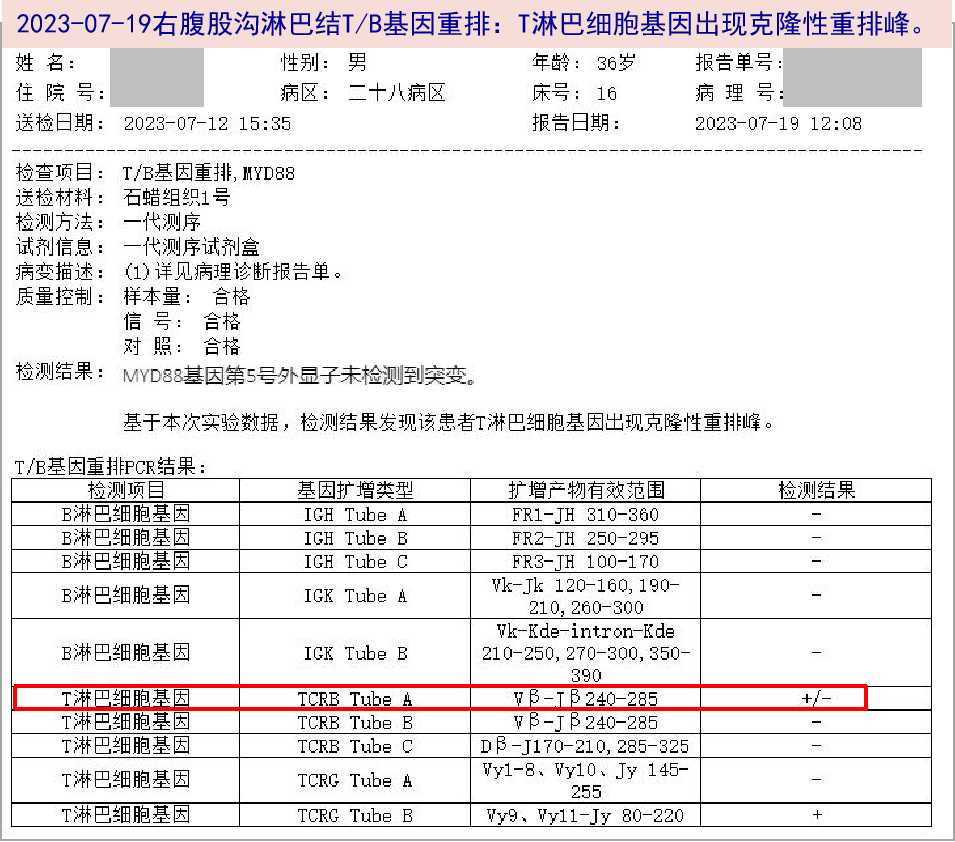
2023-06-26 停用左氧氟沙星,予对症退热、止咳。
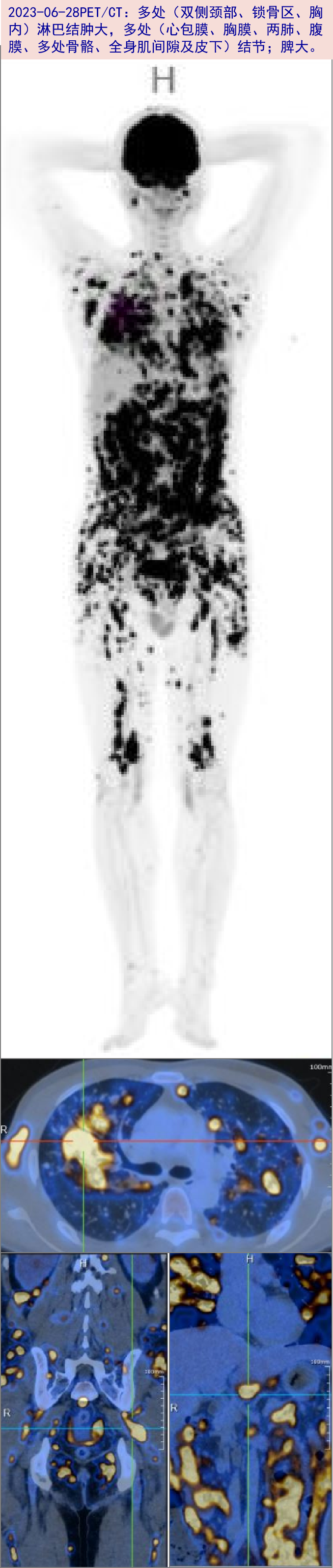
2023-06-28 PET/CT:血液系统恶性病变累及多处(双侧颈部、锁骨区、胸内)淋巴结、心包膜、胸膜、两肺、腹膜、多处骨骼、全身肌间隙及皮下;脾脏增大;盆腔积液。
2023-06-29 头颅增强MRI:脑内多发病灶,较前22-08-18额顶部部分病灶好转,左侧侧脑室颞角旁部分病灶较前稍明显。神经内科会诊:多发性硬化,病情平稳。
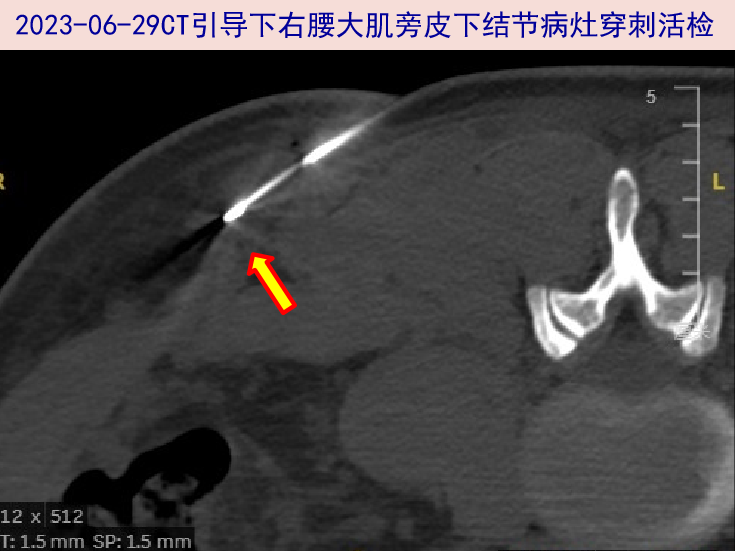
2023-06-29 建议浅表淋巴结或皮下结节病灶完整切除活检,患者及家属对全麻手术存有顾虑,故先行CT引导下右腰大肌旁皮下结节穿刺活检,组织涂片找细菌、真菌及抗酸杆菌阴性,Xpert.TB阴性。
2023-06-30 右腰大肌旁病灶初步病理:肉芽肿性病变。仍有高热,Tmax 39.6℃,行骨髓穿刺活检,并予左氧氟沙星0.5g po qd+多西环素0.1g po q12h经验性抗感染。复测新冠病毒核酸:阳性(ORF1ab基因:36.92,N基因:37.52),予氢溴酸氘瑞米德韦片抗病毒。
2023-07-01 骨髓活检初步病理:镜下骨髓造血组织与脂肪组织比约占60%,三系细胞均可见到。血mNGS(06-27采样)回报:阴性。
2023-07-02 痰mNGS回报(06-27采样):检出少量HSV1核酸序列(种严格序列数17)。
2023-07-03 右腰大肌旁病灶组织mNGS(06-29采样)、骨髓mNGS(06-30采样)回报:均阴性。骨髓细胞涂片结果:未见明显异常。
2023-07-03 复测新冠病毒核酸转阴,仍高热,Tmax 40℃,遵神经内科建议于07-04起再予甲泼尼龙8mg qd维持,并调整抗感染方案为:阿奇霉素0.25g po qd+阿米卡星0.6g ivgtt qd,当日患者体温即降至正常。
2023-07-04 骨髓流式结果回报:未见明显异常。
2023-07-05 血培养(06-30采样)回报:阴性。右腰大肌旁病灶组织细菌培养结果:阴性。主任查房仍高度怀疑血液系统肿瘤,建议行浅表淋巴结或皮下结节完整切除活检,整形外科评估宜活检病灶(腋窝、上腹壁、腰背部皮下)位置均较深,需全麻下操作,但患者及家属存有顾虑,改行CT引导下右肺病灶穿刺活检。肺组织涂片找细菌、真菌及抗酸杆菌阴性,Xpert.TB阴性。
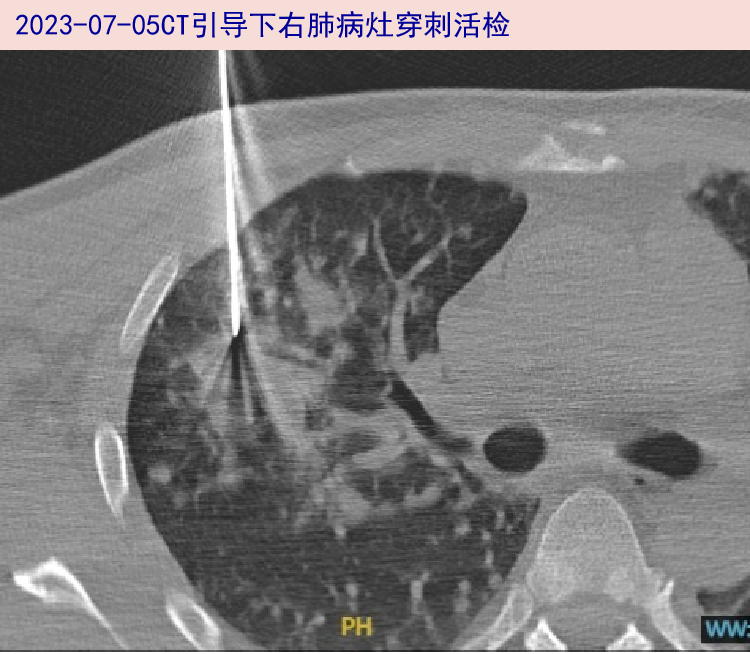
2023-07-06(1)右腰大肌旁病灶正式病理结果:肉芽肿性病变;MDM2/CEP12 FISH、T/B基因重排、MYD88基因第5号外显子突变检测均阴性。(2)骨髓免疫组化结果:未见明显异常。(3)肺组织初步病理:为淋巴组织增生性病变。
2023-07-08 肺组织mNGS(07-05采样)回报:阴性。
2023-07-12 肺组织细菌培养结果:阴性。抗IFN-γ自身抗体检测(07-05采血)回报:阴性。与病理科沟通,肺组织病理疑诊T细胞肿瘤性增生,但现有标本量确诊证据不足。再次请整形外科评估,当日行局麻下右腹股沟淋巴结切除活检,淋巴结涂片找细菌、真菌、抗酸杆菌阴性,Xpert.TB阴性。
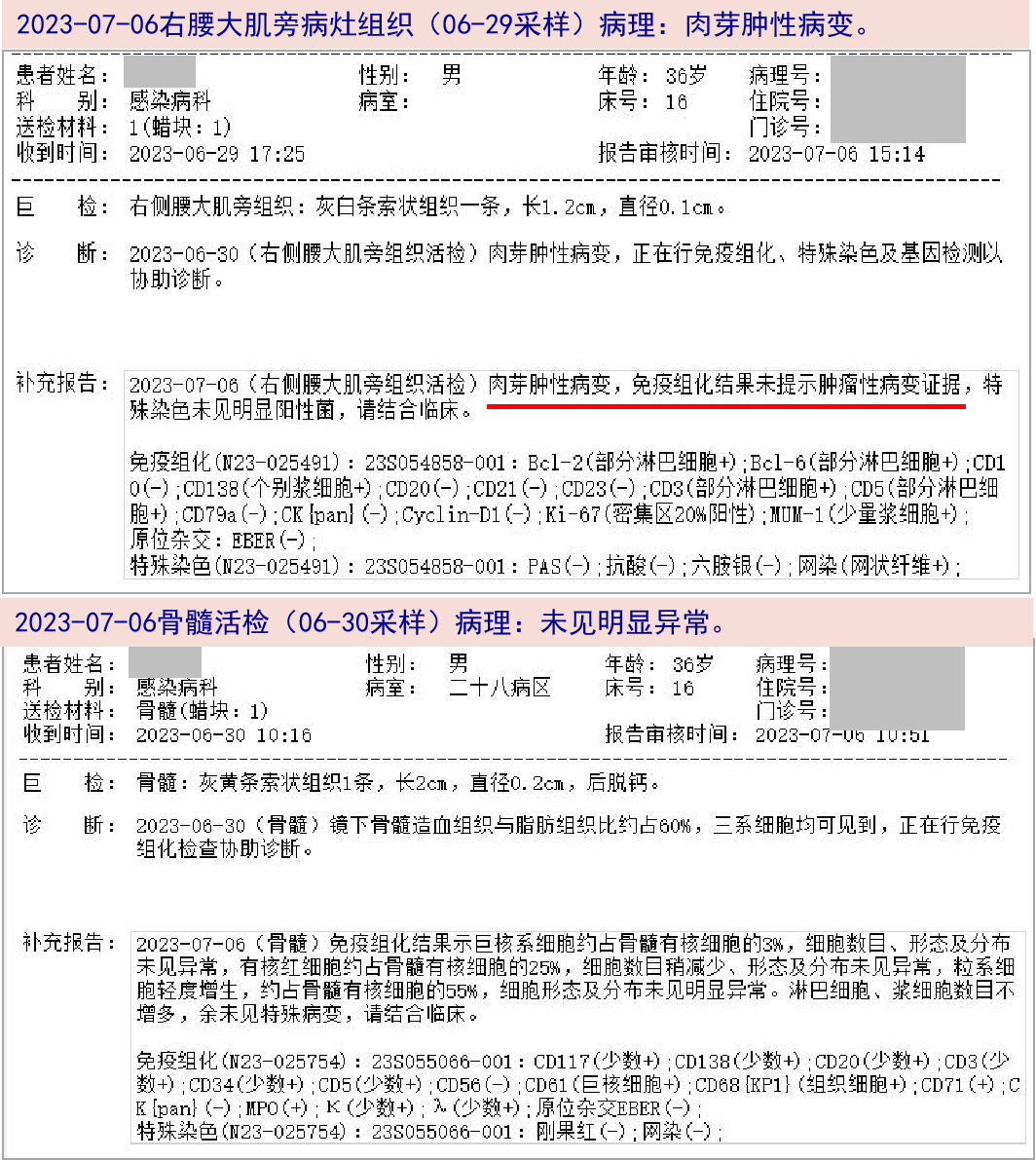
2023-07-13 (1)右腰大肌旁皮下结节组织真菌培养结果:阴性。(2)右肺组织正式病理结果回报:为CD8阴性、CD4阳性T淋巴细胞增生性病变,伴组织细胞明显增生,T淋巴细胞肿瘤性增生待排;MALT1 FISH、MYD88基因突变均阴性;B淋巴细胞基因出现可疑克隆性重排峰。(3)右腹股沟淋巴结初步病理:为淋巴组织和组织细胞增生性病变。

2023-07-16 右腹股沟淋巴结mNGS(07-12采样)回报:阴性。
2023-07-19 右腹股沟淋巴结T/B基因重排:T淋巴细胞基因出现克隆性重排峰;ALK FISH、MYD88基因突变均阴性。肺组织真菌培养、右腹股沟淋巴结细菌培养结果:均阴性。
2023-07-21 出院。
2023-07-24 右腹股沟淋巴结正式病理结果回报:为T淋巴细胞肿瘤性增生,考虑淋巴上皮样淋巴瘤(Lennert淋巴瘤)。联系患者,至血液科进一步就诊。

体温单及用药
炎症标志物
五、最后诊断与诊断依据
最后诊断
淋巴上皮样细胞淋巴瘤(Lennert淋巴瘤)
多发性硬化
白内障(术后)
新冠感染后
诊断依据:
青年男性,亚急性病程,主要表现为发热、全身广泛分布的无痛性淋巴结肿大或结节;外周血中性粒细胞、CRP轻度升高,WBC、ESR、PCT不高;影像学示多处(双侧颈部、锁骨区、胸内、腹股沟)淋巴结肿大,两肺弥漫、腹盆腔、腹膜、多处骨骼、肌间隙及皮下结节。血培养及血mNGS阴性,腰大肌旁病灶、肺组织、右腹股沟淋巴结组织细菌真菌培养及mNGS检测均阴性。腰大肌旁病灶细针穿刺病理为肉芽肿性病变;肺组织病理示CD4阳性T淋巴细胞增生性病变伴组织细胞明显增生;右腹股沟淋巴结切除活检病理示T淋巴细胞基因出现克隆性重排峰,为T淋巴细胞肿瘤性增生,考虑淋巴上皮样细胞淋巴瘤(Lennert淋巴瘤)。故诊断成立。
六、经验与体会
淋巴上皮样细胞淋巴瘤(Lymphoepitheloid lymphoma,LEL)或Lennert淋巴瘤,是非特指型外周T细胞淋巴瘤(PTCL-NOS)的一种罕见亚型,仅占非霍奇金淋巴瘤的1.4%,男性多见,平均发病年龄约49岁,主要侵犯淋巴结,表现为颈部淋巴结及肝、脾肿大,骨髓受累率为20%,少数可累及皮肤,约1/3~1/2患者有发热、乏力和体重减轻,半数患者LDH升高。PTCL-NOS的临床病程常呈侵袭性、易复发,预后通常较B细胞非霍奇金淋巴瘤差,但Lennert淋巴瘤的生物学行为较PTCL-NOS的其他类型稍好。
本例患者为青年男性,既往多发性硬化病史长期服用免疫抑制剂及激素,存在免疫抑制基础。病程早期表现为高热,新冠病毒转阴后仍持续发热,及时行影像学检查有助于甄别病情。此外,患者虽体温较高、胸部CT表现为两肺弥漫浸润性病灶,但炎症指标仅轻度升高、呼吸道症状亦不严重,同时伴有腹盆部及皮下多发无痛性结节,需警惕恶性肿瘤尤其是血液系统肿瘤,或低毒力病原体感染可能。这类患者尽早行PET/CT检查意义较大。
Lennert淋巴瘤诊断的难点在于病理,典型的病理特征是小到中等大小的淋巴瘤细胞混杂大量成簇的上皮样组织细胞,淋巴细胞绝大多数为CD4+,极少见CD8+和B细胞。是一种排除性诊断,需采集充分的活检样本,细针穿刺结果难以解读,因无法评估淋巴结的结构消失,且典型的细胞混合浸润可能类似于反应性病理过程,易漏诊。本例患者最初是建议行淋巴结完整切除活检,但因患者及家属存有顾虑,故先行CT引导下细针穿刺活检,病理提示肉芽肿而非肿瘤性病变,予经验性抗感染覆盖低毒力病原体,但微生物培养、多样本mNGS(血、痰、骨髓、腰大肌旁病灶组织)均阴性,结合PET/CT表现,仍高度怀疑血液系统肿瘤。经主任查房、血液科专家会诊,再行肺穿刺活检,病理高度疑诊T淋巴细胞肿瘤,与患者及家属充分沟通,最终行腹股沟淋巴结完整切除活检得以病理确诊,肺组织及腹股沟淋巴结的病原学检查也为阴性,除外了合并感染可能。本案例也提示临床医生,组织病理为肉芽肿性病变并不能完全除外恶性肿瘤,需结合临床仔细解读、充分沟通,必要时重复活检,并尽可能行淋巴结完整切除、或取材较多的其他组织切取活检。
参考文献
[1] Kouijzer IJE, Mulders-Manders CM, Bleeker-Rovers CP, Oyen WJG. Fever of Unknown Origin: the Value of FDG-PET/CT. Semin Nucl Med. 2018;48(2):100-107.
[2] Campo E, Jaffe ES, Cook JR, et al. The International Consensus Classification of Mature Lymphoid Neoplasms: a report from the Clinical Advisory Committee. Blood 2022; 140:1229.
[3] Yin Y, Liu H, Luo M, Yu G, Yin W, Li P. Primary extranodal soft tissue Lennert lymphoma (lymphoepithelioid variant of peripheral T-cell lymphoma, unspecified): a case report and review of the literature. Diagn Pathol. 2023;18(1):12.
[4] Cho U, Park G, Kim JA, Im S. Lymphoepithelioid variant of peripheral T cell lymphoma (Lennert lymphoma): Cytologic and histologic features. Diagn Cytopathol. 2021;49(2):322-324.
作者:李娜 马玉燕 金文婷;审阅:胡必杰 潘珏
本文转载自订阅号「SIFIC感染视界」(ID:sific2007)
本文完
责编:Jerry


