
今天我们从COVID-19相关间质性肺病、病毒性肺炎、ARDS与间质性肺病、COVID-19恢复期的肺部情况四个方面来谈谈「COVID-19与间质性肺病」。
一、与COVID-19相关的间质性肺病
非重症和危重症COVID-19的本质特征是病毒性肺炎,危重症COVID-19最常合并的肺部并发症是ARDS。基于ARDS目前的临床定义,它可能的病理基础是多样化的,包括弥漫性肺泡损伤(diffusing alveolar damage, DAD)、急性纤维素性机化性肺炎(acute fibrosing organizing pneumonia, AFOP)、机化性肺炎( organizing pneumonia , OP)等,不同于以前所认为的病理基础为DAD。重症及危重症COVID-19恢复期主要与肺部病变的修复反应相关。
在治疗方面,现在基本形成了相对统一的共识,例如:COVID-19发展到一定程度后可以使用激素或联合使用IL-6抑制剂/JAK拮抗剂,主要目的是抑制细胞因子风暴;如果发展为ARDS,更多时候使用以呼吸支持为主的综合性治疗,以及激素或联合免疫调节治疗;到恢复期时,有些患者肺纤维化非常严重,甚至可能需要肺移植,但大部分患者恢复较好,会进入自然缓解过程。下文将就这几方面的问题进行阐述。
二、病毒性肺炎
大家对COVID-19的肺部影像学表现应该非常熟悉,下图是COVID-19患者从程度较轻的肺炎,到大面积肺炎,再到出现ARDS的情况,但其实质仍然是「病毒性肺炎」。
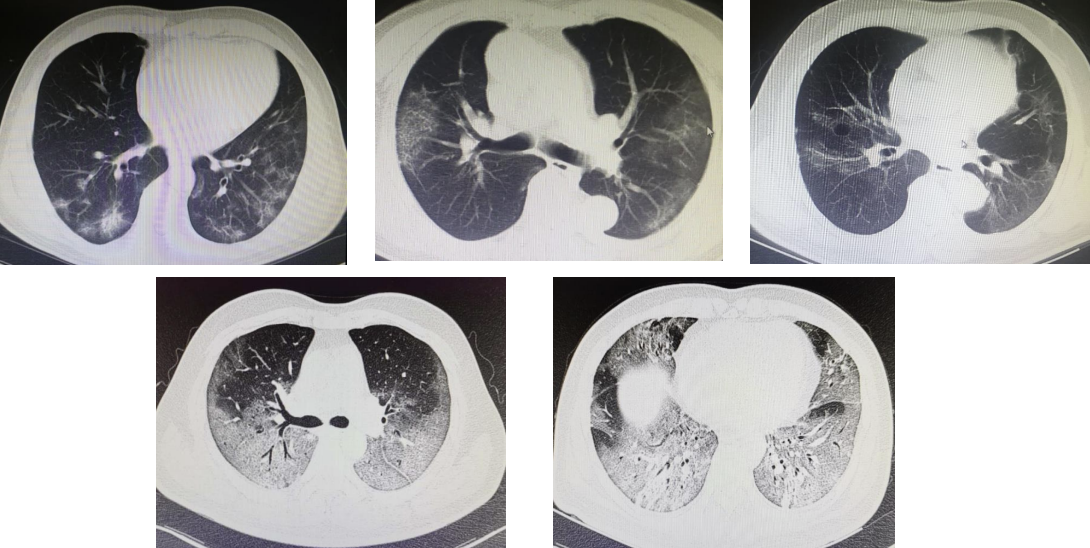
这是一位因为其他原因在发病后5天去世的COVID-19患者的肺组织病理,表现为间质淋巴细胞浸润和间质水肿,呈现出典型的病毒性肺炎特征。

在COVID-19大流行初期,WHO、美国CDC等均不推荐使用糖皮质激素。我国学者基于2003年SARS时期的临床救治经验,在早期,即2020年1月16日我国第一版指南问世时,就建议根据患者呼吸困难程度、胸部影像学进展情况,酌情短期内(3~5天)使用糖皮质激素。建议剂量为泼尼松≤1~2mg/kg·d。
使用较小剂量糖皮质激素的主要考虑是,SARS疫情期间我们的经验和后期总结发现激素治疗是有效的,但大剂量激素会造成很多严重的并发症或后遗症,包括二重感染、股骨头坏死等,显著影响到SARS患者的预后,因此这次主要建议使用相对剂量较低的激素,如上所述,不建议使用更大剂量激素甚或冲击治疗,因为风险很大。
2020年疫情之初,赵建平主任等在《中华结核和呼吸杂志》上发表新型冠状病毒肺炎糖皮质激素使用的建议,几乎与现阶段对激素治疗的认识相同。

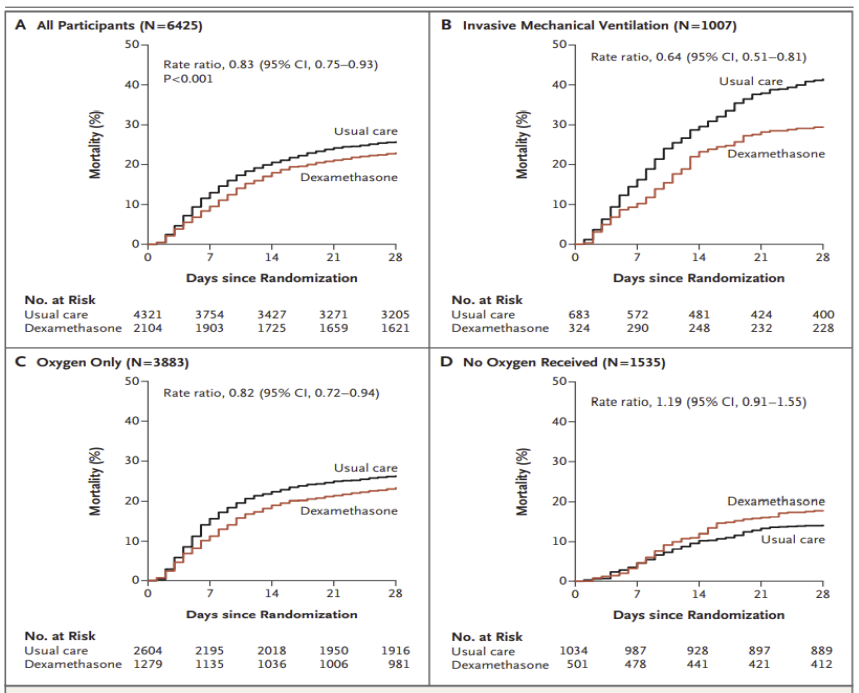
目前对激素应用价值的最终确认主要来自于大家所熟悉的英国RECOVERY研究。仔细分析这项研究中的亚组结果,地塞米松(10mg qd)虽然可以改善28天的病死率,但即使是获益最多的「机械通气组」,其与对照组相比的获益率也相对有限:29.3% vs 41.4%;「氧疗组」的获益率更低,几乎接近对照组:23.3% vs 26.2%;而对于「未接受氧疗和呼吸支持组」,从趋势看,使用激素甚至具有潜在的副作用,其数值低于对照组。
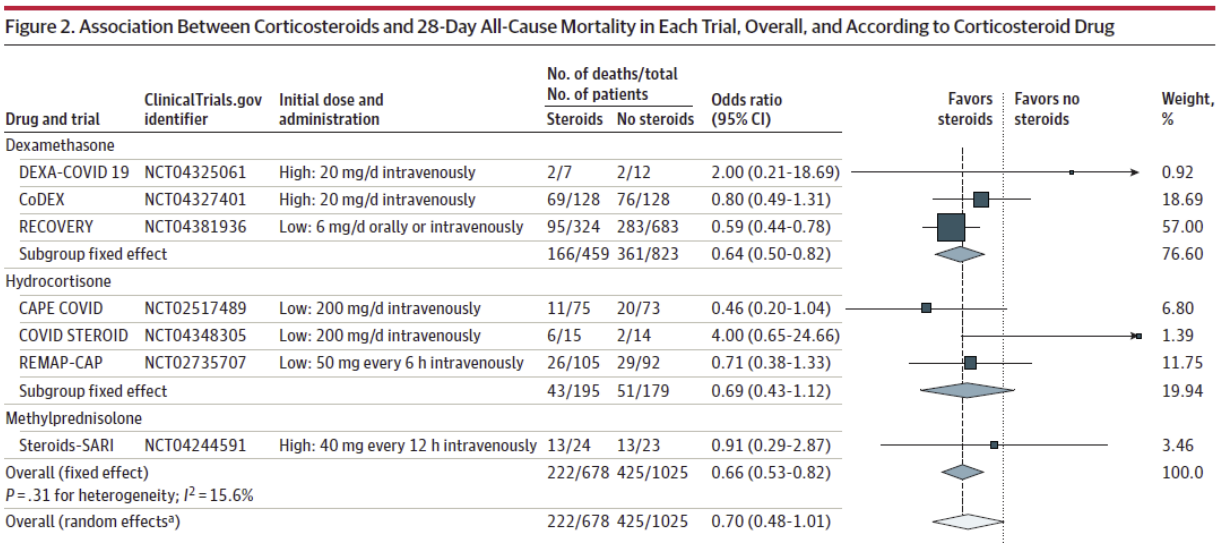
因此,需要对激素治疗的获益有充分的认识,合理选择激素的关键在于时机和病情的严重程度,这对患者非常重要、往往需要通过临床经验来把握,从一定程度上讲,属于「灰色地带」,即真正获益的情况并非是广泛而确定的。后期也有更多研究支持激素的使用,7项研究纳入1703例COVID-19危重症患者,发现与标准治疗或安慰剂相比,糖皮质激素降低了28日死亡率(32% vs 40%;OR 0.66,95%CI 0.53-0.82),且未增加严重不良事件的风险。这些结果总体而言和RECOVERY的研究相仿。
除激素以外,还有没有别的治疗方法?因为单用激素对危重症患者而言降低病死率的效果比较有限。我国学者在2020年疫情初期的研究发现,在重症新冠患者中,血白介素-6、C反应蛋白等都是升高的。

国外学者也提出,部分COVID-19可能存在细胞因子风暴,是重症可能的发病机制。目前,对细胞因子风暴的研究在临床已经积累了比较多的经验,细胞因子释放综合征(CRS)、噬血综合征(sHLH)都与细胞因子风暴相关,且经过探索和实践,已经获得了较好的治疗效果。如和CAR-T治疗相关的细胞因子释放综合症现在的治疗效果就非常不错。因此,学者们建议,在紧急情况下,应该参考已有的治疗细胞因子风暴措施,来救治重症患者。参与重症COVID-19的细胞因子谱与sHLH有相似之处,表现为IL-2、IL-7、G-CSF、IFN-γ、MCP-1α、TNF-α明显升高,而且伴随显著升高的铁蛋白(1297.6 ng/ml vs 614.0 ng/ml)与IL-6升高(p<0.001)是COVID-19患者死亡的预测因素。
在重症患者的救治中,针对细胞因子风暴,也有相应的临床研究,例如重组白细胞介素1受体拮抗剂治疗对具有巨噬细胞活化综合征特征的脓毒症患者28天生存率的影响研究,结果显示该疗法具有一定的治疗价值。

曾有研究聚焦IL-6受体拮抗剂(托珠单抗)在新冠重症肺炎住院患者中的应用,一项随机、安慰剂、对照试验从2020年4月3日至2020年5月28日共479例患者进行了评估,有452例患者接受了随机分组,438例被纳入了改良意向治疗人群(托珠单抗组294例,安慰剂组144例);安全人群分别包括托珠单抗组295例和安慰剂组143例患者;托珠单抗组224例(76.2%)和安慰剂组108例(75.0%)完成了28天的随访评估。
结果显示,28天病死数据为托珠单抗组58例( 19.7% ),安慰剂组28例(19.4%),两者之间没有明显差别;未使用呼吸机天数方面,托珠单抗组中位天数22天(9 5% C I , 18.0-28.0),安慰剂组16.5 天(95% CI,11.0-26.0),前者效果更好。

对于重症COVID-19,除激素治疗以外,很多时候是围绕介素6是整个细胞因子风暴的核心环节去思考的,而且很多重要研究发表在柳叶刀、新英格兰医学杂志等国际知名杂志上。从总体评价看,临床研究的结果倾向于白介素6受体拮抗剂有效,但它相对获益率有限。
一项JAK抑制剂巴瑞替尼治疗COVID-19所致重症肺炎住院患者中的临床研究显示,巴瑞替尼组的60天全因死亡率为10% (n=79)VS安慰剂组15% (n=116),获益率也非常接近。
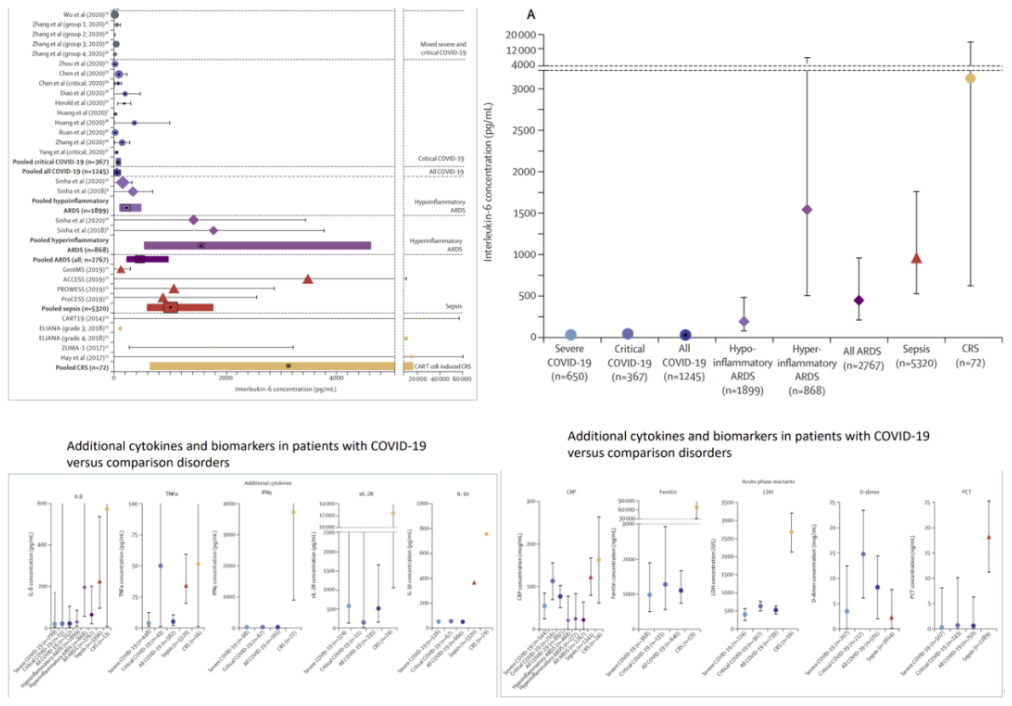
回过头看看被认为是细胞因子风暴关键因子的IL-6水平,现有的研究发现,重症COVID-19患者的IL-6水平与非重症患者相比具有显著性差异,但其升高程度比较有限,与其他细胞因子风暴所致的IL-6升高程度相比,差距很大(见下图)。而C反应蛋白、TNFα、铁蛋白等指标则与其他情况接近(见下图)。因此,在重症患者的发病机制中,虽然IL-6可能发挥了一定的作用,但可能并非唯一通路,还可能存在其他机制,有待进一步的研究。
基于上述研究结果,目前所推荐的COVID-19免疫治疗方案,我国的指南与国际指南的推荐已经非常接近了:
WHO:
• 重型或危重型COVID-19患者。
• 强烈建议:全身使用糖皮质激素,联用IL-6受体拮抗剂或JAK抑制剂巴瑞替尼
• 对接受氧疗或呼吸支持者使用DF,剂量:6mg/d,持续10日。
NIH\IDSA:基本同WHO
我国指南(第十版)
• 适应证:氧合指标进行性恶化、影像学进展迅速\机体炎症反应过度激活状态的重型及危重型患者。
• 剂量:DF 5mg/d或MP 40mg/d,<10d。
• 注意:避免长时间、大剂量使用,以减少副作用。
• IL-6抑制剂:用于重型及危重型,IL-6明显升高者,最多两剂。
IL-6抑制剂及JAK抑制剂对重症COVID-19治疗应用受细胞因子风暴的处理经验的启示,但细胞因子风暴病因众多,如CRS(细胞因子释放综合征) 、MAS(巨噬细胞活化综合征)、或感染所致者细胞因子风暴等,这些不同类型细胞因子风暴在发生机制、治疗药物选择和疗效方面也存在很大的差异。
在对重症COVID-19患者使用免疫调节治疗时,实际临床效果可能不如预期,由于免疫抑制作用,患者可能出现感染等其他并发症。虽然有很多循证医学证据支持使用药物可以让重症COVID-19这个「群体」获益,但具体到「个体」患者,因为总体效应的有限性,个体的疗效并不很确定。
免疫调节治疗对COVID-19的疗效受多种因素影响,例如高龄、糖皮质激素的使用、机械通气等,使用治疗的开始阶段或许能够带来临床改善,但到后期如果合并感染等并发症,处理将是很复杂的过程,可能会造成疗程的延长。因此,对于重症患者免疫调节治疗的选用需要慎重而全面的考虑。
三、COVID-19所致ARDS的病理基础
这是我们在武汉时遇到的一个病例,患者不到60岁,没有救治过来。CT演进到这个阶段时,临床诊断完全符合重度ARDS,氧合指数很低。可是这张CT表现与通常所看到的ARDS影像学特征相比有所不同,它太「均匀」了,重力依赖性分布的特征很不显著。

我们在疫情最开始的时候也注意到一个情况,有些患者的情况和「经典ARDS」不同:肺顺应性好、肺容积大,肺复张治疗并没有太好的效果,因为本身潮气量就很大。高PEEP对氧合的改善有限。因此,推测COVID-19所致的ARDS在发病机制方面可能存在差异。

后来,意大利重症医学领域的一些学者对这些现象进行了总结和分析。他们把COVID-19所致的ARDS分为L型(低顺应性)和H型(高顺应性),不同分型所采用的治疗策略并不一样,L型对PEEP、肺复张策略效果更好。
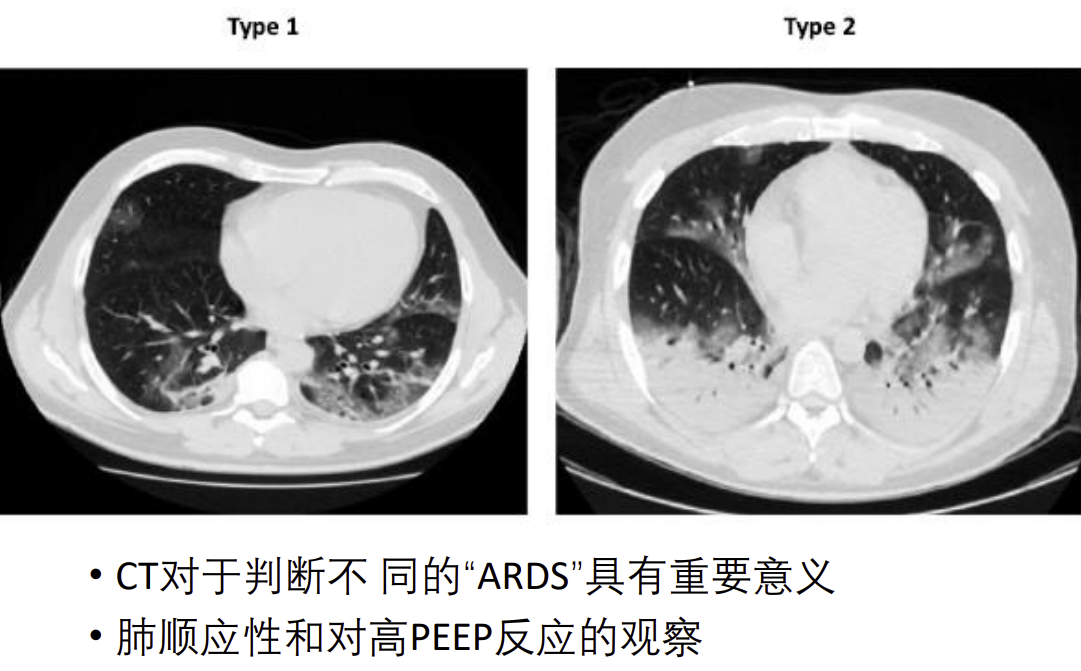
目前,俯卧位通气是改善低氧血症的重要手段,部分患者可以从肺复张手法获益。
下面是新冠病死患者的肺部病理表现,该患者曾因严重的低氧血症接受无创通气治疗,拒绝气管插管。从病理上看是典型的DAD+细胞性纤维素性渗出,右肺存在肺细胞脱落和透明膜形成,符合经典的ARDS;左肺肺水肿与透明膜形成,提示早期ARDS。间质单个核细胞浸润,以淋巴细胞为主。多核巨细胞和不典型的体积增大的肺泡上皮细胞位于肺泡腔内——符合病毒感染表现,胞核和胞浆内没有见到明显的病毒包涵体。
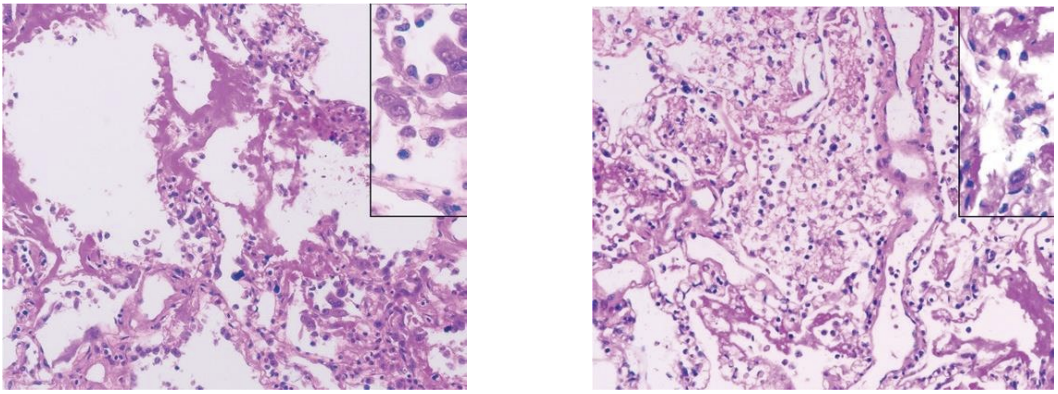
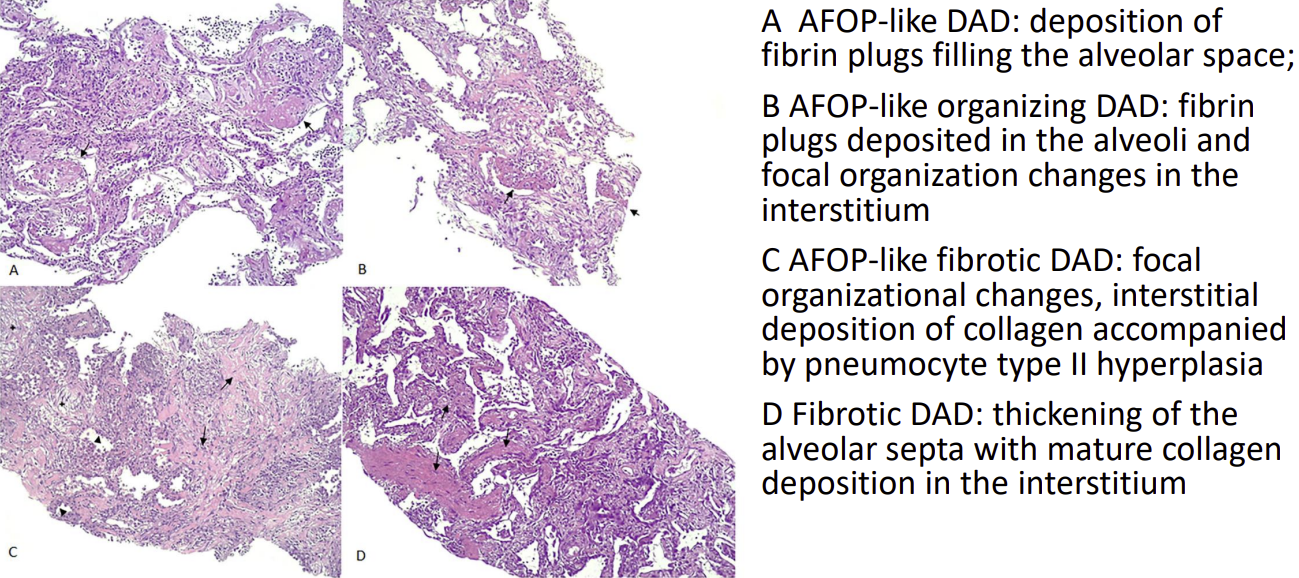
其他文献报道显示,在已经建立ARDS诊断的因各种原因死亡的COVID-19患者的尸检发现,临床表现为ARDS的患者,其病理可能没有DAD,而是表现为AFOP。一些影像-病理对照研究结果显示COVID-19所致ARDS的病理构成具有异质性。

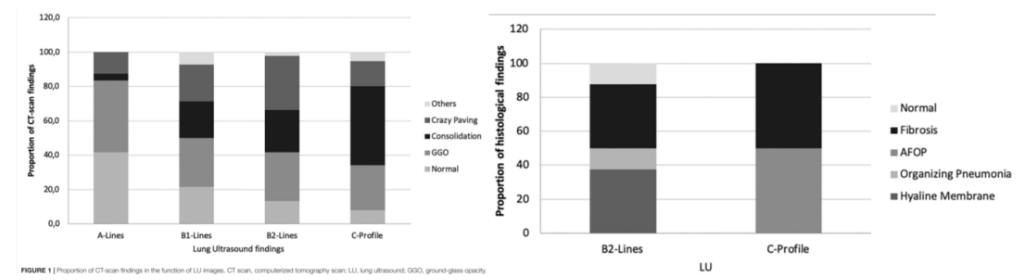
国外有研究者在COVID-19患者去世后通过B超来判断肺部情况,并与CT影像做了对比研究,结果发现不同的组织病理学表现与肺部B超的特征具有一定的对应关系。
我国的学者通过对COVID-19的胸部影像学及可能的病理基础进行比较和思考。例如,推测一些表现散在的、靠近胸膜分布的斑片状影,病理方便可能更接近于机化性肺炎。一位患者经过治疗,恢复迅速,到第19天时肺部病变已经明显吸收。另外一例表现更为复杂严重、但符合典型机化性肺炎表现的病灶也有吸收,且同样在治疗时间不长的情况下。
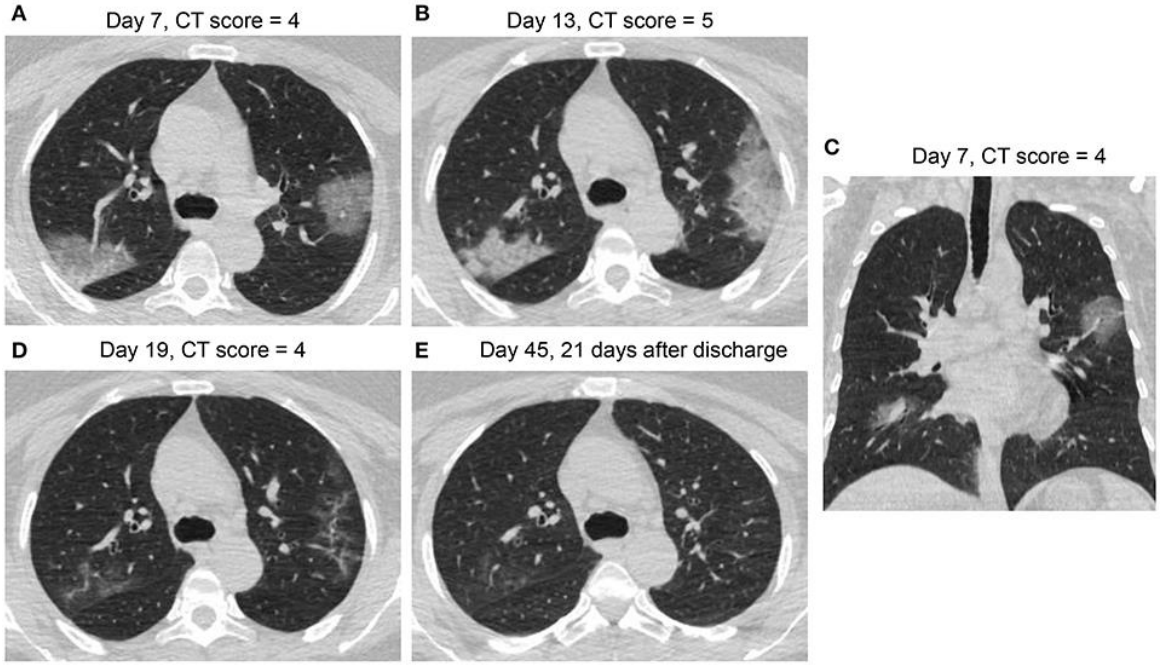
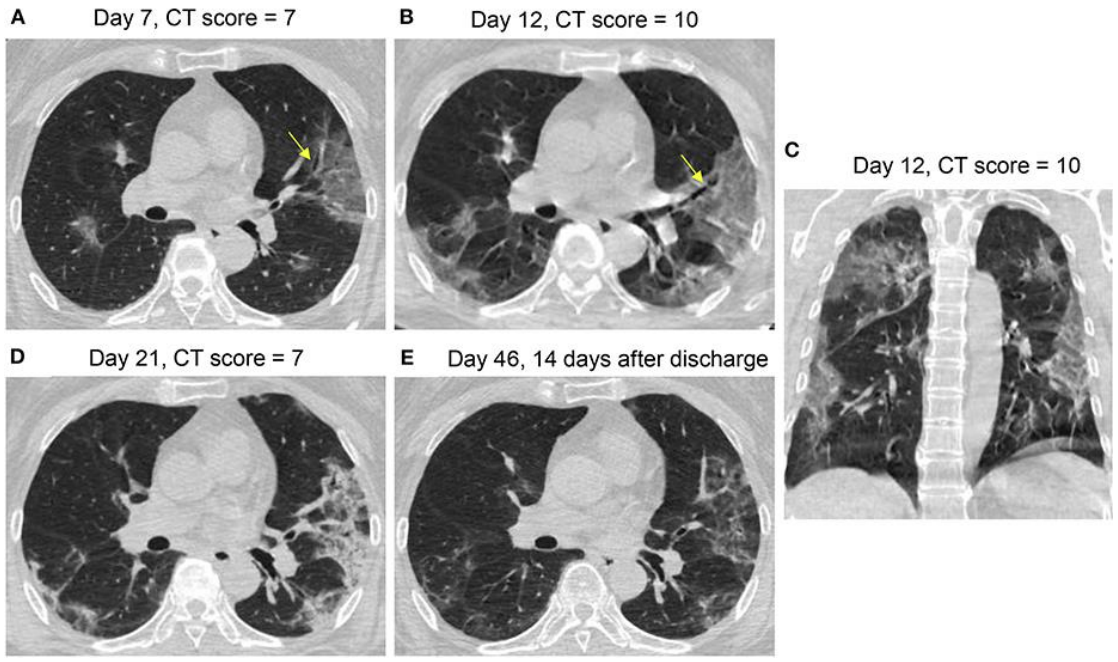

对一些弥漫分布的大面积病变,通过CT特征初步判断患者更符合机化性肺炎还是更符合DAD,通过对其预后的观察,发现两种情况的预后差别很大,提示患者的预后与可能的病理表现关系密切,并可以影像学表现上出一定的特征。

在具体临床实践中,有医生发现,给予患者大剂量激素后,部分患者很快恢复,但指南并不主张使用大剂量激素。造成这种个体诊疗效果与大样本人群临床研究推荐结果差异的原因,可能就是病理存在的异质性。因此,如何早期识别或快速识别激素治疗明显获益的患者需要进一步的研究。如果患者以AFOP或OP为主要病理特征,是否需要更大剂量的激素进行治疗?激素的疗程是否需要延长?对于这部分重症患者,如果按照指南只使用小剂量激素,患者的获益性会不会不充分?其他免疫调节治疗能否获益?等等,这些问题都有待于临床的进一步研究?同时,如果使用,必须考虑激素副作用的预防和监测。
四、COVID-19恢复期的肺部情况
疫情初期,部分患者脱离医疗后,肺部CT表现的恢复并不十分充分,甚至表现为明显的肺纤维化特征,但其活动耐力已有明显改善。因此,COVID-19所致「肺纤维化」和IPF的特征完全不同,更符合ARDS修复后的肺结构重塑过程。在SARS时期,同样的情况也存在。
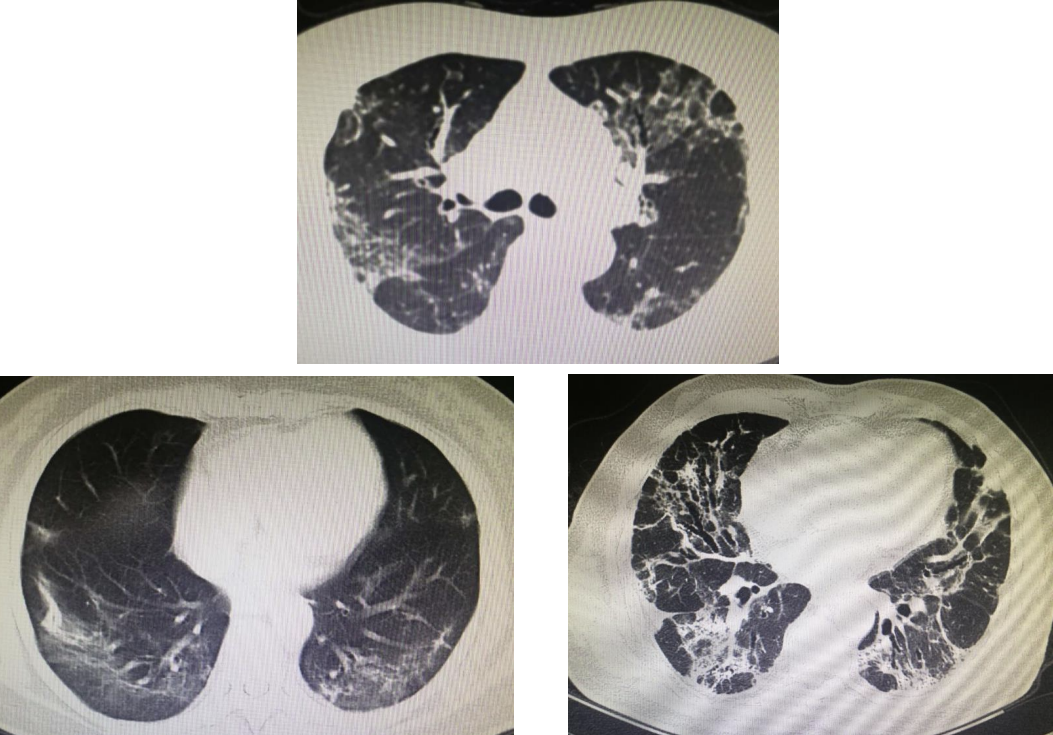
从重症及危重症COVID-19恢复过来的患者具有一般性特征:随着时间推移,劳力性呼吸困难的症状逐渐好转,如果纤维化没有发展为严重到必须要肺移植程度的话,非重症及危重症患者相当一部分肺部阴影完全或大部分吸收,肺功能可恢复正常,这个过程更符合急性肺损伤后肺脏修复过程,病理特征表现为成纤维细胞大量浸润和机化过程,然后为纤维化和重塑过程,最后会遗留一定的肺功能损害,但大部分程度轻微,且肺部影像学异常和功能障碍主要见于重症及危重症感染后的存活者,中度及以下基本完全吸收。
目前需要关注的一个问题是「长新冠」,发生率近1/5,其中部分患者长期无法工作,呼吸系统症状是最常见的原因之一,相关机制也比较复杂,常见原因包括持续免疫功能紊乱、病毒持续存在、内皮病变、胃肠道菌群失调、自身免疫及植物神经功能紊乱等;最常见的呼吸困难原因包括肺纤维化及肺间质病、肺血管异常等。
有一项比较早的英国在COVID-19流行初期进行的单中心研究,325例患者中138例患者肺部的形态功能均恢复正常、110例功能受损但形态正常,77例存在ILD(经多学科团队(MDT)判定),研究从出院后平均61天开始治疗,激素起始剂量最大0.5mg/kg。
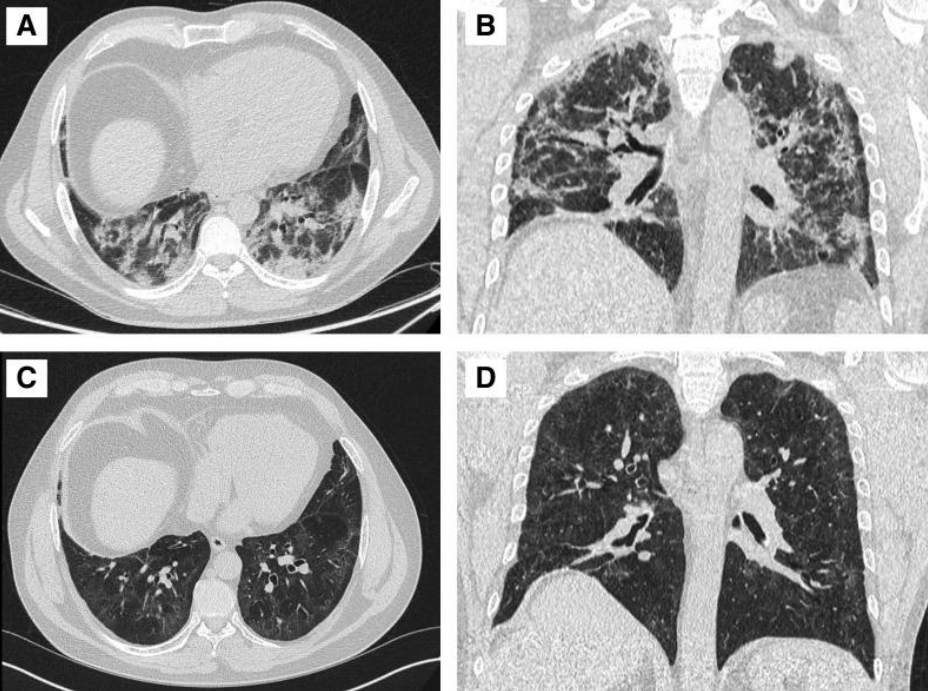
经过治疗,这些患者的肺功能情况、影像学改变都有好转,一个典型案例为57岁男性,COVID-19恢复期患者,影像学示OP样改变(A、B),肺活量、活动耐力很差,只能步行30米左右,从肺部CT看,表现为沿支气管血管束分布,胸膜下也有斑片状影,很符合机化的特征,口服激素3周后,肺部阴影明显吸收(C、D),再次复查时,患者每天可跑步30分钟,恢复很迅速。
思考
前文介绍了COVID-19与不同间质性肺病特征的关系,COVID-19所致临床情况构成复杂,包括病毒性肺炎、经典ARDS以及可能合并不同类型的免疫损害相关的间质性肺病。因为COVID-19具有传染性,活检困难,缺少准确的病理诊断,很难准确诊断,结合临床、生物标记物、影像学等的判断也尚待进一步明确。
在这种情况下,即使有推荐指南,还是应该结合临床医生对患者的判断,因为COVID-19的异质性、病理特征的复杂性,个性化治疗是不可避免的,因此,继续研究激素及免疫调节治疗选择的影响因素,如时机、临床表象后的确切机制、不同剂量和疗程激素的治疗方案确定。目前仍然有很多问题没有解决,期待在未来会有所突破。
参考文献
[1] 赵建平等.新型冠状病毒肺炎糖皮质激素使用的建议.中华结核和呼吸杂志.(2020.2.10)
[2] Mehta P, McAuley DF, Brown M, et al; HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020 Mar 28;395(10229):1033-1034.
[3] Shakoory B, Carcillo JA, Chatham WW, et al. Interleukin-1 Receptor Blockade Is Associated With Reduced Mortality in Sepsis Patients With Features of Macrophage Activation Syndrome: Reanalysis of a Prior Phase III Trial. Crit Care Med. 2016 Feb;44(2):275-81
[4] Lancet. 2021 May 1;397(10285):1637-1645.
[5] N Engl J Med. 2021 Apr 22;384(16):1503-1516.
[6] Leisman DE, Ronner L, Pinotti R et al. Cytokine elevation in severe and critical COVID19: a rapid systematic review, meta-analysis, and comparison with other inflammatory syndromes. Lancet Respir Med. 2020 Dec;8(12):1233-1244
[7] Gattinoni et al. Critical Care(2020) 24:154 https//do.org/10.1186/s13054-020-02880-z
[8] Copin MC, Parmentier E, Duburcq T, et al. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020 Jun;46(6):1124-1126
[9] Trias-SabriàP, Dorca Duch E, Molina-Molina M et al. Radio-Histological Correlation of Lung Features in Severe COVID-19 Through CT-Scan and Lung Ultrasound Evaluation. Front Med (Lausanne). 2022 Apr
[10] Jin C, Tian C, Wang Y, et al. A pattern categorization of CT findings to predict outcome of COVID-19 pneumonia. Front Public Health. 2020;8: 567672
[11] Myall KJ, Mukherjee B, Castanheira AM, et al. Persistent Post-COVID-19 Interstitial Lung Disease. An Observational Study of Corticosteroid Treatment. Ann Am Thorac Soc. 2021 May;18(5):799-806.
专家介绍

李海潮
医学博士,主任医师,教授,博导。北京大学第一医院大内科主任。教育部临床医学类教指委秘书长,教育部临床医学专业认证委员会委员。中华医学会内科学分会常委,呼吸病分会委员。《中华结核和呼吸杂志》、《中华医学教育杂志》编委。长期致力于呼吸系统疾病的临床诊疗。主要研究方向为间质性肺病。
本文由《呼吸界》编辑 Jerry 整理,感谢李海潮教授的审阅修改!
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


