
今天与大家一起分享的主题是「适合中国人群的肺癌筛查新标准与肺结节诊断新模型」,这个话题其实很值得大家共同思考和互动,关于肺癌筛查与肺结节诊断,到底应该往何处去?目前是否已初见雏形?我将从肺癌筛查发展史概述、肺癌高危人群的界定及意义、肺结节诊断新模型这三个方面与大家一起探讨。
回顾肺癌筛查的发展历史,低剂量螺旋CT(LDCT)以其「可降低肺癌20%的死亡率」成为最优筛查方式

沿着时间轴回顾肺癌筛查的发展历史:
自1930年发展出一种肺癌早期筛查方法——痰细胞学检查。1960年,Mayo和捷克的两项研究相继证实,X线胸片单独检查或联合痰细胞学检查可发现早期肺癌,但并不能显著降低肺癌死亡率。到1978年,大家又非常愿意用肿瘤标志物来探索作为肺癌筛查的一种方式。肿瘤标志物这种筛查方式是指在血液、体液及组织中可检测到的与肿瘤相关的物质,达到一定水平时,可反映某些肿瘤的存在。
1996年,美国FDA批准一项新技术,叫「液基薄层痰细胞学」技术,他们寄希望基于这项技术,有可能会提高肺癌早期诊断的阳性率。
肺癌筛查里程碑式的事件是2011年美国NLST研究,随着多项设计良好、大队列的研究和循证证据的证实,低剂量螺旋CT(LDCT)检查与胸部X线筛查的方式相比,可以说它优于所有以前的检查方式,可降低人群20%的肺癌死亡率。LDCT也成为我们的最优肺癌筛查方式。
当然,随后的探索仍然在不断进行,到2012年,英国NHS开展了基于肺癌七种自身抗体血清标记物的大规模肺癌筛查,同年中国也开展了城市癌症早诊早治项目,对肺癌高危人群进行LDCT筛查。到2018、2019年连续两年,欧洲呼吸学会仍然也在介绍生物标志物是否能承担肺癌筛查的任务和职责。
有了入组人群队列的不断积攒,2019年,NELSON研究在进行了10年随访后证明:LDCT肺癌筛查降低肺癌相关的死亡率,根据非钙化结节体积倍增时间(VDT)进行分层:VDT≥600天的恶性概率为0.8%,VDT-400-600天的概率为4.0%,VDT≤400天的概率为9.9%。这使我们不仅知道了用VDT来进行分层,并且这种分层也获得了基于数据的时间的动态变化,使其更加接近临床实践。

值得重点回顾的「痰细胞学和胸片技术筛查肺癌」,刚才讲到痰细胞学自上世纪30年代大家就在探索,到60年代,大家将痰细胞学和胸片技术这两种方式联合起来,看是否能够提高效率。
比如1971-1979年美国Johns Hopkins Lung Project(JHLP)、Memorial Stoan-Kettering National Lung Program(MSKP)、Mayo Lung Project(MLP)等研究中心通过RCT研究(实验组:年度X线筛查+4月/次的诱导痰细胞学检测,对照组:年度X线筛查)对高危人群(45岁以上的男性吸烟者)进行肺癌筛查。最终研究结果显示,因为胸片遗漏了大部分直径小于2cm的结节,所有相较于X线组,X线+痰细胞组能检测出更多更早期的肺癌,但最终结果显示其并未降低肺癌死亡率。
事实上还包括很多上世纪六七十年代做过RCT研究的学者们,大部分都没能得到一个很好的阳性结果。并非它不能检测,它是能够检测的,与JHLP、MSKP、MLP等研究中心同样,比如说他们用X线+痰细胞组,它能够检测更多、更早期的肺癌,但是随着检测的数据量的增多,证明并没有降低整个观察人群的死亡率,只能说明联用比单用胸片好,同样也是因为胸片常常会遗漏2cm以下的结节。
LDCT能被现今作为肺癌筛查的最佳推荐,同样经过了漫长的研究历程
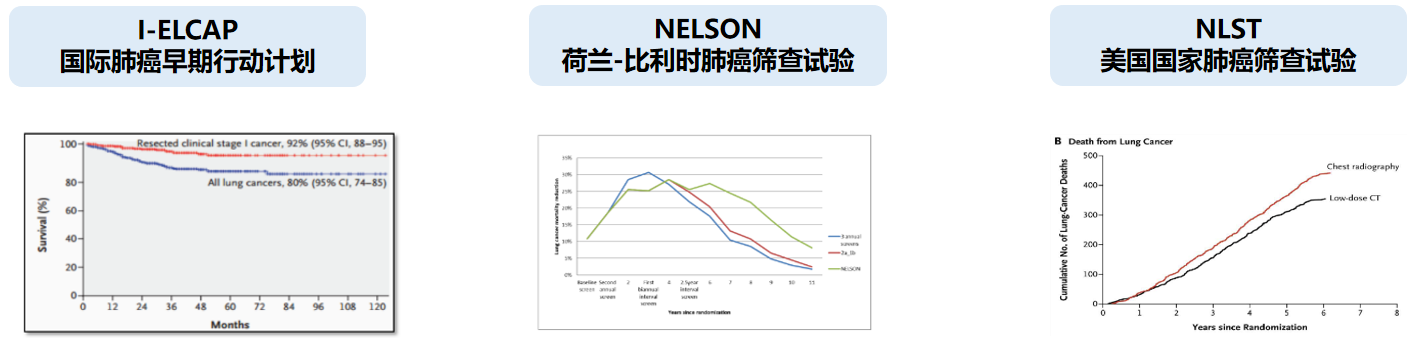
刚才提到LDCT成为肺癌筛查技术的最佳推荐,其实LDCT成为最佳推荐也是经过了一个漫长的历程,我们看到I-ELCAP国际肺癌早期行动计划、NELSON荷兰-比利时肺癌筛查试验、NLST美国国家肺癌筛查试验。
先说第一个:I-ELCAP国际肺癌早期行动计划。早在1993年开始该行动计划就在美国进行了一个超过3万人的人群队列研究,他们让这些人群进行LDCT筛查,来观察他们最终肺癌的发生和死亡率情况。这项行动计划持续到2006年结束。基于LDCT,入组:31567名受试者,LDCT筛查后发现肺癌484例,其中71%属于Ⅰ期,综合治疗后10年生存率为80%。但是,该行动计划因为一开始就没有设计对照组(随机对照)而饱受争议,所以这个结论也不能被广泛的推演。
后来,从2003年开始在欧洲,以及2002年开始在美国,他们分别发起了NELSON荷兰-比利时肺癌筛查试验和NLST美国国家肺癌筛查试验。
「NELSON」是2016年结束的,基于LDCT对比胸片,入组:15822,LDCT筛查,可以降低10年肺癌死亡率,男性降低26%,女性降低39%。根据非钙化结节体积倍增时间进行分层:VDT≥600天的恶性概率为0.8%,VDT在400-600天的概率为4.0%,VDT≤400天的概率为9.9%。
NLST研究是2009年结束的,33个医学中心参与,入组:53454名肺癌高危人群,结果显示与使用胸片筛查相比,采用LDCT对肺癌高危人群进行筛查可使人群肺癌死亡率下降20%。
NELSON荷兰-比利时肺癌筛查试验和NLST美国国家肺癌筛查试验这两个研究得到的结论是强有力的支撑,支撑着「LDCT是肺癌筛查的最佳推荐」。
除此之外,在20世纪90年代,美国纽约威尔康奈尔医学中心的Claudia I. Henschke博士和David F. Yankelevitz博士等人也提出将LDCT检查用于肺癌筛查。他们发起名为「纽约早期发现计划」(NY-ELCAP)的研究,于1999年证明了LDCT在肺癌筛查中的有效性。
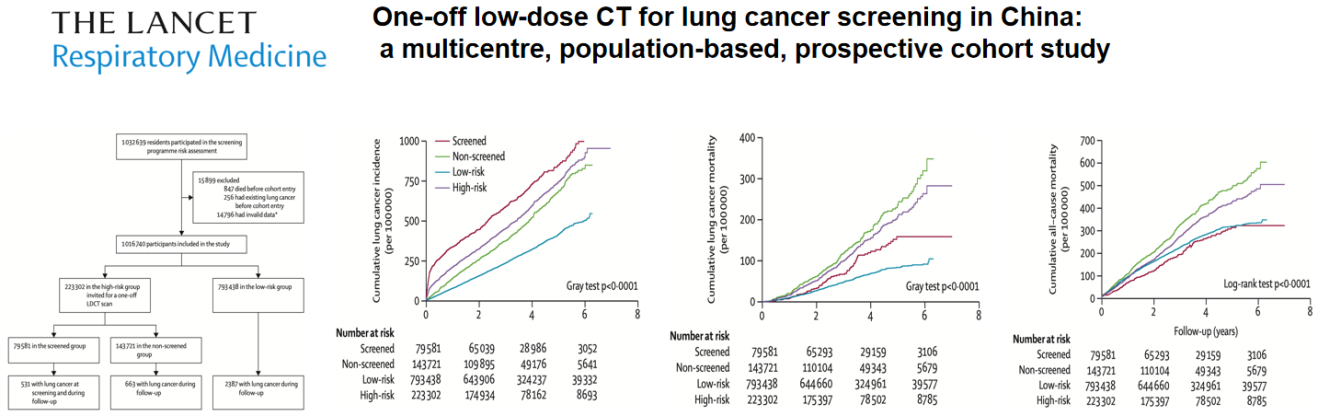
在中国,肺癌早筛项目是呈点片状进行的。发表在THE LANCET Respiratory Medicine杂志上的这篇文章,回顾总结了中国——城市癌症早诊早治项目的数据,研究者用一种叫逆概率加权(IPW)的卫生统计学的方法来告诉我们一些结论。而IPW这种方法是一种用于解释由于非随机选择观测值或人群信息的非随机缺失而造成的缺失和选择偏差的方法。
在2013年2月19日至2018年10月31日期间,1016740名参与者参加了这项研究,其中3581人(0.35%)最后(中位随访时间3.6年)被诊断为肺癌。在223302名肺癌高危人群中,79581人(35.6%)进行了LDCT扫描,经逆概率加权(IPW)后,与未筛查组相比,筛查组高出47.0%的肺癌发病率(风险比1.47 p<0.0001),但最终肺癌死亡率降低31.0%(p=0.010),全因死亡率降32.0%(p<0.0001)。
但从这些数据中我们要清楚,这些超过100万人的参与者,他们都是通过招募而来,意思就是号召而来,他们并非我们所说的高危人群。但在这100多万的参与者里,最后认定有20多万人是肺癌高危人群,其中又有将近8万人的高危人群进行了LDCT筛查,最后发现其实100多万人的参与者里,自然肺癌的患病率只有0.35%。他们是这样一种研究模式,但这是2018年以前的资料,近几年肺结节(包括磨玻璃结节)被广泛关注,也许这些数字会有一定的变化。
LDCT是所有病理类型肺癌的最佳筛查方式吗?早期小细胞肺癌(SCLC)并不能通过LDCT筛查出来,对气道内膜早期癌变的筛查也存在局限性
LDCT筛查,既然我们知道它是经过了这样的发展,才成为一个最佳推荐的肺癌筛查方式,但是它真的适合所有的肺癌的筛查方式吗?它能筛查出来所有早期肺癌吗?
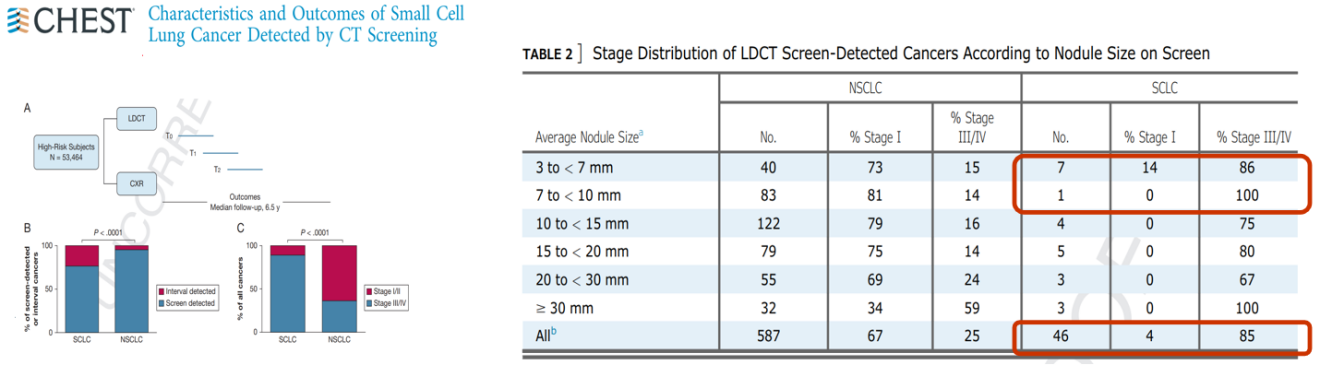
在NLST研究中,共确诊143例小细胞肺癌(SCLC),其中49例(34.2%)为筛查检测到的,15例(10.5%)为随访中检测到的,79例(55.2%)为非筛查/筛查后被确诊。与NSCLC相比,更多的SCLC是间隔检测到的(23%vs. 5%;p<0.0001)。与非小细胞肺癌(NSCLC)病例相比,更多的SCLC是晚期(III/IV:86%vs. 36%;p<0.0001),SCLC在早期不能通过LDCT检测出来。即使是LDCT筛查检测到亚厘米结节,大部分的SCLC亦出现他处转移,处于晚期,对改善预后没有影响。
就以小细胞肺癌为例,年度LDCT筛查,但在筛查完之后的一个月,再做肺CT发现不到半年时间就发生多处转移。所以需要探索更完善的SCLC筛查方法,例如生物标志物。
自荧光支气管镜( AFB)、荧光共聚焦显微镜(FCFM)
LDCT对气道内膜早期癌变的筛查也存在局限性。新版《肺癌筛查与管理中国专家共识》再次指出「影像学很难回答如何对长期大量吸烟、易患中央型鳞癌的高危人群进行筛查等问题 ,特别是对于影像学阴性但反复血痰的患者。」
因此,对于这两类人群,一个是生长特别快的恶性肿瘤,它的高危因素到底在哪里?另外一个是气道内膜病变,我们知道高危人群是重度吸烟者,那么对于重度吸烟者是否应该推广荧光支气管镜检查?这些其实我们都没有数据。
肺癌高危人群为什么要界定?如何识别「高危人群」?……根据我国的肺癌发病危险因素,定义我国肺癌高危人群的几点建议
肺癌高危人群为什么要界定呢?这是一个涉及卫生经济学的评价指标,因为我们不可能所有的人都去做CT,既不可能有足够的财力,而对于任何一个国家、社会,也不可能实现让所有的人都去做CT,我们只能在高危人群里去给他们进行更强有力的一种筛查方式,才是比较合理的。
这是全球肺癌筛查卫生经济学评价。从中我们可以得出三个结论:
1.基于肺癌筛查模型,界定肺癌高危人群进行LDCT肺癌筛查,卫生经济学更获益;
2.预算有限时低频次LDCT筛查更佳,而筛查起始年龄和吸烟史等细节确定需结合当地人群特征进行精准评价;
3.我国肺癌筛查卫生经济学评价研究尚不成熟,亟待开展我国人群特异性的肺癌筛查卫生经济学评价研究。
当然,病因学的调查是漫长的,所以对我国的卫生经济学评价,我们也没有看到很有用的数据,这应该是未来发展的方向。
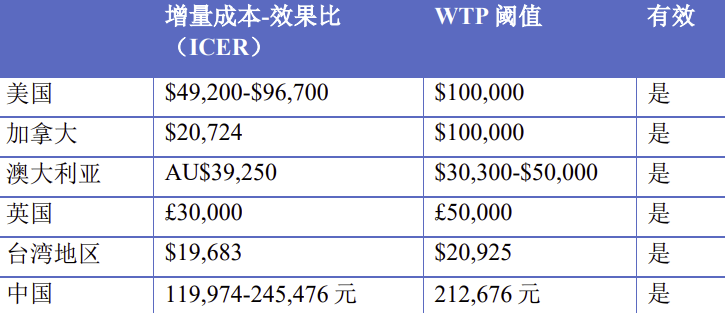
肺癌高危人群筛查卫生经济学评价
为什么要识别高危人群?这是肺癌高危人群筛查卫生经济学评价。世界卫生组织(WGO)推荐意见:
ICER<人均GDP——推荐有效
人均GDP<ICER<3倍人均GDP——有效
ICER>3倍人均GDP——非推荐有效
卫生经济学评价研究结果表明:针对高危人群的肺癌筛查具有一定的经济合理性。
这是什么意思呢?在欧美国家,他们有专门的数据支撑,他们认为如果增量成本效果比是低于人均GDP的,说明这种方式是有效的,应该推荐。LDCT筛查在这几个国家里,经过计算增量成本效果比,完全能够推荐给他们国家的社会,作为高危人群的筛查,具有经济合理性。
对于高危人群的确定,我们似乎都认为教科书上所提到的从来都存在,但事实上我们的教科书上的高危人群确定来自于上世纪六七十年代欧美国家的一些队列研究。他们的LDCT肺癌筛查队列人群的建立,为肺癌高危因素的确定提供了大量的循证学依据。我们又将这些高危因素更加中国化、本土化,凝练成我们中国人群的肺癌高危因素,就是以下8点:
1.年龄、吸烟史和(或)曾经吸烟史;
2.环境或高危职业暴露史,如:石棉、铍、铀、氡等;
3.慢性阻塞性肺疾病;
4.肺纤维化;
5.肺结核病史;
6.既往罹患恶性肿瘤;
7.肺癌家族史;
8.被动吸烟、暴露于烹饪油烟和空气污染暴露史。
有了这些高危因素的判断标准,患者如果刚好有符合条件的,就会让他们赶紧拍个CT看看有没有问题。我们通常是这样的一个路径。
对于高危人群的设定,国外都是将年龄设定在55-74岁之间。比如《NCCN临床实践指南:肺癌筛查2023.1版》:高危人群——年龄55-74岁,且有30包年以上的吸烟史,目前仍在吸烟或戒烟不足15年(1类);还比如美国胸外科协会(ATS)设定高危人群:在55-79岁、吸烟≥30包/年的人群及≥50岁、吸烟≥20包/年且同时合并其他肺癌危险因素(如慢性阻塞性疾病(COPD)、环境或职业暴露、既往罹患癌症、接受过放射治疗、家族史等人群)。
但在中国,我们看到有一个明显的区别,年龄定在了≥40岁。(见《肺结节诊治中国专家共识(2018)》)

为什么中国要将高危人群年龄设定在40岁?这也是有依据的。我国的肺癌发病的危险因素较国外更为复杂,比如更年轻的吸烟者;超过40%的非吸烟肺癌患者;严重的空气污染、生物燃料的使用等其他危险因素对我国肺癌的影响更大。
近年来我国关于肺结节、早期肺癌的数据越来越多,经肺结节筛查后再诊断为肺癌的过程中发现,40-50岁出现肺癌的比例非常高,显然如果还把高危人群年龄设定在50岁以上不太合适。

这就形成了我们现在的限定,将我国肺癌的高危人群在年龄上限定在≥40岁,加上具备随着队列研究数据逐渐凝练而成的危险因素。因此,建议将我国肺癌高危人群定义为:
年龄≥40岁且具有以下任一危险因素者:
(1)吸烟≥400年支(或20包年),或曾经吸烟≥400年支(或20包年),戒烟时间<15年;
(2)有环境或高危职业暴露史(如石棉、铍、铀、氡等接触者);
(3)合并COPD、弥漫性肺纤维化或既往有肺结核病史者;
(4)既往罹患恶性肿瘤或有肺癌家族史者,尤其一级亲属家族史。
此外,还需考虑被动吸烟、烹饪油烟以及空气污染等因素。
肺癌筛查模型可作为优化筛查效果及质量的工具,准确的识别肺癌高危人群,能够最大限度的提高肺癌筛查的好处

我们知道了高危因素,在做筛查项目的时候还需要有一个「加速器」,还需要有一个「策略」。这个「加速器」和「策略」在英国用得非常好,但在我们国家还需要发展。比如:用于心血管病方面,有一个小的「APP软件」,可以帮助我们自测自己是不是高危人群。如果是高危人群,那么就赶紧做冠脉造影。就是这样的一种工具,我们国家目前还并没有,因此我们需要有一个基于这些高危因素做出来的简单的数学模型,让每个人都能自测。比如:你属于肺癌的高危因素,接下来推荐你去做LDCT筛查。

比如英国现在就已经发展出很多可用于进行风险评分的数学模型,可以通过自测评估自己是否是肺癌高风险,再根据结果推荐做LDCT筛查,这样的方式更加具有卫生经济的效能。

英国、美国广泛地使用这些模型。比如CISNET(Cancer Intervention and Surveillance Modeling Network),这是由美国国家癌症协会NCI申办的研究者联盟,他们通过模拟建模的方式来研究癌症预防诊治过程中各种干预措施对发病率和死亡率的影响,CISNET模型已被用于美国多个癌症筛查指南的策略制定。
我们看到,在CISNET模型框架或PLCO对照组下,比较筛查模型与USPSTF筛查标准的有效性:
· USPSTF标准下,筛查比例是19.9%,每10万人可预防613例肺癌死亡,预计增加寿命8590,整体降低肺癌死亡率10.8%;
· 利用Bach模型进行筛查,筛查比例是26%,每10万人可预防767例肺癌死亡,预计增加寿命10054,整体降低肺癌死亡率13.5%。
他们通过癌症干预和监测网络建设,这些结果确实能够提高审查比例,能够增加人群的寿命,降低肺癌死亡率。但是,他们过度诊断的比例也会有所增高,所以他们下一步的主要工作可能是在降低过度诊断率这方面。
过度诊断的问题也是可以通过筛查技术,对筛查出来的人群通过一些技术加以确诊。
高危人群肺CT筛查的肺结节如何诊断为肺癌(肺结节诊断新模型)是医生面临的重点和难点问题
政府目前面临的问题是界定高危人群,在卫生经济学范畴更高效开展筛查。这是体现如何高效率筛查,锁定高危人群来持续进行筛查,让高危人群获益;而高危人群肺CT筛查的肺结节如何诊断为肺癌,也就是肺结节诊断新模型,是医生面临的问题。
我们知道肺结节的诊断有很直接的方式,比如经皮肺穿刺,气管镜下就能诊断,但的确还有很大一部分患者不愿意做或者微小结节无法做到完成介入性的检查,对于这些人群如何诊断?
所以,多维度的数据及有效的组合,让我们的判断更加接近真相。
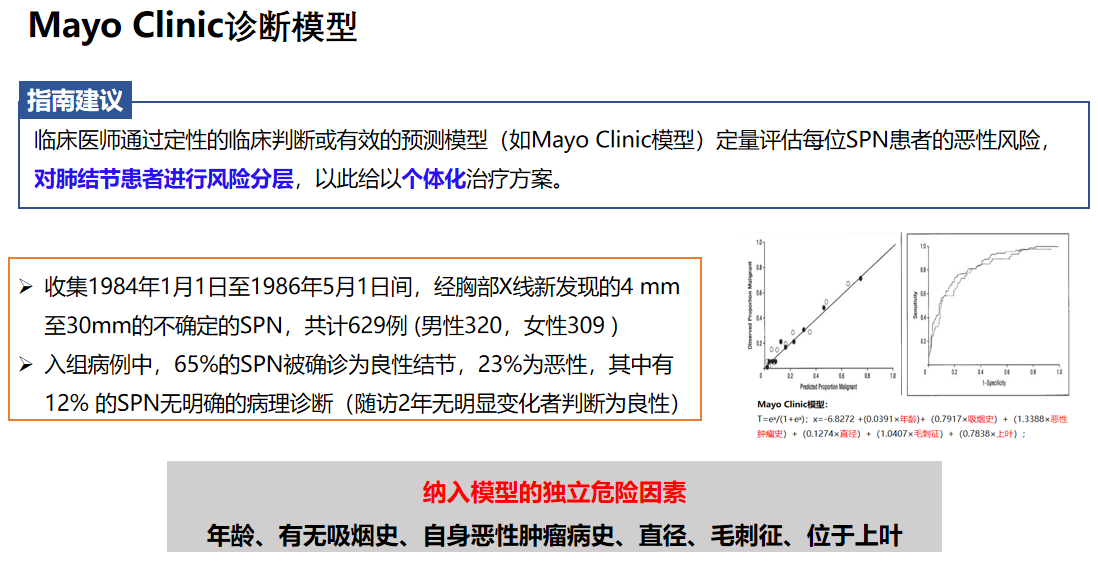
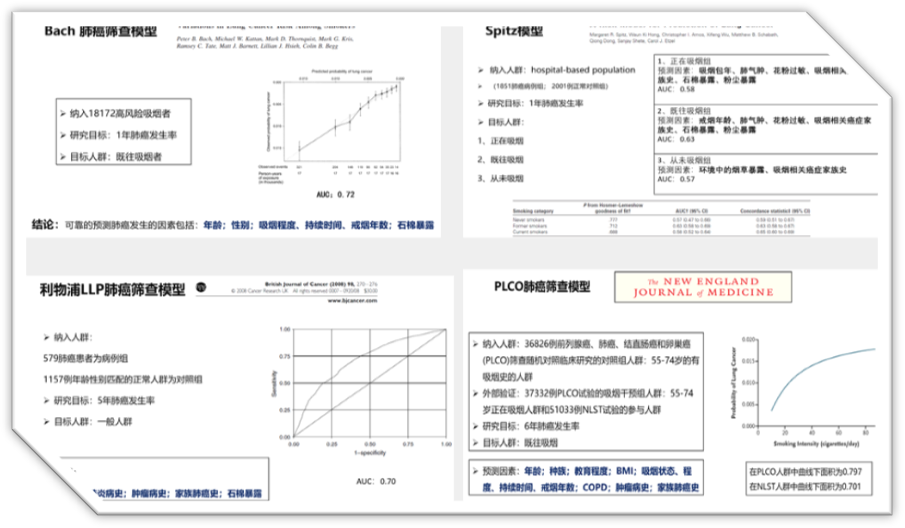
美国梅奥模型作为最经典的数学模型之一。在建立时,收集了共计629例经胸部X线新发现的不确定的肺结节,直径在4mm至30mm之间,其中65%的孤立性肺结节(SPN)被确诊为良性结节,23%为恶性,其中有12%的SPN无明确的病理诊断(随访2年无明显变化者判断为良性),基于采集的临床及影像学信息,通过多因素回归分析计算出影像肺结节良恶性的独立危险因素,分别为年龄、吸烟史、恶性肿瘤史、直径、毛刺征、位于上叶,将筛选出的独立危险因素及相关系数带入函数方程,得到风险预测模型。
该模型AUC为0.8328,检验精度较高,但是在SPN良恶性判断上与临床医生的判断相比并无统计学的差异。值得注意的是,Mayo模型对低度恶性或良性SPN的评价会更加客观。

我们经常会讲模型,尽管它已经过时了,因为它的三四十年前的数据都来自胸部X线,而目前也没有更好的数据来替换。所以梅奥模型多年来没有数据来支撑改进,并且它也是在非亚裔人群中进行的。
美国因其模式是保险公司支付医保,因此他们并不会给患者掏钱做CT筛查,所以美国的肺结节、磨玻璃结节没有我国发现的多,这也给我们的研究带来了利好。
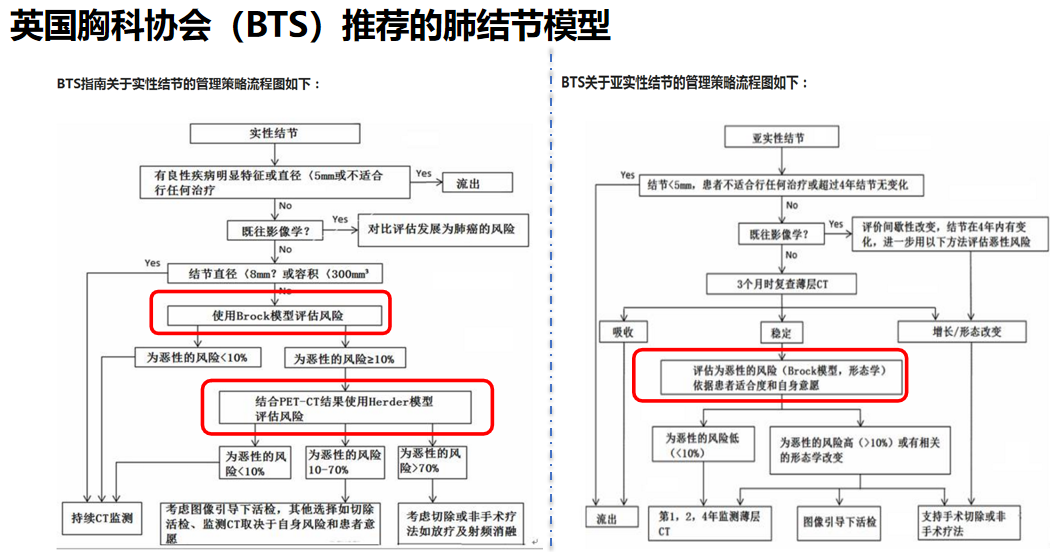
英国胸科协会(BTS)也发布了肺结节诊疗指南,指南中推荐,实性结节和亚实性结节应根据不同情况使用Brock模型和Herder模型进行恶性风险评估。

McWilliams等收集了PanCan数据库的7008个肺结节资料建立模型,以及使用BCCA数据库的5021个肺结节资料对模型进行验证;模型纳入的因素有年龄、性别、肺癌家族史、肺气肿有无、影像特征(结节大小、类型、位置)。该模型表现出优异的预测效能,即便对于10mm甚至更小的肺结节也是很好的风险预测工具。

该模型是纳入的数据量迄今为止最大,之后有多项验证性研究结果均表明其预测准确性较高,但是模型建立时,排除了吸烟史和五年外肿瘤史等患者基本信息,且同Mayo模型一样是在非亚裔的人群中进行的研究与验证,是否同样适用于中国人群,需要进一步验证。
英国在这方面我个人认为是非常卫生经济学的,比如Brock模型的每一阶段它都有一个模型,先评估为高危人群,才报销CT筛查的钱,如果不是高危人群,拍了CT也不报销。如果拍完CT,要让国家掏钱治疗,还需要进行评估,依然是高危人群,才能继续往下进行,这也有效地限制了过度治疗。
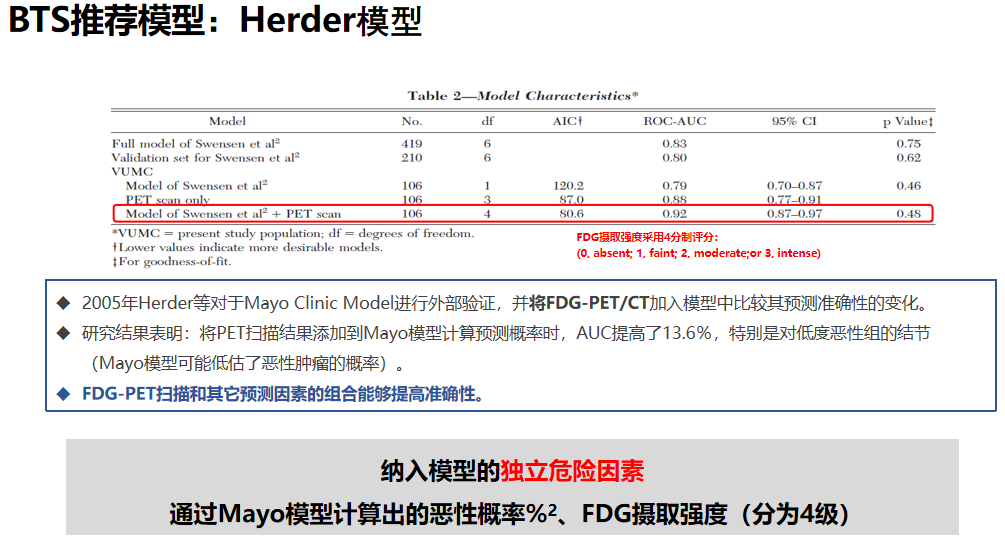
这是Herder模型,Herder等人对于Mayo Clinic Model进行外部验证,在mayo模型的基础上,将FDG-PET/CT加入其中,最终新模型的AUC相比原来的MAYO 模型提高了13.6%,在对低度恶性风险组的结节评估时其优势会更加明显。

Herder预测模型是以原有的Mayo Clinic模型为基础,添加FDG-PET CT数据进行模型效能的优化。BTS指南已推荐当初步的影像学检查发现实性结节,且恶性风险≥10%时,应结合PET-CT结果运用Herder模型进行风险评估。
我国LCBP风险预测模型对肺结节患者危险分层敏感性达94.6%,特异性达94.2%,更适合国内肺癌高危人群肺结节风险评估

来自于复旦大学附属中山医院白春学教授牵头的LCBP研究结果显示,四项联合检测(ProGRP+SCC+CYFRA21-1+CEA)可检出57%CT漏检的肺癌患者。同时,联合肺癌标志物可将CT的肺癌检出率从78.1%提升至90.6%。随后该研究团队建立包含血液生物标志物的LCBP模型,该模型纳入的独立危险因素:年龄、性别、吸烟史和4项肿瘤标志物(ProGRP, CYFRA21-1, CEA 和SCC)。LCBP模型对肺结节患者进行危险分层时,其敏感性达 94.6%,特异性可达 94.2%,同时通过对比验证发现,LCBP 模型较Mayo模型更适合对中国肺癌高危人群进行肺结节的风险评估。

我们现在的难点其实就是磨玻璃结节。我们在河南省也做肺结节模型,其实纳入研究的患者来自于哪一个省的人群,对哪一个省的效能应该是最好的,因为它结合了当地的环境因素和人口学特征。
当然,还有许多前沿的研究:
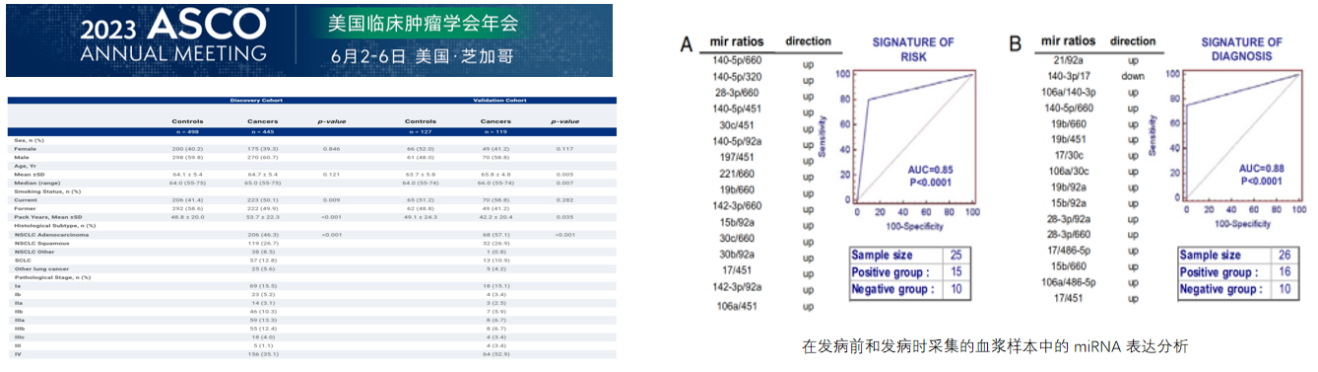
比如2023年美国临床肿瘤学会(ASCO)公布了一项关于使用小RNA早期检测肺癌的研究,前瞻性地招募了1189名符合2013年USPSTF肺癌筛查标准的患者,并采集患者的全血。在验证数据集中,通过在螺旋CT检测肺癌前采集的15个样本中,miRNA成功识别了其中12个肺癌样本,灵敏度为80%,特异性为90%。
这些miRNA的特征预测值在疾病发生前28个月被评估为有效,mir-660、mir-140-5p、mir451、mir-28-3p、mir-30c和mir-92a是其中最常见的失调miRNA类型。
这项研究建立了诊断模型,并报告发现队列的中位ROC AUC为0.86(95% CI 0.84-0.86),验证队列的总体AUC为0.84。miRNA检测的诊断效能从I期肺癌的 AUC 0.73(95% CI 0.71-0.76)提高至IV期肺癌的AUC 0.90(95% CI 0.89-0.90)。
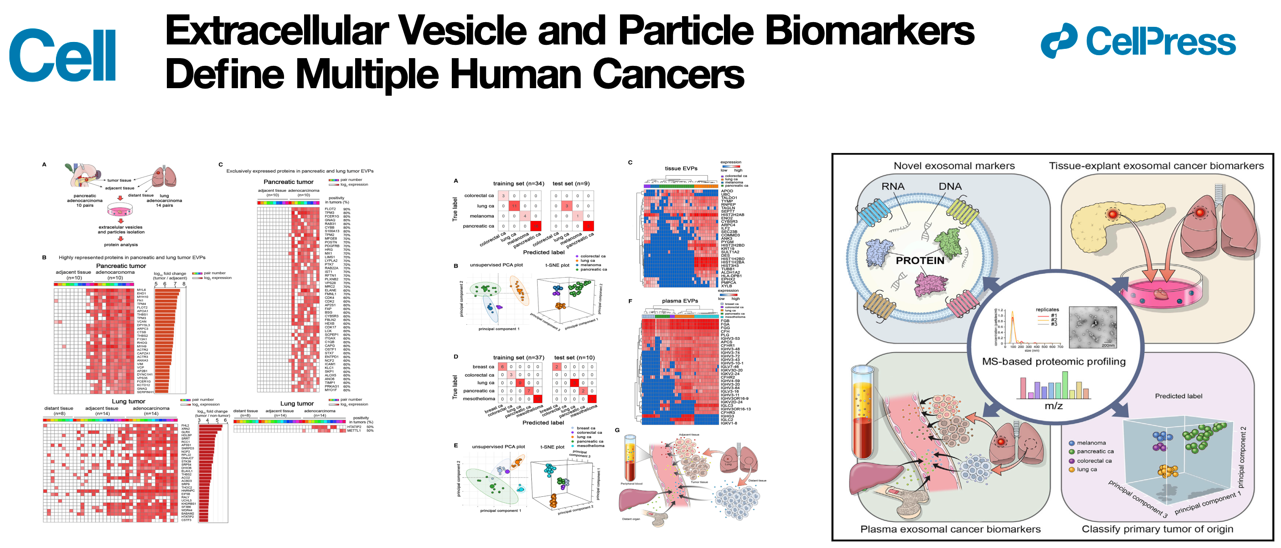
该研究对来自426个人源样品的细胞外囊泡和颗粒(EVP)进行了全面蛋白质组学分析,确定了泛EVP(pan-EVP)蛋白标记,用于分离人EVP,并确定出了一系列肿瘤特异性EVP标志性蛋白,用于癌症检测和确定癌症类型。
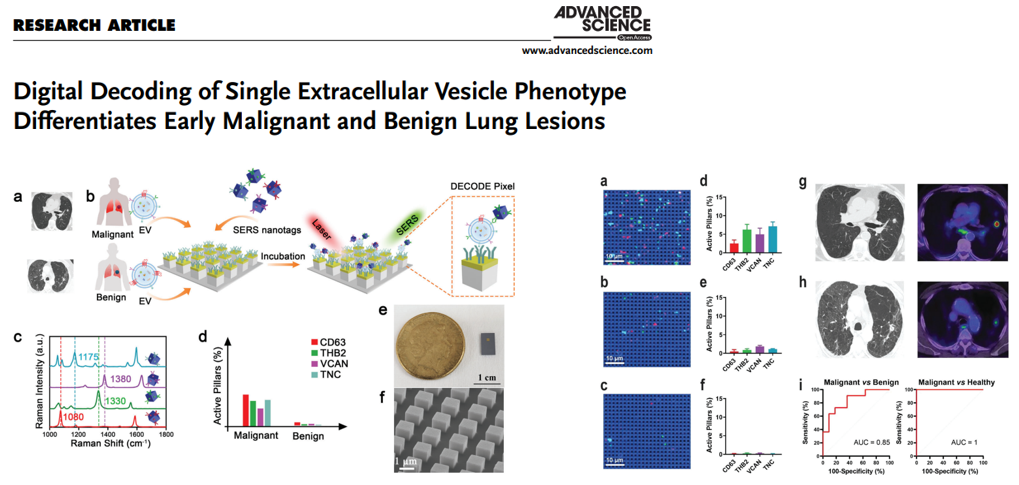
2022年,澳大利亚生物工程与纳米技术研究所的相关团队通过开发一种非侵入性的、基于血液样本的解码肿瘤特异性sEVs(细胞外囊泡)的分子谱技术(DECODE),成功获取并生成sEVs分子图谱,能够区分早期恶性和良性肺部病变。可作为一种新型肺癌辅助诊断工具。
在33人的队列中,包括恶性和良性肺结节和健康人,DECODE揭示了sEVs特异性分子图谱允许恶性与良性(曲线下面积,AUC = 0.85)。
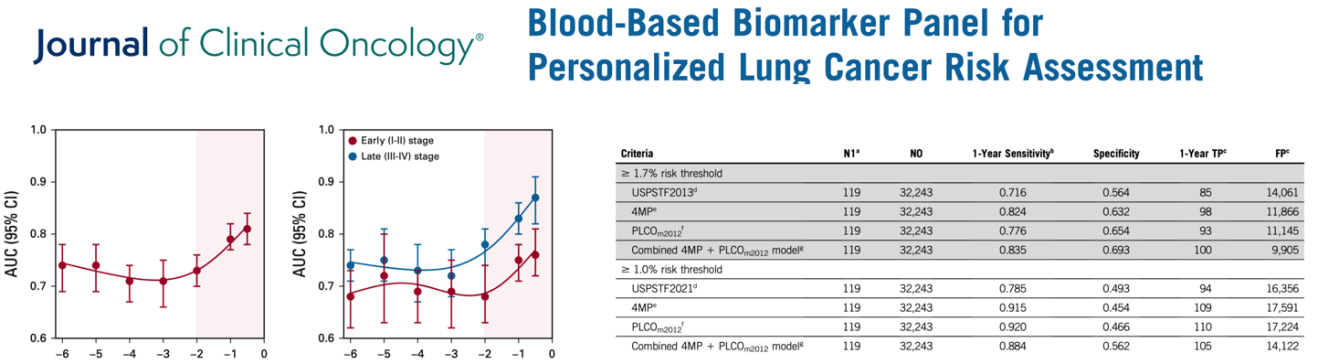
在一项研究中研究人员对552名肺癌患者诊断前采集的1299份血清样本和2193名未患肺癌个体的8709份血清样本进行了一项多中心、盲法验证研究。研究中评估的四标记蛋白组(4MP)包括表面活性蛋白B、癌抗原125、癌胚抗原和细胞角蛋白-19片段的前体形式。
该团队将通过联合4MP血液检测和风险辅助模型诊断肺癌的敏感性和特异性与当前的USPSTF标准进行比较。在一年至少吸10包烟的个体中,与目前的USPSTF标准相比,结合风险模型的血液检测显示总体敏感性(88.4%对78.5%)和特异性(56.2%对49.3%)有所提高。与USPSTF 2021筛查标准相比,4MP+PLCOm2012联合模型将每年多筛查出9.2%的肺癌病例,并且非肺癌患者的转诊率将减少13.7%。
我国肺癌筛查及规范化管理标准:推荐LDCT+四项肿瘤标志物+个体化CAC检测+AI
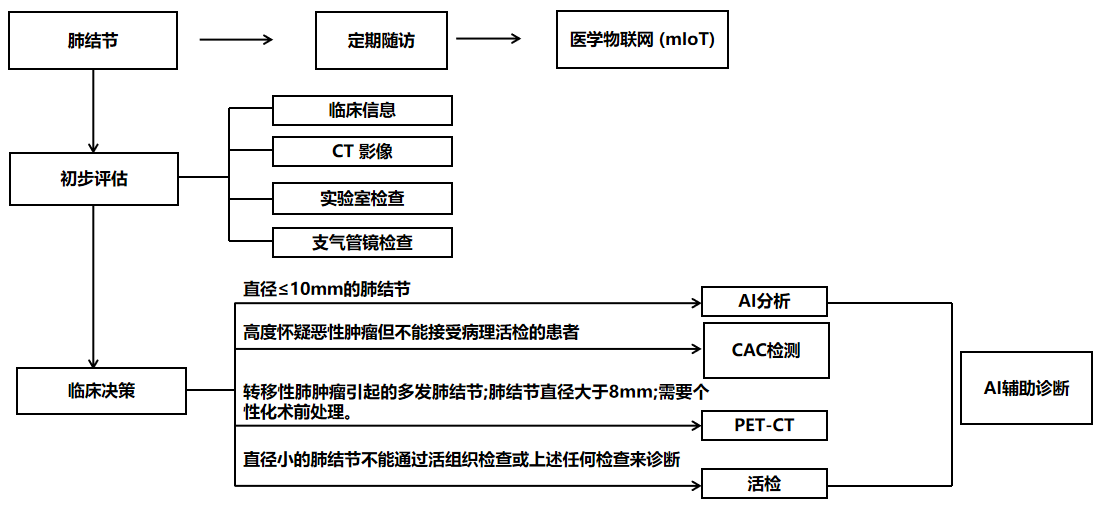
目前我国肺癌筛查和管理的标准化,将筛查和管理策略定位于:提高参与度是肺癌筛查和患者管理的基础。一旦发现肺部结节,应安排定期随访。在初步评估中,临床信息和CT图像的收集是最重要的因素。鉴别诊断还需要进行结核病、真菌感染和肿瘤生物标志物检测。
临床判断方面,肺结节直径约10毫米以下的病例在初步评估中很难诊断,往往需要临床判断或通过AI进一步分析。对于无法排除肿瘤且不适合活检的患者,建议进行个性化CAC检测。
对于不能排除肺转移肿瘤引起的多发性肺结节、肺结节直径大于8毫米、需要个体化术前处理的患者,应考虑行PET-CT检查。

文章结合我国国情介绍了肺癌筛查的高危人群以及部分肺癌筛查方法的优缺点。基于医疗物联网(MIoT)的应用可以方便地对患者进行健康教育,鼓励患者参与筛查,并协助精准管理。还需要深入研究权威共识/指南,将知识融入到医生的工作流程中,充分利用医院信息系统的数据,开发一个可以辅助医生工作的系统。临床决策,并确保有效的质量控制,以达到符合国家标准的同质诊断和治疗水平。

未来我们仍然面临挑战,比如需要更加高效、精准地锁定肺癌高危人群。根据地方人口、经济及环境学特征,制定具有地方特征的高危人群标准;探索适用于具有非吸烟、女性等特征的亚洲人群的风险模型;可整合生物标志物到风险模型中;开发人工智能工具,以确定是否继续筛查并优化随访间隔。

探索最适合中国人群的肺癌筛查新标准与肺结节诊断新模型的脚步仍将不断前行。但值得高兴的是,我们重点学习的CAC现在已初见雏形和具有代表性,这个模型在临床实践中有不断自我优化的方式,因为它是用数据推演论证出来的,因此我们也非常期待和自信,它将来能够解决临床难题。
参考文献
1. National Lung Screening Trial Research Team, et al., N Engl J Med.2011 Aug 4;365(5):395-409.
2. L Rivero, 2018 WCLC, Press Program Press Release FINAL.
3. Henschke CI, Boffetta P, Gorlova O, et al. Assessment of lung-cancer mortality reduction from CT screening. Lung Cancer, 2011, 71(3): 328-332.
4. 2022年https://doi.org/10.1016/S2213-2600(21)00560-9
5. CHEST 2018 DOI:https://doi.org/10.1016/j.chest.2018.07.029.
6. n engl j med 365;5 nejm.org august 4, 2011
7. 《肺癌筛查与管理中国专家共识》
8. 中华流行病学杂志, 2019,40(2) : 218-226. DOI:10.3760/cma.j.issn.0254-6450.2019.02.018
9. Samuel G Radiology December 2002
10. Lancet Glob Health. 2019 Feb;7(2):e257-e269.
11. Kovalchik S A, Tammemagi M, Berg C D, et al. Targeting of low-dose CT screening according to the risk of lung-cancer death[J]. New England Journal of Medicine, 2013, 369(3): 245-254
12. Ten Haaf K, Bastani M, Cao P, et al. A comparative modeling analysis of risk-based lung cancer screening strategies. Journal of the National Cancer Institute. 2019.
13. Swensen S J, Silverstein M D, Edell E S, et al. Solitary pulmonary nodules: clinical prediction model versus physicians[C]//Mayo Clinic Proceedings. Elsevier, 1999, 74(4): 319-329.
14. Perandini S, Soardi GA, Motton M, Montemezzi S (2015) Critique of Al-Ameri et al. (2015) - Risk of malignancy in pulmonary nodules: a validation study of four prediction models. Lung Cancer 90:118–119
15. 2015 BTS Guidelines
16. N Engl J Med. 2013 Sep 5;369(10):910-9. doi:10.1056/NEJMoa1214726.
17. Herder GJ et al. Chest. (2005)
18. Eur Radiol.2017 May;27(5):1929-1933. doi: 10.1007/s00330-016-4538-5. Epub 2016 Aug 23.
19. Yang DW, Zhang XJ,Bai CX
20. Early detection of lung cancer using small RNAs. 2023 ASCO Abstract 3035.
21. Adv. Sci. 2023, 10, 2204207
22. https://doi. org/10.1200/JCO.21. 01460
23. Chinese Medical Journal. June 02, 2023.
专家简介

张晓菊
河南省人民医院呼吸与危重症医学科主任,教授,博士生导师;国家百千万人才工程入选者-有突出贡献中青年专家,河南省卫健委新冠肺炎救治省级专家组副组长,中华医学会呼吸病学分会肺癌学组委员,中国医师协会呼吸医师分会委员,中华预防医学会呼吸专委会委员,河南省医学会呼吸病分会主任委员,河南省健康管理学会呼吸病专科分会主任委员;2009-2012年间美国加州大学旧金山分校(UCSF)博士后;担任第九届《中华结核和呼吸杂志》编委,《中华医学杂志(英文版)》通讯编委,国际呼吸杂志编委,Thorax杂志中文版编委、《结核与肺部疾病杂志》副主编;从事呼吸内科临床、教学和科研近30年,擅长肺部结节、肺癌、肺部感染、肺间质性疾病等疾病的诊断和治疗,主攻方向为早期肺癌(肺部结节)诊治新技术;承担国家自然科学基金面上及重点项目共4项、省部级科研项目10余项,发表SCI等文章100余篇,获河南省科技进步奖及新技术引进奖等共5项。
本文由《呼吸界》编辑 冬雪凝 整理,感谢张晓菊教授的审阅修改!
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


