特发性肺纤维化(IPF)是一种慢性、进行性、纤维化性间质性肺疾病(ILD),发病人群以老年人为主,发病率和患病率都呈逐年增加的趋势,其病理上呈现普通型间质性肺炎(UIP)的组织学征象,诊断后平均年生存期为2~3年。因此,特发性肺纤维化的治疗在间质性肺病治疗中尤为重要。
目前特发性肺纤维化(IPF)治疗的药物根据是否上市可分为两类:已上市抗纤维化药物和有希望上市的抗纤维化药物。
一、已上市抗纤维化药物
(一)尼达尼布
1. INPULSIS研究
研究人群:特发性肺纤维化(IPF)患者。
主要终点:自基线至第52周,与安慰剂组相比,尼达尼布治疗组平均FVC下降减少107ml,减缓患者的FVC下降率为43%(图1)[1]。
结果表明:尼达尼布对IPF患者有改善肺功能或减缓肺功能下降的作用。
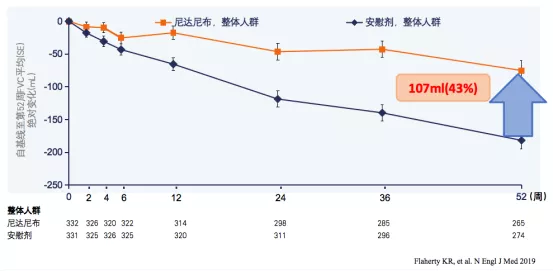
图1:尼达尼布治疗组与安慰剂组自基线至第52周FVC下降的变化
2. SENSCIS研究
2019年发布的SENSCIS研究是一项随机、双盲、安慰剂对照组Ⅲ期临床试验。
研究人群:系统性硬化病相关间质性肺疾病(SSc-ILD)患者。
主要研究终点:与安慰剂组相比,尼达尼布治疗组能显著减缓SSc-ILD患者FVC年下降率,延缓下降44%,两组之间的差值为40.95 mL/年,P=0.0350(图2)[2]。
研究表明:尼达尼布可延缓系统性硬化病相关间质性肺疾病(SSc-ILD)的进程。
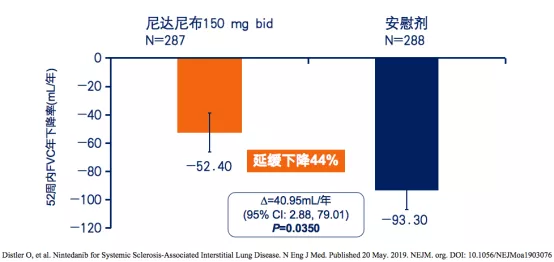
图2:尼达尼布治疗组与安慰剂组52周内FVC年下降率对比
3. INBUILD研究
2019年《新英格兰医学杂志》发表的INBUILD研究也是一项随机、双盲、安慰剂对照组Ⅲ期临床试验。
研究人群:进行性纤维化性间质性肺病(PF-ILD)患者。
研究终点:PF-ILD患者FVC年下降率。
研究结果:与安慰剂组相比,尼达尼布治疗组肺功能下降率减缓了57%。针对高分辨率CT(HRCT)表现为普通型间质型肺炎(UIP)的患者,尼达尼布组比安慰剂组肺功能下降率减缓了61%(图3)[3]。
INBUILD研究显示:尼达尼布可延缓进行性纤维化性间质性肺病(PF-ILD)的进展。
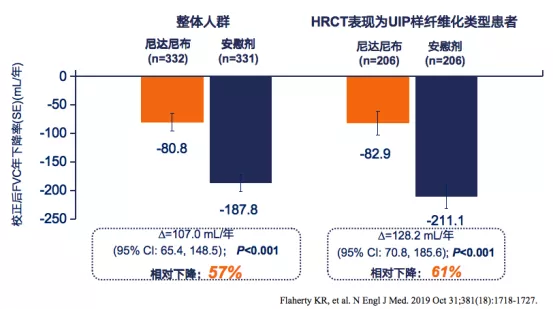
图3:PF-ILD患者(左)、UIP患者(右)的治疗组与安慰剂组FVC年下降率对比
(二)吡非尼酮
1. ASCEND研究
研究人群:特发性肺纤维化(IPF)患者。
主要终点:从基线到第52周,用力肺活量(FVC)下降的变化。
研究结果:与安慰剂组相比,吡非尼酮治疗组平均FVC下降减少了193ml,减缓下降率为45.1%,P<0.001(图4)[4]。
结果表明:吡非尼酮可延缓特发性肺纤维化(IPF)患者肺功能的下降速度。
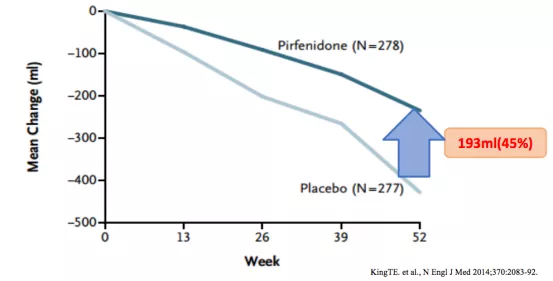
图4:吡非尼酮治疗组与安慰剂组自基线至第52周FVC下降的变化
2. RELIEF 研究
2021年《柳叶刀》发表了吡非尼酮治疗非IPF-PF-ILD患者的随机、双盲、安慰剂对照Ⅱb期试验的研究[5]。
研究人群:非特发性肺纤维化伴有进行性进展的间质性肺病患者(非IPF-PF-ILD),其中慢性过敏性肺炎患者占57.45%,CTD-ILD患者占37.29%、纤维化非特异性间质性肺炎患者占27.21%、石棉诱导的肺纤维化患者占6.5%。
主要终点:从基线到第52周,用力肺活量(FVC)下降的变化。
研究结果:从基线至第48周,吡非尼酮治疗组FVC、DLco预测值的下降显著低于安慰剂组(图5)。
研究显示, 吡非尼酮能延缓非IPF-PF-ILD患者FVC和DLco的下降趋势。
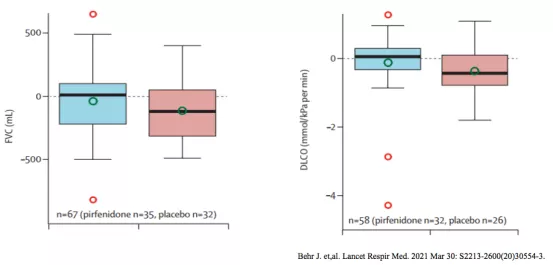
图5:吡非尼酮治疗组与安慰剂组FVC(左)和DLco(右)之间的差异
3、2019年《柳叶刀》发表了吡非尼酮治疗无法分类的进行性纤维化间质性肺病的全球多中心、双盲、随机、安慰剂对照II期临床试验的研究(图6)[6]。
研究人群:无法分类的进行性纤维化间质性肺病(U-ILD)。
研究显示,24周时,吡非尼酮治疗组FVC较基线的预测均值变化为-17.8 ml,安慰剂组为113.0 ml。24周时,吡非尼酮治疗组通过每日家庭肺活量测定法测量的FVC较基线的预测中位数变化为-87.7 mL,安慰剂组为-157.1 mL。吡非尼酮治疗组的127名患者中有18例(占14%)FVC的绝对下降超过10%,而安慰剂组的126名患者中有34例(占27%)。

图6:吡非尼酮治疗组与安慰剂组较基线FVC变化(左)和FVC下降>10%的患者比例(右)
研究表明,吡非尼酮能延缓U-ILD患者FVC下降。
二、有希望上市的抗纤维化药物
特发性肺纤维化(IPF)的发病机制,最初病因是肺泡上皮细胞损坏,损伤发生后,修复过程中不能完成正常的再上皮化过程,进而导致肺泡-毛细血管损伤。这一过程诱发细胞因子产生,成纤维细胞表面表达细胞因子受体,在细胞因子作用下聚集到损伤部位并增殖,从而损坏肺部结构(图7)[7]。

图7:特发性肺纤维化发病机制示意图
(一)抗结缔组织生长因子(CTGF)抗体
结缔组织生长因子(CTGF)是1991年Bradham等首先在人脐静脉内皮细胞的条件培养基中发现的,是一种由349个氨基酸组成、分子量为34~38KD的富含半胱氨酸的多肽。
CTGF对成纤维细胞具有促细胞增殖、迁移及分化等作用。TGF--β1、PDGF、脂质过氧化物、乙醛均可刺激肺泡上皮细胞产生CTGF(图8)。
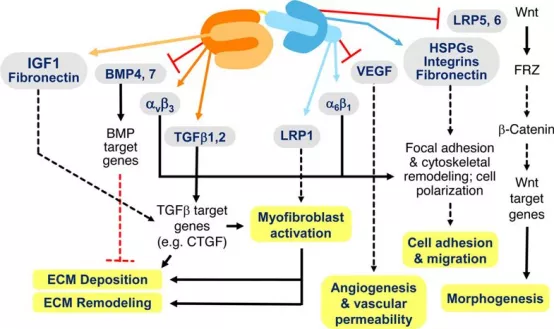
图8:CTGF影响多种信号通路的过程
特发性肺纤维化(IPF)患者的CTGF明显增加,因此,抗CTGF抗体药物可以中和结缔组织生长因子。
抗结缔组织生长因子抗体(Pamrevlumab),是一种全人源重组单克隆抗体,可以抑制结缔组织生长因子的生物活性。目前已完成的3项特发性肺纤维化临床研究,包括规模较大的Ⅱ期临床研究(见下表)。
表:抗结缔组织生长因子抗体治疗IPF研究
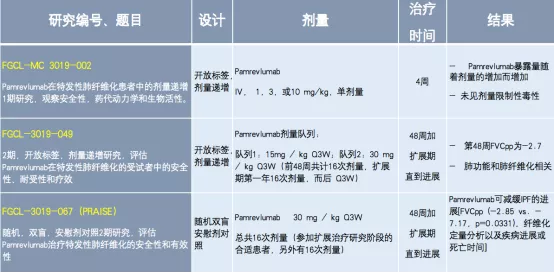
2019年《柳叶刀》发表了一项抗CTGF抗体(Pamrevlumab)治疗IPF(II期)研究,将纳入的103例患者随机分为两组,其中Pamrevlumab组有50例患者,安慰剂对照组有53例患者,持续48周试验。
结果表明,Pamrevlumab治疗组与对照组相比,受试者的FVC下降速度有明显减慢,临床复合指标(FVC占预计值百分比下降大于10%和死亡的百分比)也较安慰剂组明显降低(图9)[8]。次要观察指标:SGRQ评分和肺纤维化定量评分也有统计学差异。
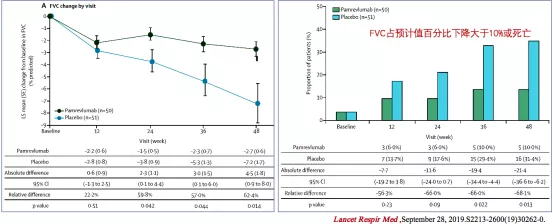
图 9:Pamrevlumab治疗组与对照组FVC下降变化(左)和临床复合指标对比(右)
(二)溶血磷脂酸(LPA)抑制剂
LPA作为一种细胞间的磷脂信使,可以激活G蛋白偶联受体,引起生长激素样作用,从而产生广泛的生物学效应,对细胞的生长、增殖、分化及细胞内信息传递产生多种影响。
LPA与受体LPAR结合能够:①促使上皮细胞激活,产生多种促炎性(pro-inflammatory)信号;②改变上皮细胞生理特性;③刺激成纤维细胞聚集。
IPF患者肺组织中LPA表达量显著增加[9]。
2018年《柳叶刀》发表了一项新的溶血磷脂酸抑制剂(GLPG1690)治疗IPF的随机、安慰剂对照IIa 期临床研究[10]。该研究共入组23例患者,观察时间是14周。在第14周,两组FVC差值间统计学差异不显著,p=0.06(图10)。
研究提示,溶血磷脂酸抑制剂(GLPG1690)可能对IPF有治疗作用。
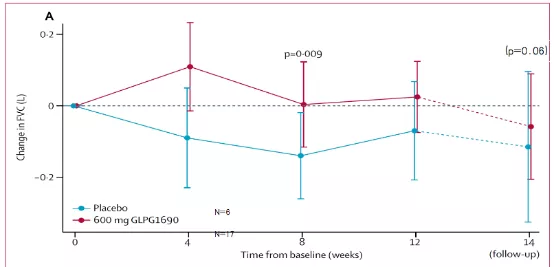
Maher TM, et al. Lancet Respir Med 2018, 6: 627–35.
图10:治疗组与安慰剂组自基线至第14周FVC变化
(三)正五聚蛋白(穿透素)-2
一个蛋白质家族,在电镜下能观察到特定的正五边形,包括C反应蛋白、血清淀粉样物质P(Pentraxin-2)组分、神经元正五聚蛋白、精子顶体正五聚蛋白等。
Pentraxin-2具有调节天然免疫反应、抑制单核细胞分化为促成纤维细胞或纤维化发生表型及活化巨噬细胞亚群(M2a)的功能。具有抑制纤维化及促进修复的双重作用。
PRM-151具有广泛的抗纤维化活性。减少胶原表达和沉积;可抑制已形成的肺纤维化进展;减少了巨噬细胞的浸润和纤维细胞的数量,增加了纤维组织中 IP10/CXCL10 的表达(图11)。
PRM-151能调节单核细胞分化,抑制促纤维化、促炎性巨噬细胞和纤维细胞的生成 [11,12]。
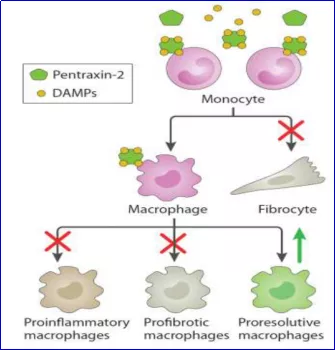
图11:PRM-151调节单核细胞分化机制
2018年《JAMA》上发表了重组人正五聚蛋白2对IPF患者FVC的影响。该研究为随机、安慰剂对照II期研究[13],共纳入117例患者,随机分为两组,随访28周。结果显示,治疗组与安慰剂组患者的FVC下降程度具有统计学差异(P=0.001)。
研究表明,重组人正五聚蛋白-2能减缓IPF患者肺功能的下降(图12)[13]。其Ⅲ期临床试验已经在全球启动,我国也有患者参与。
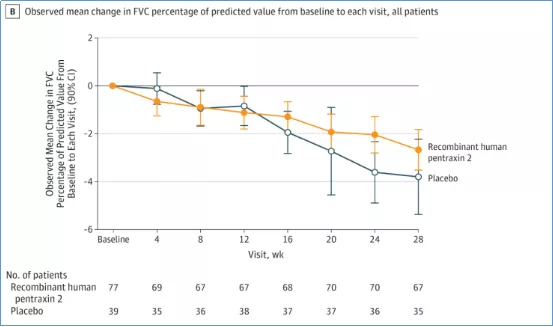
图12:重组人正五聚蛋白-2延缓IPF患者FVC下降趋势
(四)JAK-STAT信号通路抑制剂
IPF存在着JAK-STAT信号通路过度活化,激活的STAT因子可以定位到细胞核内调节下游基因的表达。
国内研发的杰克替尼是JAK激酶抑制剂,可以通过JAK-STAT信号通路,抑制STAT底物的磷酸化,有效抑制细胞因子的释放,从而改善肺纤维化。此外,杰克替尼还对骨髓纤维化、斑秃等都有治疗作用,但在特发性肺纤维化方面还没有研究。
目前,杰克替尼作为国内1.1类新药,已开展治疗特发性肺纤维化患者多中心、随机、双盲、安慰剂对照Ⅱ期临床研究。预期招纳100例IPF患者,现已纳入将近70例患者。
(五)磷酸二酯酶4(PDE4)抑制剂
磷酸二酯酶4(PDE4)抑制剂具有抑制很多炎性介质释放的作用,对肥大细胞、嗜碱粒细胞、中性粒细胞、单核细胞、淋巴细胞合成和分泌炎性介质均有抑制作用。这些炎性介质能够参与到肺纤维化的发病机制中,因此,磷酸二酯酶4(PDE4)抑制剂可能对治疗IPF研究有重要意义。
目前,企业正准备做PDE4抑制剂治疗IPF (II期)研究,患者将按照1:2比例入组,观察12周。该研究国际上已经开始进行,我国也有参与。
研究目的:基于FVC自基线的改变,评估BI 1015550 18 mg b.i.d相比安慰剂的有效性,同时评估BI 1015550在总体试验人群中的安全性与耐受性(图13)。

图13:PDE4抑制剂治疗IPF II期临床研究方案设计
主要终点:第12周FVC自基线的改变(mL)。
次要终点:治疗期间出现的不良事件(TEAE)的患者百分比 (%)。
(六)TAS-115 (多种细胞因子受体TKI)
TAS-115(多种细胞因子受体TKI),如PDGFR、CSF-1R、AXL、VEGFR、MET等络氨酸激酶受体有高度抑制作用;对细胞的分泌和增殖有很高的选择性而且耐受性好。初步的临床研究显示,31例患者经过TAS-115药物治疗13周后,⅔患者的肺功能都有所改善,只有⅓患者的肺功能呈下降趋势(图14)。因此,研究结果也显示出多种细胞因子受体药物对IPF有一定的治疗效果。
日本学者将在亚太地区做大规模、不同剂量TAS-115治疗IPF的研究。
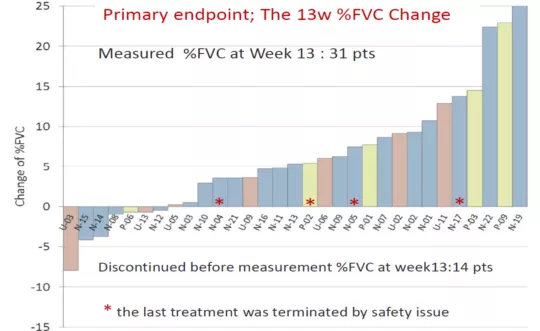
图14:TAS-115药物治疗自基线至第13周%FVC变化
(七)其它治疗药物
1、吡非呢酮衍生物(伊非呢酮)
2、整合素(Integrin aVb6)拮抗剂
3、组蛋白去乙酰化酶抑制剂
4、干细胞移植
总结
随着对间质性肺疾病(ILD)认识的不断深入,一些新的抗纤维化药物不断涌现。相信不久的将来,间质性肺疾病的抗纤维化治疗将会进入一个新纪元。
参考文献
[1] Flaherty KR, et al. N Engl J Med 2019.
[2] Distler O, et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N Eng J Med. Published 20 May. 2019. NEJM. org. DOI:10.1056/NEJMoa1903076.
[3] Flaherty KR, et al. N Engl J Med. 2019 Oct 31; 381(18):1718-1727.
[4] KingTE. et al. N Engl J Med 2014; 370:2083-92.
[5] Behr J. et, al. Lancet Respir Med. 2021 Mar 30:S2213-2600(20)30554-3.
[6] Lancet Respir Med 2019. Published Online, September 29, 2019.S2213-2600(19)30341-8.
[7] Ahluwalia N, et al. Am J Respir Crit Care Med. 2014, 190(8):867-78.
[8] Lancet Respir Med, September 28, 2019. S2213-2600(19)30262-0.
[9] Ninou et al doi: 10.3389/fmed. 2018.00180.
[10] Maher TM, et al. Lancet Respir Med 2018, 6:627–35
[11] Murray LA, et al. PLoS ONE. 2010;5(3):e9683.
[12] Verstovsek S, et al. 欧洲医学杂志. 2016. 213(9):1723–1740.
[13] Raghu G, et al. JAMA. 2018, 319(22):2299-2307.
专家介绍

徐作军
医学博士,教授,博士生导师;北京协和医院呼吸内科主任医师。担任中华医学会呼吸病分会间质病学组副组长,中国医师协会呼吸医师分会间质性肺病工作委员会副主任委员,中国老年医学学会呼吸病学分会副会长,中国医师协会中西医结合呼吸专业委员会常委,北京医师协会内科分会理事,北京中西医结合学会呼吸专业委员会常委,北京医学会呼吸病分会慢阻肺(COPD)学组副组长,海峡两岸医药卫生交流协会呼吸病学专业委员会委员。担任《中华结核和呼吸杂志》、《中华老年医学杂志》《中国呼吸及危重监护杂志》等杂志的编委 。
本文由《呼吸界》编辑 Asiya 整理,感谢徐作军教授的审阅修改!
本文完,排版:Jerry
未经许可,请勿转载


