
病例回顾
65岁,男性,主诉:发热1周。入院日期:2018年8月3日。
现病史
2018年7月26日无明显诱因出现头晕、乏力,继而出现意识障碍、抽搐,测体温为40℃,当地医院诊断为「肺炎」,先后给予「哌拉西林他唑巴坦 4.5g/日」、「头孢哌酮舒巴坦 9g/日」、「莫西沙星 0.4g/日」、「亚胺培南西司他汀 2g/日」治疗,每日仍有高热,体温波动于38~40.2℃之间。
不伴畏寒、寒战,无咳嗽、咳痰、胸痛、咯血、呼吸困难等症状,为明确发热原因由当地医院转入我科。
发病以来,精神、食欲差,留置导尿,大便干燥,2~3天一次,体重无明显减轻。
既往、个人史
10年前确诊帕金森病,平素口服左双多巴控释片治疗,3年前行脑起搏器置入术,平素活动量少,言语不畅。
入院查体
T 38.5℃;P 87次/分;R 25次/分;Bp 126/79mmHg。
神清,表情淡漠,言语不利,交流困难。左上胸壁皮下可见脑起搏器。唇红,双肺呼吸音略粗,未闻及干湿性啰音。心、腹无阳性体征,双下肢不肿。病理征阴性。
辅助检查
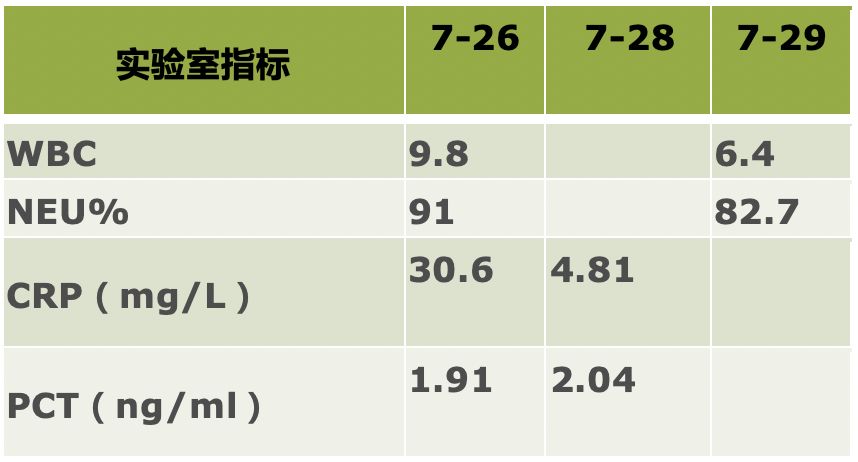
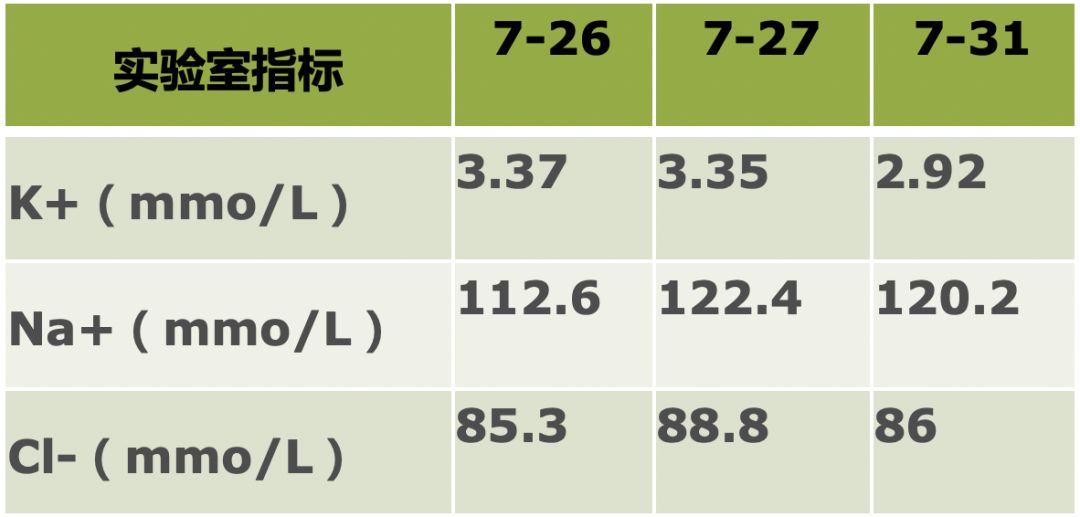
ESR 44mm/第1小时末。
脑脊液常规:无色透明,潘氏试验(-),白细胞计数0,红细胞总数50×10^6/L。
脑脊液生化:葡萄糖3.57mmol/L,总蛋白1.05g/L,Cl- 104.9mmo/L,ADA 0。
肝肾功能、凝血检查、肿瘤标志物、乙肝、丙肝、HIV-Ab、梅毒检测均未见异常。
头颅CT:DBS术后改变。
胸部X线:左下肺斑片状密度增高影,边界模糊,左膈面、肋膈脚略模糊。左上胸部见电子高密度影。
胸部CT:双肺散在斑片状高密度影,部分呈磨玻璃样,左肺下叶为著。双肺多发结节,部分钙化,双侧胸膜增厚粘连。
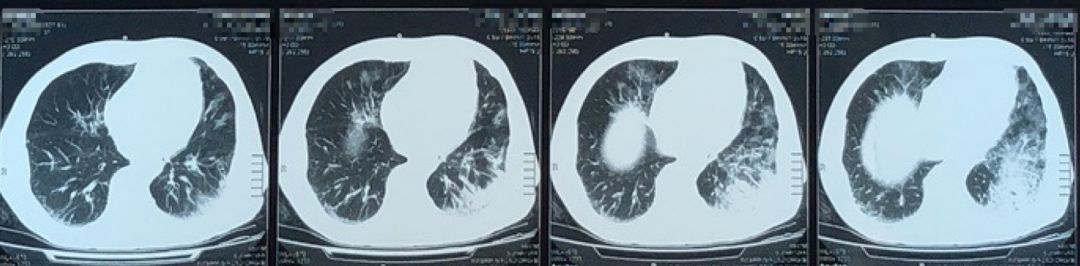
2018年7月28日胸部CT
分析病例特点
老年男性,急性起病,主要表现为高热,院外应用多种抗生素治疗效果差。实验室检查示血象、降钙素原、C反应蛋白增高,血沉增快,胸部CT示双肺炎性病灶,左下肺为著。
初步诊断
双侧肺炎、低钾血症、低钠血症、低氯血症、帕金森病、脑起搏器植入术后
诊疗经过
2018年8月3日起进行抗感染治疗:美罗培南1.0g ivgtt q12h+依替米星 0.2g ivgtt qd。体温有所下降,波动于37.5~38.5℃,精神、食欲好转,无咳嗽、咳痰。
8月7日再次出现高热,体温39.3℃,不伴畏寒、寒战,物理降温无效,持续高热,伴腹痛、腹泻,水样便,4-5次/日。血常规:WBC 3.9×10^9/L,NEU% 80%。Na+ 122mmo/L,Cl- 89mmol/L。便常规(-),便球杆比 1:8。对症治疗后腹痛、腹泻渐止,发热时间缩短,体温波动于38.1~39.8℃,物理降温有效,但反复发热。
血培养、尿培养均阴性。
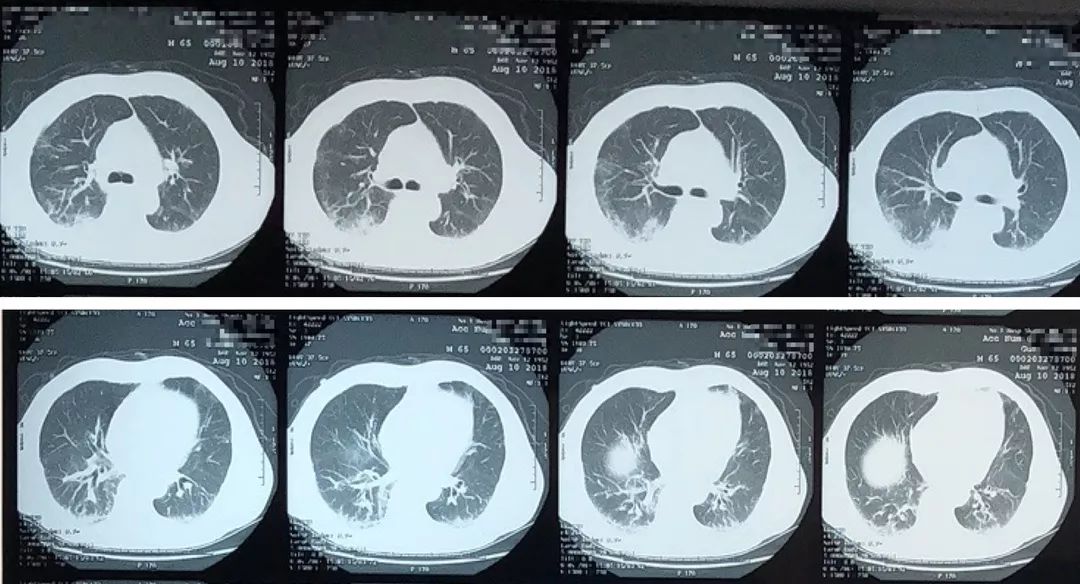
2018年8月10日胸部CT
复查胸部CT,双肺多发斑片状、磨玻璃密度增高影,以双下肺为著,左下肺病灶较前相比明显吸收,右下肺部分病灶范围较前增大。
鉴于肺部炎性病灶有吸收,中性粒细胞百分百下降,8月12日~8月21日调整抗感染治疗方案:头孢噻肟舒巴坦 3.0g ivgtt bid+莫西沙星 0.4g ivgtt qd。
但每日仍有发热,多于午后及夜间出现,体温波动于38~39.8℃,不伴畏寒、寒战,出现2次一过性晕厥,均与坐位时发生,无咳嗽、咳痰、呼吸困难。
完善风湿免疫相关实验室检查无明显异常。监测血细胞分析,中性粒细胞百分百进一步下降至77%。仍存在低钠、低氯血症。床旁气管镜检查见双侧支气管管腔内少量分泌物,粘膜充血水肿明显,灌洗液细菌培养、G试验、GM试验、抗酸染色等均为阴性。
肿瘤标志物:CA125 78.9U/ml,铁蛋白671.3ug/L。为进一步排查肿瘤可能,行PET-CT检查:双下肺小斑片影,较前相比感染病灶进一步吸收。全身未见肿瘤征象。
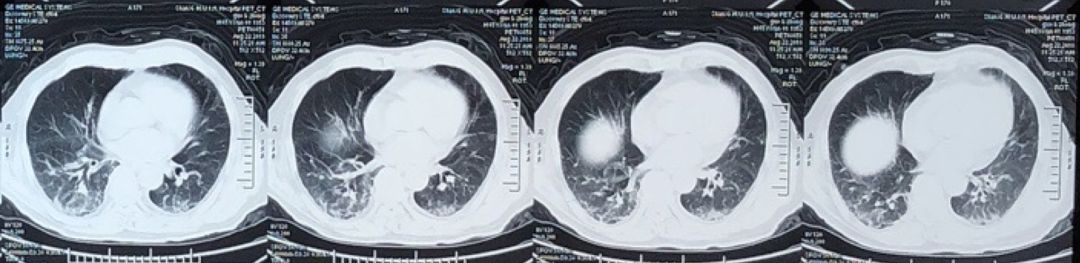
2018年8月21日PET-CT
8月22日至8月24日,治疗方案同前,患者体温较前下降,波动于37.5~38.8℃,精神状态良好,无呼吸道症状。
多学科会诊分析病情:由「体位性低血压」追问病史
近1月来反复高热,多种抗生素治疗效果差,肺部感染病灶明显吸收,炎症指标改善,抗生素治疗后体温较前下降,但每日仍有发热,合并顽固性低钠血症,尿量多,4000~6000ml/日,予以食物摄入、静脉补钠(6~12g/d)治疗,血钠水平维持在114~122mmol/L之间。停用抗生素仍有发热,药物热不符合。
请感染科、风湿免疫科、神经内科、消化科、内分泌科相关科室进行多学科疑难病例讨论。
神经内科会诊过程中,发现患者存在体位性低血压(卧位、立位血压相差>40mmHg),追问病史,患者在本次发热前2~3天自行减少抗帕金森药物左双多巴控释片的剂量(因患者沟通困难,具体减量情况不详)。患者高热、顽固性低钠血症、一过性晕厥、腹痛、腹泻等症状,考虑为帕金森病晚期非运动性症状常见的并发症。高热为抗帕金森药物减量过快引起的撤药综合征,导致体温调定点敏感性降低,继发中枢性高热。
查阅相关文献
帕金森病高热综合征(The Parkinsonism-Hyperpyrexia Syndrome,PHS),或抗帕金森药物撤药恶性综合征(NMS),是一种中枢多巴胺水平急剧减少或者停服抗帕金森药物后的神经生理反应。临床特征为肢体肌张力增高、意识障碍、高热、自主神经功能紊乱。
PHS的病理生理机制:1、中枢多巴胺能活性的突然抑制;2、中枢及外周交感神经活动以及中枢5-HT代谢的改变;3、突然停药后脑脊液中多巴胺代谢物高香草酸浓度的降低。
PHS的诱因:感染,摄入不足,脱水及肠梗阻
症状与体征:1、肌肉僵硬(伴或不伴震颤);2、发热(> 38℃);3、意识水平降低(昏迷);4、自主神经紊乱(血压不稳定,心动过速,出汗,尿失禁);5、构音障碍,吞咽困难
实验室检查:1、肌酸激酶增高;2、白细胞增多;3、肝功异常;4、代谢性酸中毒;5、血钠降低
并发症:1、急性肾功能衰竭;2、横纹肌溶解症;3、吸入性肺炎;4、深静脉血栓形成/肺血栓栓塞;5、弥散性血管内凝血;6、呼吸衰竭;7、癫痫发作
治疗措施
1、重新启动之前使用的多巴胺能药物,可以口服或者通过鼻饲管给药,如果存在鼻饲禁忌(如肠梗阻),基于左旋多巴治疗的患者可以静脉给药(50~100mg持续输注大于3小时)可以重复4次,直到患者可以口服药物;
2、根据临床表现可以给予溴隐亭 7.5~15mg/d,金刚烷胺 ,或静脉注射甲泼尼龙1g/d;
3、支持治疗:补液、降温、吸入性肺炎风险高的患者及早抗感染、呼吸支持;
4、肢体肌张力增高的患者:给予丹曲林钠(2~3mg/kg/d);丹曲林机制:骨骼肌松弛剂,具有抑制肌浆网中钙释放作用,对恶性高热有作用
5、密切监测肝肾功能、凝血因子、CK水平、尿肌红蛋白
预防
1、避免由于药物副作用而减少或者突然停服帕金森药物;2、避免脱水,尤其是在发热情况下;3、对于帕金森患者谨慎使用抗精神病药物
针对病因治疗情况
本病例调整抗帕金森药物为屈昔多巴,口服托伐普坦排水保钠治疗,停用抗生素,发热持续时间逐渐缩短,集中于傍晚及夜间发热,入睡后体温自行下降,体温波动于37~38.5℃,尿量逐渐减少,体位变化时收缩压差值减少(相差10mmHg左右),血清钠逐渐上升至133mmol/L。调整药物1周后好转出院。
病例诊治体会
该患者老年男性,基础疾病帕金森,入院时确实存在肺炎,考虑此为发热原因,经积极抗感染治疗,肺部炎症消散,最高体温有所下降,但每日仍有发热,使得诊治陷入僵局。最终通过多学科探讨,明确患者除感染以外,还有中枢性发热存在,即帕金森撤药恶性综合征表现之一。
总结疾病诊治经过
1、不明原因发热,需注意排查发热原因,尤其对于有神经系统基础疾病的患者,要注意中枢性发热。
2、询问病史要详细,本例患者因自身言语不畅,交流困难,未能及时获知其自行将抗帕金森药物减量。重视基础疾病,一些看似稳定的基础疾病,可能隐藏病因。
3、多学科诊疗(MDT)模式有助于开拓思路及疾病的诊断。
作者介绍

庞敏
博士,教授,硕士生导师。山西医科大学第一医院呼吸科病区副主任。中华医学会呼吸病学分会第九、十届青年委员会委员,中国医师协会呼吸医师分会教育工作委员会第一届委员会委员,中国慢阻肺联盟委员等。

闫薇
副主任医师,山西医科大学第一医院呼吸与危重症医学科,研究方向:肺血管疾病;支气管哮喘。


