
近年来,抗菌药物不合理使用,使得细菌耐药问题越来越严重,特别是多重耐药(MDR)菌出现,尤其是对碳青霉烯类抗菌药物的耐药问题,已成为威胁全球公共卫生健康的重要问题之一。
目前尚无新的针对性抗菌药物被研发,而多黏菌素作为最后一道防线用于临床上MDR革兰阴性菌感染的治疗,使其再度成为世界关注的焦点。然而,2015年我国首次报道质粒介导的多黏菌素耐药基因mcr-1出现,引起全球轰动,亦对临床感染性疾病的治疗提出了巨大挑战。
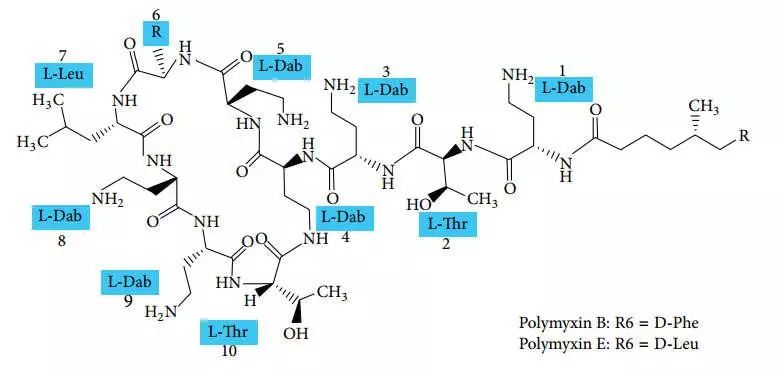
【图1】多黏菌素化学结构
一、多黏菌素作用机制
多粘菌素的抗菌作用机制尚存在争议,基于其生物物理研究已提出多种模型。目前公认其抗菌作用机制分两个阶段:首先,在液体环境下,带正电荷的多粘菌素与外膜(outermembrane,OM)上带负电荷类脂 A 发生静电结合,导致外膜膨胀;随后,通过「自促摄取」机制透过外膜,破坏细胞膜磷脂双层的物理完整性,导致渗透失衡,使细胞内的核苷酸、氨基酸、磷酸盐等重要成分外漏,抑制细菌的生长或导致细菌死亡。
二、多黏菌素耐药机制
1、染色体介导的多黏菌素耐药
革兰氏阴性菌对多黏菌素的耐药分为先天性耐药和获得性耐药。多黏菌素 B 和多黏菌素E存在交叉耐药,以往的研究发现,多黏菌素的耐药机制主要由染色体介导产生(见图2 [9])。
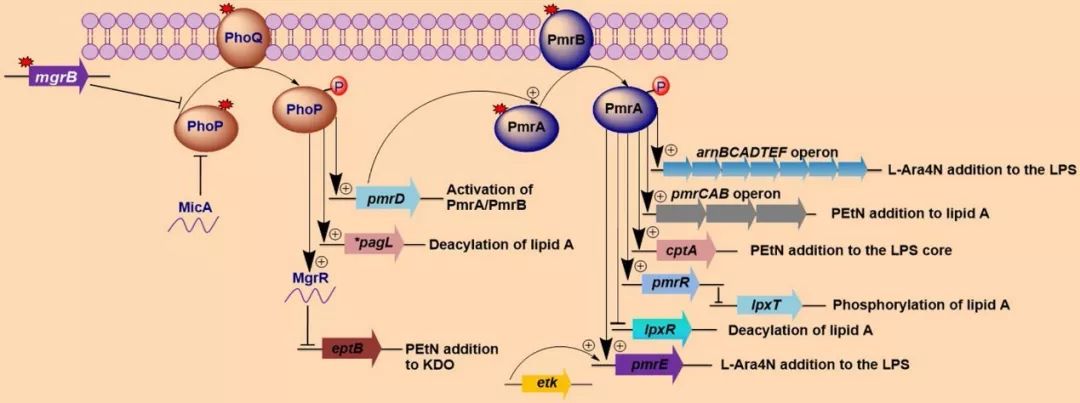
【图2】多黏菌素的耐药机制
(1)脂多糖修饰(lipopolysaccharide modifications)是革兰阴性菌对多黏菌素主要耐药机制(见图3)。带正电荷的4-氨基-4-去氧-L-阿拉伯糖(4-amino-4-deoxy-L-arabinose,L-Ara4N)或磷酸乙醇胺( phosphoethanolamine ,PEtN)修饰脂质 A 带负电荷的磷酸基团,前者强于后者,使脂多糖表面总净负电荷减少,从而降低多黏菌素与细菌外膜的静电作用,减弱多黏菌素与细菌初始结合位点的结合力,继而耐药。这主要通过调节PhoP/PhoQ 和PmrA/PmrB 双元件系统(two-component system,TCS)来抵抗阳离子抗菌肽。TCSs 由外界环境刺激或内部特定基因的突变而被激活,引起LPS结构修饰的改变,从而降低多黏菌素与细胞外膜的亲和性。
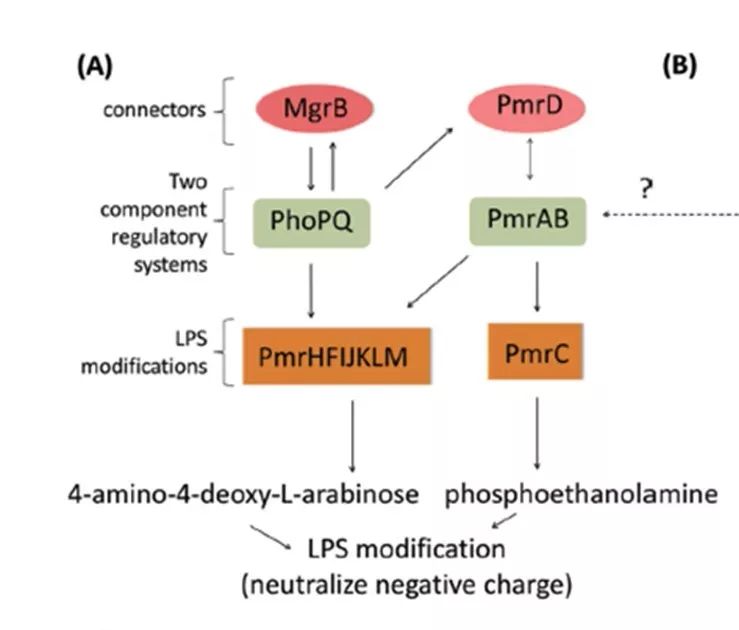
【图3】脂多糖修饰机制
(2)外排泵机制:一类特殊的存在于革兰阴性菌细胞膜上转运蛋白,将细胞膜周质间隙的多黏菌素排到细胞外,减少与内膜发挥抗菌作用的药物浓度,从而导致耐药。
(3)过度表达细胞外膜蛋白 OprH,导致低水平耐药。有研究显示在铜绿假单胞菌中,无论是低K+外界环境还是本身基因突变所导致的外膜蛋白OprH高表达,都会引起细菌对多黏菌素耐药。
(4)有研究表明鲍曼不动杆菌、肺炎克雷伯菌和铜绿假单胞菌对多黏菌素存在异质性耐药。
2、质粒介导的多黏菌素耐药
2015年底,中国学者Liu等第一次报道质粒介导的多黏菌素耐药基因mcr-1(mobile colistin resistance),并由接合试验证实该基因可通过接合性质粒在细菌间传播。为了鉴定导致多粘菌素抗性的基因,对质粒pHNSHP45(GenBank登录号KP347127)进行了完全测序,结果显示质粒为64015bp,平均GC含量43.0%,见图4。迄今发现的mcr-1基因多位于细菌质粒上,主要包括下列不相容性分型的质粒:IncI2、IncI1、IncHI2、IncHI1、IncP、IncX4、IncFI、IncFII、IncN和IncK等。质粒大小不一(32~400kb),以IncI2和IncX4最常见,世界多国有报道。Laurent等通过对mcr-1阳性的序列进行比对提出mcr-1位于一个2607bp的称作「mcr-1 cassette」的结构上,该结构能够整体移动,拥有自己的启动序列。
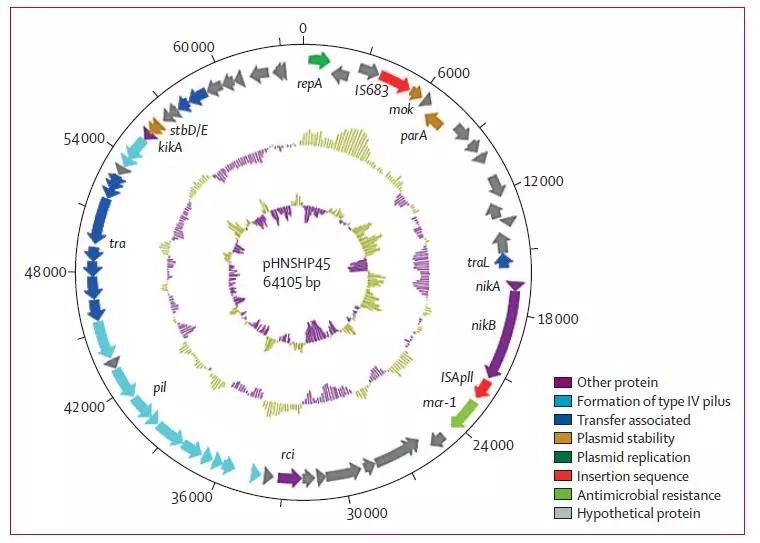
【图4】大肠杆菌SHP45携带mcr-1基因质粒pHNSHP45的结构
三、多黏菌素耐药现状
由于质粒介导的mcr-1基因可以在不同菌株间进行水平传播,致使动物源性多黏菌素类药物耐药率趋高,而临床有关携带mcr-1多黏菌素耐药菌株的报道也随之增多。大肠埃希菌为携带mcr-1 的最常见菌种,自mcr-1 报道以来,肠杆菌科中的其他细菌也陆续有mcr-1 的检出,包括肺炎克雷伯菌、沙门菌、阴沟肠杆菌和弗氏枸橼酸杆菌等10余种。携带mcr-1的菌种具有多样性,其分布也具有广泛性。mcr-1 阳性菌已遍布世界五大洲,目前在世界 30 多个国家已有mcr-1的报道。其中,亚洲mcr-1 的流行现状最为严峻,mcr-1检出率高于欧洲等其他国家和地区。从国内水平来看,mcr-1 广泛分布于我国多个城市和地区。
Liu等对2007~2016年我国CARST细菌耐药监测网从全国28家三级甲等医院收集的3854株大肠埃希菌和2410株肺炎克雷伯菌进行mcr-1基因检测。3854株大肠埃希菌中,共筛选出34株mcr-1阳性菌,2007~2008年、2009~2010年均未有mcr-1的检出,2011~2012年、2013~2014年和2015~2016年mcr-1检出率分别为1.44%、1.37%和1.80%,十年间零散检出5株mcr-1阳性肺炎克雷伯菌。2014~2015年全球SENTRY监测结果显示,大肠埃希菌分离株中mcr-1的检出率升高(32.2%的粘菌素耐药菌株检测出mcr-1),但SENTRY调查的总菌数中检出率非常低(<0.1%),所有肺炎克雷伯菌分离株都没有检测到mcr-1。
我国于2017年4月1日起,全面禁止多黏菌素作为饲料添加剂应用于畜禽业,多黏菌素在我国尚未正式投入临床使用,在此情况下即产生了mcr-1的全国范围内流行,应当引起高度重视。在当前细菌耐药形势严峻的情况下,多黏菌素这个「老抗菌药」虽然发展艰难,但它仍被认为是一种治疗多重耐药革兰阴性菌感染的有效药物,在临床上市成为必然趋势。
主要参考文献
[1] Liu YY, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161-168.
[2] Shang D,Zhang Q,Dong W, et al. The Effects of Lps on the Activity of Trp-containing Antimicrobial Peptides Against Gram-negative Bacteria and Endotoxin Neutralization[J]. Acta Biomaterialia. 2016, 33: 153-165.
[3] Olaitan AO, Rolain J-M. Interruption of mgrB in the mediation of colistin resistance in Klebsiella oxytoca[J]. International Journal of Antimicrobial Agents. 2015,46(3):354-355.
[4] Wang Y, Tian G B, Zhang R, et al. Prevalence, risk factors,outcomes, and molecular epidemiology of mcr-1-positiveEnterobacteriaceae in patients and healthy adults fromChina: An epidemiological and clinical study[J]. Lancet Infect Dis, 2017, 17(4): 390-399.
[5] Poirel L, Kieffer N, Brink A, et al. Genetic features ofMCR-1-producing colistin-resistant Escherichia coli isolates in South Africa[J]. Antimicrob Agents Chemother, 2016, 60(7): 4394-4397.
[6] Xiangjun Liu, Yang Wang, Lanqing Cui, et al. A retrospective study on mcr-1 in clinical Escherichia coli and Klebsiella pneumoniae isolates in China from 2007 to 2016 [J]. Antimicrob Chemother 2018,73:1786–1790.


