一、病情介绍
患者女,65岁,2022年12月因口干就诊于当地医院,外院检查血常规提示贫血,激素治疗后口干改善,贫血持续加重,完善骨穿后提示急性白血病(不除外AML,M2可能性大)。
2月24日胸部CT:双肺轻度间质病变或坠积效应,用药后体温未控制,为进一步治疗,于2023年2月27日收入院内。
既往史:高血压病史10余年,2017年行腰椎间盘手术,2022年左下肢骨折,保守治疗。
入院检查:体温:39℃,心率:76次/min,呼吸:18次/min,血压:134/78mmHg(1mmHg=0.133kPa)
二、一般实验室检查
患者入院期间WBC、RBC、 Hb 、Plt检查结果见(Table.1),入院以来患者CRP一直处于一个较高水平,直到3月20日才趋于正常(Table.2)。
Table.1 患者入院期间WBC、RBC、 Hb 、Plt检查结果
Table.2 患者入院期间CRP结果
三、微生物学检查
2023年3月3日送检痰标本3份进行真菌培养及涂片,涂片结果为 :真菌直接涂片找到真菌孢子。
在沙保弱培养基(SDA)35℃培养3天后可见黑色黏状菌落,边缘光滑,初起表现为潮湿、有光泽的酵母样菌落(图A)。基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS)鉴定结果显示为皮炎外瓶霉(Exophiala dermatitidis,Ed)(图B)。革兰染色可见卵圆形酵母样出芽孢子及菌丝(图C)。继续培养7天左右变成羊毛状,该菌产生气生菌丝,形成短绒状菌落(图D)。乳酸棉兰染色镜下观察,在菌丝末端和侧面生长环痕梗,呈圆桶形或瓶形,环痕孢子椭圆形聚集在环痕梗顶端聚集成球形(图E、F)。本文未能在显微镜下找到典型的环痕产孢结构,图G为典型的环痕孢结构(王端礼.医学真菌学)。
药敏试验:采用E-test方法,将真菌孢子在0.9%的无菌生理盐水中配置为0.5麦氏浊度,选用RPMI 1640培养基进行药敏试验。28℃48h后读取E-test条结果。两性霉素B的MIC值为1.5mg/L、伊曲康唑MIC值为1.5mg/L、伏立康唑MIC值为0.064mg/L、泊沙康唑MIC值为0.38mg/L。
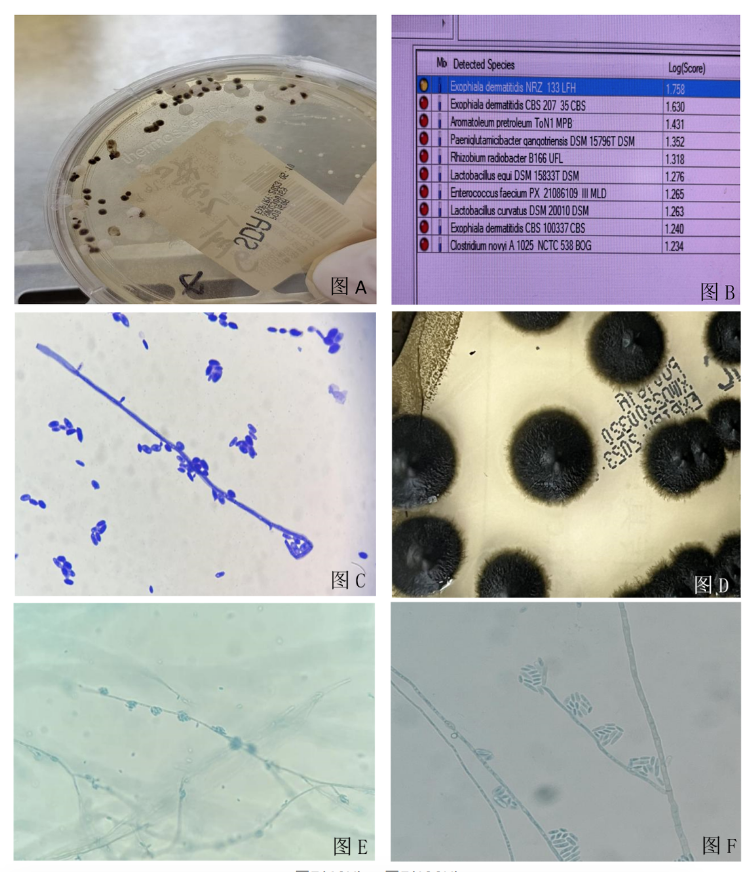
图E(40X) ;图F(100X)
四、诊疗过程
2月27日患者入院前一直口服索拉非尼(0.4/0.2g),入院时发热,给予美平+万古霉素进行抗感染治疗。
3月3日临床送检3份痰标本真菌培养。此时体温仍未得到控制。
3月4日患者明确诊断AML, 索拉非尼+阿扎胞苷进行治疗。胸部CT提示双肺存在局限性膨胀不全或陈旧性病灶,双侧胸腔积液。考虑可能存在不典型病原体。患者体温仍未控制,临床更换舒普深继续抗感染治疗。
3月7日更换莫西沙星+万古霉素,体温相较之前得到控制。
3月9日检验科通知临床:患者3月3日送检痰标本检出酵母样真菌。临床增加医嘱:泊沙康唑TID1(8-12-4) 口服单次剂量5ml,及临时医嘱:泊沙康唑105ml ONCE。
3月15日胸部CT平扫对比提示双肺存在局限性膨胀不全或陈旧性病灶,较前无明显变化,双侧胸腔积液较前部分吸收。
3月20日检验科微生物报告痰标本检出皮炎外瓶霉。
3月28日患者情况好转出院,并定期来医院化疗。
3月30日患者门诊留取痰标本进行真菌培养,结果:培养5天,未检出真菌。
五、病程总结
患者3月4日胸部CT结果提示患者存在肺部感染。本患者情况比较特殊,3月5日在患者骨髓抑制期临床经验性使用抗真菌药物泊沙康唑,皮炎外瓶霉的药敏结果也显示泊沙康唑有较低的MIC值,可能导致患者后来的标本再次送检的时未能检出,3月15日患者的胸部CT 结果也较之前有所改善。此前国内外也有部分文献报道皮炎外瓶霉引起患者肺部感染,虽然病例数相对较少,但我们也应该提起重视(Table.3)。尤其是患者在化疗期间,免疫力低下,一些潜在的条件致病菌有可能就成为致病菌,进而加重患者病情。
Table.3 2010年以来国内外皮炎外瓶霉肺部感染相关报道
六、思考
皮炎外瓶霉(Exophiala dermatitidis,Ed)又称黑酵母,是一种暗色真菌,广泛分布于自然环境和人类环境中,其特征是细胞壁中存在黑色素,并能够从酵母样状态转换到菌丝状态。在正常人中较少致病,但在免疫力低下的人群中,该菌可导致临床严重的暗色丝孢霉病,包括肺部、皮肤及皮下、中枢神经系统及眼部感染。在这里,我们报告一例在急性髓性白血病患者痰液中检出该菌的过程并对该菌进行一系列分析。
皮炎外瓶霉在1937年首次由Kano从一名日本妇女面颊损伤处分离出。该菌是二形态暗色真菌,典型形态特征是瓶梗无领口状结构,以环痕产孢方式为主,可特征性的在40℃生长,不能同化硝酸盐。其在免疫抑制人群中可导致暗色丝孢霉病,在免疫功能正常的人群可引起着色芽生菌病和致命的中枢神经系统感染。
目前关于皮炎外瓶霉毒力因子的研究有以下几个观点:
黑素,作为黑色酵母细胞壁的一部分,是已知的皮炎外瓶霉致病性的一个主要因素,其对皮炎外瓶霉具有保护性作用,可以增强抵抗宿主防御和抗感染治疗。黑素还可以抑制促炎症细胞因子IL-1b、IL-6、TNF的产生从而发挥免疫抑制作用。Ed还可通过改变黑素电子特性,利用电磁辐射及代谢过程中产生的能量从而促进自身生长。
生物膜不仅可以帮助真菌抵御机体的免疫作用,还可以通过发挥屏障作用等一系列机制阻碍真菌药物作用,这也是患者反复感染的主要原因。有报道称在水龙头、淋浴喷头或洗碗机等环境和临床样本中都有检出。
细胞色素P450(cytochrome P450,CYP),参与真菌初级、次级、外源性代谢的多个过程,在真菌致病性中发挥重要作用。研究指出,皮炎外瓶霉具有较高CYP基因比例,有助于其在恶劣环境中生存。
真菌培养联合ITS或其他基因位点测序已成为被推荐的皮炎外瓶霉的鉴定方法。有研究表明,通过对众多参考菌株的核rDNA ITS测序,证实了存在两个显著的基因型,即基因型A和B在ITS1的三个位置不同(162 bp、184 bp和196 bp )。所有菌株对两性霉素B、伊曲康唑、伏立康唑、咪康唑和泊沙康唑均有较高的抗真菌敏感性,不同基因型和分离区之间均无差异。
皮炎外瓶霉受到其缓慢生长行为的限制,常存在细菌过度生长的风险,所以目前常推荐使用选择性培养基,通过抑制细菌生长提高分离率。值得注意的是,目前还没有可用的标准化肉汤微量稀释方法或经验证的MIC折点用于体外耐药性测试。两性霉素B和伊曲康唑由于对中枢神经系统的最佳渗透不足,在脑脊液中分布相对有限,多数使用这些药物治疗的患者的预后较差,可能导致治疗失败。相比之下,伏立康唑和泊沙康唑具有良好的脑渗透性,因此,可能为Ed引起的播散性真菌病提供额外的治疗选择。有文献表明,棘白菌素对Ed感染无效,只有氟康唑与伏立康唑、两性霉素B或伊曲康唑联合使用对该真菌具有协同活性。
综上,随着低免疫力人群的增多,越来越多的少见菌被临床发现,及时检出并与临床有效沟通就显得尤为重要。随着分子技术的不断发展,如何将这些分子技术与临床微生物培养相结合,成为我们应该思考的问题。因此,作为一名检验人,要不断学习提高自身检验水平,不漏掉任何一个可疑的致病菌。
参考资料 (可上下滑动浏览)
[1] Setoguchi D, Iwanaga N, Ito Y. Pulmonary phaeohyphomycosis due to Exophiala dermatitidis in a patient with pulmonary non-tuberculous mycobacterial infection. J Infect Chemother. 2023 Mar 13:S1341-321X(23)00070-3. doi: 10.1016/j.jiac.2023.03.010. Epub ahead of print. PMID: 36921763.
[2] 王端礼.医学真菌学[M].北京:人民卫生出版社,2005:338.
[3] Alimu Y, Ban S, Yaguchi T. Molecular Phylogenetic Study of Strains Morphologically Identified as Exophiala dermatitidis from Clinical and Environmental Specimens in Japan. Med Mycol J. 2022;63(1):1-9. doi: 10.3314/mmj.21-00012. PMID: 35228479.
[4] Nakatani R, Ashiarai M, Yoshihara H. Multidisciplinary management of disseminated Exophiala dermatitidis mycosis in an infant with mixed phenotype acute leukemia: a case report. BMC Infect Dis. 2022 Oct 23;22(1):797. doi: 10.1186/s12879-022-07773-w. PMID: 36274136; PMCID: PMC9590134.
[5] Mpakosi A, Siopi M, Demetriou M. A fatal neonatal case of fungemia due to Exophiala dermatitidis-case report and literature review. BMC Pediatr. 2022 Aug 10;22(1):482. doi: 10.1186/s12887-022-03518-5. PMID: 35948953; PMCID: PMC9364490.
[6] Ayling-Smith J, Speight L, Dhillon R. The Presence of Exophiala dermatitidis in the Respiratory Tract of Cystic Fibrosis Patients Accelerates Lung Function Decline: A Retrospective Review of Lung Function. J Fungi (Basel). 2022 Apr 7;8(4):376. doi: 10.3390/jof8040376. PMID: 35448607; PMCID: PMC9031959.
[7] Watanabe Y, Sano H, Konno S. Sinobronchial Syndrome Patients with Suspected Non-Tuberculous Mycobacterium Infection Exacerbated by Exophiala dermatitidis Infection. Infect Drug Resist. 2022 Mar 20;15:1135-1141. doi: 10.2147/IDR.S359646. PMID: 35340672; PMCID: PMC8948093.
[8] Li Z, Tang J, Zhu J. The convoluted process of diagnosing pulmonary mycosis caused by Exophiala dermatitidis: a case report. BMC Infect Dis. 2022 May 4;22(1):433. doi: 10.1186/s12879-022-07399-y. PMID: 35509001; PMCID: PMC9069750.
[9] 高青波,张蓓蕾,陈成.慢阻肺急性加重合并皮炎外瓶霉感染2例及文献复习[J].临床肺科杂志,2020,25(08):1287-1289.
[10] Tzar MN, Meor Jamaludin WHB, Abdul Wahab A. Exophiala dermatitidis, 'the real black fungus' fungemia in a patient with COVID-19. IDCases. 2022;27:e01428. doi: 10.1016/j.idcr.2022.e01428. Epub 2022 Jan 29. PMID: 35127454; PMCID: PMC8800164.
[11]Sekiguchi R, Urabe N, Sakamoto S. Exophiala dermatitidis pneumonia with bronchiectasis required prolonged voriconazole treatment. Respirol Case Rep. 2021 May 25;9(6):e00783. doi: 10.1002/rcr2.783. PMID: 34084534; PMCID: PMC8144837.
[13] Suzuki K, Nakamura A, Fujieda A, Nakase K, Katayama N. Pulmonary infection caused by Exophiala dermatitidis in a patient with multiple myeloma: A case report and a review of the literature. Med Mycol Case Rep. 2012 Oct 17;1(1):95-8. doi: 10.1016/j.mmcr.2012.10.002. PMID: 24371750; PMCID: PMC3854633.
[14] Mukai Y, Nureki S, Hata M. Exophiala dermatitidis pneumonia successfully treated with long-term itraconazole therapy. J Infect Chemother. 2014 Jul;20(7):446-9. doi: 10.1016/j.jiac.2014.02.006. Epub 2014 Apr 22. PMID: 24767462.
[15] Radonjic A, Pakhale S, Aaron SD, Earlam K, Gaudet E, Gomes MM, Gupta A, Mulpuru S, Chin M. Organizing pneumonia secondary to Exophiala dermatitidis in cystic fibrosis: A case report. J Cyst Fibros. 2020 Sep;19(5):e33-e35. doi: 10.1016/j.jcf.2019.12.010. Epub 2020 Jan 17. PMID: 31959463.
作者简介
陈蕊
医学硕士,检验技师,就职于河北省沧州中西医结合医院实验诊断科,从事临床微生物工作2年。自2023年2月于北京大学人民医院检验科进修,为期半年。
安柳璇
主管检验师,就职于石家庄市中医院检验科,从事临床微生物工作2年。自2023年2月于北京大学人民医院检验科进修,为期半年。
作者:陈蕊(河北省沧州中西医结合医院)、安柳璇(石家庄市中医院);审校:王占伟(北京大学人民医院)
本文转载自订阅号「京港感染论坛」(ID:PIDMIC)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


