随着SARS-CoV-2不断变异,特别是delta病毒株的出现,各种新冠疫苗保护效力呈不同程度下降。此外,迄今还没有针对致死率高达11%的SARS-CoV-1的有效疫苗,而且源于蝙蝠、穿山甲等宿主的其他冠状病毒可能再次跨物种传播,引起大流行。因此,我们亟需开发一种广谱疫苗,其不仅能够免疫现有和未来SARS-CoV-2变异株,而且可能预防尚未传播至人类的其他冠状病毒感染。
北京时间2021年8月19日凌晨,《新英格兰医学杂志》(NEJM)在线发表一项来自杜克-新加坡国立大学医学院(Duke–NUS Medical School)的研究[1],其结果表明SARS-CoV-1感染幸存者在接种mRNA新冠疫苗BNT162b2后,体内出现了高水平交叉反应型抗体。这些抗体不仅能够高效中和SARS-CoV-1以及目前已知的几种SARS-CoV-2变异体(alpha、beta、delta),而且能够中和5种以蝙蝠和穿山甲为宿主的sarbecovirus亚属其他冠状病毒。这项研究为广谱抗冠状病毒疫苗的研发带来了希望。
《NEJM医学前沿》邀请了复旦大学华山医院感染科主任张文宏教授、复旦大学基础医学院应天雷教授从临床和科研两个角度点评这项重要研究(见文末)。
在这项研究中,研究团队招募了8名感染过SARS-CoV-1的受试者,为其接种BNT162b2 mRNA疫苗。这些受试者体内能检测到SARS-CoV-1中和抗体,但检测不到或只能检测到低水平SARS-CoV-2中和抗体。
在接种2剂疫苗后,8名受试者的体内均能检测到非常高水平的交叉反应型抗体,对SARS-CoV-1以及SARS-CoV-2都呈现中和效应。其中,有2名受试者在接种1剂后的中和抗体水平就已经对SARS-CoV-2呈现饱和抑制;而其余6名受试者在接种2剂后也达到了相同的中和抗体水平。
受试者体内产生的交叉反应型抗体是否具有广谱抗病毒效应?它们能否中和sarbecovirus亚属的其他冠状病毒?带着这样的问题,研究人员从sarbecovirus亚属的系谱中挑选了10种病毒,包括来自SARS-CoV-1分支的3种(SARS-CoV-1,蝙蝠WIV1和蝙蝠RsSHC014)以及SARS-CoV-2分支的7种(SARS-CoV-2,SARS-COV-2变异体B.1.1.7 [alpha]、B.1.351 [beta]、B.1.6172 [delta],蝙蝠冠状病毒RaTG13、穿山甲冠状病毒GD-1和GX-P5L)。
除了采纳上文所提到的SARS-CoV-1幸存者未接种疫苗(SARS-CoV–1patients)以及幸存者接种1剂BNT162b2后的血清(SARS-CoV-1–vaccinated),研究人员还采纳了健康受试者接种2剂BNT162b2后的血清(Healthy–vaccinated),SARS-CoV-2幸存者未接种疫苗(SARS-CoV-2–patients)以及幸存者接种2剂辉瑞疫苗后的血清(SARS-CoV-2–vaccinated)。研究表明,只有SARS-CoV-1–vaccinated组对10种病毒都有100%的抑制效率(图1)。
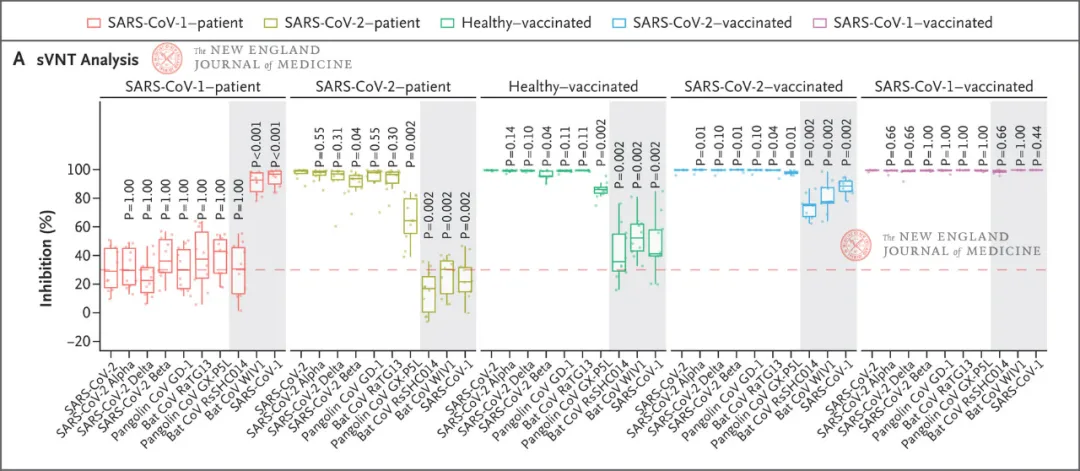
图1:不同来源血清对于10种sarbecovirus亚属冠状病毒的抑制率[1]。
为测定50%中和抗体滴度(NT50),研究人员稀释了各组血清样本。他们发现,SARS-CoV-1–vaccinated组不仅对于SARS-CoV-1分支的3种病毒有较高NT50值,而且对于SARS-CoV-2分支的7种病毒也有相当水平的NT50值;而SARS-CoV-2–vaccinated组仅对SARS-CoV-2分支的病毒有较高NT50值。
这两个实验证实SARS-CoV-1–vaccinated组产生的交叉反应型抗体对sarbecovirus亚属的冠状病毒存在广谱抗病毒效应。研究团队认为在SARS-CoV-1–vaccinated组血清中检测到高水平交叉反应型抗体是「初始-加强」(prime-boost)免疫的结果。为了验证这个猜想,他们采用了两种手段。
首先,他们用多克隆抗体5B7D7与SARS-CoV-1–vaccinated组的血清进行竞争实验,这种多克隆抗体能够中和上文提到的10种病毒。研究发现,在多克隆抗体竞争下,SARS-CoV-1–vaccinated组是唯一对所有病毒保持高水平抑制的血清样本。
他们进一步通过SARS-CoV-1和SARS-CoV-2的受体结合区域(RBD)蛋白对血清中的B细胞进行染色处理,并用流式细胞术检测双阳细胞比例。如图2所示,SARS-CoV-1–vaccinated组中的双阳细胞比例明显比其他血清样本高。

图2:双阳细胞比例[1]。
目前已知sarbecovirus亚属的所有人畜共患冠状病毒均通过RBD与人2型血管紧张素转换酶(hACE2)相互作用进入人体。此外,有研究表明亚属内不同病毒RBD结构和功能改变都是有限的。这也就解释了为什么本研究受试者体内的中和抗体可以呈现交叉反应性。
研究团队表示未来还需要进行更全面研究,因为本研究数据只限于SARS-CoV-1幸存者接种基于SARS-CoV-2刺突蛋白S的mRNA疫苗后产生的中和抗体水平。他们将在SARS-CoV-1幸存者中接种基于RBD蛋白的疫苗,以及在SARS-CoV-2幸存者中分别接种基于RBD和S蛋白的疫苗,考察这些处理是否也会产生高水平的广谱交叉反应型抗体。
如果成功的话,这将为开发第三代Covid-19疫苗,为控制当前和新出现的SARS-CoV-2变异株以及预防未来的sarbecovirus亚属冠状病毒大流行奠定坚实基础。
张文宏
复旦大学附属华山医院感染科
新冠病毒变异株在一定程度上逃逸了目前新冠疫苗的免疫保护。基于此,我们希望能找到一种新型疫苗接种策略,可以预防目前已知和未来可能出现的新冠变异株,或其他潜在感染人类的冠状病毒。该研究给SARS感染恢复者接种了BNT162b2疫苗,发现与单纯BNT162b2免疫或SARS感染比较,可以有效诱导出针对跨进化枝的泛冠状病毒中和活性,即不仅能够中和目前的新冠突变株,还能够中和在蝙蝠和穿山甲中已发现的其他冠状病毒(Sarbecovirus亚属,均与SARS或SARS-CoV2相近),相对具有广谱性。
未来的疫苗接种策略中,如何通过疫苗诱导出广谱中和抗体依然是科学难题。 在既往HIV研究中,通过人免疫球蛋白基因区转基因小鼠模型,科学家们按照一定顺序使用不同基因型HIV包膜蛋白作为免疫原依次接种,可以诱导出广谱中和抗体[2] 。但是,该策略需要对每一次免疫后的中和谱系进行细致评价,以判断使用何种HIV包膜蛋白进行下一轮免疫,从而达到精准疫苗免疫[3,4] 。因此,以目前HIV研究中发现的现象来看,如何能诱导出针对冠状病毒的广谱中和抗体,
这篇NEJM研究虽然提出了可能的科学数据,但哪种免疫原顺序可以诱导出最优广谱中和活性,仍有待大量研究和科学的探索。
总结而言,
这篇研究对目前及未来可能的其他冠状病毒或新冠变异株流行的疫苗接种策略提供了新的思路。但是基于序贯免疫的疫苗接种策略能在多大程度上对未来的新发冠状病毒感染进行保护,仍然需要大量的后续研究。
应天雷
复旦大学医学分子病毒学教育部/卫健委重点实验室;
上海市重大传染病和生物安全研究院
新冠病毒近期不断出现变异,有些变异毒株在全球大肆流行,使目前上市的疫苗保护能力均显著降低,完全逃逸部分已上市的中和单抗新冠药物。显然,新冠病毒免疫逃逸是人类与新冠病毒战争中面临的最严峻挑战。实际上,对冠状病毒来说,免疫逃逸是一个普遍现象,在当初SARS-CoV-1冠状病毒、MERS-CoV冠状病毒第二波疫情中,均发生突变株对之前中和抗体的逃逸现象。如何开发具有冠状病毒广谱效力的疫苗和中和抗体,有效应对新冠病毒的不断突变以及预防以往冠状病毒的再次爆发,是科学界一直面临的重大科学问题。
新冠病毒、SARS-CoV冠状病毒以及蝙蝠等野生动物中存在的大量冠状病毒都属于Sarbe冠状病毒(sarbecoviruse)亚属。为了评价先前暴露于Sarbe冠状病毒亚属的人群是否可以通过免疫不同进化枝上的病毒的疫苗,从而诱导出广谱的pan-sarbecoviruse中和抗体,此项研究根据人群接种新冠病毒mRNA疫苗(BNT162b2)情况以及既往冠状病毒感染情况划分为5组:未接种新冠疫苗的SARS-CoV幸存者,未接种新冠疫苗的SARS-CoV-2幸存者,接种新冠疫苗的健康人,接种新冠疫苗的SARS-CoV-2幸存者,接种新冠疫苗的SARS-CoV幸存者。研究者采集了这5组人群的血浆并采用基于sVNT的高通量方法检测这些血浆对多种不同的sarbecoviruse病毒株的中和能力,包括SARS-CoV、新冠病毒及其变异体。
非常有意思的是,研究者通过检测首次发现,接种了新冠疫苗的SARS-CoV幸存者血浆中具有更高水平和更广谱的中和抗体,对所有测试的冠状病毒都有很强的中和能力。而其他4组人群的血浆只对其暴露的同源病毒有很强的中和作用。因此,
该研究提出利用序贯免疫的方法对人群注射两种不同病毒的S或RBD蛋白,有望作为新一代Covid-19疫苗用于控制变异株以及未来可能出现的冠状病毒疫情。虽然机制还待进一步深入研究,但这个发现为新冠广谱疫苗与抗体的研发提供了新的思路,具有较强的潜在临床转化价值。
参考文献
1. Tan CW, Chia WN, Young BE, et al. Pan-sarbecovirus neutralizing antibodies in BNT162b2-immunized SARS-CoV-1 survivors. N Engl J Med 2021;DOI: 10.1056/NEJMoa2108453 (Epub ahead of print).
2. Verkoczy L. Humanized immunoglobulin mice: models for HIV vaccine testing and studying the broadly neutralizing antibody problem. Adv Immunol 2017;134:235-52.
3. Chen XJ, Zhou TQ, Schmidt SD, et al. Vaccination induces maturation in a mouse model of diverse unmutated VRC01-class precursors to HIV-neutralizing antibodies with >50% breadth. Immunity 2021;54:324-39.
4. Wang SS, Fink JM, Kriegsman B, et al. Manipulating the selection forces during affinity maturation to generate cross-reactive HIV antibodies. Cell 2015;160:785-97.
本文转载自订阅号「NEJM医学前沿」(ID:NEJM-YiXueQianYan)
版权信息:本文由嘉会医学研究和教育集团(J-Med)与《新英格兰医学杂志》(NEJM)联手打造的《NEJM医学前沿》翻译、编写或约稿。中译全文及所含图表等由NEJM集团独家授权。如需转载,请联系nejmqianyan@nejmqianyan.cn。未经授权的翻译是侵权行为,版权方保留追究法律责任的权利。
本文完
排版:Jerry


