引用本文: 中华医学会呼吸病学分会, 中国医师协会呼吸医师分会. 中国成人2019冠状病毒病的诊治与防控指南 [J/OL] . 中华医学杂志,2021,101 (2021-02-04).http://rs.yiigle.com/yufabiao/1308465.htm. DOI: 10.3760/cma.j.cn112137-20210112-00090.[网络预发表].
2019冠状病毒病(coronavirus disease 2019,COVID-19;又称新型冠状病毒肺炎)大流行是全球瞩目的公共卫生问题。尽管我国已初步控制住了COVID-19疫情,但是由于目前全球疫情加速蔓延,境外输入、冷链传播、病毒株变异等因素导致本地传播的风险增大,我国可能在未来一段时间内仍处于疫情散发状态,并且局部地区可能出现聚集性病例。目前COVID-19临床诊疗已积累了大量证据,我国亟需一部符合国情的循证诊治与防控指南,以期更好地指导我国COVID-19患者的救治与疫情防控。为此,中华医学会呼吸病学分会(Chinese Thoracic Society,CTS)与中国医师协会呼吸医师分会(Chinese Association of Chest Physicians,CACP)组织多学科专家制订了本指南,旨在进一步规范我国成人COVID-19患者的诊治与防控。
第一部分:方法学
本指南的制订遵循世界卫生组织(World Health Organization,WHO)2014年发布的《世界卫生组织指南制订手册》[1]及2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》[2],并依据国际实践指南报告标准(Reporting Items for Practice Guidelines in Healthcare,RIGHT)[3]和指南研究与评价(Appraisal of Guidelines for Research and Evaluation Ⅱ,AGREE Ⅱ)工具撰写全文[4]。本指南已在国际实践指南注册平台(International Practice Guideline Registry Platform)上注册(注册号IPGRP-2020CN187)。
一、指南制订发起机构
该指南由CTS与CACP发起,兰州大学健康数据科学研究院指南与标准研究中心、中华医学会杂志社指南与标准研究中心、WHO指南实施与知识转化合作中心、兰州大学GRADE中心、Cochrane兰州大学中心提供方法学支持。
二、指南工作组
本指南制订工作组由指南专家组、指南方法学组、指南协调组构成。
指南专家组:由呼吸与危重症医学、感染病学、重症医学、病毒学、免疫学、病理学、流行病学、输血医学、预防医学、康复医学等多学科专家构成,主要职责为:(1)确定指南范围及优先的临床问题;(2)各专家对各自负责的章节进行文献检索和证据评价,拟定初步推荐意见;(3)根据指南方法学组和指南协调组的反馈对初步推荐意见进行修改;(4)通过Delphi法共识最终推荐意见;(5)审定指南全文初稿和终稿。
指南方法学组:由指南方法学家和循证医学专家构成。主要职责为:(1)协助确定指南范围及优先的临床问题;(2)确定适用于本指南的证据评价和推荐意见形成的方案;(3)总结目前COVID-19指南的推荐意见,供专家组参考;(4)对专家组进行方法学培训,明确指南证据检索与评价方法以及推荐意见的撰写规范;(5)与指南协调组合作审核初步推荐意见;(6)提供必要的其他方法学支持。
指南协调组:主要职责为:(1)协助确定指南范围及优先的临床问题;(2)撰写指南计划书;(3)收集利益冲突声明;(4)制订指南工作计划、推动指南工作计划的执行;(5)协助专家组进行文献检索和初稿撰写;(6)和指南方法学组合作审核初步推荐意见;(7)进行整个指南制订过程的质量控制。
指南外审组:指南外审组由不参与指南制订的相关学科专家构成。指南初稿形成后,指南外审组阅读并反馈意见。
三、利益冲突声明与管理
本指南工作组成员均填写利益声明表,声明近3年相关的经济利益冲突与学术利益冲突。收集汇总后的利益声明表经指南制订工作组成员共同讨论判定,若专家组成员声明的利益关系对指南的内容构成利益冲突,则根据利益冲突的程度限制核心工作的参与或剔除本次指南的制订过程。
四、指南使用者与目标人群
本指南供呼吸与危重症医学科、感染科、重症医学科、急诊科、药剂科、影像科等参与COVID-19诊疗管理的临床学科专业人员,以及病毒学、免疫学、流行病学、预防医学等其他COVID-19疫情防控相关专业人员使用。指南推荐意见的目标人群是成人COVID-19患者。
五、指南范围与优先临床问题的确定
指南范围由CTS和CACP相关专家起草,在第一次全体专家讨论会中确定了本指南范围。指南的编写采取每个章节指定相应专家负责的方式。每一章节对应的临床问题由负责专家提出,并由指南方法学组和指南协调组整合、审核、提出修改建议,最后由指南专家组确定。此次指南对两类临床问题(背景问题和前景问题)进行回答。
六、证据的检索与评价
指南方法学组在指南工作启动会后对各专家团队进行方法学培训,严格地进行文献检索策略的制定、筛选与评价。本指南采用“COVID-19、2019-nCoV、Coronavirus Disease 2019、新型冠状病毒、新冠肺炎”等检索词系统检索Medline、Cochrane Library、WHO COVID-19数据库(https://search.bvsalud.org/global-literature- on-novel- coronavirus-2019-ncov/)、Epistemonikos COVID-19 数据库(https://iloveevidence.com/)、中华医学会杂志社新型冠状病毒肺炎科研成果学术交流平台(http://medjournals.cn/2019NCP/index.do)、中国生物医学文献服务系统、万方知识数据服务平台和中国知网数据库,纳入COVID-19相关的系统评价、随机对照试验和观察性研究等。运用系统评价偏倚风险评价工具(a measurement tool to assess systematic reviews,AMSTAR)量表对纳入的系统评价、荟萃分析和网状荟萃分析进行偏倚风险评价。使用Cochrane偏倚风险评价工具[risk of bias,ROB,针对随机对照试验(randomized controlled trial,RCT)]、诊断准确性研究的质量评价工具(quality assessment of diagnostic accuracy studies,QUADAS-2,针对诊断准确性试验研究)等对相应类型的原始研究进行方法学质量评价。各专家团队在证据检索、评价等过程中如果遇到疑问,方法学组和协调组成员将进行协商解决并进行质量控制。
七、指南要点与推荐意见的形成
本指南基于背景问题和前景问题两种方式撰写。背景问题采用要点总结的形式撰写。前景问题按照推荐意见、推荐意见说明、证据总结(推荐依据)的形式进行撰写,并采用2009版牛津大学循证医学中心的证据分级和推荐强度标准(表1)对推荐意见的证据水平和推荐强度进行分级(OCEBM Levels of Evidence Working Group;https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009)。综合考虑我国患者的偏好与价值观、干预措施的成本和利弊等因素后,专家组形成初拟的要点和推荐意见。方法学组和协调组对初拟的要点和推荐意见进行评估,给出反馈意见,经过两轮的反馈修改后,指南专家组成员通过Delphi的方法对所有要点和推荐意见进行共识,确定最终的要点和推荐意见。

表1 2009版牛津大学循证医学中心的证据分级与推荐强度标准
八、指南的撰写、外审与批准
各部分初稿确定后,指南协调组整合指南初稿。经指南专家组审议通过后的指南初稿提交外审专家组进行审阅。基于外审专家组的反馈意见,指南协调组对整体意见进行修改,最后由指南专家组讨论批准指南的发布。
九、指南的发布、传播与更新
指南发布后将同时结合线上和线下的学术会议形式在全国范围内进行广泛传播,从而更好地促进指南的使用。指南发布后协调组会定期进行文献检索和评估,如果出现了可能改变要点或推荐意见的证据,将会启动相关章节的更新。
(陈耀龙)
第二部分:新型冠状病毒(SARS-CoV-2)
一、病毒特征
要点
1.新型冠状病毒(SARS-CoV-2)属于β冠状病毒属的严重急性呼吸综合征相关冠状病毒(SARSr-CoV)。
2.SARS-CoV-2基因组大小约为30 kb,具有典型的冠状病毒基因组结构。
3.SARS-CoV-2病毒颗粒呈球形,直径为60~140 nm,呈现典型的冠状病毒形态特征。可使用Vero E6等细胞进行分离培养。
4.血管紧张素转化酶2(ACE2)是SARS-CoV-2的受体。
5.SARS-CoV-2对高温、紫外线和多种消毒剂敏感。
新型冠状病毒是COVID-19的病原体,国际病毒分类委员会将其命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome virus 2,SARS-CoV-2)。SARS-CoV-2是目前已知的第七种人类冠状病毒,属于β冠状病毒属的严重急性呼吸综合征相关冠状病毒(severe acute respiratory syndrome-related coronavirus,SARSr-CoV) [5] 。
SARS-CoV-2基因组为单股正链RNA,大小约为30 kb,具有和其他β冠状病毒类似的基因组结构。包括6个主要的开放阅读框(open reading frame,ORF),其顺序与SARS冠状病毒(SARS-CoV)一致。从基因组5′端到3′端依次为编码复制相关非结构蛋白的ORF1a/1b,以及分别编码刺突蛋白(S蛋白)、囊膜蛋白(E蛋白)、膜蛋白(M蛋白)和核衣壳蛋白(N蛋白)的4个结构蛋白基因。S基因下游还分布有ORF3、ORF6、ORF7a、ORF7b、ORF8等多个编码辅助蛋白的附属基因[6, 7]。
SARS-CoV-2具有和其他冠状病毒类似的形态特征。病毒颗粒主要为球形,直径约为60~140 nm,有囊膜。囊膜表面分布有长约9~12 nm的刺状突起,为病毒的S蛋白,呈放射状排列。在电子显微镜下观察,病毒粒子外观形似日冕[8]。体外分离培养SARS-CoV-2时,在接种96 h后可在人呼吸道上皮细胞中观察到细胞病变,接种非洲绿猴肾细胞(Vero E6)和人肝癌细胞(Huh-7)等细胞3~6 d后出现典型的细胞病变[8, 9]。
SARS-CoV-2的受体为血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)[9]。病毒的S蛋白与ACE2结合,启动病毒入侵。除人ACE2受体外,SARS-CoV-2还可与猴、犬、猫、兔、穿山甲等多种哺乳动物的ACE2受体结合,表明其可能具有广泛的宿主范围[10]。此外,Ⅱ型跨膜丝氨酸蛋白酶(TMPRSS2)等宿主细胞蛋白酶能够协同SARS-CoV-2入侵细胞[11, 12]。
室温条件下,气溶胶中的SARS-CoV-2可在16 h内维持感染性[13]。SARS-CoV-2在不同物体表面的稳定性不同,在塑料、不锈钢等材料表面可存活3 d,在硬纸板、布料等材料表面的存活时间在1 d以内[13, 14]。SARS-CoV-2对高温和紫外线敏感。0.7~1.6 W/m2的中波紫外线照射可快速灭活病毒[15],56 ℃作用30 min能使病毒失活[13]。SARS-CoV-2在低温环境中如冷链食品包装表面可长时间存活[16]。冠状病毒普遍对化学消毒剂敏感。75%乙醇、0.5%过氧化氢溶液、次氯酸钠等含氯消毒剂均可有效灭活病毒[17]。
二、病毒的进化与突变
要点
1.蝙蝠冠状病毒RaTG13是已知与SARS-CoV-2进化关系最近的病毒,但目前SARS-CoV-2从动物跨种传播到人群的直接源头仍然未知。
2.估测SARS-CoV-2进化速率约为每个位点8×10-4个替换/年。
3.SARS-CoV-2已经出现多种变异,其中S蛋白D614G突变毒株已在SARS-CoV-2的全球流行中占据主导地位。该突变可导致病毒感染力增强,但对疫苗功效造成影响的可能性低。
与SARS-CoV-2同处于β冠状病毒属、Sarbecovirus亚属同一进化分支的还包括在蝙蝠、穿山甲等野生动物中发现的冠状病毒,表明SARS-CoV-2可能来自野生动物[9, 18, 19, 20, 21, 22]。已知和SARS-CoV-2最为相似的冠状病毒是在云南的中菊头蝠中发现的冠状病毒RaTG13,全长基因组序列相似度达到96.2%[9]。我国广西、广东两地海关截获的走私穿山甲中也发现了类似SARS-CoV-2的冠状病毒,其中广东截获的穿山甲中分离到的冠状病毒S蛋白受体结合区(receptor-binding domain,RBD)与SARS-CoV-2高度相似[21, 22]。尽管RaTG13是目前发现的和SARS-CoV-2亲缘关系最近的病毒,但它们之间还存在至少20年的进化距离,尚未在蝙蝠、穿山甲等动物中发现SARS-CoV-2的直接祖先[23]。SARS-CoV-2从动物跨种传播到人群的直接源头仍然未知。
截至2020年12月7日,国家生物信息中心2019新型冠状病毒信息库在对全球公布的229 812条SARS-CoV-2全基因组序列变异分析中,共鉴定出22 252个单核苷酸多态性(single nucleotide polymorphism,SNP)变异[24]。全球流感数据共享倡议组织(Global Initiative on Sharing All Influenza Data,GISAID)数据库按照SARS-CoV-2的代表性突变位点将SARS-CoV-2划分为多个主要的亚型,包括:L型(以武汉分离株为代表)、S型(标志性突变为C8782T,T28144C)、Ⅴ型(标志性突变为G11083T,G26144T)、G型(标志性突变为C241T,C3037T,A23403G)等。估算测得SARS-CoV-2在人群中的突变速率约为8×10-4/位点/年,流感病毒突变速率约是其2~6倍[25, 26]。由于SARS-CoV-2进化速率相对较低,且具备高效的人际传播能力,说明其在大规模暴发时可能已经是一种适应人群的病毒[26, 27]。
S蛋白的D614G突变是SARS-CoV-2的一个典型突变。相比武汉分离株,一些毒株在基因组23403核苷酸位点上发生了非同义突变,导致S蛋白的614氨基酸位点由天冬氨酸(D)变更为甘氨酸(G)。目前这一突变毒株已成为全球SARS-CoV-2流行的主要形式,表明其可能具有适应性优势[28, 29]。相比D614毒株,G614毒株的感染性和病毒粒子稳定性更强,但没有证据表明该突变和疾病严重程度有关,且该突变对疫苗功效造成影响的可能性不大[28, 29, 30]。
另一个发生在S蛋白的典型突变为N501Y突变株。该突变株最早于2020年9月20日在英国出现,随后在南非等国家相继被报道。该突变株属于B.1.1.7分支,除N501Y之外,该分支还包含S蛋白的69~70 del,P681H等其他多个突变。S蛋白的501位点是与受体ACE2直接相互作用的关键位点之一。目前尚未有正式发表的研究数据证实该突变株是否在人群中具有更高的传播性以及是否与疾病的严重程度相关。
在人类这一新宿主中,为适应体内环境,病毒会加快变异和进化,今后可能会出现更多变异,变异后的病毒可能在感染性、潜伏期、传播性、致病性、体内存留时间、抗原性等多方面发生变化。因此,专业性的监测、判断和干预非常重要。
三、SARS-CoV-2与SARS-CoV、MERS-CoV的区别
要点
1.SARS-CoV-2与SARS-CoV、MERS-CoV的基因组相似度分别为79%和50%。
2.SARS-CoV-2的中间宿主未明确,SARS-CoV和MERS-CoV的中间宿主分别是果子狸和单峰骆驼。
3.SARS-CoV-2与SARS-CoV的受体都是ACE2,但SARS-CoV-2 S蛋白的ACE2亲和力高于SARS-CoV。MERS-CoV则使用DPP4受体。
4.SARS-CoV-2的传播能力高于SARS-CoV,远高于MERS-CoV。
5.SARS-CoV-2病死率低于SARS-CoV(9.6%)和MERS-CoV(34%)。
COVID-19之外,21世纪还出现过两种由冠状病毒引起的新发传染病。分别是2002—2003年在我国暴发的严重急性呼吸综合征(severe acute respiratory syndrome,SARS)和2012年出现在中东并在该地区多次暴发的中东呼吸综合征(Middle East respiratory syndrome,MERS),造成这两类疾病的病原分别是SARS冠状病毒(SARS-CoV)和MERS冠状病毒(MERS-CoV)。SARS-CoV-2、SARS-CoV和MERS-CoV是已知的三种高致病性冠状病毒。
SARS-CoV是人类冠状病毒中与SARS-CoV-2亲缘关系最近的一种,和SARS-CoV-2同属Sarbecovirus亚属,两者全长基因组序列相似度为79%。MERS-CoV与SARS-CoV-2的亲缘关系稍远,为Merbecovirus亚属成员,与SARS-CoV-2全长基因组序列相似度仅为50%[31]。蝙蝠可能是这三种冠状病毒的最初源头。目前已证实蝙蝠是SARS-CoV的自然宿主,果子狸是其中间宿主,而MERS-CoV的中间宿主是单峰骆驼[32, 33, 34]。SARS-CoV-2的动物溯源尚未清晰,中间宿主尚未确定。
SARS-CoV-2和SARS-CoV使用的受体同为ACE2。然而,SARS-CoV-2 S蛋白的RBD和SARS-CoV差异较大,在与ACE2结合的5个关键氨基酸位点上,SARS-CoV-2和SARS-CoV均不相同。这些差异增强了人ACE2分子表面两处病毒结合热点的稳定性,因此SARS-CoV-2与ACE2受体结合的亲和力要高于SARS-CoV[35, 36]。MERS-CoV则通过结合二肽基肽酶4(dipeptide peptidase 4,DPP4)受体入侵细胞,使用的是和SARS-CoV-2完全不同的受体[37]。
SARS-CoV-2的传播能力在三种高致病性冠状病毒中最强。估测得到SARS-CoV-2基本再生数(basic reproduction number,R0)在1.8~3.6之间。SARS-CoV的R0为2.0~3.0,略低于SARS-CoV-2[38]。和SARS-CoV和SARS-CoV-2相比,MERS-CoV传播能力较弱,R0低于1[39]。
SARS-CoV-2、SARS-CoⅤ、MERS-CoV引起的疾病普遍表现为发热、咳嗽、乏力、呼吸困难、咽痛等,重症患者可进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[40]。从目前统计数据来看SARS-CoV-2的病死率小于3%,其病死率低于SARS-CoV(9.6%)和MERS-CoV(超过30%)[41]。
(胡犇、谭文杰、石正丽)
第三部分:流行病学
一、传染源
要点
COVID-19患者和无症状感染者是主要传染源。SARS-CoV-2感染的动物也可能为传染源。
(一)COVID-19患者
COVID-19患者发病前(潜伏期)、发病期间和症状消失后(恢复期)均可能具有传染性。受体内病毒繁殖时间、病毒排出方式与数量等因素影响,COVID-19患者在不同临床进程中的传染性强弱有所差异[42]。
COVID-19病例常见潜伏期为1~14 d[43, 44, 45, 46, 47, 48],平均潜伏期约为5 d[43, 44, 45, 46, 47, 48]。同时也存在暴露后24 d出现症状的个案病例[45]。COVID-19病例可在症状出现前24~48 h传播病毒[43, 44, 45, 49],成为潜在的传染源。
COVID-19患者在症状期传染性最强。COVID-19患者上呼吸道标本病毒载量在临床症状初期较高,1周之内达到峰值,随后1~3周缓慢下降[44, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63]。下呼吸道痰液样本中的病毒载量通常在发病后2周内达到高峰,且病毒载量高于上呼吸道样本[50, 58, 61, 64, 65, 66]。粪便样本中病毒载量通常在发病后2~3周达到顶峰[53, 64, 65, 67, 68, 69, 70, 71, 72]。COVID-19患者病毒排出时间为8~37 d,平均为20 d[73]。
恢复期患者可能也是传染源。恢复期是指从COVID-19患者临床症状及体征基本消失,至恢复到疾病前状态的时期,此阶段SARS-CoV-2尚未被完全清除[42],鼻咽拭子和大便中可能检测到病毒的存在[74, 75]。
(二)无症状感染者
据估计,SARS-CoV-2无症状感染者大约占总感染人群的40%~45%[76]。无症状感染者可污染周围环境[77],将病毒传染给他人[74, 78, 79, 80, 81, 82],传染期可能更长,部分感染者传染期可能超过14 d[76]。无症状感染者与患者排出的病毒量可能差异不大[62, 81],无症状感染者也是重要的传染源[62, 76, 81]。
(三)受感染的动物
来自SARS-CoV-2感染者的SARS-CoV-2可以扩散到猫科(家猫、圈养的老虎和狮子)、犬科(宠物狗)和鼬科(养殖水貂)等动物[83, 84, 85, 86]。此外,猫、狗、雪貂、埃及果蝠、金色叙利亚仓鼠和猕猴可在实验条件下感染[87]。但尚不能确定这些受感染动物是否能将病毒传染给人类[88]。
(冯录召、杨维中)
二、传播途径
要点
1.SARS-CoV-2主要传播途径是经呼吸道飞沫传播和接触传播。
2.在相对封闭的环境中长时间暴露,存在经气溶胶传播的可能性。
3.接触病毒污染的物品可造成感染,应关注冷冻冰鲜食品、货物等接触传播的风险。
(一)呼吸道飞沫传播
呼吸道飞沫传播是指含有大量病原体的飞沫在呼气、咳嗽、打喷嚏时经口鼻排入环境所引起的传播,范围多在1 m之内,含有病毒的飞沫可以被易感者吸入而致病[89, 90, 91, 92, 93, 94]。
(二)接触传播
接触传播可分为直接接触传播和间接接触传播。SARS-CoV-2在环境中具有高度的传染性和稳定性[95]。目前的调查研究表明,在感染者的粪便、尿液中存在SARS-CoV-2,提示与COVID-19患者接触的家庭成员、医护人员等可能通过直接接触传播途径获得感染[96]。另外,有研究显示,眼结膜、眼角膜都存在AEC2受体,可能成为间接接触传播的潜在途径[97]。
(三)气溶胶传播
含病原体颗粒的气溶胶在空气中可以较长时间悬浮,播散到较远距离引起的传播[98]。特定条件下,在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能[99, 100]。
(四)传播重点环节与场所
冷冻食品可携带SARS-CoV-2造成远距离传播,给接触者(工作人员和消费者)带来较大的感染风险。继北京市新发地之后,我国多地陆续报道从冷冻食品的外包装或相关食品表面的样本中检测出SARS-CoV-2核酸、甚至活病毒,此前已有研究证实病毒可在冷冻食品中存活较长时间,提示冷冻食品可能成为新的传播途径[56, 101, 102, 103]。
COVID-19聚集性疫情多发生于人群密集、相对封闭的重点场所,如医疗机构、社会福利机构、工厂、军队、监狱、学校、娱乐场所等。这些场所的人员间物理距离更短,身体接触更加紧密,相对封闭,加之一些社会、经济因素,使得他们更容易暴露和感染SARS-CoV-2[104]。
(五)其他可能的传播途径
消化道ACE2受体的存在、患者粪便可检测到SARS-CoV-2是COVID-19经消化道传播的理论基础,但目前学界对经消化道传播还存在一定争议,有待进一步研究[96, 105, 106]。母乳中可检测到SARS-CoV-2核酸,也有新生儿出生后鼻咽分泌物检测出SARS-CoV-2核酸的个案,但是COVID-19是否可以通过母婴垂直传播存在争议,需要更多证据[107, 108, 109, 110, 111]。有研究从血清样本检测到低水平SARS-CoV-2核酸,提示血液制品有可能是传播途径[112]。有研究从COVID-19患者或志愿者的睾丸活体及精液中分离到SARS-CoV-2,但暂时没有从阴道液中分离到病毒的研究证据,有关COVID-19是否可以通过性传播需要进一步研究证实[113, 114, 115]。
(冯录召、杨维中)
三、易感人群与重症高危人群
要点
1.所有年龄段的人群对SARS-CoV-2均易感。
2.患者和无症状感染者的密切接触者均有较高的风险感染SARS-CoV-2。
3.老年人、男性、妊娠期女性、吸烟者、肥胖者、患基础疾病者为重症高危人群。感染后发生急性肾损伤、凝血功能障碍等是COVID-19患者进展为重症或死亡的危险因素。
全球人群均缺乏对SARS-CoV-2的免疫力,所有年龄段的人群均易感,尤其是20岁以上的人群 [116] 。患者和无症状感染者的密切接触者有较高风险感染SARS-CoV-2;医疗、社会和教育等领域的工作者均有SARS-CoV-2暴露风险,其中医疗工作者的风险最高 [117] 。
COVID-19患者的病死率与年龄相关,高龄患者的病死率更高[118, 119, 120, 121, 122]。患基础疾病的人群发生重症COVID-19的风险及病死率更高,常见基础病包括:高血压、糖尿病(或入院高血糖水平)、哮喘、慢性阻塞性肺疾病、间质性肺病、心力衰竭、冠状动脉疾病、心肌病、肺动脉高压、慢性肝病、慢性肾病、恶性肿瘤、免疫缺陷等[73, 122, 123, 124, 125]。男性、妊娠期女性、吸烟者和肥胖人群也有更高的重症和死亡风险[126, 127, 128, 129, 130, 131, 132, 133]。服用肾素-血管紧张素系统抑制剂并不会显著改变罹患COVID-19的风险、病情严重程度和病死率[134]。应在病情发展过程中持续监测实验室参数[135]。白细胞计数升高、淋巴细胞计数降低、中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyteratio,NLR)升高、部分炎症标记物升高(如IL-6、CRP、铁蛋白)、D-二聚体水平升高是重症COVID-19的危险因素[135, 136, 137, 138, 139, 140, 141, 142]。此外,出现急性肾损伤、凝血功能障碍和血栓栓塞的患者出现不良预后的风险更高[73, 124, 143]。重症COVID-19患者常见的凝血功能障碍表现包括D-二聚体水平升高,血小板计数降低,凝血酶原时间(prothrombin time,PT)延长,纤维蛋白原、凝血因子Ⅷ和血管性血友病因子水平升高[144, 145, 146, 147, 148]。
(程真顺、陈荣昌)
四、再感染、复查核酸阳性
要点
1.COVID-19患者康复后可能再感染。
2.复查核酸阳性与样本采集和处理、病毒载量、检测灵敏度和特异度等因素有关,复查核酸阳性者具有传染性的证据不足。
SARS-CoV-2可能出现再感染,中国香港、美国、荷兰、比利时、厄尔多瓜等多地均报告了再感染病例 [149, 150, 151, 152, 153] 。再感染患者的病情严重程度不一致,可能为无症状感染,也可能出现更严重的临床表现 [149, 150, 151, 154, 155] 。
复查核酸阳性指COVID-19患者达到连续两次呼吸道标本核酸检测阴性(采样时间至少间隔24 h)的出院标准后[156],非再感染情况下核酸检测再次呈阳性。复查核酸阳性可能与样本采集和处理、病毒载量、检测试剂的灵敏度和特异度等因素有关。复查核酸阳性现象在全球多地均有报道,比例从2.4%~69.2%不等,多数发生于出院后1~38 d,一般不超过90 d[157, 158, 159, 160, 161]。复查核酸阳性者具有传染性的证据不足[162]。
(冯录召、杨维中)
五、疾病负担
要点
1.COVID-19已在全球造成了大量发病和死亡。
2.COVID-19占用医疗资源较多,间接经济影响巨大。
(一)健康负担
人群对SARS-CoV-2普遍易感。截至2020年12月29日,全球已有超过8 015万例COVID-19确诊病例,及超过172万死亡病例[163]。然而约40%~45%的SARS-CoV-2感染者不会出现临床症状[76]。据估计,2020年1月27日至9月31日,美国大约每8例SARS-CoV-2感染者中仅有1例被官方报告[164],提示实际感染者的人数可能远多于报告病例数。
一项研究利用公开的多种来源数据,包括被动监测报告和主动筛查的COVID-19的发病、死亡数等,系统校正了实验室检测方法的敏感度、前瞻性社区筛查及就医行为后,定量测量出2019年12月至2020年3月间,武汉市COVID-19的发病率为796/10万(95%CI:703/10万~977/10万),就诊率为489/10万(95%CI:472/10万~509/10万),住院率为370/10万(95%CI:358/10万~384/10万),死亡率为36.2/10万(95%CI:35.0/10万~37.3/10万),其住院率超过2009年甲型H1N1流感的3.1倍,是季节性流感的1.8~2.6倍。
早期研究显示,COVID-19患者中81%为轻型或普通型,14%发展为重型,5%为危重型[122];冰岛2020年3—4月份的数据显示,67%的SARS-CoV-2感染者在整个病程症状较轻[165]。疫情初期武汉COVID-19患者住院率约为370/10万,26%~32%的住院患者需要入住重症监护室ICU[122];而4月底之前美国加州与华盛顿州COVID-19住院患者中男性ICU住院率为48.5%,女性为32.0%[166]。一项关于全球COVID-19患者的系统评价显示,在ICU的患者中,67.7%需要有创机械通气,65.9%需要血管加压药物,16.9%需要肾脏替代治疗,6.4%需要体外膜式氧合(extracorporeal membrane oxygenation,ECMO)[167]。
各国COVID-19患者的病死率(case-fatality rate,CFR)介于0.05%~6.10%之间[122, 168, 169, 170],住院患者的CFR介于1.4%~18.9%之间[171],感染死亡比(infection fatality rate,IFR)在0.09%~1.60%之间[172, 173]。各国病死率与医疗资源承载情况和老龄化程度有关。COVID-19所致超额死亡率在男性中略高于女性,60岁以下人群显著低于60岁以上老年人[174]。
(二)经济负担
我国确诊患者人均医疗费用约2.3万元,重症患者人均治疗费用超过15万元,危重症患者治疗费用几十万元甚至上百万元,全部由国家承担[175]。除此之外,全球经济运行受COVID-19疫情冲击,面临巨大挑战。2020年全球经济增速为-4.4%,有些国家衰退甚至超过10%[176]。
(冯录召、杨维中)
第四部分:病理表现
一、COVID-19呼吸系统病变
要点
1.肉眼观察,双肺充血、肿胀、暗红色,重量增加,呈不同程度的实变。
2.光镜下,肺组织病变主要包括弥漫性肺泡损伤、肺泡渗出性炎、肉质变、间质炎和纤维化,可见灶性出血。
3.电镜观察,肺泡上皮细胞和肺泡壁毛细血管内皮细胞损伤,气管、支气管黏膜上皮和肺泡Ⅱ型上皮细胞胞质内可见冠状病毒样颗粒。
4.免疫组化可检测到SARS-CoV-2 S蛋白和N蛋白,PCR可检测到SARS-CoV-2核酸。
COVID-19病变具有多系统,多器官、多种组织受损的特点,肺脏最显著 [177] 。大体观察,双肺充血、肿胀、暗红色,重量增加,呈不同程度的实变 [178] 。各肺叶病变程度有差异,可见胸膜黏连和胸腔积液,部分病例可见灶性出血、坏死 [179] 。
光镜下,肺脏不同区域病变不同,复杂多样;同一区域病变不同步,新旧交错。多样性的肺组织病变主要包括弥漫性肺泡损伤、肺泡渗出性炎、肉质变、间质炎和纤维化,可见灶性出血[177]。肺泡结构不同程度的破坏,Ⅰ型和Ⅱ型肺泡上皮细胞坏死、脱落,Ⅱ型肺泡上皮细胞增生、体积大、核大,可见多核,部分细胞脱落于肺泡腔内[180, 181, 182]。少数增生的Ⅱ型肺泡上皮内可见红染圆形或卵圆形的病毒包涵体[179]。肺泡腔内见浆液和纤维蛋白性渗出物及透明膜形成,部分肺泡腔内见大量单核和巨噬细胞,少量淋巴细胞和中性粒细胞,偶见嗜酸性粒细胞[183]。肺泡壁毛细血管扩张、充血,可见单核和淋巴细胞等炎细胞浸润,微血管内透明血栓多见[183, 184, 185]。肺脏内各级血管均可见到血栓,大血管内以混合血栓为主,并可见血栓栓塞。肺泡间隔增厚,血管形态异常,扭曲长度增加,可见以套叠式血管生成为主的血管新生现象[178, 179, 180, 181, 182, 183, 184, 185, 186]。肺泡间隔较多巨噬细胞和淋巴细胞浸润,淋巴细胞多为CD4+T细胞,可见少量CD8+T细胞和CD20+B细胞。可见肺组织出血、坏死灶,部分区域见出血性梗死。少数肺泡过度充气、肺泡隔断裂,或气肿囊腔(大泡)形成。病程较长的病例,可见肺泡腔渗出物机化(肉质变)和肺间质纤维化。上述病变中,肺泡结构破坏、渗出、间质炎和广泛微血栓形成可引起气体交换功能障碍;气道黏膜上皮增生、脱落、黏液阻塞导致通气受阻(主要是小气道)。这些改变是呼吸功能衰竭的重要病理基础[177,179,183]。
气管、支气管黏膜充血、分泌物增多。镜下主要表现为急性支气管及细支气管炎。支气管和细支气管黏膜部分上皮脱落,黏膜下层水肿,小血管充血,炎细胞浸润;管腔内炎性坏死物或黏液,并可见黏液栓形成[178, 179]。
电镜观察发现,Ⅱ型肺泡上皮细胞核大、胞质丰富,线粒体肿胀;有较多的板层体、粗面内质网、滑面内质网和高尔基氏器[178,183]。肺泡壁毛细血管内皮细胞破裂,管腔内可见纤维素形成的血栓[178]。气管、支气管黏膜上皮和肺泡Ⅱ型上皮细胞胞质内可见冠状病毒样颗粒。病毒样颗粒直径60~140 nm,常聚集在双侧膜包绕的结构内。在病毒内部,N蛋白呈小的高密度点,常规电镜很难看到S蛋白形成的冠。电镜可观察到病毒样颗粒排出细胞的过程[187]。免疫组化可检测到SARS-CoV-2 S蛋白和N蛋白,PCR可检测到SARS-CoV-2核酸[183]。
二、COVID-19免疫器官病理改变
要点
1.脾脏体积缩小,白髓区萎缩,淋巴细胞减少,红髓区巨噬细胞增生,吞噬红细胞和(或)淋巴细胞现象多见。
2.淋巴结淋巴滤泡减少,生发中心缺如,边缘窦内巨噬细胞聚集。
3.骨髓三系细胞数量减少,少数病例显增生。
(一)COVID-19患者脾脏病理改变
大体观,脾脏体积不同程度缩小,重量减轻,脾表面包膜皱缩。切面暗褐色、质地中等,部分病例淤血明显。部分患者脾脏可见局灶梗死[179, 183, 188]。
镜下观察,脾脏内白髓区萎缩,淋巴滤泡减少或缺如,淋巴细胞总数减少,动脉周淋巴鞘结构紊乱;红髓区脾脏巨噬细胞增生,吞噬红细胞和(或)淋巴细胞现象多见。可见淤血、出血、血管内血栓形成,灶性坏死和含铁血黄素沉积。脾窦纤维组织增生。部分病例表现为急性脾炎,可见较多中性粒细胞浸润。免疫组化检测显示,T细胞明显减少,CD4+和CD8+细胞稀少。
(二)COVID-19患者淋巴结病理改变
肉眼可见淋巴结体积增大。镜下可见到边缘窦有较多CD68标记的巨噬细胞聚集,生发中心减少。淋巴细胞数量不同程度地减少,滤泡减少,生发中心缺如。特别是CD4+和CD8+T细胞减少,浆母细胞增多;可见淋巴细胞变性、坏死[179,189]。
(三)COVID-19患者骨髓病理改变
多数病例骨髓三系细胞数量减少,少数病例显增生[183]。红细胞发育异常,浆细胞数量增多,且具有不典型的形态改变[190]。
三、COVID-19其他脏器病理病变
要点
1.全身主要部位小血管炎,可见血管内混合血栓形成、血栓栓塞及相应部位的梗死。SARS-CoV-2核酸阳性的心脏可表现为心肌炎。
2.消化道炎症性病变伴微血管内血栓;肝脏可见微血栓形成和小叶中心性肝坏死。
3.肾脏主要表现为急性和亚急性肾小管炎,球囊腔渗出性改变;睾丸不同程度的生精细胞数量减少,Sertoli细胞和 Leydig细胞变性。
(一)心血管系统病理改变
血管病变是COVID-19的突出特点之一。全身主要部位小血管可见内皮细胞脱落、内膜或全层炎症,浸润的炎细胞以淋巴细胞为主[178]。可见血管内混合血栓形成、血栓栓塞及相应部位的梗死。主要脏器微血管可见透明血栓形成。部分脏器内可见局灶血管出血[186]。
心脏病理改变多表现为与基础疾病相关的非特异性改变,主要表现为心肌细胞肥大、部分心肌细胞变性、坏死,间质轻度充血、水肿,少量淋巴细胞、单核细胞和中性粒细胞浸润[189, 191, 192, 193]。电镜下见部分心肌纤维肿胀、溶解[183]。
心脏组织偶见SARS-CoV-2核酸检测阳性。SARS-CoV-2核酸阳性的心脏可表现为心肌炎,心肌细胞变性坏死,间质小血管炎,心脏全层见较多淋巴细胞和巨噬细胞浸润,局灶可见中性粒细胞[178]。
(二)消化系统病理改变
食管、胃和肠黏膜上皮不同程度变性、坏死、脱落,固有层及黏膜下层小血管扩张、充血,血管内血栓形成,黏膜、黏膜下层及血管壁见淋巴细胞、单核细胞浸润[194, 195, 196]。
大体观察,肝脏体积增大,包膜紧张,颜色暗红。光镜观察,肝细胞可见变性、灶性坏死伴中性粒细胞浸润。部分肝细胞可见胆色素沉积,小胆管内可见胆栓。肝血窦充血,可见Kupffer细胞增生。汇管区见淋巴细胞和单核细胞为主的炎细胞浸润。可见微血栓形成,部分患者见缺血导致的小叶中心性坏死[189, 192, 197]。胆囊高度充盈,黏膜上皮脱落,慢性炎[177]。
胰腺外观无异常,镜下外分泌部上皮细胞未见明显异常,少数胰岛细胞变性[177, 183]。
唾液腺,胃肠黏膜,肝脏和胆囊可检测到SARS-CoV-2核酸[177]。
(三)泌尿生殖系统病理改变
大体观,可见肾脏增大或缩小,硬度不一,可见硬化、苍白外观。肾皮质可变薄。镜下主要表现为急性和亚急性肾小管炎,肾小管上皮浊肿、脱落,管腔内可见透明管型;肾小球毛细血管充血,偶见节段性纤维素样坏死;球囊腔内见蛋白性渗出物;可见肾小球纤维化;间质充血,可见微血栓和纤维化[179, 198, 199, 200, 201, 202]。
睾丸见不同程度的生精细胞数量减少,Sertoli细胞和Leydig细胞变性[203, 204]。
肾脏、膀胱及睾丸组织内SARS-CoV-2核酸检测阳性[177, 198, 204]。
(四)中枢神经系统病理改变
神经元变性坏死、尼氏体消失,可见嗜神经现象;血管周隙炎细胞浸润和灶性脑梗死;星形胶质细胞和少突胶质细胞增生;脑膜及脑组织充血、水肿。可见蛛网膜下腔出血和脑实质内微出血灶[205, 206]。
(五)其他
部分患者出现皮肤红斑疹。镜下可见角质层下脓疱,表皮内及真皮浅层淋巴细胞和嗜酸性粒细胞浸润[207, 208]。
肾上腺可见皮质细胞变性,灶性出血和坏死[177]。
胎盘组织血管病变多见,表现胎盘炎及母体和胎儿面胎盘灌注不良,可见血栓形成,管壁内纤维蛋白沉积,绒毛基质血管核碎裂,部分绒毛内血管缺如等病变[209, 210]。电镜可观察到胎盘组织内存在病毒样颗粒[211]。
(卞修武)
第五部分:发病机制
一、SARS-CoV-2感染的细胞与器官
要点
SARS-CoV-2感染的主要靶细胞是呼吸道杯状细胞、纤毛上皮细胞、Ⅱ型肺泡上皮细胞、肠上皮细胞、血管内皮细胞和嗅觉神经元。此外病毒也有可能感染肾小管上皮细胞、足细胞、单核巨噬细胞和树突状细胞等。
SARS-CoV-2感染同时表达ACE2和TMPRSS2的细胞。主要的靶细胞有呼吸道杯状细胞、纤毛上皮细胞、Ⅱ型肺泡上皮细胞、肠上皮细胞、血管内皮细胞和嗅觉神经元,而肾小管上皮细胞、足细胞、单核巨噬细胞和树突状细胞也可能被病毒感染 [212, 213, 214, 215] 。尚无直接证据表明病毒可感染T细胞、B细胞或其他免疫细胞。作为致细胞病变病毒,SARS-CoV-2直接引起感染细胞细胞坏死、凋亡或其他形式的破坏及死亡 [216] 。
SARS-CoV-2感染的主要靶器官是上下呼吸道、肺、肠道、血管系统和肾脏。病毒也有可能感染二级淋巴器官如脾脏和淋巴结[217, 218]。
二、免疫系统的保护作用
要点
1.T细胞免疫应答发挥关键保护作用。病毒特异的细胞毒性T细胞(CTL)可提供免疫保护。
2.中和抗体发挥重要保护作用。血清中IgM最早出现而后逐渐消失,IgG随后出现但长时间维持高水平。
3.部分健康者及COVID-19患者体内有针对其他冠状病毒的交叉反应性中和抗体和T细胞。
4.早期Ⅰ型干扰素(IFN-Ⅰ)发挥病毒控制作用,而延迟型IFN-Ⅰ可能诱导免疫损伤。
免疫应答对机体的保护作用主要由细胞毒性T细胞(cytotoxic T lymphocyte,CTL)、中和抗体及Ⅰ型干扰素(type Ⅰ interferon,IFN-Ⅰ)组成。
T细胞免疫应答发挥关键保护作用。CD3+Granzyme B+perforin+CTL在感染症状出现的第2天检出,约1~2周达到达峰值,并维持3个月以上(图1)[219]。重症患者有更强的CTL应答[220, 221]、更高频率的CD45RA+CCR7-效应记忆T细胞(effector memory T cells,Tem)、CD45RA+CCR7+中心记忆T细胞(central memory T cells,Tcm)和Th2占优的细胞因子分泌[222]。多数康复者和无症状感染者有记忆性T细胞,可提供免疫保护[223]。
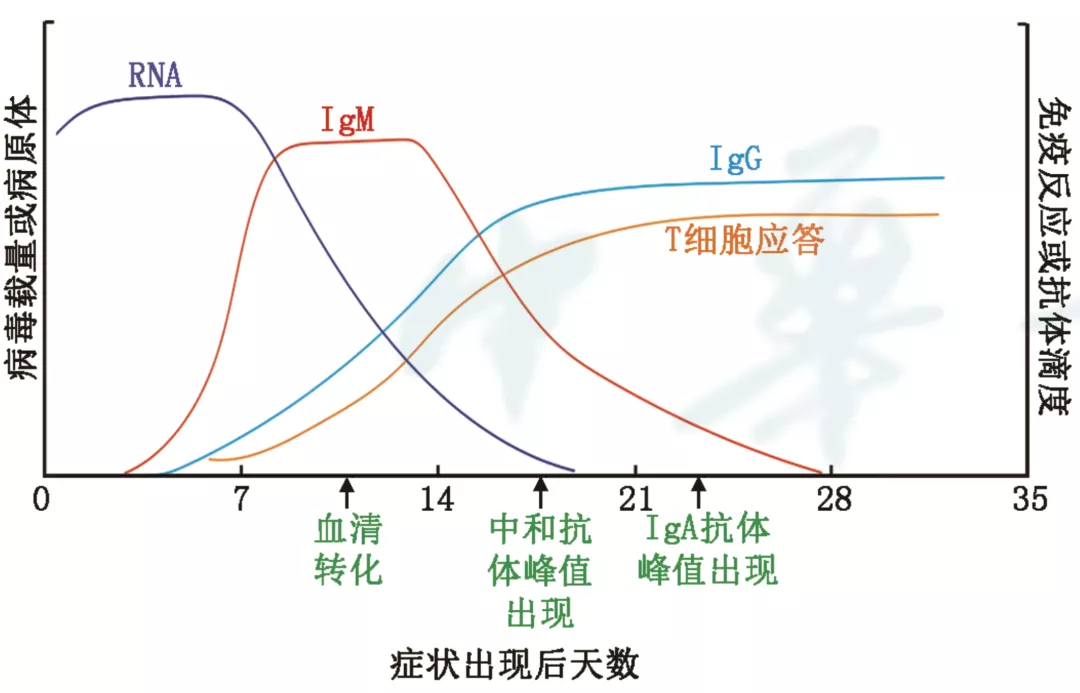
图1 新型冠状病毒感染分子与血清学生物标记物变化过程
患者血液中有CXCR5+ICOS+PD-1+滤泡辅助性T细胞(follicular helper T cells,Tfh),可辅助中和抗体产生及类别转化[224]。中和抗体可封闭病毒S蛋白与ACE2受体的结合而阻止SARS-CoV-2入侵,发挥重要保护作用[225]。抗体最早在症状出现的第2天检出,第25~30天到达峰值。IgM滴度随后逐渐下降,IgG滴度可维持高水平,持续超过6个月(图1)[226, 227]。疾病的严重程度不影响IgG滴度到达峰值时间,但轻症患者IgM滴度比重症患者提前约7 d到达峰值[226]。多数康复者依然有病毒特异性的中和抗体,可能有保护作用[228, 229]。
部分健康者及康复者体内可检测到针对其他冠状病毒(如SARS-CoV、HCoV-OC43、 HCoV-229E、HCoV-NL63及HCoV-HKU1)的交叉反应性中和抗体和T细胞[230, 231]。该交叉中和抗体可阻断SARS-CoV-2入侵细胞,可能有保护作用[230]。约20%人群有交叉反应记忆CD8+T细胞[232],约40%~60%人群存在交叉反应记忆CD4+T细胞[233, 234],这些T细胞是否有免疫保护作用尚不明确[235]。
SARS-CoV-2感染可刺激机体快速产生IFN-Ⅰ,其可促进干扰素激活相关基因(IFN-stimulated genes,ISG)表达而发挥抗病毒作用[236]。轻症患者IFN-Ⅰ水平早期升高后期下降,发挥重要的病毒控制作用。但重症患者IFN-Ⅰ分泌延迟并伴随ISG显著升高,可能导致免疫损伤[237],提示IFN-Ⅰ的临床治疗与给药的时间点密切相关。
三、病理损伤机制
要点
1.部分COVID-19重症患者出现病毒性感染中毒症(viral sepsis)。
2.SARS-CoV-2感染可导致淋巴细胞减少甚至急性T细胞耗竭。
3.部分COVID-19患者出现过度炎症反应及血管病变。
除对靶细胞的直接致病作用之外,SARS-CoV-2感染也可诱发免疫损伤。COVID-19重症患者出现急性T细胞耗竭 [238] 及淋巴细胞减少症 [239] ,可能与胸腺细胞输出减少、脾脏萎缩及大量促炎因子诱发细胞凋亡有关 [240, 241] 。同时,重症患者Th17细胞和致病性CD8 + T细胞比例升高,可能加重免疫损伤 [181, 242] 。此外,老年患者多为低亲和力的CTL应答,其抗病毒能力不足 [235, 236, 237, 238, 239, 240, 241, 242, 243] 。
部分COVID-19患者可发生病毒性感染中毒症(viral sepsis)[244]。此外,COVID-19重症患者血清和支气管肺泡灌洗液中多种炎症因子(IL-1β、IL-2、IL-6、TNF-α及VEGF等)较轻症患者及健康者显著升高[239, 245, 246, 247, 248, 249, 250],可能加剧病理损伤并导致毛细血管渗漏综合症(capillary leak syndrome)[251],表现为毛细血管通透性增加、低血压、水肿和急性呼吸衰竭等。
SARS-CoV-2也可破坏肺毛细血管内皮细胞引起内皮细胞炎[186, 252]。包括血管通透性增加,大量的血浆成分、单核细胞和中性粒细胞汇入,出现肺水肿、透明膜形成或全身小血管内透明血栓形成[183];COVID-19患者血清D-dimer水平明显升高[253]。多数重症患者可合并深静脉血栓及肺栓塞事件[196]。
(曹彬、吴玉章)
本指南第二部分请见下一条推送
本文转载自「中华医学杂志」(ID:nmjc1915)
原链接戳:标准与规范丨中国成人2019冠状病毒病的诊治与防控指南(一)
本文完


