编前语
育龄期女性5年半前体检时发现肺部多囊病变,这五年多都无明显症状,9个月前症状却悄然加重——活动后喘息、活动耐力下降,多家医院均考虑淋巴管平滑肌瘤病,但根据更新后的诊断标准来看,情况似乎并不简单……病情急转直下时,患者接受了双肺移植手术。
追究病因,什么疾病使专家反复强调影像学的动态变化?观众为何纷纷感慨「要挡住烟草诱惑」?大家不约而同在遗憾什么?王辰院士又为何提醒呼吸医生不能被「一肺障目」?
女性,32岁,因发现肺部病变5年半,活动后喘息9个月于2018年12月4日入院。
现病史
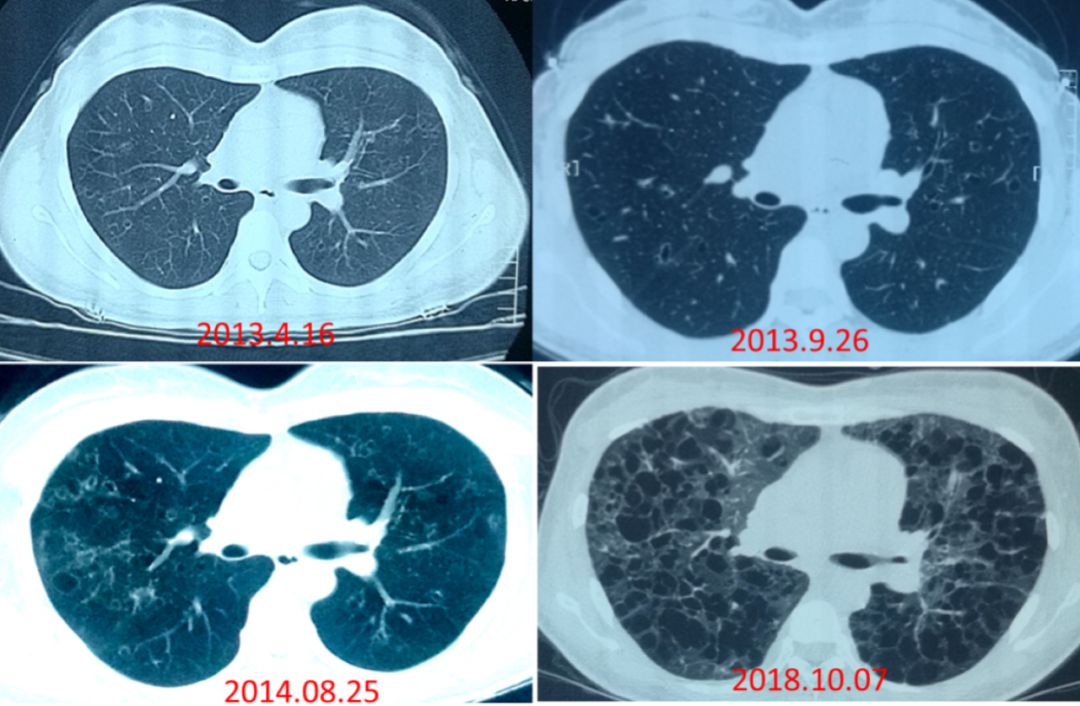
> 5年半前(2013.4.16)患者体检时发现双肺散在囊性病变,无临床症状,未予治疗。3个月后(2013.7.9)复查胸部CT示双肺囊性病变较前略增多,于当地医院诊断为淋巴管平滑肌瘤病(LAM),未予任何治疗。
> 5年前(2013.9.26)和4年前(2014.8.25)曾分别复查胸部CT,双肺囊性病变逐渐增多,但因无任何临床症状,此后未继续复查。
> 9个月前(2018.3)开始出现活动后喘息,活动耐力下降,就诊于多家当地医院,均考虑LAM,给予口服中药治疗(多种草药煎服,具体不详),活动后喘息进行性加重, 并出现双下肢水肿,不能长时间平卧,为求肺移植治疗来我院。
既往史
既往体健,否认高血压、糖尿病、冠心病等慢性疾病病史。
个人史
做面馆收银工作,很少接触油烟,否认毒物及特殊化学物品接触史,无宠物饲养史。吸烟15年,平均每日吸烟10支,已戒烟9个月。
婚育史
已婚,育有1子,配偶及儿子体健。
家族史
否认家族遗传病史。
查体
T 36.5℃,P 75次/分,R 22次/分,BP 125/70mmHg,口唇无发绀,双肺呼吸音低,未闻及干湿性啰音。心律齐,P2>A2,三尖瓣区可闻及3-6级收缩期杂音,双下肢轻度可凹陷性水肿,未见杵状指(趾)。
辅助检查
胸部CT:
总结病历特点
育龄期女性,隐匿起病,慢性病程;有长期吸烟史(15年,平均10支/天),体检时发现双肺多囊病变5年余,初期无任何临床症状,肺部病变逐渐进展,9个月前出现活动后喘息,活动耐力进行性下降。查体:颈静脉怒张,听诊双肺呼吸音低;心律齐,P2>A2,三尖瓣区可闻及3/6级收缩期杂音。合并肺动脉高压。
问题1
肺部病变考虑何种疾病?
A. 肺淋巴管平滑肌瘤病(LAM)
B. 肺朗格汉斯细胞组织细胞增生症(PLCH)
C. 肺腺癌/双肺转移瘤(肉瘤等)
D. 淋巴细胞性间质性肺炎(LIP)
E. Birt-Hogg-Dube综合征(BHD)
F. 其他
原发病的诊断及鉴别诊断
1、淋巴管平滑肌瘤病
淋巴管平滑肌瘤病(LAM)多发于成年女性,起病隐匿,以进行性呼吸困难为主症,影像学可见双肺弥漫性薄壁囊性改变。
本病例支持点
育龄期女性,起病隐匿,以进行性呼吸困难为主症,胸部HRCT:双肺弥漫性囊性改变 ;LAM 合并肺动脉高压少见,欧美文献报道为8%左右。
需要注意的是,2017年ATS/JRS更新了LAM的诊断标准,单纯胸部HRCT不能作为LAM的确诊依据,需要具备以下至少一项支持证据才可确诊LAM:TSC、肾AML、血清血管内皮细胞生长因子D≥800ng/L、乳糜或乳糜性腹水、淋巴管肌瘤、在浆膜腔积液或淋巴结中发现LAM细胞或LAM细胞簇或组织病理证实为LAM(肺、腹膜后或盆腔肿瘤)。
2、肺朗格汉斯细胞组织细胞增生症
肺朗格汉斯细胞组织细胞增生症(PLCH)是以朗格汉斯细胞增生、浸润、肉芽肿形成,导致器官功能障碍为主要临床特征的一种罕见病。好发20~40岁,与吸烟密切相关。肺部CT常有结节、囊样变和网格样病变,合并肺动脉高压者多见。
本病例支持点
青年女性,长期大量吸烟史;活动后呼吸困难,进行性加重;胸部HRCT:双肺弥漫性囊样改变,囊腔大小不等,囊壁厚薄不均;心脏彩超:右心增大,肺动脉高压。
入院诊断
双肺囊性病变待查
肺朗格汉斯细胞组织细胞增生症?
淋巴管平滑肌瘤病?
I 型呼吸衰竭
慢性肺源性心脏病
肺动脉高压
心功能IV级
问题2
下一步诊疗措施?
A.肺移植评估
B.支气管镜检查
C.试用西罗莫司
D.其他
入院后的辅助检查(肺移植前评估)
血气分析提示(FiO2 0.41):pCO2 41.9mmHg,pO2 80.9mmHg。
肺功能:混合型通气功能障碍,弥散量降低,呼吸总气道阻力增高。
FVC 1.47(38.9%),FEV1 0.79(24.1%),FEV1/FVC 53.99%, DLCO-SB 1.42(14.9%)
6分钟步行试验:不能耐受。
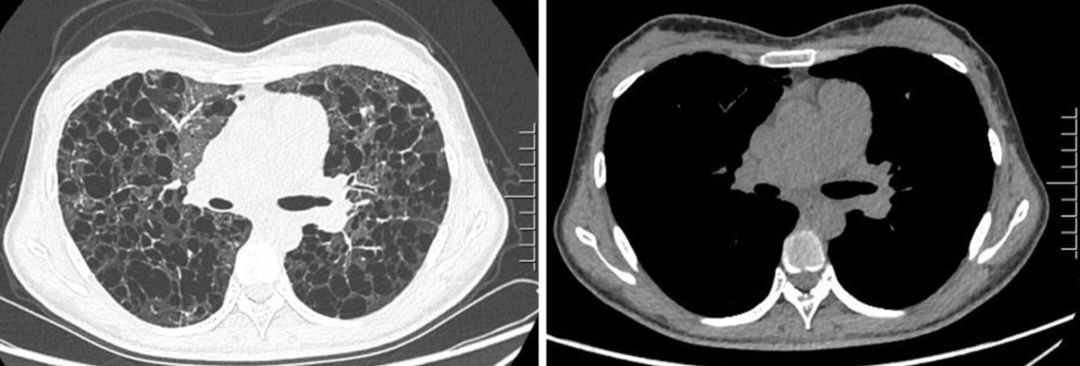
胸部CT:
心脏超声:右心扩大,右室壁稍厚,肺动脉高压(46mmHg),三尖瓣反流(少量),右室收缩功能减低。
心梗四项:CK-MB、Myo 、cTnI正常,BNP 1234.31pg/ml↑。
血常规、尿常规、肝功、肾功、凝血六项、D-二聚体、血沉、CRP、免疫球蛋白+补体C3、C4、甲功五项、T淋巴细胞亚群、肿瘤标志物全套(女性)均正常,抗核抗体谱+血管炎抗体谱、PRA均为阴性。心电图、腹盆CT未见明显异常。
经以上评估,患者存在严重的肺功能受损和运动耐力下降以及静息状态下低氧血症,已达肺移植标准,无手术禁忌症,患者及家属同意手术。
遂于2018年12月26日在我院行双肺移植术,术中发现肺动脉压严重高于正常。右心漂浮导管数据:肺动脉压力为75/40/55mmHg,CI:2L/㎡,TPVRi 27.5 mmHg/L/min/㎡ 。血压:80/50 /65mmHg。
问题3
肺动脉高压原因?
A.低氧或肺部疾病相关
B.栓塞相关
C.合并其他血管病
D.其他
肺移植术及术后情况
患者心功能差,随行VA-ECMO辅助,行双肺移植术,手术过程顺利。术后第2天撤除ECMO,第3天拔除气管插管,术后第5天出ICU,转入普通病房。
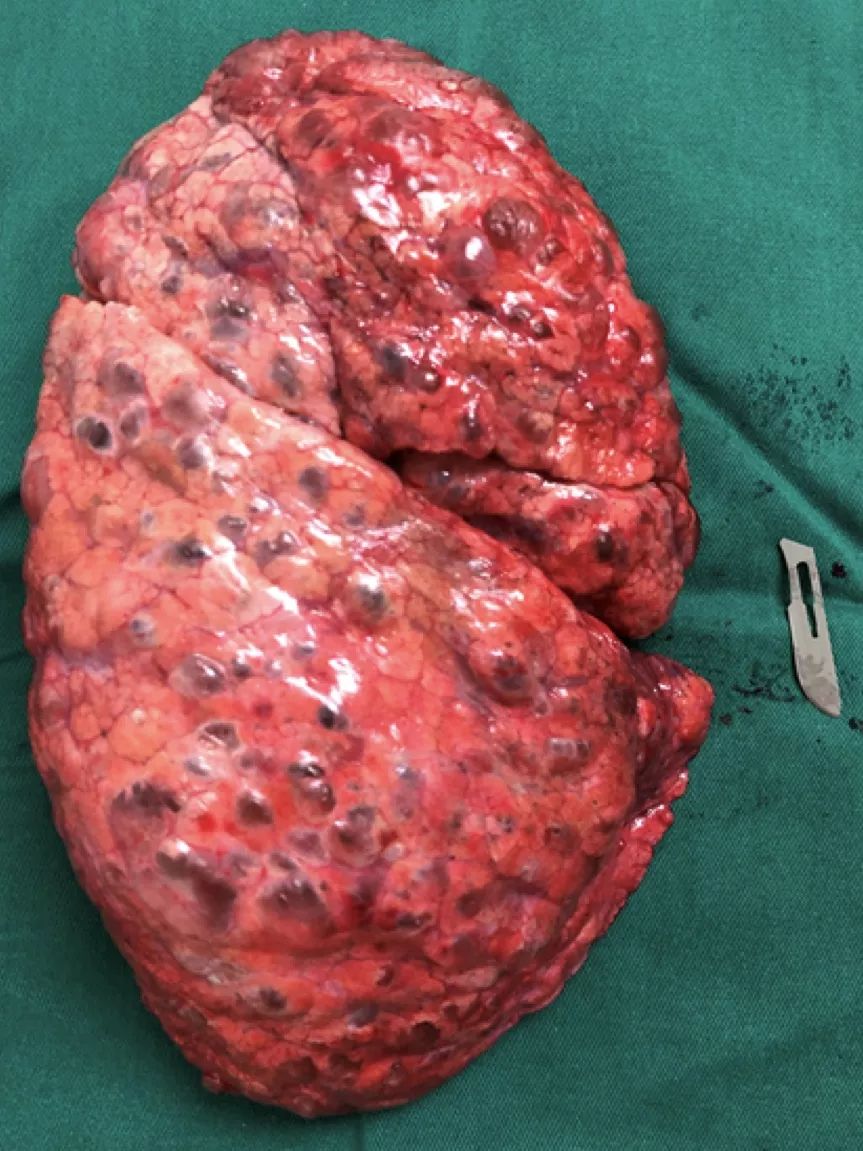
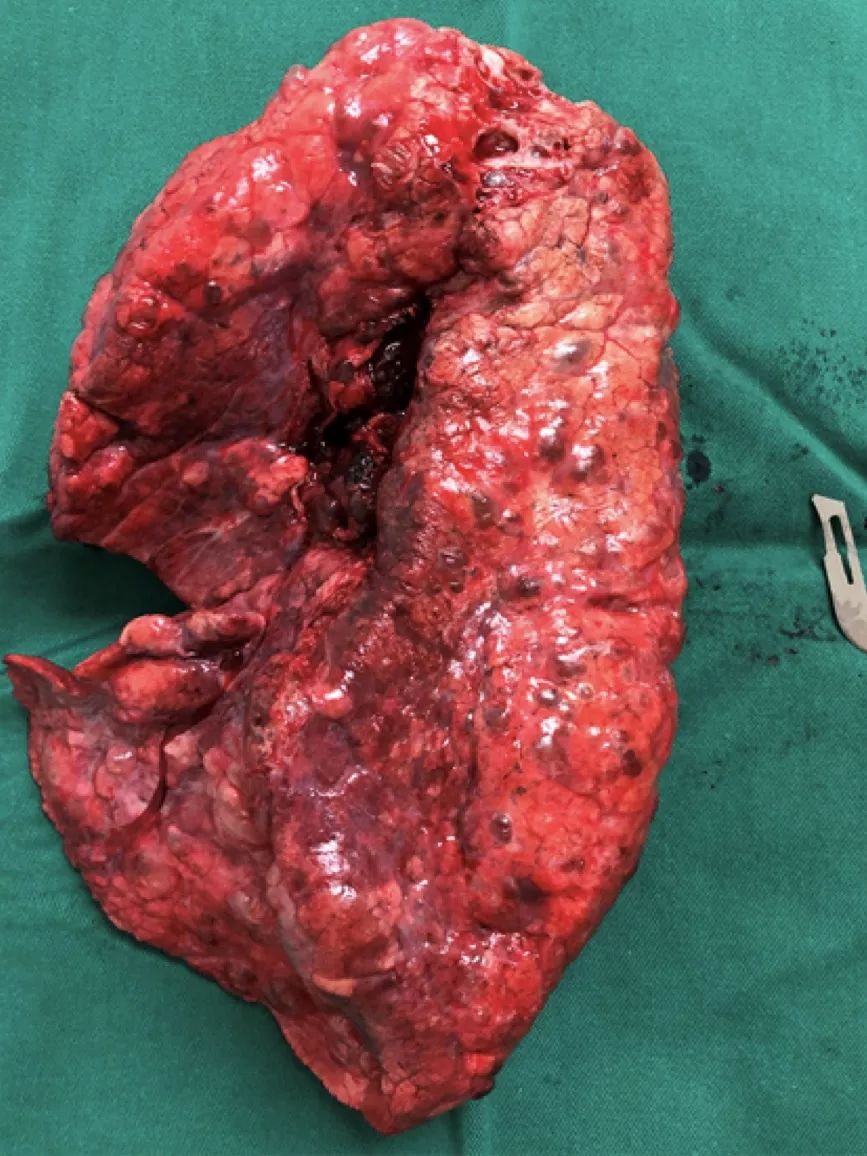
(术中切除的病肺)
术前 vs. 术后 —— 肺CT

2018.12.19(术后) 2018.12.05(术前)
术后复查肺功能、6分钟步行试验、心脏彩超、BNP、血气分析较术前均有大幅度改善。患者恢复顺利,无明显并发症,于2019.01.28出院。
2019.01.28初步病理回报
肺毛细血管瘤病(正式报告未出)。
肺毛细血管瘤病可否解释患者病情呢?
肺毛细血管瘤病(PCH)是一种罕见的、预后不良的血管增生性疾病,病因不清,目前认为吸烟为危险因素之一。发病年龄为 2~71岁,发病率无明显性别差异。该病以肺泡壁毛细血管增生为主要病理特点,肺动脉高压为主要临床症状。胸CT可见肺动脉扩张,广泛分布、磨玻璃样的小叶核心结节,组织病理学检查为诊断金标准。
结合本病例,患者有长期吸烟史,进行性加重的活动后呼吸困难、肺动脉高压,支持PCH的诊断;而不支持点为:患者肺部影像学表现并非典型的PCH征象,是以弥漫性囊性改变为主,而结节数量少。
是否有其他诊断可能?
后经与病理科反复沟通,最终病理结果为:肺朗格汉斯细胞组织细胞增生症的晚期改变(「Burn-out」PLCH)合并肺动脉高压及毛细血管瘤病样改变,吸烟相关改变(呼吸性细支气管炎)。
最终诊断
肺朗格汉斯细胞组织细胞增生症
I 型呼吸衰竭
慢性肺源性心脏病
肺动脉高压
心功能IV级
双肺移植术后
现场点评
中日医院PCCM科陶新曹大夫
患者病变早期的肺部囊腔不典型,分布不均和形状不一、大小不等,伴有结节,与典型LAM影像不同。且此患者长期病程中没有出现过气胸、乳糜胸,这也与LAM不符。患者右室形态改变明显,右心增大,当时在疾病评估应该做右心造影。另外患者在术中做了右心导管,在麻醉状态下会相对低,实际有可能更高,而且当时应该做PAWP的测定。
中日医院放射线科刘敏大夫
患者影像学需要动态查看,起初患者的病变以双上肺为主,有结节,但后来囊逐渐进展,形态不规则,数目增多,下叶也会出现结节和囊,但是肋膈角始终比较少。直到2018年急转直下,双肺所有病变均可见到薄壁囊。如果割裂地去单看2018年10月的影像学,很容易误诊为LAM,因为PLCH到了后期,病变几乎全以囊性变为主,看不到疾病初期的结节样变和不典型小囊,所以观察影像学的动态变化对疾病诊断是非常必要和有帮助的。
中日医院PCCM科代华平教授
对于患者的治疗方面,首先,治疗要基于诊断,患者诊断不明,过于积极的使用药物治疗不可取。西罗莫司可以用于LAM,但是目前循证医学证据仍然不足。PLCH与吸烟关系密切,若患者能在2013年发现肺部病变后就开始戒烟的话,结局也许会好很多。支气管镜对疾病诊断还是有一定意义的,主要是看吸烟相关ILD的问题,也有可能肺泡灌洗液中看到LAM细胞或PLCH细胞。
中日医院手术麻醉科张亚军大夫
对于此患者的肺动脉高压的问题,手麻科见到的肺动脉高压有2类,主要是III类PAH和I类PAH。当平均肺动脉压(mPAP)超过平均体循环压力(MPA)的60%的时候,就考虑右心不能承受负荷,否则右冠脉的供血就停止了,对于右心来说非常危险。该患者的mPAP已经远超过MAP的60%,肺动脉阻断的操作中非常危险。因此患者为保证手术安全,在手术中进行了VA-ECMO的建立,患者在建立VA-ECMO后,肺动脉压力也是明显减低。这也保证了手术的顺利进行。
中日医院PCCM科翟振国教授
患者心脏超声肺动脉压只报了46mmHg,显然是不够的。对于肺移植术前评估,合并肺动脉高压的患者,右心漂浮导管还是必要做的。目前肺动脉高压的定义也在有变化,LAM逐渐放在第III类肺高压中,PLCH导致的肺动脉高压比较复杂,因为PLCH可能合并多种问题,如果不明确的话,PLCH放在第V类。PLCH导致的肺动脉高压中肯定有III类的因素在其中,另外还有血流动力学的问题,组织的问题血管的扭曲,这是II类原因,另外可能有血管的重塑,这是I类问题,另外有没有小的血栓的问题,这是IV类,目前不清楚。PCH/PVOD是I类的PAH,有特发的,也有继发(感染等),距最近的指南,PCH和PCOD的分类也分出来了,叫做以PCH和PVOD为主的PAH,因为很多PCH/PVOD的改变也与继发因素也有关系。另外这个患者有些可惜,2013年就发现肺部阴影,但没有做右心的评估,也没有戒烟,一直到2018年病情发展到了需要肺移植的程度。如果能在疾病的早期就开始让患者戒烟,并间断的做右心功能的评估,给予一定的干预,也许肺移植并非必需。
中日医院PCCM科王诗尧大夫
患者诊断PAH明确,而且较为严重,与病变的进展程度平行,患者后期存在显著的低氧,考虑可能存在肺部疾病/低氧诱导肺动脉高压。但是PLCH的病理生理学机制之一就是血管病变,其中以闭塞性病变为特征,机制可能是LCH细胞增生堵塞血管管腔,在终末期形成纤维化后,局部组织的扭曲变形也会导致血管闭塞,但是PLCH的血管病变可能不止于此,在研究中发现PLCH的病理表现还可看到动脉内膜的增殖,这说明PLCH的发病机制中可能本身就存在血管病变,可能是PLCH分泌某些因子导致血管内皮增殖导致PAH,这就类似I型PAH的表现。所以PLCH形成PAH的机制可能是多种的。
中日医院病理科赵玲大夫
患者病理切片,低倍镜下肺组织内有一些囊形成,大小不等,一些可以见到肺泡结构仍然存在,部分可见星芒状纤维化的区域,部分组织内、支气管黏膜下、纤维化区域、及肺泡腔内也可见嗜酸性粒细胞,部分肺泡腔内可见含铁血黄素巨噬细胞。一般在LAM囊壁可见增生的梭形的LAM细胞,该患者囊壁内可见较多嗜酸性细胞,没有见到LAM细胞的存在。血管内膜可见偏心性增生,弹性动脉可见内膜增生,弹力纤维染色可见血管的闭塞。局部肺静脉可见闭塞,伴毛细血管瘤样表现,肺泡间隔增宽伴明显增生的毛细血管,患者肺泡间隔内的毛细血管至少有3~4层。结合患者有嗜酸性粒细胞浸润,部分有纤维化表现,也有相对显著的血管表现,在50多张片子中仅有一张片子内可见一灶的朗格汉斯细胞,CD1a和S100阳性,故诊断PLCH明确。而且是burn-out的PLCH,包括星状瘢痕,嗜酸性粒细胞浸润,吸烟相关改变(DIP),血管病变。
王辰院士做总结发言

1、回顾最近患者4年的影像学表现,一开始从双上肺小结节合并囊性变,逐渐发展到从上到下的厚壁空洞的表现,这种空洞样病变与LAM明显不符,而与PLCH影像特点是相符的。所以,临床医生一定要仔细追踪病史,不能割裂的看待某一次化验检查,连续追踪才能发现问题;另外,临床医生考虑问题要多一条思路,不要固化于某些著名医院的诊断,人云亦云,而应该在基于实际病情和掌握资料的基础上做出自己的判断。
2、LCH大部分是全身性疾病,一小部分是只累及肺脏的PLCH,所以患者应该完善全身系统的评估,如肝脾、淋巴结、骨骼等,以及易感基因的检查。呼吸科医生应该着眼全局,不能被「一肺障目」。
3、患者的病理只找到少量的朗格汉斯细胞,可以联合多单位会诊,我们应该有胸怀和气度去接受挑战。有自信心检视自己的不足。
4、肺移植的指证,这个患者已经发展到疾病的晚期,合并右心衰竭,有肺移植的指证,但是反过来说,这种PLCH的患者是否完全没有可逆性?如果一开始就戒烟,会不会结局不一样?所以临床医生不光要在疾病治疗方面给予干预,在生活不良习惯的干预方面也应该有所行动。
5、患者肺移植后治疗,到底LCH是否存在全身受累,是否需要化疗?未来是否有复发的可能?环孢素是一种细胞毒药物,此患者是否可用CsA代替他克莫司,来减少PLCH复发的可能?这些问题要考虑。
6、这次是我们PCCM fellow的大查房,是我们专培最重要的环节之一。特别是年轻医生,临床上走的每一步,都要带着「检视性思维」去审视,不要随波逐流,而应该有更多自己的思考,积极地发言,表达自己的观点,在相互交流中才能有更好的提高!
作者介绍

荆蕾
PCCM医师,中日友好医院肺移植科临床博士后,吉林大学白求恩第一医院呼吸与危重症医学科博士研究生,曾于多伦多总院附属Latner胸外科实验室进修学习共2年。

陈文慧
副主任医师,中日友好医院肺移植科副主任。国家卫计委肺移植专业质控中心副主任委员、中国医师协会呼吸医师分会肺癌工作委员会委员、中国抗癌协会整合肿瘤学分会委员会委员、围手术期学组副组长、中华医学会呼吸危重症学组委员等。
特别鸣谢
阿斯利康(中国)
对本季PCCM疑难病例讨论直播的支持


