
原文:Fishman JA, Gans H; AST Infectious Diseases Community of Practice. Pneumocystis jiroveci in Solid Organ Transplantation - Guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant. 2019 May 11:e13587. doi: 10.1111/ctr.13587. [Epub ahead of print]
摘要
美国移植学会(AST)感染病实践委员会发布的更新版指南,回顾了移植后患者发生耶氏肺孢菌(PJ)感染的诊断、预防和处置。耶氏肺孢菌肺炎(PJP)可来源于空气传播或既往感染的再激活。也有移植患者间发生院内聚集性感染的描述报道。
预防性使用甲氧苄氨嘧啶-磺胺甲噁唑(TMP-SMX)能防止PJP发生。如果没有预防,发生PJP的风险主要是在器官移植后的前6个月,但也可能延迟发生。感染风险因素包括淋巴细胞计数降低、巨细胞病毒(CMV)感染、低丙种球蛋白血症、抗移植排斥或皮质类固醇激素治疗,以及患者高龄>65岁。
PJP患者典型表现包括发热、咳嗽和低氧性呼吸困难。胸部影像检查以CT扫描最佳,通常显示弥漫性间质病变。患者常常表现氧分压<60mmHg、血清乳酸脱氢酶和血清(1→3) β-D-葡聚糖升高。对呼吸道标本进行直接免疫荧光染色是特异性诊断手段,但获取标本需要侵入性操作;定量PCR是一种实用的辅助诊断手段。
治疗可选择TMP-SMX,在选择替换方案前,应记录药物过敏反应。早期辅助糖皮质激素治疗可能有效。移植后PJP常规预防推荐移植后至少6~12个月,以TMP-SMX为佳。
引言:耶氏肺孢菌原称卡氏肺囊虫,在实体器官和干细胞移植但未接受有效预防的免疫功能低下患者,仍然是一种重要的机会性真菌感染病原体 [1-4]。随着生存期延长和免疫抑制剂强化应用,接受实体器官移植的患者发生PJP被持续重点关注 [5]。主要进展包括诊断方法的提高和不完全有效的预防,前者有助于对于非典型病例的诊断。
病原学 - 微生物
肺孢菌的包囊是在1909年由Chagas首次描述,1910年又被Carinii描述为克氏锥虫生命周期中的一种表现类型。1952年,这种病原微生物首次证实与人类疾病有关,当时描述为在营养不良儿童和新生儿发病的间质性浆细胞肺炎 [6]。在1970s,由于接受皮质类固醇和化疗药物导致的PJP患者发病率增加,促使疾病控制中心(CDC)开始研究。但直到80年代,作为AIDS相关第一特征性疾病,PJP才引起全球重视,而自1979年以来已经有超过200, 000多例PJP患者,造成超过1/4 HIV感染者社区获得性肺炎。为纪念捷克寄生虫学家Otto Jírovec发现该微生物的宿主特异性,这种引起人类感染的病原微生物重新命名为耶氏肺孢菌 [7]。
基于mRNA的保守序列,耶氏肺孢菌被鉴定为真菌(根足虫纲、粘液菌门、接合菌门、裂殖酵母菌属、脉孢菌属、念珠菌属和红色酵母菌),而不是原生动物的寄生虫。
在人类和动物体内,已经发现了该生物体的三种形式:滋养体、包囊和孢子体(或称囊内体)。
滋养体,直径2~5μm,呈圆形或镰刀状,包含一个细胞核、线粒体和多个空泡,同时有伪足和丝足。包囊直径通常3~6μm,它的细胞壁由三层成分组成,细胞浆包含可多达八个多形性卵圆形囊内小体,称为孢子体。另外两种包囊形式也曾描述,但可能只是中间体,为空的或正在形成的包囊。在包囊和滋养体的表面,有许多小的表面突起或管状扩张,形成分枝网络。在肺泡中,肺孢菌被来自自身和宿主的糖蛋白所包裹。该生物体只产生相对有限的表面糖蛋白;在动物和人类来源的菌体中,其通过共享和独有的抗原表位来适应宿主 [8, 9]。细胞壁含有胆固醇,但不含麦角固醇,也不从头合成固醇,因此对唑类和多烯类抗真菌药缺乏敏感性。耶氏肺孢菌的表面富含碳水化合物,包括葡萄糖、甘露糖和β-1,3-葡聚糖,帮助病原体附着在上皮细胞或表面活性剂表面,并发挥吞噬作用,同时也成为诊断检测指标。
肺孢菌的生命周期尚不完全清楚,人类来源的肺孢菌在体外生长也不一致。似乎是包囊中孢子体或其子代发展成滋养体,滋养体成熟后形成包囊并重复生活周期。已经认定滋养体存在有性和无性的中间阶段。在不同宿主、不同免疫缺陷状态的肺孢菌生长可能存在一定差异。
流行病学和风险因素
一些研究表明,环境中可能存在耶氏肺孢菌 [10],但尚未确定导致人类感染的确切环境宿主。出现临床症状的患者几乎完全局限于有免疫缺陷的个体,但血清学研究表明暴露通常发生在儿童时期 [11]。通过对动物模型和对人类肺孢菌的研究表明,新发疾病可能通过空气传播,或来源于以前感染和/或未充分治疗的再激活 [10, 12-15]。已有在心脏、肾脏和肝脏移植患者中发生院内感染暴发的文献描述,包括其分子分型 [16-19],这些证据支持耶氏肺孢菌在医院环境中人与人传播,潜伏期可达150天。在对普遍实施预防措施之前的研究分析表明,实体器官移植患者发生感染的风险约为5~15% [20]。发病率因移植器官、移植地区或中心采取的预防和免疫抑制方式而异。
接受TMP-SMX能有效预防患者PJP发生 [21, 22]。如果不预防,在实体器官移植后6个月内发生PJP风险最大, 尤其是肺移植后的强化免疫抑制期(为抑制免疫排斥而应用大剂量糖皮质激素、淋巴细胞耗竭抗体疗法),和应用糖皮质激素治疗(相当于15~20mg强的松等效剂量应用3~6个月)[20, 23]。值得注意的是,25%患者PJP发生在8周后或更小剂量的糖皮质激素治疗后 [24, 25]。在接受肺或心肺联合移植的患者中,无症状患者的肺孢菌分离率超过10% [26]。
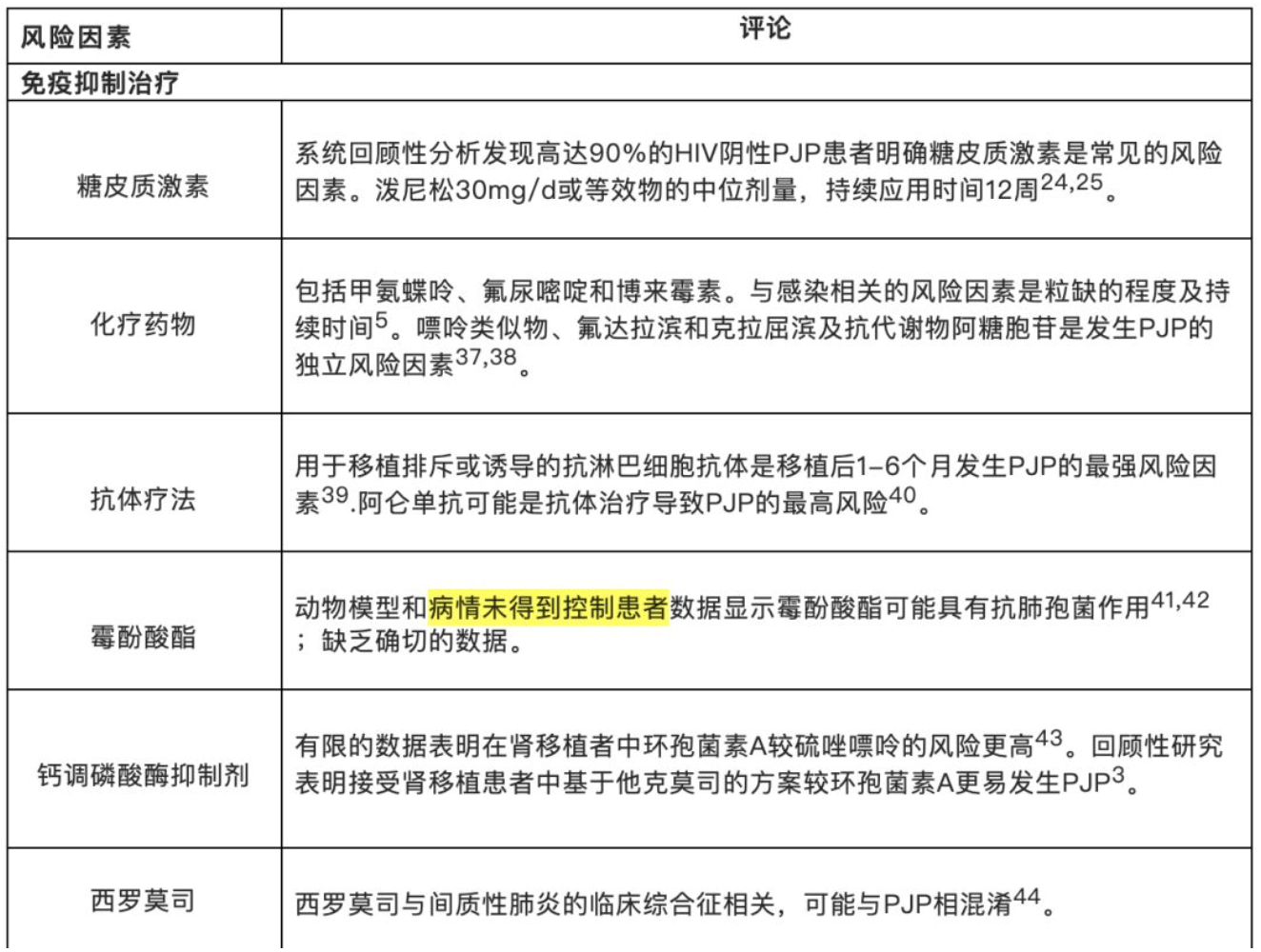
最近的报道显示,尽管移植后6~12个月进行有效的预防措施,但移植后12个月后仍可能出现PJP [22]。风险因素包括总淋巴细胞和CD4+淋巴细胞计数下降、巨细胞病毒(CMV)感染、低丙种球蛋白血症、移植物排斥反应和患者年龄 [23]。PJP也使得西罗莫司肺综合征复杂化,后者为接受以西罗莫司为基础免疫抑制治疗的实体器官移植患者发生的以弥漫性肺浸润为特点的一种特殊综合征。不具有上述风险因素的PJP感染者可能暗示有因多种因素导致的过度的免疫抑制状态(代谢因素、中性粒细胞和淋巴细胞计数与功能、CMV病毒共感染、潜在肺疾病)、暴露于感染者、恶性肿瘤或HIV感染。表1中概述了一些充分描述的有关非HIV感染者发生PJP的风险因素。
【表1】肺孢菌肺炎发生的风险因素
临床表现
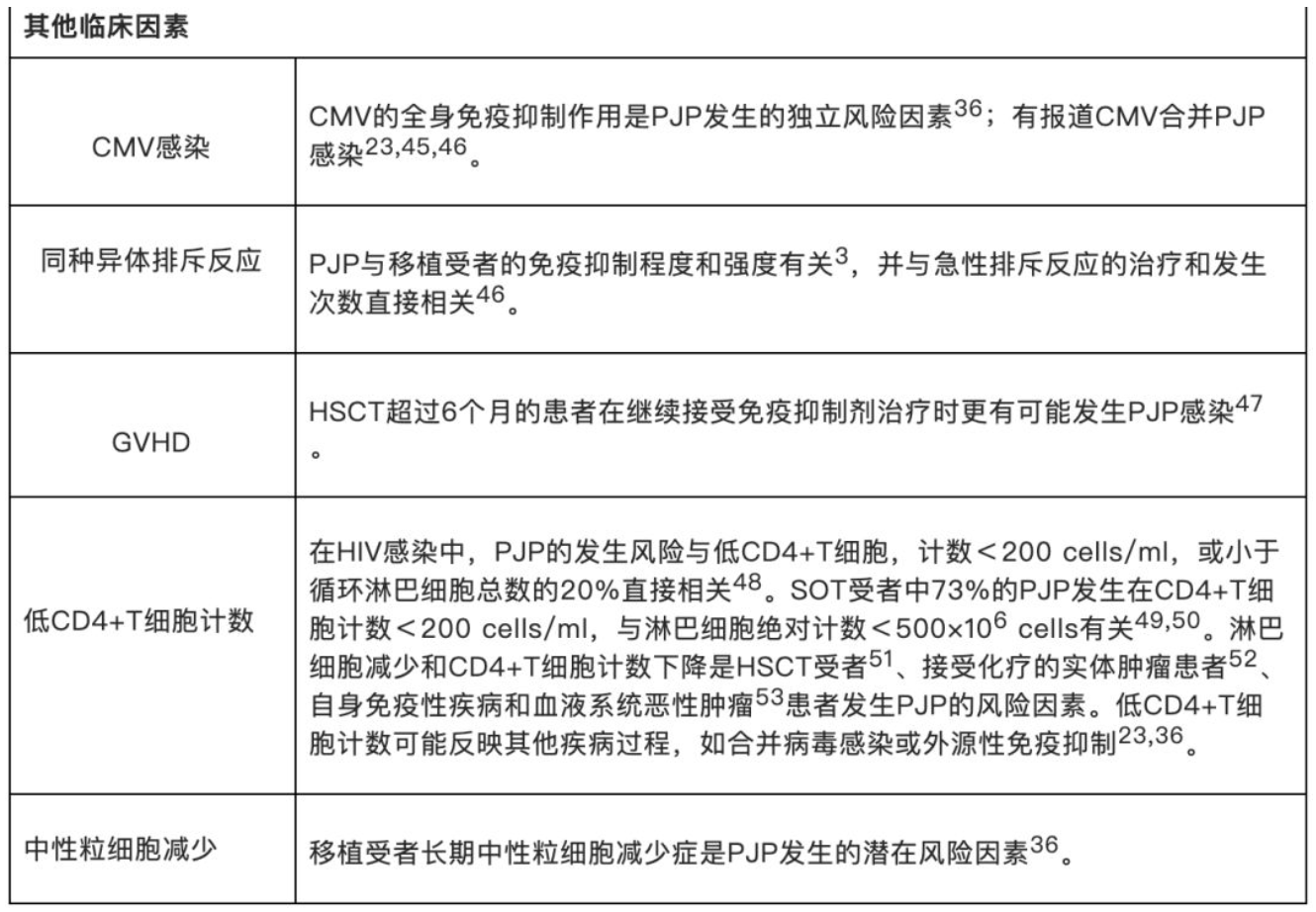
相较于艾滋病患者,HIV阴性患者PJP的症状多变且进展更快。在移植受者中,症状常发生在移植后数天至1~2周,以低氧血症为主,且与影像学表现不符。应用糖皮质激素、钙调磷酸酶抑制剂和西罗莫司可能会掩盖PJP的症状和体征。PJP典型症状和体征 [27] 见表2。除了起病更迅速外,HIV阴性PJP患者的肺炎表现和肺部浸润往往更为严重,伴有更低的动脉血氧分压,以及更频繁发生的呼吸衰竭。
【表2】PJP的症状和体征
诊断策略 胸部影像学
耶氏肺孢菌感染无特征性的影像学表现。其影像学表现形式最终取决于患者的伴随疾病、免疫抑制状态和感染持续时间。早期PJP表现为双侧、肺门周围弥漫性浸润影,进展为蝶翼样间质性改变,浸润通常累及肺尖或肺底。其他少见表现包括结节、单侧浸润、胸腔积液、气胸、淋巴结肿大或肺叶实变。要注意与合并真菌或分枝杆菌感染以及肺移植患者中移植物排斥、CMV感染的鉴别。
实验室评估
用于诊断PJP的非特异性指标(表3)。PO2<60 mmHg伴呼吸性碱中毒。明显低氧血症伴肺泡-动脉PAO2-PaO2梯度升高;几乎所有PJP患者LDH会升高(超过300 IU / ml)[27]。血清中血管紧张素转化酶(ACE)水平升高(非特异性)。血清(1→3)β-D-葡聚糖升高,敏感性高(> 90%),但特异性较低(<80%)[28-32]。
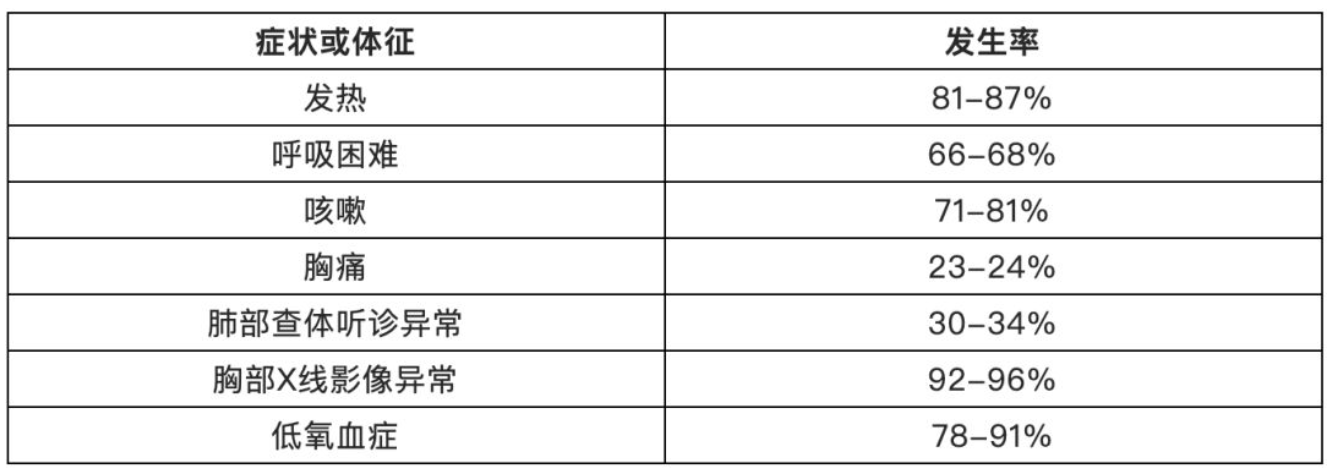
【表3】伴有血液系统肿瘤、干细胞移植和实体器官移植PJP患者推荐的诊断手段
微生物学
明确诊断PJP靠肺组织或呼吸道分泌物中找到肺孢菌(见表3)。标本选择应考虑的因素包括诊断灵敏度和侵入性诊断技术的可行性。存在肺弥漫性改变者,应从上叶进行肺泡灌洗。
组织病理学和侵入性诊断
肺孢菌感染肺的组织病理学很独特。肺泡腔内充满泡沫状类似蜂窝样的嗜酸性渗出物,肺泡间质可见多形核白细胞和淋巴细胞浸润。呈片状分布。
治疗
一经确诊或拟诊PJP,药物治疗选择见表4。推荐移植受者将TMP-SMX作为首选用药治疗PJP。重症患者,静脉注射喷他脒仍是继TMP-SMX后的二线药物。低氧血症患者(室内空气时pAO2 <70mmHg),推荐联合糖皮质激素作为辅助治疗。应尽早使用,最好在抗菌治疗的72h内使用。糖皮质激素的最佳剂量尚未确定,但推荐成人40~60 mg泼尼松(或等效物)每日两到三次;儿童1mg/kg每天两次,持续5~7天,然后逐渐减量,疗程7~14天。抗菌治疗时间尚未完全确定,但至少14天,通常需要更长的疗程,为避免疾病进展和复发建议治疗21天。集落刺激因子(G-或GM-CSF)和降低免疫抑制等辅助治疗尚无临床试验支持。
反应较差治疗或有非典型表现时,需要考虑合并其他病原体感染可能。巨细胞病毒(CMV)肺炎可能需要抗病毒治疗。
【表4】治疗PJP的药物选择
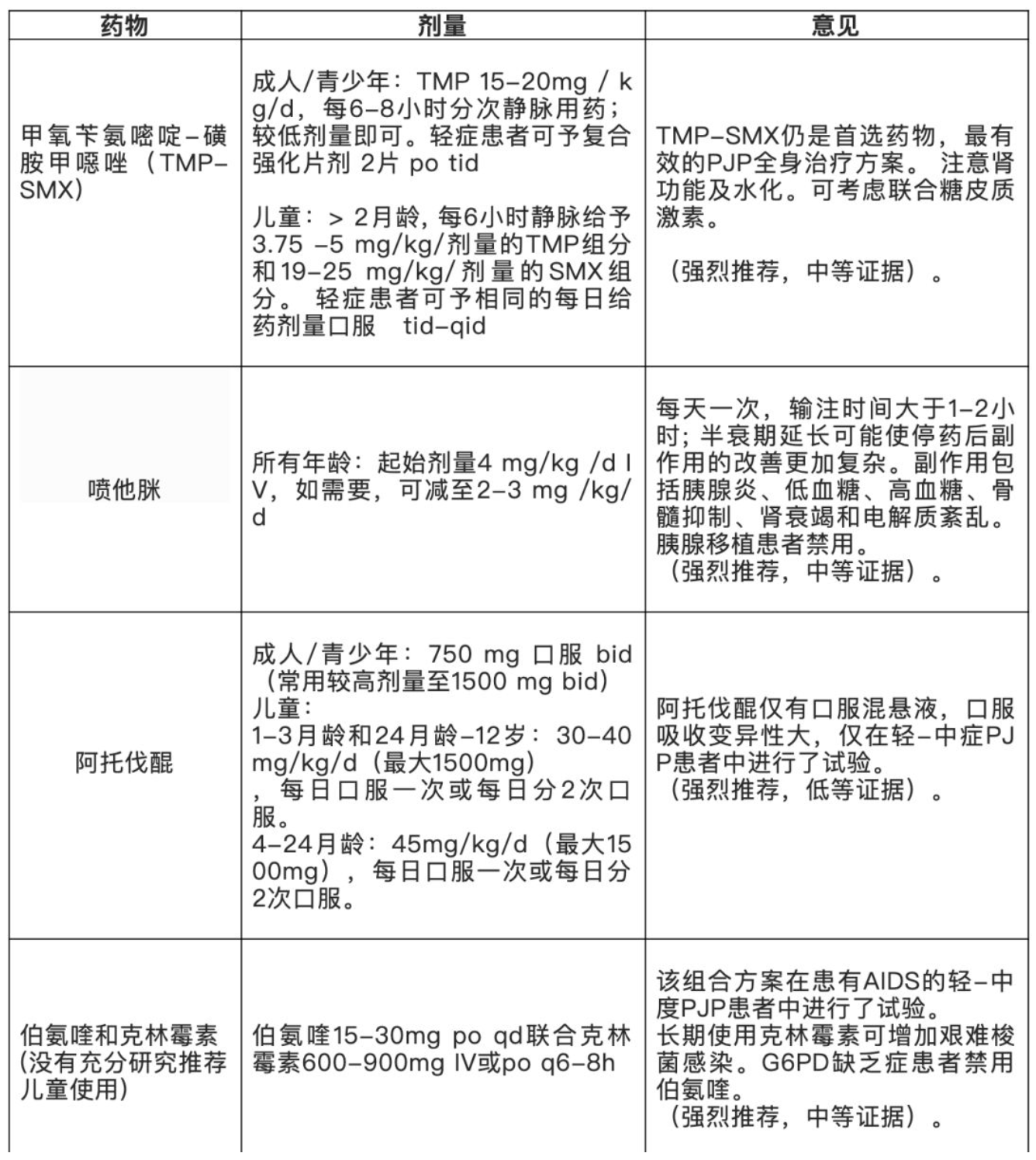
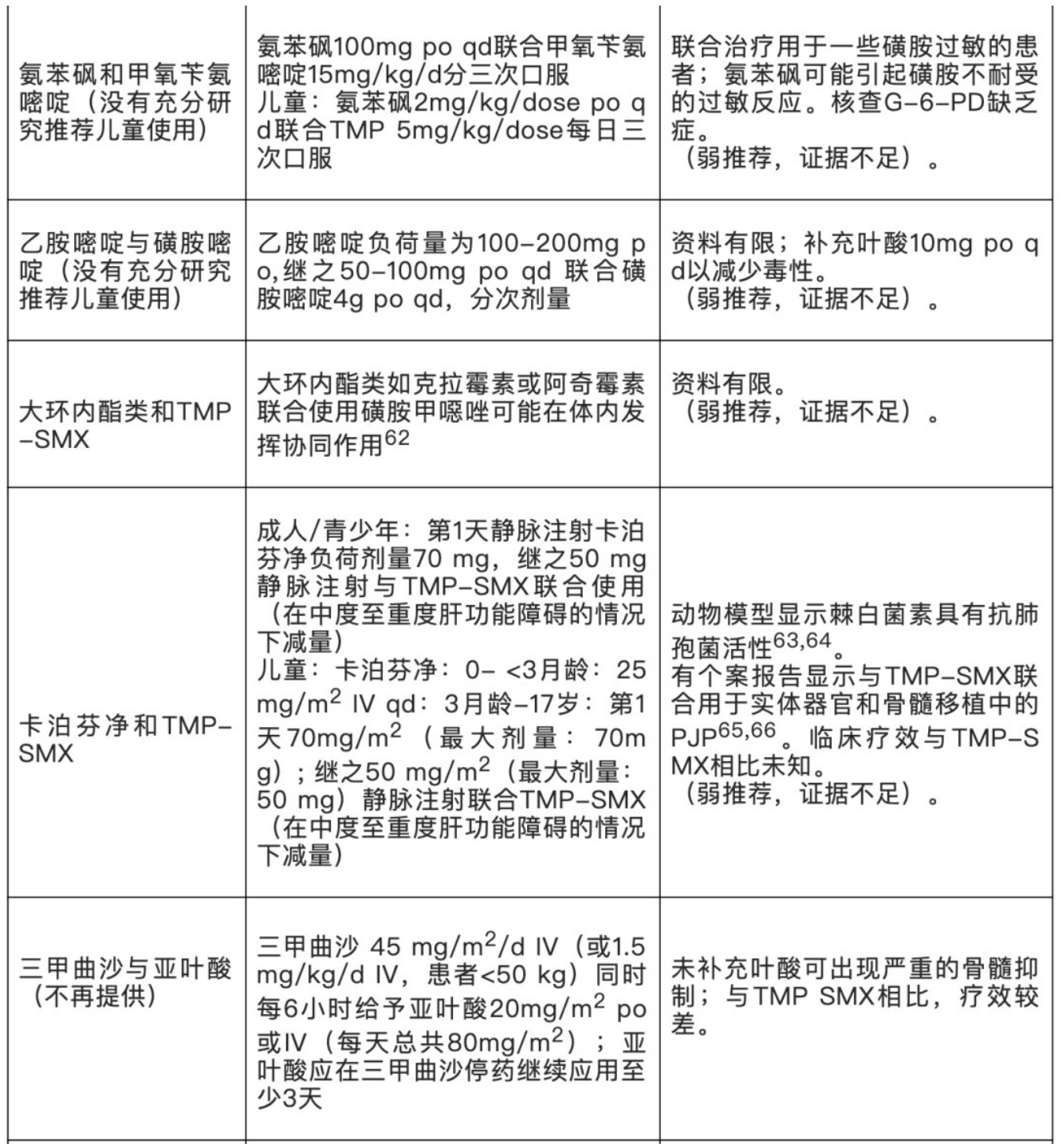

预防及感控问题
建议所有实体器官移植受者在移植后进行至少6~12个月的抗肺孢菌预防治疗(强烈推荐,中等证据),以及至少有3~5%可能性发生PJP的等待移植受者(强烈推荐,中等证据)。
对于肺移植和小肠移植受者、免疫抑制强度较高患者、或有既往PJP感染史或慢性CMV感染患者,可能需要终身预防治疗(强烈推荐,低等证据)。
甲氧苄氨嘧啶-磺胺甲噁唑(TMP-SMX)是预防PJP的首选药物(强烈推荐,高等证据)。氨苯砜通常用作PJP预防的二线药物。
由于可能存在人与人之间的传播,院内可能出现肺孢菌感染暴发。
未来研究方向
肺孢菌在不同宿主潜伏感染的机制,更快速的侵入性疾病诊断技术,了解宿主对肺孢菌的免疫反应。
参考文献略,见原文。
译者:韩秀迪,青岛市市立医院本部呼吸与危重症医学科;王亚东,河北医科大学第三医院感染科。审校:王一民、宁永忠、鲁炳怀。


