
编前语
青年男性近期出现活动后呼吸困难,最初只认为是精神压力较大,但症状越来越多、越来越重,经历六个阶段,辗转六家医院,跨越大江南北,真相在哪?是较常见的肺炎吗?能排除肺结核吗?确实是肺栓塞吗?如果不是这三者,又会是什么?
先看看疾病的六个阶段
第一阶段:活动后呼吸困难,间断发热,诊断肺炎;
第二阶段:咯血、胸痛、肺部阴影,诊断肺炎,继续抗感染;
第三阶段:痰中带血、低热、血沉快、CRP升高,寻因未果;
第四阶段:肺部阴影、胸腔积液、疑诊结核,寻找证据;
第五阶段:肺部阴影此起彼伏,经皮肺穿提示梗死,CTPA见到血栓,抗凝治疗症状好转;
第六阶段:再次发热、肺部阴影、右侧肺炎、肺栓塞、胸腔积液。
病例详情
患者张某,男,23岁,学生。
主诉
间断发热伴呼吸困难2月余。
现病史
患者诉2月余前(8月25日)无诱因出现活动后呼吸困难,表现为快走或者上楼受限,伴失眠多梦,无咳嗽咳痰,无胸痛,无畏寒发热,未予重视,后因症状逐渐加重(8月31日)至当地A医院胸外科就诊,行心电图检查提示:窦性心律,心电图大致正常。胸部正位片示:正常。心脏超声示:未见异常。诊断考虑患者精神压力较大所致,未予处理。
一周后,患者无明显诱因出现咳嗽,无咳痰以及痰中带血,活动后呼吸困难较前轻微加重,无胸痛心悸,自觉低热,测体温37~38℃左右,自行口服退热药后体温可降至正常,但维持约4小时即再次发热……
9月4日,患者至当地A医院呼吸科门诊就诊,查血常规示:白细胞:10.35×10^9/L↑(3.5-9.5);中性粒细胞:7.57×10^9/L↑(1.8-6.3),中性粒细胞百分比:73.2%(40-75);淋巴细胞:19.1%(20-50);红细胞:4.60×10^12/L(4.3-5.8);血红蛋白:142g/L(130-175);血小板:336×10^9/L(125-350),D-二聚体:100ug/L(<550); BNP:12.31ng/L(0-100)。考虑「肺部感染」,先后自行口服头孢类抗菌素及静脉输液(具体不详),呼吸困难及咳嗽轻度好转,但仍有间断热。
9月11日,患者抗感染治疗一周后晨起出现咯血,主要为痰中带暗红色血块,9月12日出现胸痛,右侧明显,体位变化时明显,主要表现为闷痛,无心悸,无意识障碍,无心前区憋闷感,遂于9月16日就诊于B医院呼吸科门诊;查D-二聚体示:69ng/ml(<255.0ng/ml)。血常规示:白细胞:9.3×10^9/L(3.5-9.5);中性粒细胞:6.9×10^9/L↑(1.8-6.3),中性粒细胞百分比:73.8%(40-75);淋巴细胞:18.2%(20-50);红细胞:4.30×10^12/L(4.3-5.8);血红蛋白:133g/L(130-175);血小板:402×10^9/L↑(125-350)。肌钙蛋白和电解质正常。行胸部CT示:右肺炎症改变,建议抗炎后复查。诊断为「肺部感染」,建议其住院治疗,患者拒绝。
3天后(9月18日)胸闷、呼吸困难较前进一步加重,伴有明显的痰中带血,初为洗肉水样,后转为暗红色,多在清晨出现,遂就诊于C医院住院治疗。
入院查体
T 37.5°C;P 109次/分,双肺底可闻及少许湿性啰音。查血常规示:白细胞:10×10^9/L(4-10);中性粒细胞:7.26×10^9/L(2-8),中性粒细胞百分比:72.4%(50-70);淋巴细胞:20.9%(20-40);红细胞:4.40×10^12/L(3.5-5.5);血红蛋白:132g/L(110-165);血小板:392×10^9/L↑(100-300)。C反应蛋白:96mg/L(0-3) ↑,血沉:78mm/H↑。降钙素原:正常。肝肾功能电解质:正常。尿粪常规正常。心电图正常。痰细菌培养、抗酸染色为阴性。
住院期间(9月21日)至D医院结核科就诊,行PPD试验阴性,气管镜检查灌洗液抗酸染色示:阴性,利福平快速检测组套(gene-Xpert)阴性,给予给予「莫西沙星」联合「美洛西林/舒巴坦」抗感染及化痰治疗后,咳嗽,胸闷,气喘好转,体温正常。
9月23日复查血常规示:白细胞:6.6×10^9/L(4-10);中性粒细胞:4.77×10^9/L(2-8),中性粒细胞百分比:72.0%(50-70);淋巴细胞:20.7%(20-40);红细胞:3.90×10^12/L(3.5-5.5);血红蛋白:115g/L(110-165);血小板:326×10^9/L↑(100-300)。9月25日复查胸部CT示:右肺炎症,较前无好转,伴出现右侧胸腔积液。遂自动出院。
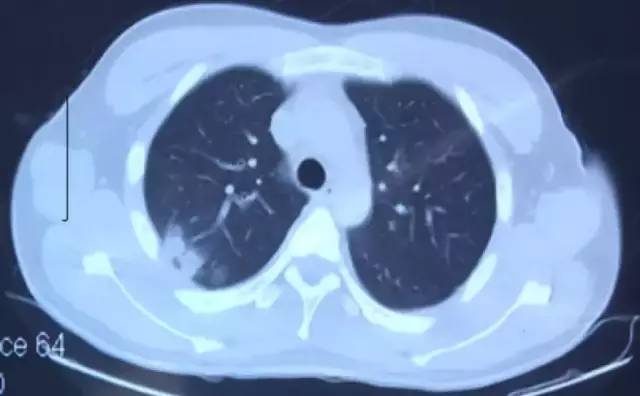
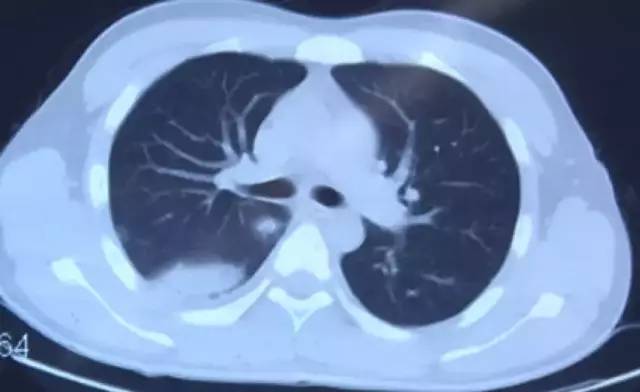
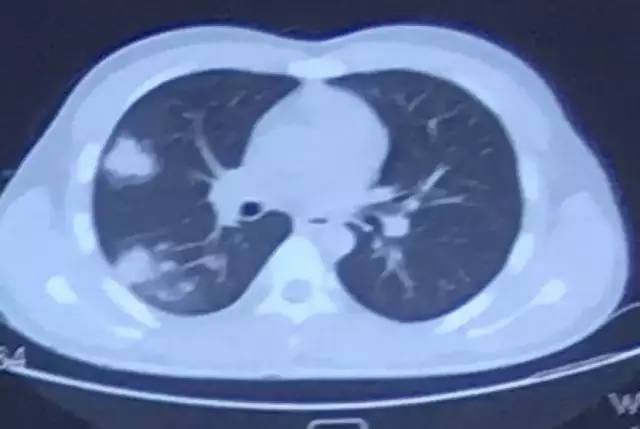
9月16日胸部CT
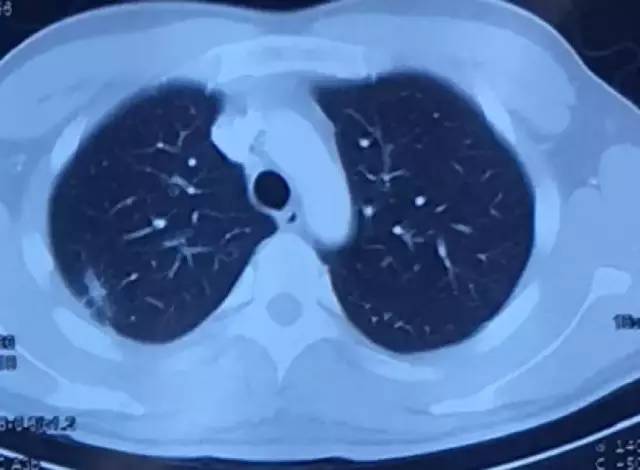
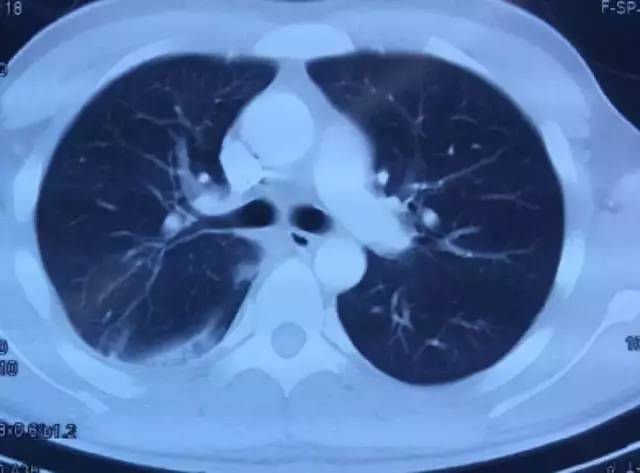
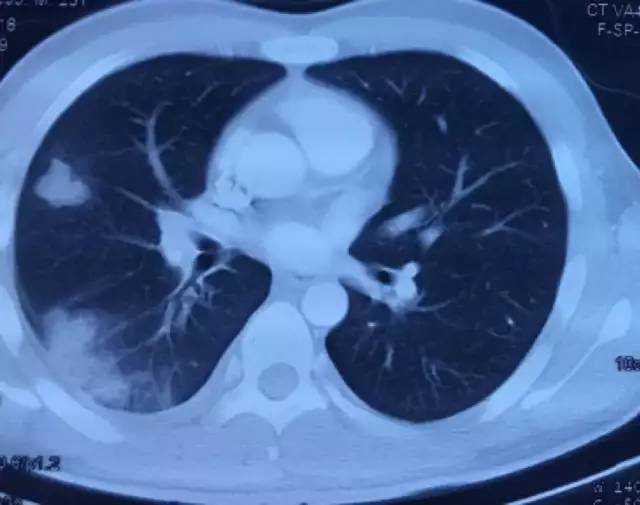
9月25日胸部CT
9月26日至E医院住院治疗,入院查体主要为心率99次/分。余无特殊。
辅助检查
查血常规示:白细胞:6.59×10^9/L(4-10);红细胞:3.96×10^12/L(3.5-5.5);血红蛋白:119g/L(110-165);血小板:344×10^9/L↑(100-300)。血沉:24mm/H↑。CRP:54.86mg/L↑。凝血示:PT:12.2秒;PT.INR:1.06,APTT:30.3秒,Fib:5.4g/L,TT:15.2秒,DD:0.13mg/L。生化示:ALT:51U/L,AST:27U/L,CK:45U/L,CK-MB:6U/L。肿瘤标记物:CA125:51.25u/ml↑(0-35);余(AFP、CA50、CA153、CA199、CYFRA211、铁蛋白、NSE、TPSA、CEA、SCCA)均阴性。病原方面:血清结核抗体:16KDa:阴性。38KDa:阳性。T-SPOT:阴性。G试验:阴性。痰涂片染色以及培养阴性。肺穿刺组织细菌、真菌、抗酸抗菌涂片、染色以及培养阴性。心电图:窦性心律不齐。
胸部增强CT示:右肺感染性病变可能,右侧胸腔少量积液。右肺下叶穿刺涂片示:镜下见部分坏死样物。CT引导下经右肺穿刺活检病理示:镜下见均为梗死物,坏死物及少量梭形细胞,期间散在少量淋巴细胞。抗酸染色阴性。
考虑肺栓塞,遂行CTPA示
右肺感染,较前比较病灶有吸收,右中下肺动脉栓塞可能。并进一步行超声心动图未见异常。行下肢血管彩超示未见明显异常。
10月8日复查血常规,白细胞:8.12×10^9/L;红细胞:4.13×10^12/L;血红蛋白:124g/L;血小板:312×10^9/L。凝血示:PT:11.1秒;PT.INR:0.97,APTT:33.5秒,Fib:3.25g/L,TT:17.5秒,DD:0.06mg/L。CRP:8.57mg/L↑。10月11日血常规:白细胞:8.2×10^9/L;红细胞:4.23×10^12/L;血红蛋白:127g/L;血小板:292×10^9/L。凝血示:PT:12.9秒;PT.INR:1.12,APTT:34.2秒,Fib:4.93g/L,TT:14.2秒,DD:0.06mg/L.血气分析:PCO2:39mmHg;P02:104.4mmHg。自身免疫抗体均为阴性。
最终诊断
右肺炎、右侧胸腔积液、右肺栓塞
先后给予左氧氟沙星(9-26至10-3);头孢曲松钠(10-3至10-16)抗感染,低分子肝素桥接华法林抗凝(10-7开始)等治疗后,患者病情有所好转,发热减轻,胸闷气短,胸痛以及咳嗽症状均好转。10月16日出院。
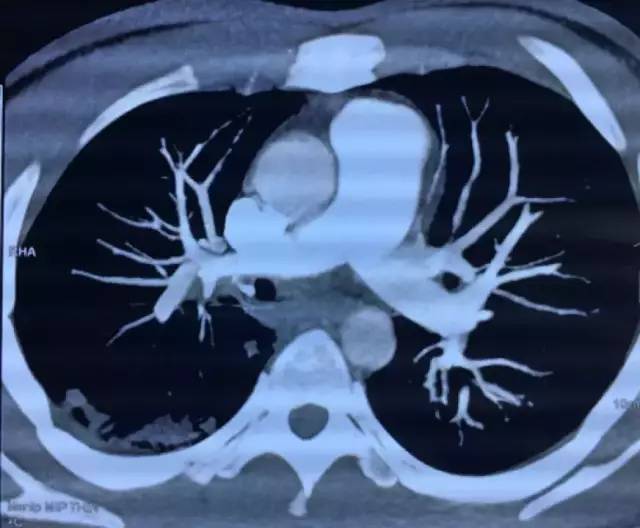
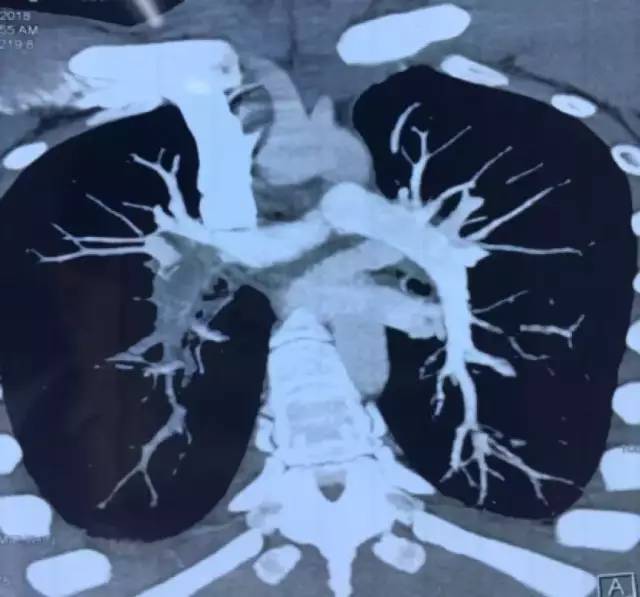
9月28日CTPA
10月17日,再次出现胸闷憋气,胸痛,伴有发热,轻微咳嗽,痰少。10月19日就诊于F医院,查凝血示:PT:17.8秒,PTA:56%;INR:1.49;APTT:48.5秒。血常规示:白细胞:11.39×10^9/L(4-10);中性粒细胞:9.33×10^9/L(2-8),中性粒细胞百分比:81.9%(50-70);淋巴细胞:11.9%(20-40);红细胞:4.47×10^12/L(3.5-5.5);血红蛋白:133g/L(110-165);血小板:320×10^9/L↑(100-300)凝血示:凝血酶原时间:18秒,凝血酶原时间活动度:55%;国际标准比值:1.50;活化部分凝血活酶时间:43.4秒,D-二聚体:0.40;纤维蛋白原降解产物:2.50。NT-proBMP:11.50(0-250)。血气分析:PH 7.435;PO2:86.1mmHg;PCO2:36.1mmHg;cLac:0.62mmol/L;BE:-0.5。肌钙蛋白、肌红蛋白、肌酸激酶同工酶均正常范围。
10月20日,G医院急诊科行胸部CT示:两肺炎症,右侧胸腔积液。期间仍有发热,体温波动在37~38°C之间,胸闷憋气,胸痛基本平稳。轻微咳嗽,痰少。无咯血。仍诊断为「右肺栓塞、右肺炎、右侧胸腔积液」;建议当地医院抗凝治疗,随诊。
10月25日,再次出现发热体温最高达38.5℃,遂至H医院就诊,诊断为「肺栓塞、肺炎、胸腔积液」;
入院查体
T 38.5°C;P 106次/分,R 18次/分,血压119/79mmHg。余正常。辅助检查:血常规示:白细胞:9.63×10^9/L;红细胞:4.78×10^12/L;血红蛋白:138g/L;血小板:385×10^9/L。CRP:74.65mg/L↑(10-25)、56.12mg/L↑(10-28)、68.16mg/L↑(11月5日)正常范围(0-5)。D-二聚体:130ng/ml 0-243)。血气分析示:PH 7.41;PCO2:37.3mmHg;PO2:82mmHg;Lac:1.9mmol/L;BE:-1.4mmol/L。尿粪常规正常。NT-proBNP:5pg/ml(0-125)。病原方面:痰细菌、真菌涂片以及培养均阴性。连续三次痰抗酸染色均阴性。风湿免疫方面:抗核抗体、血管炎抗体谱均阴性。抗心磷脂抗体-IgG:阴性。心电图示:窦性心律,腹部超声示:肝内钙化灶。肺动脉CTA示:1、右肺中叶及下叶肺动脉血栓形成,2.右肺门淋巴结肿大,3.右肺胸膜下多发病变,炎症考虑,肺栓塞待排。
治疗方面
哌拉西林他唑巴坦 4.5g q12h抗感染,氨溴索化痰,华法林4.5mg抗凝治疗12天后,仍有发热。11月4日发热至39℃。11月5日出院。
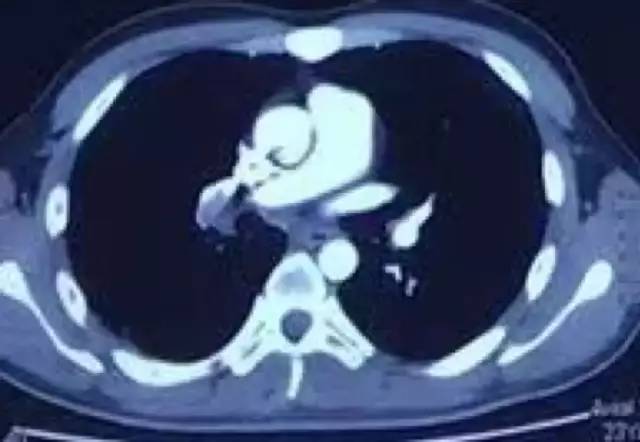
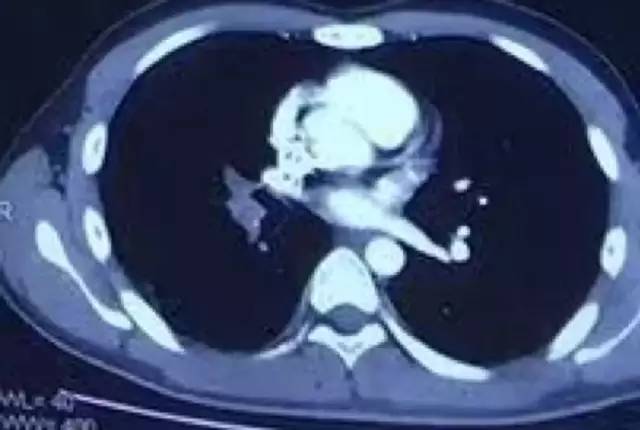
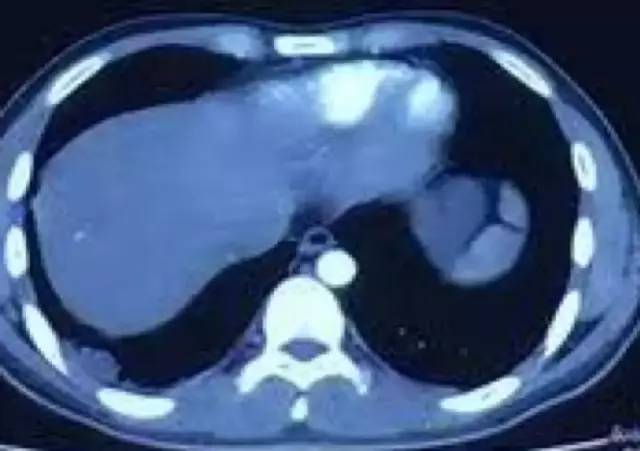
10月31日CTPA
为求进一步诊治,11月9日我院就诊;发病来精神尚可,饮食睡眠好,二便如常,体重下降约3kg。
查体
T:37℃ P:80次/分 R:20次/分 BP:120/80mmHg;双肺未闻及干湿性啰音,心脏腹部查体未见异常,双下肢无水肿。
既往史
2009年外伤致右前臂骨折,经外固定已愈,余既往史、个人史、家族史无特殊。
诊疗过程解析:患者症状总无明显改善?从何寻因?
患者青年男性,入院前多家医院辗转诊治,先后诊断为「肺部感染、肺结核、肺栓塞」,确诊为肺栓塞后给予标准抗凝治疗,症状短暂缓解,其后再次出现咯血、胸痛等症状,患者症状无明显改善。
根据患者入院前CTPA,肺栓塞诊断明确,但治疗效果不佳,故入院后根据2018版肺栓塞指南对于急性PTE诊断与处理的疑诊-确诊-求因-危险分层的策略,立即展开求因——根据VTE危险因素,任何可以导致静脉血流淤滞、血管内皮损伤和血液高凝状态的因素均为VTE的危险因素,包括遗传性和获得性2类。
1、遗传性因素方面
由遗传变异引起,常以反复发生的动、静脉血栓形成为主要临床表现。<50岁的患者如无明显诱因反复发生VTE或呈家族性发病倾向,需警惕易栓症的存在。
2、获得性因素方面
获得性危险因素是指后天获得的易发生VTE的多种病理生理异常,多为暂时性或可逆性的。如手术,创伤,急性内科疾病(如心力衰竭、呼吸衰竭、感染等),某些慢性疾病(如抗磷脂综合征、肾病综合征、炎性肠病、骨髓增殖性疾病等);恶性肿瘤是VTE重要的风险因素,但不同类型肿瘤的VTE风险不同,胰腺、颅脑、肺、卵巢及血液系统恶性肿瘤被认为具有最高的VTE风险,恶性肿瘤活动期VTE风险增加。VTE与某些动脉性疾病,特别是动脉粥样硬化有共同的危险因素,如吸烟、肥胖、高胆固醇血症、高血压病和糖尿病等。心肌梗死和心力衰竭也能够增加VTE的风险。具体如下:

该患者首先常规检查方面:遗传性危险因素结果未见异常。考虑获得性危险因素所致肺栓塞可能性大。
病程中主要阳性结果为:血沉快,CRP高,血小板升高,其余生化未见明显异常。其他方面:风湿,免疫指标:抗核抗体、血管炎抗体以及类风湿抗体均未见明显异常,凝血功能、易栓症、肿瘤及其他慢性疾病等方面未见明确线索以及证据。
总结病例特点
患者为青年男性,以胸痛、咯血为主要表现,发病以来反复多次血沉、CRP、血小板计数等炎症指标异常,其他方面均未见明显异常。CTPA提示为右肺中叶及下叶肺动脉血栓形成。虽然抗核抗体、血管炎抗体、类风湿抗体均为阴性,但是考虑患者发病年龄早,无明显诱因,血沉、CRP升高,病程中伴有发热,病变以单侧为主,不符合单纯肺栓塞表现,需考虑自身炎症性疾病(如大动脉炎或白塞病)继发的可能,综合患者既往史无口腔溃疡等表现及CTPA影像表现,考虑大动脉炎可能性最大。遂安排胸部MRI增强检查示:累及升主动脉、肺动脉主干、右肺动脉及左肺动脉,右肺动脉干鼠尾样明显狭窄,管壁可见延迟强化,符合大动脉炎表现。如下图:
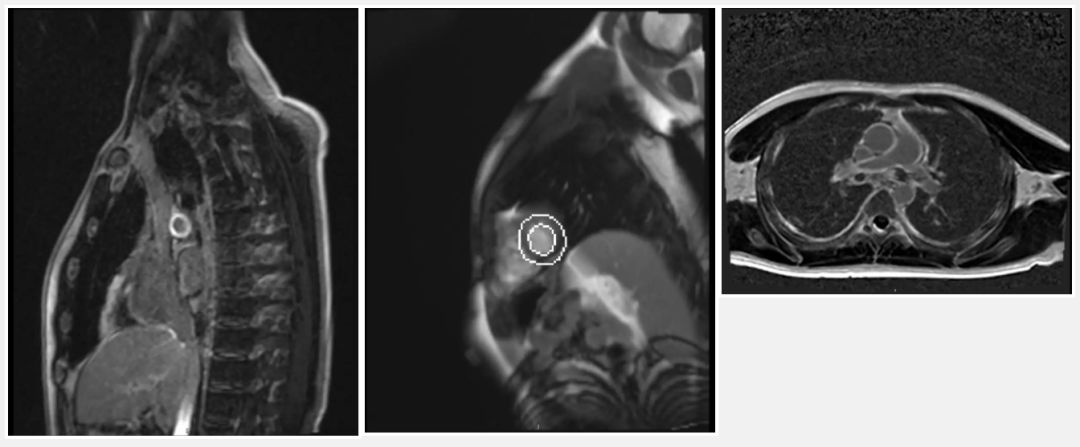
进一步完善四肢动静脉以及颈部血管超声未见异常。
最终诊断
大动脉炎(胸腹主动脉型、肺动脉型)、肺动脉原位血栓形成、肺梗死、胸腔积液
综合患者病史及治疗反应,最后该患者诊断为大动脉炎(肺动脉型)并原位血栓形成。考虑患者血沉,C反应蛋白均升高,经风湿免疫科会诊后给予患者甲强龙40mg qd静点3天后改为强的松40mg口服维持1月,环磷酰胺 0.4g 每半月静点1次,1月后风湿免疫科随诊调整激素用量。抗凝方面患者初期应用依诺肝素6000iu Q12h,后因少量痰中带血改为6000iu qd,出院后给予利伐沙班15mg qd抗凝治疗。
患者自觉一般情况较前好转,无明显胸痛、咯血、发热等不适。1月后患者因大量饮酒,再次出现胸痛,右肺中叶出现新发小楔形影,D-D较前升高,考虑出现新发肺栓塞,将利伐沙班调整为20mg qd。
大动脉炎?相关误诊率达63.6%?
大动脉炎(Takayasu arterifis,TA)是指主动脉及其主要分支的慢性进行性非特异性炎性疾病。本病多发于年轻女性,30岁以前发病约占90%。40岁以后较少发病,国外资料患病率为2.6/百万人。
该病病因尚未完全清楚,有报道自身细胞和体液免疫、遗传、感染(结核杆菌、链球菌、病毒感染等)、性激素多因素参与疾病的发生,诱发主动脉壁和(或)其主要分支动脉壁的抗原性,产生抗主动脉壁的自身抗体,发生抗原抗体反应引起主动脉和(或)主要分支管壁的炎症反应。该病病变多见于主动脉弓及其分支,其次为降主动脉、腹主动脉和肾动脉。主动脉的二级分支,如肺动脉、链状动脉也可受累。受累的血管可为全层动脉炎。
早期血管壁为淋巴细胞、浆细胞浸润,偶见多形核中性粒细胞及多核巨细胞。由于血管内膜增厚,导致管腔狭窄或闭塞,少数患者因炎症破坏动脉壁中层,弹力纤维及平滑肌纤维坏死,而致动脉扩张、假性动脉瘤或夹层动脉瘤。
根据病变部位可分为4种类型
头臂动脉型(主动脉弓综合征),胸—腹主动脉型,广泛型和肺动脉型,肺动脉型包括体动脉合并肺动脉受累和单独肺动脉受累两种情况。各研究报道的肺动脉受累发生率差别较大,从14%~86%不等,单独累及肺动脉的发生率仅为4%。一项对159例大动脉炎的回顾性分析显示头臂动脉型和广泛型最多见,分别占48.4%和30.1%,而肺动脉型仅占5.7%。
大动脉炎临床表现多种多样
在局部症状或体征出现前,少数患者可有全身不适、易疲劳、发热、食欲不振、恶心、出汗、体质量下降、肌痛、关节炎和结节红斑等症状,可急性发作,也可隐匿起病。有研究显示该病有多达50%的病例中会累及肺动脉出现病理性改变;然而,与肺动脉炎相关的症状并不多见。肺部表现包括胸痛、呼吸困难、咯血以及肺动脉高压,呼吸困难的主诉也可能源于主动脉扩张和主动脉瓣关闭不全引起的心力衰竭。
实验室检查结果的改变反映了炎性进程,但多为非特异性的。急性期反应物如红细胞沉降率(ESR)增快、血清C反应蛋白(CRP)和α-2球蛋白浓度增高以及低白蛋白血症反映了潜在的炎性过程。这些检查结果并不总是精确的或稳定可靠的指标,但通常反映了疾病的活动。未在大动脉炎中发现与其他类型血管疾病相关的自身抗体(包括抗核抗体、抗中性粒细胞胞浆抗体、抗DNA抗体和抗磷脂抗体)。但是血清自身抗体如AECA、循环内皮细胞和血清蛋白如血管内皮生长因子、基质金属蛋白酶-9、IL-6和IL-18已被研究作为TA疾病活动的潜在生物标志物,虽目前尚无定论。在一项研究中,TA患者血小板P-选择素和血浆血栓素β2水平较高,血浆环磷酸腺苷水平低于健康受试者,这表明血小板活性增加。Akazawa等证明TA患者的β-血栓球蛋白,凝血酶/ AT-III复合物,纤维蛋白肽A和D-二聚体水平显着高于正常对照组,反映了高凝状态,这可能是原位血栓形成的主要因素。
大部分情况下,诊断部分基于MRI、CT扫描或传统血管造影所示动脉树的影像。传统的血管造影曾经是黄金标准,但目前常规的应用中经常被CT或MRI检查取代,一项研究显示CT血管造影清楚地描述了胸主动脉及其主要分支中的各种腔内变化,包括狭窄、闭塞、扩张和动脉瘤。
CT血管造影准确描绘了200条动脉中的190条(95%),尽管5例(2%)高估了狭窄闭塞病变的程度,5例(2%)低估了。但CT血管造影能提示血管壁的变化,包括壁增厚,钙化和壁血栓,而常规血管造影未见。CT血管造影在诊断大动脉炎中的敏感性和特异性分别为95%和100%,并且在检测血管壁改变方面比传统血管造影更敏感。
美国风湿病学会1990年制定了大动脉炎的分类标准,此标准主要是目的是区分大动脉炎与其他类型的血管炎。
具体如下:
①发病年龄小于等于40岁;
②肢体跛行;
③单侧或双侧肱动脉搏动减弱;
④双上肢收缩压相差至少10mmHg;
⑤单侧或双侧锁骨下动脉或腹主动脉处闻及杂音;
⑥主动脉全程、其一级分支或上下肢近端大动脉的动脉造影所示动脉狭窄或闭塞,且不能用动脉硬化、纤维肌发育不良或其他原因解释。
若具有上述6项分类标准中至少3项,则患者可被认为有大动脉炎;该分类标准的敏感性和特异性分别为90.5%和97.8%。
但是临床上在诊断大动脉炎肺动脉受累时,并不能完全采用上述大动脉炎的诊断标准,如单纯累及肺动脉时,因未能满足3项指标而排除大动脉诊断,容易造成漏诊,应同时参考以下几点:
①是否存在呼吸困难等肺动脉病变的临床表现;
②红细胞沉降率、C反应蛋白等免疫指标异常;
③CTPA或肺动脉造影表现为肺动脉多发狭窄,扭曲,管腔变细和扩张并存,管壁增厚,管腔呈鼠尾状改变等;
④除外其他引起肺动脉狭窄或闭塞的原因,如先天性肺动脉狭窄、先天陛肺动脉缺如、肺动脉内血栓、肿瘤、白塞病和肺部慢性感染性疾病累及肺动脉等。
关于治疗
目前认为最有效的仍然是皮质类固醇激素,2009年欧洲抗风湿病联盟(EULAR)指南推荐使用泼尼松初始剂量1mg/kg/d (最大剂贯60 mg/d)。维持3~4周后逐渐减量,随后规律减量至停药。然而,大量的患者在皮质类固醇激素逐渐减少的过程中出现复发,通常联合使用免疫抑制剂,如甲氨蝶呤、硫唑嘌呤、来氟米特、霉酚酸酯和环磷酰胺。越来越多的证据也表明,抗肿瘤坏死因子(TNF)、利妥昔单抗等生物制剂可有效用于难治性病例。除了免疫抑制治疗外,缺血症状患者该需要血管内干预或血管手术治疗。
最后,有文献报道大动脉炎累及肺动脉误诊率达63.6%,误诊时间1个月~10年不等。最常误诊为肺栓塞,其次为肺结核和肺炎。该患者在明确诊断之前先后诊断为肺炎、肺结核、肺栓塞,误诊时间达2月余。
分析误诊原因
① 临床症状上:主要表现为低热,咳嗽伴有呼吸困难,故易误诊为肺结核和肺炎。如果不做肺血管的影像学检查,很难得出正确的诊断。
② 体格检查不仔细,如未测量双上肢血压进行对比,未听诊颈动脉、胸、腹主动脉及肺野区血管杂音等有重要提示意义的体征。
③ 大动脉炎缺乏特异性血清标志物,血常规检查可有贫血、白细胞升高、血小板升高等,活动期ESR、CRP可明显升高,稳定期时这些指标正常更易忽视本病。
④ 大动脉炎侵犯肺动脉及肺栓塞均为肺血管受累疾病,均使血流通过减少或中断,放射性核素肺通气/灌注显像均存在灌注缺损,容易误诊为肺栓塞。
但肺动脉炎患者的CTPA表现与肺栓塞明显不同,所有患者肺动脉内均没有充盈缺损或附壁的充盈缺损,而主要以肺动脉狭窄闭塞为主,少部分活动期患者可见肺动脉壁增厚。
另外,对于合并肺动脉高压的患者,多表现为左右主肺动脉的重度狭窄,甚至整个肺叶动脉及其分支不显影。在肺动脉造影检查中,会发现肺动脉呈鼠尾状变细、闭塞改变,远端分支不显影。肺动脉走形不自然,僵硬、扭曲变形,管腔多发狭窄,分支纤细。当出现上述表现时,应首先考虑肺动脉炎而非肺栓塞。而肺栓塞的影像学上肺动脉充盈缺损、缺支;急性栓子多呈中心性充盈缺损,可见轨道征、漂浮征、蜂窝征;慢性血栓多呈附壁型充盈缺损或血管闭塞。误诊暴露出对于大动脉炎累及肺动脉的诊断意识不足,且对肺动脉炎的影像学认识不足,结合患者病史进行病情全面分析的能力不够。
因此,加强临床医师对该病的认识,拓宽诊断思路,提高警惕性,详细询问病史,对患者的全面仔细的体格检查,及时完善血管影像学检查,尽可能减少误诊误治,都是我们在以后的临床工作中应该引起重视和关注的地方。
参考文献
[1] 中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018,98(14):1060-1087.
[2] 李菁, 朱孟铸, 杨云娇, 等. 多发性大动脉炎合并活动性结核感染36例的病例对照研究[J]. 中华风湿病学杂志, 2016,20(3):176-180.
[3] 孔秀芳, 姜林娣. 大动脉炎诊断治疗的研究进展[J]. 中华医学杂志, 2016,96(27):2203-2205.
[4] 中华医学会风湿病学分会. 大动脉炎诊断及治疗指南[J]. 中华风湿病学杂志, 2011,15(2):119-120.
[5] 党爱民, 刘国仗, 郑德裕. 大动脉炎易感性与HLA-DRB基因相关性研究[J]. 中华心血管病杂志, 2000,28(5):374.
[6] 温淑云, 张文, 赵岩, 等. 大动脉炎临床特征及治疗转归173例分析[J]. 中华风湿病学杂志, 2011,15(9):604-607.
[7] 窦静波, 龚娟妮, 马展鸿, 等. 大动脉炎累及肺动脉的临床分析[J]. 中华结核和呼吸杂志, 2016,39(8):603-607.
[8] 邓小虎, 黄烽. 大动脉炎159例回顾性临床分析[J]. 中华风湿病学杂志, 2006,10(1):39-43.
[9] Arend W P, Michel B A, Bloch DA, et al. The American College of Rheumatology 1990 criteria for theclassification of Takayasu arteritis[J]. Arthritis Rheum, 1990,33(8):1129-1134.
[10] Karadag B, Kilic H, Duman D, etal. Takayasu disease with prominent pulmonary artery involvement: confusionwith pulmonary disease leading to delayed diagnosis[J]. Mod Rheumatol,2008,18(5):507-510.
[11] Yamada I, Nakagawa T, Himeno Y,et al. Takayasu arteritis: evaluation of the thoracic aorta with CTangiography[J]. Radiology, 1998,209(1):103-109.
[12] Seyahi E. Takayasu arteritis:an update[J]. Curr Opin Rheumatol, 2017,29(1):51-56.
[13] Russo R, Katsicas M M. TakayasuArteritis[J]. Front Pediatr, 2018,6:265.
[14] Nakabayashi K, Kurata N, NangiN, et al. Pulmonary artery involvement as first manifestation in three cases ofTakayasu arteritis[J]. Int J Cardiol, 1996,54 Suppl:S177-S183.
[15] Lee J S, Mount G R, Schachter DT. Critical ostial left main and right coronary artery stenosis secondary totakayasu arteritis in a young female simulating pulmonary embolism atpresentation[J]. J Invasive Cardiol, 2013,25(2):E45-E47.
[16] Chauhan S K, Tripathy N K,Nityanand S. Antigenic targets and pathogenicity of anti-aortic endothelialcell antibodies in Takayasu arteritis[J]. Arthritis Rheum,2006,54(7):2326-2333.


