1、什么是肌肉功能
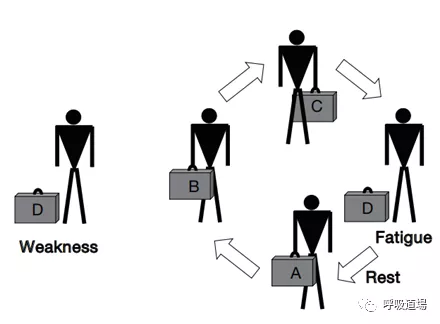
肌肉产生最大收缩力和保持一定亚极量收缩持续一段时间的能力;什么是力弱(weakness)?最大用力程度的减低;什么是疲劳(fatigue)?反复进行一个动作,或维持一定负荷的能力的下降;(barreio et al,2015)
2、慢性阻塞性肺疾病中的肌肉功能障碍
骨骼肌肉功能障碍在慢阻肺等慢性呼吸系统疾病中间非常常见,肌肉萎缩和力弱影响体力活动、活动耐力、生活质量甚至生存时间。既往文献发现,握力降低同慢阻肺急性加重的再住院率相关。肌肉功能障碍不仅在疾病末期发生,在早期就开始出现了。(seymour,2010)
慢阻肺患者股四头肌肌力通常在急性加重期会进一步降低,而股四头肌肌力减退会导致出院后运功功能改善缓慢,需要3个月才能恢复正常。
欧洲一项研究发现,COPD患者的股四头肌力较同年龄人群低25%。(Seymour JM,2010)
一项对161名患者的cohort研究发现,患者的股四头肌肌力和股直肌纤维面积,与同年龄段健康人相比,均有19-25%的减少。股四头肌和呼吸肌力弱会导致运动功能减退,生活质量下降,死亡率的上升(Marquis K,2002;Swallow EB,2007)Seymour 发现COPD I/II期力弱患者的比例为30%,而到IV期增加到38%。一项多元线性回归研究发现,力弱的程度与GOLD分级或气道阻塞严重程度无关,而在BODE指数、呼吸困难程度较高的患者中发生率更高。(Seymour JM,2010)
3、肌肉功能的影响因素
解剖层面上,肌肉的生理横断面越大,产生的肌肉收缩力也就越大。肌力同肌肉收缩前的初长度也有一定相关性,当初长度保持在静息长度的1.2倍,产生的肌肉收缩力量最大,而肌肉长度被拉到最长状态时,几乎不能产生收缩力。
生理层面上,肌肉的力量由收缩的肌肉收缩的方式、短缩的速度、激活的运动单位的数量、体积、肌肉的类型决定的。爆发力往往由肌肉的大小决定,而储存在肌肉里的糖酵解决定了耐力的能量来源,决定了耐力持续的时间。
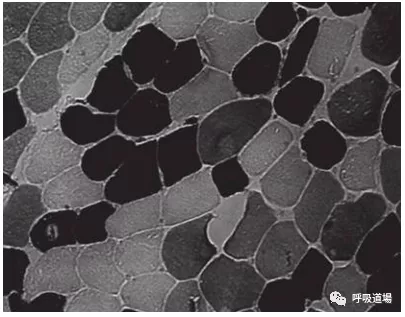
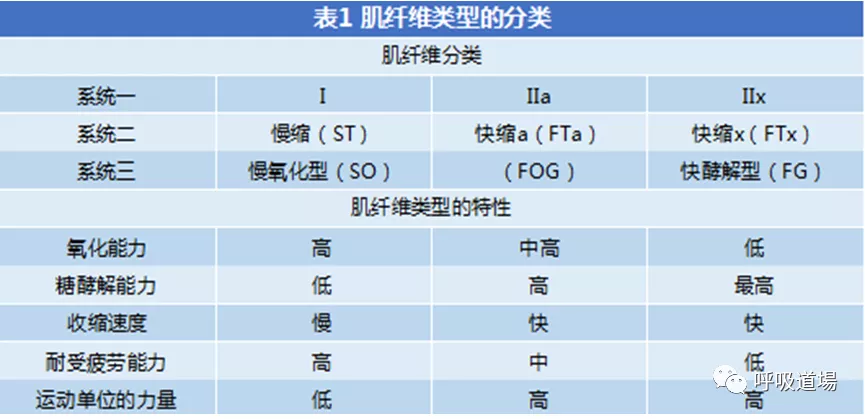
肌肉由三种肌肉纤维类型组成,其中I型纤维(黑色),慢肌纤维,具有很强的抗疲劳特性;IIa型纤维(白色),快肌纤维,具有爆发力,易疲劳;IIX型纤维,(灰色)介于两者之间。COPD患者晚期1型纤维将向IIX型纤维转换。
病理层面上,COPD患者会出现股四头肌容积减少,线粒体功能障碍,肌肉中I型纤维比例减少,肌肉力量下降,患者的有氧活动能力也随之降低。(François Maltais,2013)
4、激素对肌肉功能的影响
短期的激素使用不会改变患者的肌肉功能,但是反复长期使用会导致肌肉的萎缩和力弱。
病理变化包括肌肉容积变小、纤维变多、中央肌纤维的坏死。激素似乎优先影响II型纤维,与这些药物破坏收缩蛋白产生和下调IGF-1通路有关系,皮质醇也可以通过增加肌抑素水平来产生蛋白水解。(ATS/ERS 2014)
一、炎症(Inflflammation):慢性疾病的全身炎症反应与肌肉萎缩的发展之间存在密切关系
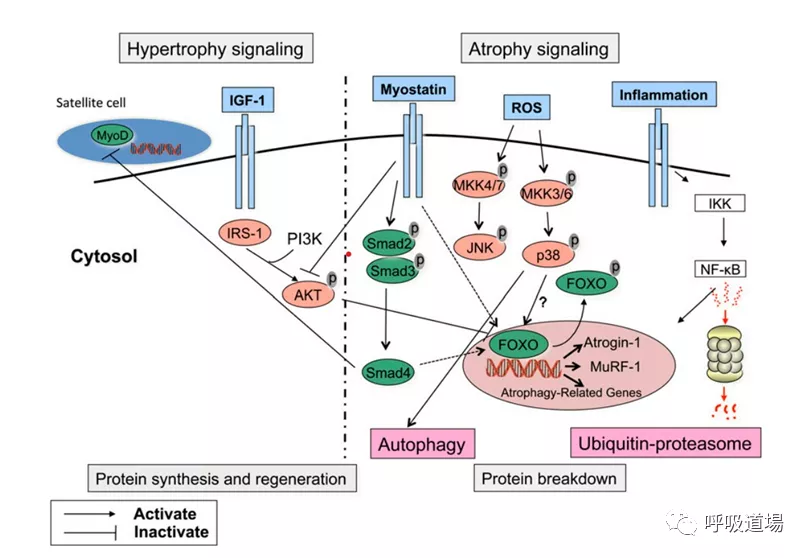
既往的研究发现,慢性疾病的全身炎症反应与肌肉萎缩的发展之间存在密切关系。细胞因子可以产生一系列细胞反应,包括通过NF-kB和FOXO(Fork head box O)、凋亡和大自噬(macroautophagy)的转录活性诱导泛素蛋白酶体(Udp,ubiquitin proteasome)系统,这些都与肌肉萎缩的发展有关。在COPD患者股四头肌中观察到Atrogin-1、MuRF-1和神经前体细胞表达发育下调蛋白4(Nedd4)的增加。Nedd4表达的增加通过支持泛素化和降解,参与调控这些过程的重要转录因子Notch来损害卫星细胞增殖和肌肉再生。
然而,虽然COPD加重期期间可以看到炎症反应的增加。但在稳定的患者中在这个问题上存在一定争议。即使在肌肉萎缩或急性加重期间存在感染的状态,只有很少和可信度不高的数据支持COPD患者股四头肌炎症的存在。因此,肌肉炎症作为COPD肢体肌肉功能障碍发展的明确作用尚未得到证实。
二、过氧化应激(Oxidative stress):在COPD中,已发现全身和局部氧化应激的证据,剧烈运动和炎症急性加重增加氧化应激水平
在包括COPD在内的几种慢性疾病,氧化应激的失衡可以改变肌肉蛋白质的完整性,增强它们的降解。在COPD中,已发现全身和局部氧化应激的证据,剧烈运动和炎症急性加重增加氧化应激水平。直接氧化应激暴露或通过炎症反应间接产生活性氧簇(ROS,Reactive oxygen species)诱导蛋白水解,增加UbP成分的表达。虽然确切的机制尚不清楚,但氧化应激诱导NF-kB和FOXO转录活性或p38激酶活性被认为在蛋白水解信号中起作用。
三、缺氧(hypoxia):低氧血症也可能损害肌肉氧化能力和毛细血管化,并导致肌肉容易疲劳
基于人和动物的试验发现,在缺氧的情况下,动物和人类的肌肉质量下降。此外,在低氧含量下,培养的成肌细胞过程存在缺陷(较慢的增殖和分化)。动脉O2水平低或O2转运减少的慢阻肺患者,往往比那些动脉O2水平正常或足够的O2转运的患者体重更低。
在低氧状态下,细胞存活的协调反应是由缺氧诱导因子-1完成的。COPD中患者中的缺氧有可能是驱动肢体肌肉组织变化的一个因素。与健康受试者相比,在重度COPD患者的肌肉样本中(平均PaO2为69mmHg)的VHL(VonHippel-Lindau),一种参与HIF-1a亚基蛋白水解降解的E3连接酶蛋白的表达增加,改变的HIF信号化可能进一步损害肌肉质量。
此外,在慢性阻塞性肺病(COPD)低氧患者的肌肉样本中,最近研究报道了在发育和DNA损伤反应中调节的REDD1基因激活。在几种细胞层面的应激作用下,REDD1使mTOR的激酶活性失活,而mTOR是AKT信号在蛋白质合成过程中转导的关键参与者。
在组织水平上,已经在培养的肌管研究中证明,在COPD患者中通过激活UbP系统和停止合成而导致蛋白质水解的增加。慢性氧转运改变和氧使用受损促进肢体肌肉氧化应激,导致亚硝基氧化还原失衡,这可以解释转录后改变(抑制S-硝基化)导致肢体肌肉功能障碍。低氧血症也可能增强炎症反应,将缺氧与肌肉萎缩过程中特定细胞反应联系起来。低氧血症也可能损害肌肉氧化能力和毛细血管化,并导致肌肉容易疲劳。
四、高碳酸血症(Hypercapnia):慢性高碳酸血症患者的细胞CO2含量增加,在COPD加重期会进一步发展或恶化
慢性高碳酸血症患者的细胞CO2含量增加,在COPD加重期会进一步发展或恶化。因此,组织pH降低,酸中毒可改变收缩蛋白的合成和降解。在肌肉组织中,酸中毒增加了UbP通路编码蛋白的基因的表达,并损害AKT信号,从而减少蛋白质的合成和进一步促进UbP通路的活性。
五、低水平的激素和生长因子:慢性阻塞性肺病患者的睾酮水平较低。慢性缺氧和皮质类固醇治疗都观察到这现象
慢性阻塞性肺病患者的睾酮水平较低。慢性缺氧和皮质类固醇治疗都观察到这现象。内分泌协会的近期指南说明,在症状性性腺功能减退的高危人群中,包括COPD患者的横断面研究表明,COPD患者肢体肌肉功能指标与血清睾酮水平不一致。Laghia等人观察到COPD男性性腺功能减退的患病率较高,但与肢体或呼吸肌表现或全身运动能力无关。不同的是,VanVliet和他的团队发现到股四头肌力量,与低循环睾酮水平有关。但全身运动能力与睾酮无关。
生长因子在肌肉组织稳态中起着至关重要的作用。虽然生长激素GH/IGF-1轴或睾酮增加肌肉含量,但肌抑素是肌肉生长的强负调节因子。肌抑素是一种转化生长因子b家族成员,作为肢体肌肉生长的负调节因子,它在全身动态平衡中的作用近期得到重视。肌抑素负调控肌肉生长的主要手段是通过抑制细胞周期进展,来抑制成肌细胞增殖。有研究报告COPD患者股四头肌肌抑素m RNA转录本和蛋白表达增加,血清肌抑素升高。肌抑素m RNA转录水平也与COPD患者的肌力有关。相反的情况下,急性加重期的阻力训练可能降低COPD患者股四头肌抑素mRNA的表达。根据Nedd4的表达增加和肌抑素对卫星细胞增殖和分化的抑制活性,推测COPD患者肌肉修复可能发生改变是很有吸引力的。
六、能量平衡受损:能量平衡和蛋白质平衡的损害可能同时发生,但这些过程也可以解离
由于能源需求升高,饮食摄入量减少导致能量平衡受损。这里包含许多因素的复杂相互作用,包括厌食、全身能量需求升高、肌肉蛋白质合成与分解之间的不平衡、脂解增强以及肺和全身炎症介质的增加。COPD的能量平衡可能受到损害。能量平衡和蛋白质平衡的损害可能同时发生,但这些过程也可以解离,反映在不同的COPD身体组成表型中。负能量平衡和负蛋白平衡的患者将消耗身体脂肪和蛋白质储存,这反映在体重减轻、脂肪量丢失和肌肉消瘦。能量平衡且负蛋白平衡的患者,虽然体重正常且稳定,但肌肉质量却已经丢失。
七、皮质类固醇:慢性或反复使用可增强COPD患者的肌肉萎缩和虚弱
虽然短期应用全身皮质类固醇可能不会改变COPD患者的肢体肌肉功能,但其慢性或反复使用可增强COPD患者的肌肉萎缩和虚弱。慢性阻塞性肺病(COPD)患者股四头肌出现皮质类固醇相关肌病的形态学变化,包括肌肉纤维大小的变化增加,结缔组织的数量增加,中央和次角膜核的数量增加和弥漫性坏死纤维。皮质类固醇,特别是其氟化形式,似乎优先影响IIX型纤维;当接触这些药物时,这些纤维会严重萎缩。皮质类固醇可能影响肌肉功能的机制与这些药物损害收缩蛋白产生和降低IGF-1途径的能力有关。皮质类固醇也可以通过增加肌他汀水平的来增强蛋白溶解。
八、维生素D缺乏:可能导致肢体肌肉功能障碍
维生素D受体(VDR)在肢体肌肉中广泛存在,它介导几个基因启动子,产生不同的基因表达。维生素D通过细胞内VDR的非基因组或其他更快的作用影响肌肉。因此,维生素D通路可能在维持肢体肌肉健康中起重要作用。佝偻病通常表现为严重的肌肉无力,低维生素D血清水平与肢体肌力降低和跌倒风险增加有关。在老年人中,维生素D水平预测长期随访期间的身体功能表现和随后的功能下降。然而,维生素D介导这些潜在影响的潜在机制尚不完全清楚。严重维生素D缺乏的成人主要表现为II型肌纤维萎缩,纤维间间隙浸润脂肪、纤维细胞和糖原颗粒。反过来看,在老年人使用维生素D治疗后,相对纤维组成和II型纤维体积的增加也有报道。1-25(OH)2 维生素D也影响活性钙转运到肌浆网,因为它通过磷酸化调节Ca-ATP酶。通过VDR介导的基因转录,影响钙调素、肌动蛋白和肌钙蛋白C含量,也可以上调IGF-1的表达。
维生素D缺乏在COPD患者中非常普遍,维生素D缺乏可能导致肢体肌肉功能障碍。与同年龄段的吸烟对照者相比,60%至70%的严重疾病患者的25-OHD水平低于20ng/ml或50nmol/L,这通常伴随肌肉纤维类型向II型纤维的转变。维生素D缺乏优先减少II型纤维的大小。这是一个可以通过补充维生素D来解决跌倒的问题。
虽然如此,Jackson等人的研究未能发现COPD患者维生素D水平、肌肉MHC蛋白表达与肢体肌力之间存在显著关系。然而,在另一项研究中,VDR的遗传多态性与肌力强度有关。这些研究表明,在某种程度上,维生素D通路的改变可能存在于COPD中,这一途径可能在疾病期间进一步受损和加重,从而独立于血浆维生素D水平来影响肌肉功能。
九、肾素-血管紧张素系统:可能对COPD肢体肌肉功能障碍的发展有影响
肾素血管紧张素系统可能对COPD肢体肌肉功能障碍的发展有影响。该系统在骨骼肌中表达,并产生血管紧张素II,从而抑制IGF-1信号化级联,刺激NF-kB,从而刺激UbP通路,并并与肌抑素积极相互作用。血管紧张素转换酶(ACE)基因的多态性,随着染色体17上一对碱基序列的缺失,与更高的组织水平的ACE活性有关,继而增加血管紧张素II在组织内的含量,同较少的氧化肌肉表型和较低的I型纤维比例存在一定联系。相反,同样的多态性与COPD保存较好的肌肉力量有关,而健康受试者在进行抗阻训练后的观察到了更好的力量反应。
十、吸烟:可能使患者易患肢体肌肉功能障碍
吸烟本身对肌肉生物学有一定的影响,它可能使患者易患肢体肌肉功能障碍。同时。吸烟本身可能与肌肉萎缩和虚弱有关。研究发现,吸烟还与I型纤维横截面积减少、I型纤维比例的降低、细胞色素氧化酶活性降低、乳酸脱氢酶活性提高和股四头肌蛋白氧化水平存在较高的联系。
肌肉质量调节机制
ATS/ERS 2014
参考文献
François Maltais et al,An Offificial American Thoracic Society/European Respiratory Society Statement: Update on Limb Muscle Dysfunction in Chronic Obstructive Pulmonary Disease.Am J Respir Crit Care Med Vol 189, Iss 9, pp e15–e62,DOI: 10.1164/rccm.201402-0373ST
作者介绍

段亚景
中日友好医院康复医学科主治医师。毕业于北京大学医学部。目前为中日医院康复科医师组组长,肺移植康复组副组长,中国康复医学会呼吸康复专业委员会青年委员,中国中医药协会养生康复分会青年委员,学会物理医学与康复学分会青年委员,北京市康复医学会骨科分会青年委员。擅长慢性呼吸系统疾病康复、肺移植围手术期康复、骨科及运动损伤康复、免疫性肌炎康复。参与十一五、十二五康复课题多项2013-2016年作为主要参与人参加北京市科委“骨科常见疾病术后康复模式和临床路径的研究”。近年来参加包括北京市科委课题“基于ICF的膝关节置换围手术期康复评定规范化研究”,十三五国家重点研发计划老年全周期康复技术体系与信息化管理研究“老年常见心肺疾病综合康复体系研究”等研究项目。参与编译“腰部疾患循证预防与康复”等图书。
本文转载自订阅号「呼吸道場」(ID:hxdc_2017)
原链接戳:第199期 COPD骨骼肌肉功能障碍(二) 四肢肌肉功能障碍的发病机制
本文完
排版:Jerry


