临床微生物样本采集与结果解读是从事临床感染与微生物的医务人员每天都要面临的问题。实际上,刚进入微生物室工作的大夫也常会询问这样一个问题:「培养基上长这么多菌落,我给临床报告哪一个,哪个才是真正的致病菌?」现在应用mNGS,情况与以往不同,不论做出什么结果,屏蔽的不多,大部分检测到的序列都会上报给临床。同样,现在也出现了临床医生以前没有遇到的问题,比如检测一个呼吸道样本,以前微生物室的医生基本不会报告「肠球菌」给临床,不论是屎肠球菌还是粪肠球菌,但是现在很多mNGS的报告中会出现。有些临床医生拿到这样的报告,就会询问:「是不是因为肠球菌培养困难,所以没有培养出来?而真正的病原是肠球菌。」实际上,很多微生物室医生都知道,在传统的概念里,肠球菌很少引起呼吸道感染,所以微生物实验室在血平皿上见到肠球菌,基本也不会上报临床的。这多数情况下是口腔内菌群污染样本所致。
同时,在mNGS的应用过程中,开拓了我们的眼界。比如一些少见的病原体,以前诊断鹦鹉热衣原体是非常罕见的,因为常规方法检测不到,而且临床也很少考虑到这种病原体,考虑到以后也没有更好的检测手段。但现在mNGS应用比较广泛,常会碰到鹦鹉热衣原体的报告,反而肺炎衣原体很少见了。另外,还有一些患者的呼吸道样本中有解脲脲原体,以前我也不会想到肺泡灌洗液怎么会去测解脲脲原体呢?但是mNGS结果告诉我们,呼吸道中有这种病原体,而且应用PCR技术进行验证,的确有解脲脲原体的存在。
总之,mNGS不仅给我们提供了许多答案,还给我们提出了很多问题,也让我们的视野更加开阔。
下面对部分《mNGS共识》进行解读
共识29
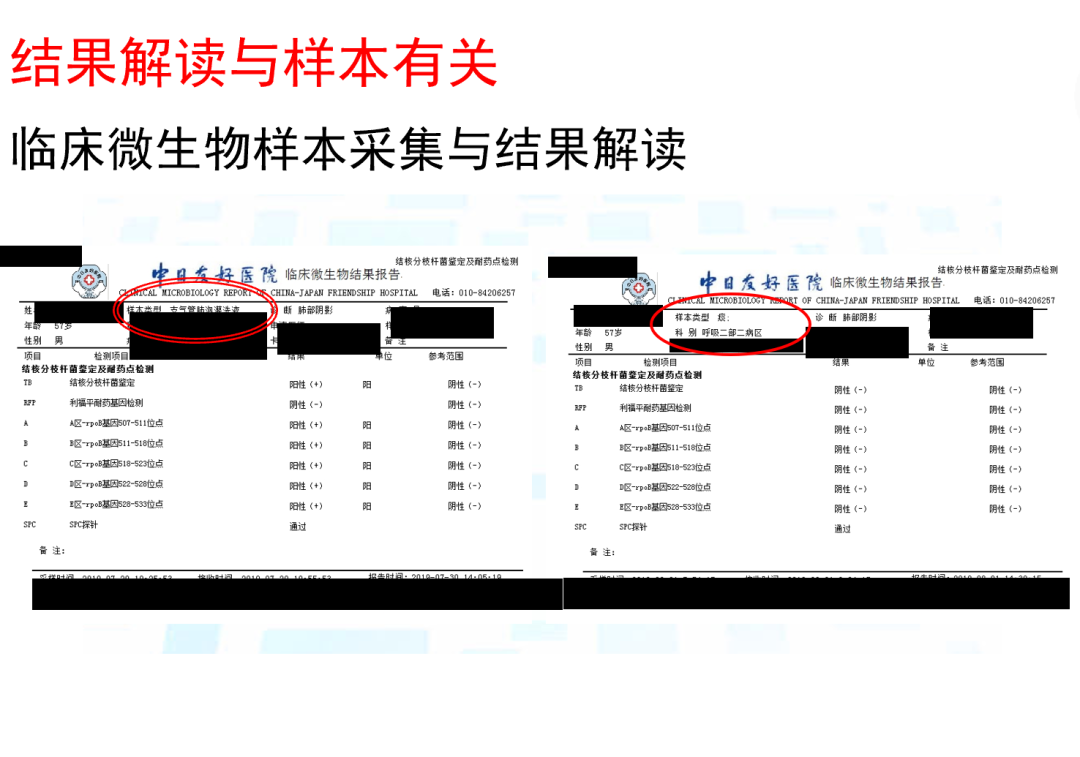
首先要明确「结果解读与样本的质量有关」,正确解读是建立在合格的样本的基础上。这项技术不论有多么先进,做培养组学、基因组学或者转录组学,它只是告诉你进入实验流程的,临床采集的这份样本中有哪些微生物,而不是就能明确告诉你这是哪一种病原的感染。所以,留取一份合格的样本永远是正确解读结果的前提。
解读报告考虑如下参数:测序质量(是否去除低复杂度、低质量序列,Q20、Q30等)、读长、特异性读长、覆盖率、深度、丰度、微生物序列的数据量、阈值等。要确定报告合格、可信。
共识30
mNGS检测报告中,建议结合不同标本类型与检出病原微生物的种类进行解读,区分无菌部位(血、无菌体液、组织、骨髓等)与正常有菌部位(如呼吸道、尿液、开放性伤口)。 确认致病微生物时,应考虑检出微生物是否为感染部位的潜在病原。 比如发现了一个很罕见的、文献里从来没有报道过这个部位可以有这种病原微生物感染和常见的环境微生物的感染,如果出现这样的情况,一定要提高警惕,注意排除常见定植菌、污染菌与工程菌的影响。
另外,比如脑脊液检出新型隐球菌,呼吸道标本检出结核分枝杆菌、腺病毒(有些无症状儿童可能检出腺病毒)、流感病毒,关节液或血液标本检出布鲁菌属,常规情况下我们认为是致病微生物,但也不是绝对的,比如我们做Xpert的时候,检测出结核分枝杆菌不一定会就诊断为结核病,它可能是死亡的病原体,也可能是在留取肺泡灌洗液的过程中,上一个患者是阳性,经过消毒处理后,再给下一个患者采集样本。其实下一个患者并没有感染,只是死亡菌体的DNA还是存在的,被检测到了。所以,做mNGS也是这样,如果出现与临床不是特别相符的情况,要多加考虑。
病毒性肺炎

个人认为,检测常见的病毒不是mNGS的强项,就像现在筛查新型冠状病毒,肯定不会去做mNGS,而采用PCR技术。常见的病毒以后可能会通过Realtime-PCR、POCT多重PCR检测来解决这个问题。呼吸道病毒感染的种类相对来说比较有限,常见的最多有十余种,所以特别适合多重PCR快速检测。
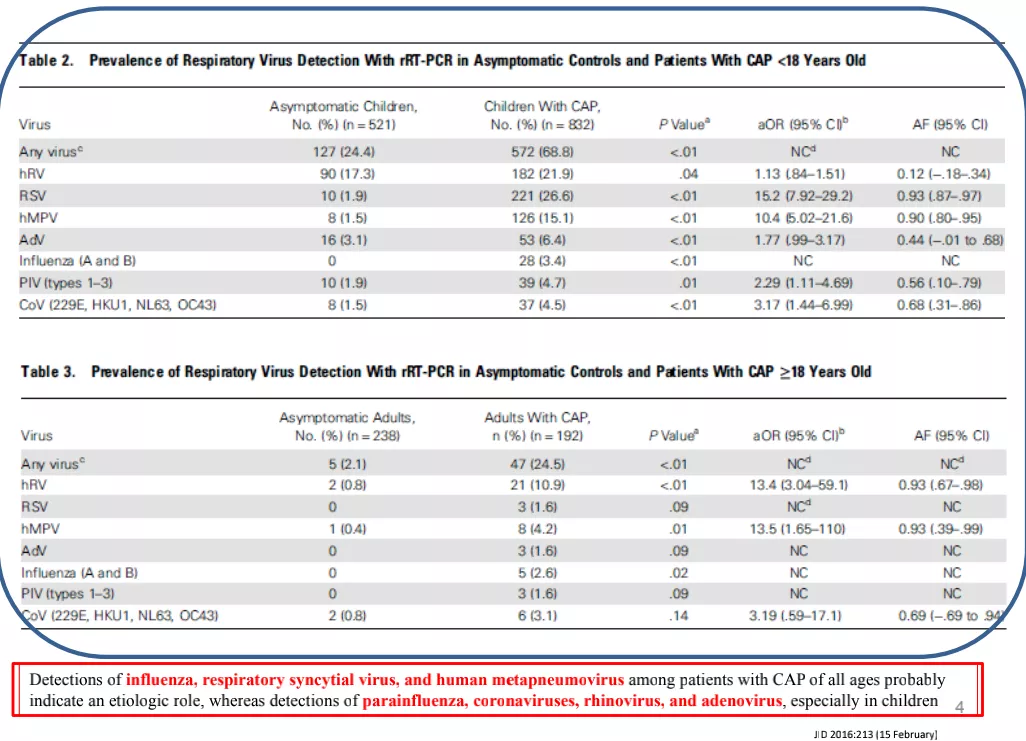
这篇文献研究了对于18岁以上成人和18岁以下儿童,在无症状对照和CAP患者中使用rRT-PCR进行呼吸道病毒检测。发现在所有年龄段的CAP患者中检测到流感病毒、呼吸道合胞病毒和人类偏肺病毒,可能表明其致病作用,而副流感病毒、冠状病毒、鼻病毒和腺病毒可在无症状人群检测阳性,尤其是儿童。
依据这一类的研究大致可以推断,有些病原体的检出很少会成为定植菌或者污染菌,绝大多数情况下检出即有价值,比如腺病毒、隐球菌、结核分枝杆菌等。
cell-free DNA在血流感染中的应用
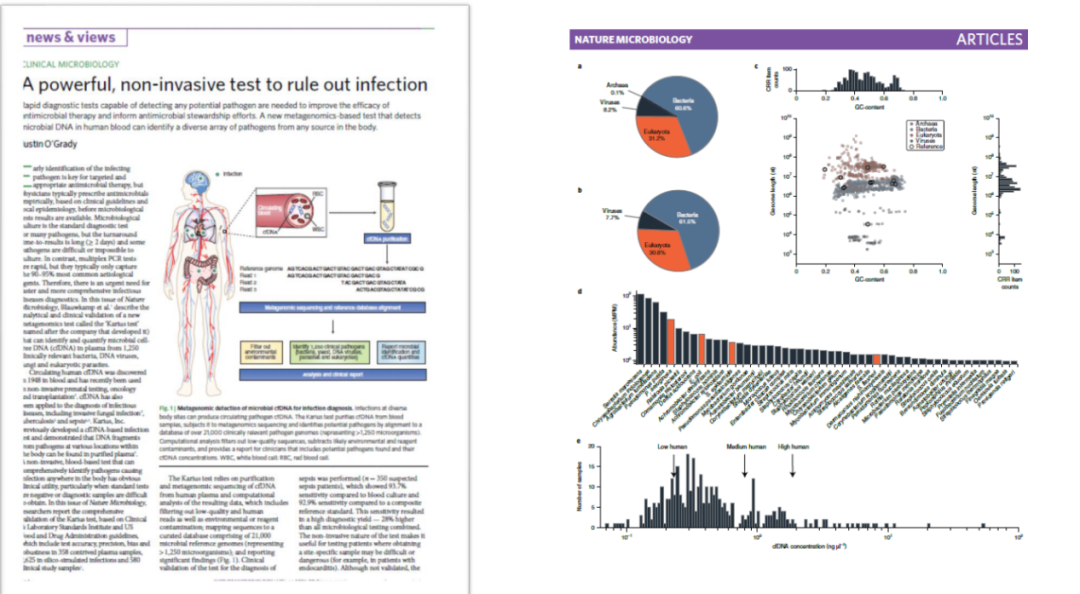
共识31
血浆样本对cfDNA进行mNGS检测时,建议从临床的角度鉴别检出序列属于致病微生物、样本污染、死亡微生物裂解,还是定植菌群所致的一过性菌血症。
也就是说,采用mNGS检测出的一些口腔链球菌、血链球菌、肠球菌的reads时,并不意味着样本中一定存在这种病原体的感染,可能就是在口咽部定植量比较大释放入血,不可以此根据患者血液样本中的肠球菌、链球菌等感染判断。当然,此类菌引起的血流感染,mNGS也会检测阳性。
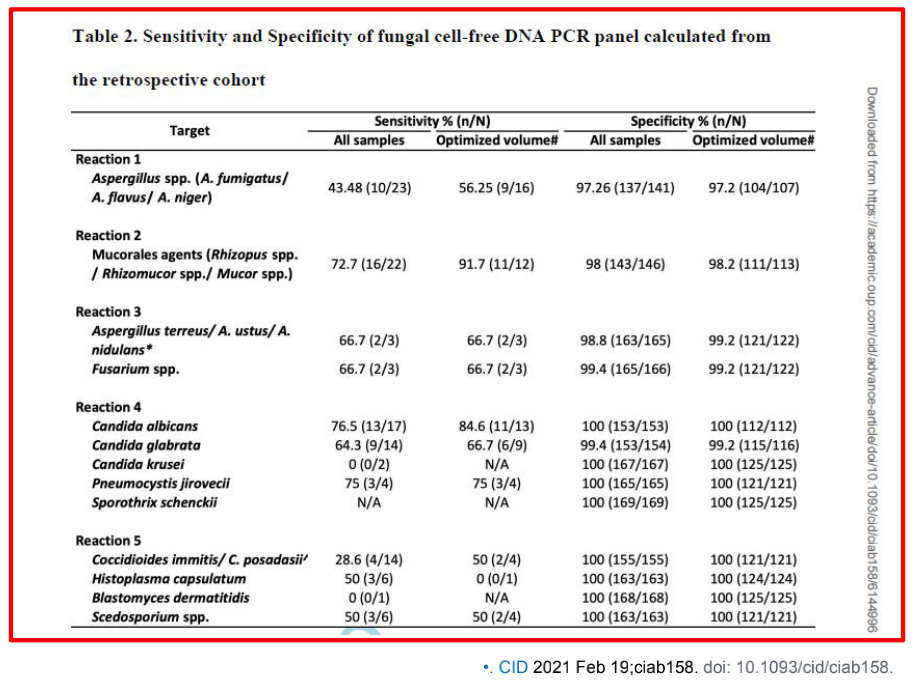
这篇文献应用多重PCR技术直接检测血浆中的曲霉菌、镰刀菌等特征性的序列,此类方法可能在国内尝试不多。如果血液样本检出曲霉菌或其他真菌的游离DNA,并不意味着此类微生物入血,可能是游离的DNA入血所致,与其他部位的侵袭性真菌感染有较大相关性。
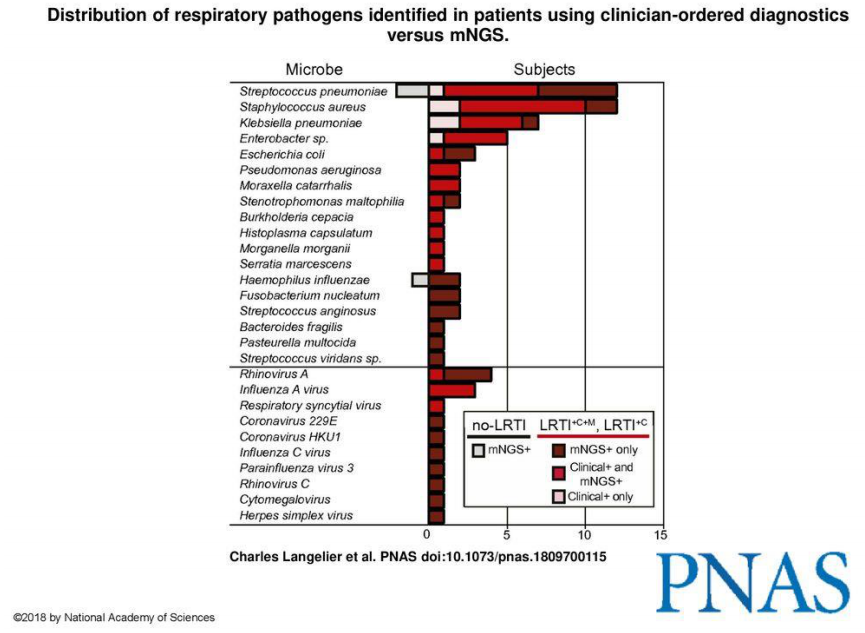
PNAS发布的这篇文章告诉我们,mNGS分子检测方法和传统培养方法各有所长,从肺炎克雷伯菌的比例就可以看出来,并不是mNGS一定比培养更灵敏。
共识32
注意感染诊断的多种方式,即关注新技术,也不忽视传统方法,传统与精准相结合:mNGS报告中常规容易培养的病原菌,建议临床医师结合传统方法,综合判断其临床价值。
如果应用mNGS检测出大量的肺炎链球菌,下面可能会出现化脓性链球菌或草绿色链球菌的序列,这可比对错误的结果,并不意味着原此样本中有很多链球菌。再比如检出大量的肺炎克雷伯菌,后面的序列中可能会有大肠埃希菌,这并不意味着有两种菌的感染。所以,这种情况下要结合培养的结果。对于常见菌,传统的培养方法已经解决大多数问题了,mNGS的优势不在于此。
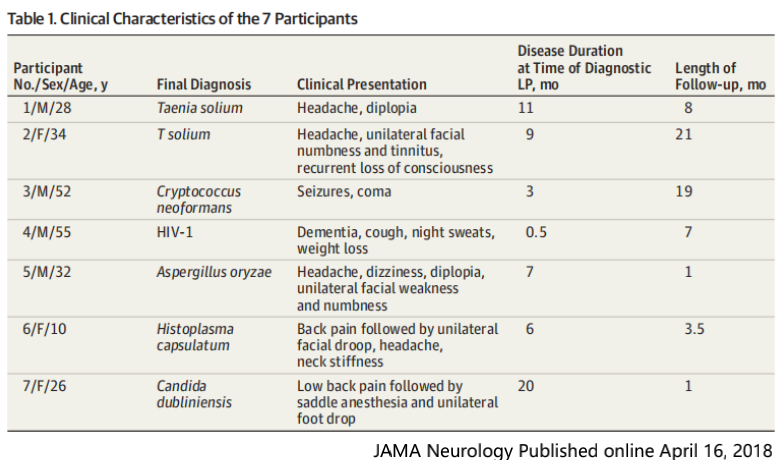
共识33
建议对于在核酸提取过程中破壁困难的微生物,如分枝杆菌属、诺卡菌属、真菌(主要包括曲霉菌、毛霉菌、隐球菌属与双相真菌)等,即使在检测报告中读长数较低,也要考虑其为致病微生物的可能,不能根据序列的多少来判断,认为序列多的是致病菌,序列少的就不是致病菌。如果和临床症状比较相似,要采用其他方法验证,如特异引物的PCR或一代测序等分子生物学检测,G试验,GM试验,曲霉菌IgG抗体或隐球菌荚膜多糖抗原等血清学试验,我们不能忽略这些传统手段的临床价值。

上图所示,怀疑隐球菌感染时,可采用隐球菌荚膜多糖抗原试验。即可以检测血清样本诊断不同部位的隐球菌感染(如肺部感染、脑组织感染、皮肤软组织感染、血流感染等),也可以对采集的脑脊液进行检测,以诊断隐球菌脑膜炎。灵敏度高,特异性也非常好。
共识34
采用mNGS进行病原微生物鉴定的同时,可以考虑检测耐药基因,但需要将耐药基因准确定位到具体的病原体上以明确其临床价值。即通过对mNGS测得序列进行具体病原体基因组组装之后,确定耐药基因位于哪个病原体上,位于质粒上还是位于染色体上。
这里要强调WGS,拿到已经培养出的病原微生物或者原始样本含有某一种病原微生物数量非常多的时候,尤其是当检测目标是结核分枝杆菌、非结核分枝杆菌等具有特异性原因引起的耐药,比如点突变引起的耐药,做耐药基因检测的效果比较好,因为此类微生物培养与药敏的时间都很长,患者等不及那么长时间。
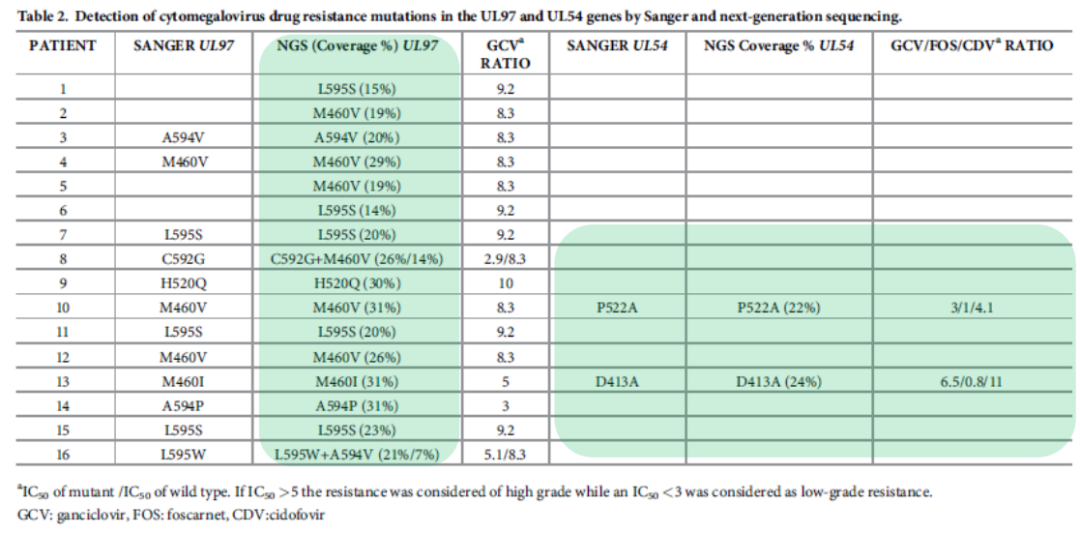
不论是骨髓移植还是肺移植,很担心在移植的患者中发生巨细胞病毒的感染。这篇文献提到,巨细胞病毒在更昔洛韦治疗的过程中有可能发生耐药,耐药是点突变的耐药。实际上如果原始样本中CMV-DNA拷贝数>10^5/mL,完全可以应用mNGS来观察点突变,从研究的结果看,准确性也相当不错。
mNGS在临床疑难感染诊断中的应用
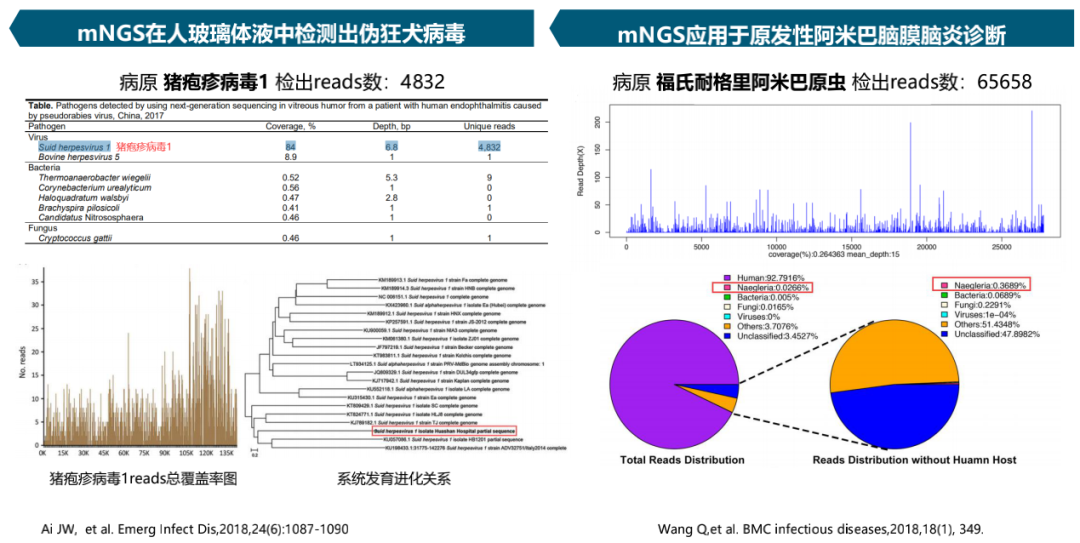
共识35
mNGS对于新发或少见病原微生物的检出具有重要价值。建议解读报告单前应了解比对数据库的内容,明确其是否涵盖少见病原或新发病原。检出高致病性病原微生物,应及时与临床联系。
对于临床传统的检测方法不能涵盖的罕见病原体,其中主要是少见的病毒和大多数的寄生虫,目前实验室没有丰富的检测方案。临床工作中,不太可能针对一个十分罕见、一年没有一例的病原体,去设计或准备一种检验试剂,这样一年下来没有进行检测的话,试剂会过期。厂家可能也不愿意实施这件事情,因为注册需要一定的样本、一定的阳性率,可能找不到足够多的罕见病原体来完成注册。
共识36
mNGS结果为阴性,对于排除感染常具有较好的阴性预测值。如果是常规的、数量多的病原体,mNGS的灵敏度非常好,应该可以检测出来。但对于某些病原微生物,如结核分枝杆菌等,原始样本中含量较少,或核酸提取困难的病原微生物,应考虑mNGS检测灵敏度较低,阴性预测性差,并不一定优于PCR等常规检测方案。

上图所示,曾经有一个肺移植的患者,有一次检出结核分枝杆菌复合群42个序列数,过段时间复查又检测出结核分枝杆菌复合群1个序列数,这可能与病程有关,与采样有关,与核酸提取情况有关,解释起来非常棘手。
感染诊断:传统和精准的契合
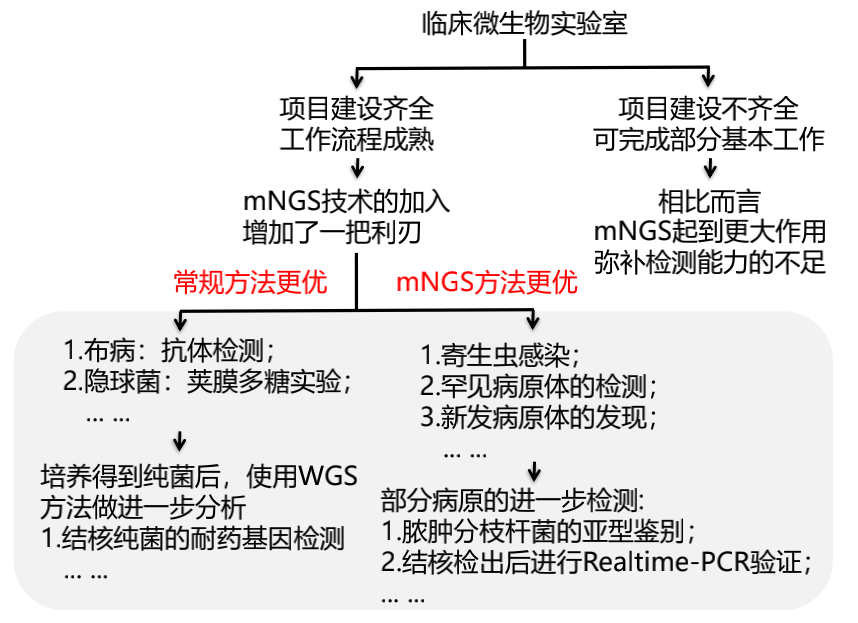
怀疑某种病原体感染,有些传统的手段可能会更有价值。比如怀疑布病,血培养和抗体检测均是必不可少的,而不是每次都要采样去做mNGS测序;考虑隐球菌感染,隐球菌荚膜多糖抗原试验是首选的检测手段,因为便宜、快捷,灵敏度、特异性高;但是怀疑寄生虫或者罕见病原体,这时候传统手段的检测能力非常弱,mNGS可以优选。
共识37
建立mNGS病原诊断的阈值影响因素较多,包括测序平台、测序流程、标本类型、病原种类、患者状况,一旦出现和临床不可解释的情况或者和传统理念有冲突的情况,要特别慎重,采取其他方法去验证。目前尚无统一公认的阈值,建议各实验室根据不同的病原体和不同的样本建立自已的阈值,并在临床工作中加以验证,但是很难在其他的实验室或者其他平台全面推广。
共识38
不同病原微生物读长对结果判断的影响:同等条件下(相同微生物,相同标本),如某一微生物检出的读长数量多,为致病微生物的可能性大。但是,不同病原微生物基因组大小不同(寄生虫>真菌>细菌>病毒),核酸提取效率存在差异[难易程度:病毒<革兰阴性菌<革兰阳性菌(不包括分枝杆菌、需氧放线菌等)<真菌],致病力也相去甚远,因此不能仅仅依靠读长多少来判断是否感染,建议同时考虑病原微生物种类差异与致病特性。
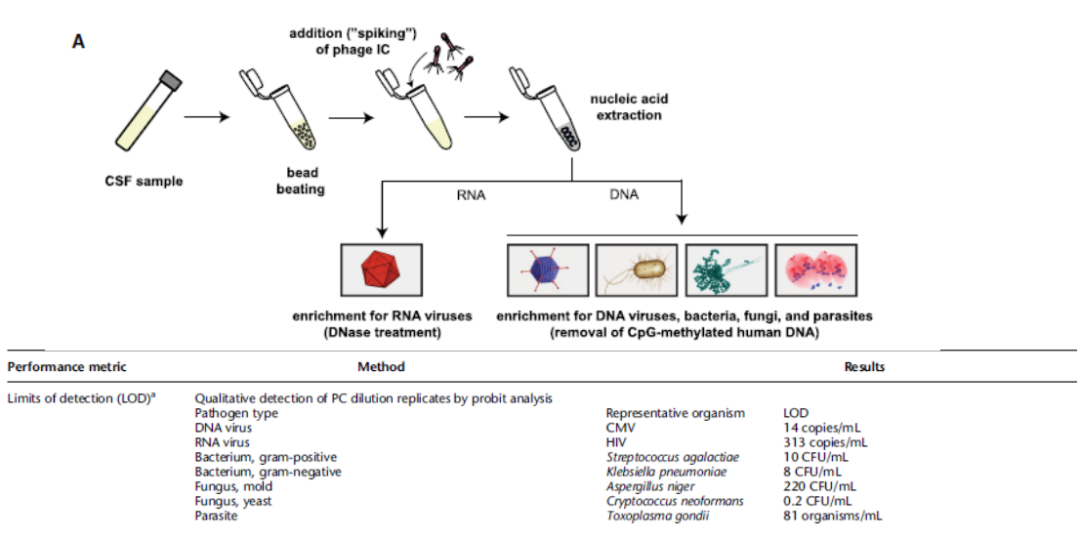
实际上不同的阈值检出最低限都是不一样的,所以设定阈值的时候除了考虑临床感染、致病能力等因素,也要考虑最低检出限,这是一个非常复杂的情况。我曾经设想过,给不同的病原微生物赋值,致病能力越强,赋值越高,比如结核分支杆菌,给它赋值就要高于鸟分枝杆菌复合群,这样根据赋值的情况来进一步推断阈值的可能性,致病力越高,阈值可以降得越低,但执行起来还是非常困难。
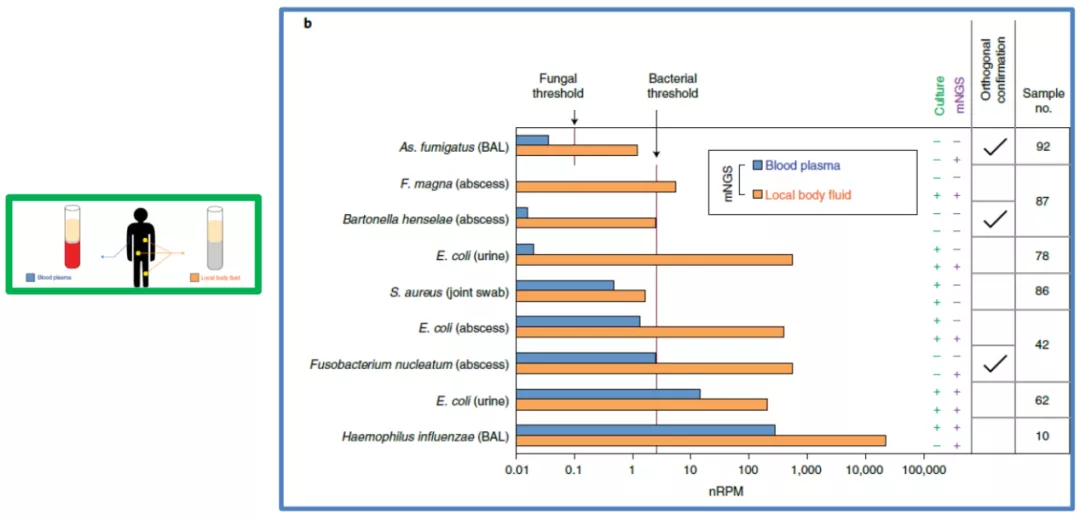
上图所示,不同病原体的类型,检测阈值也是不一样的。
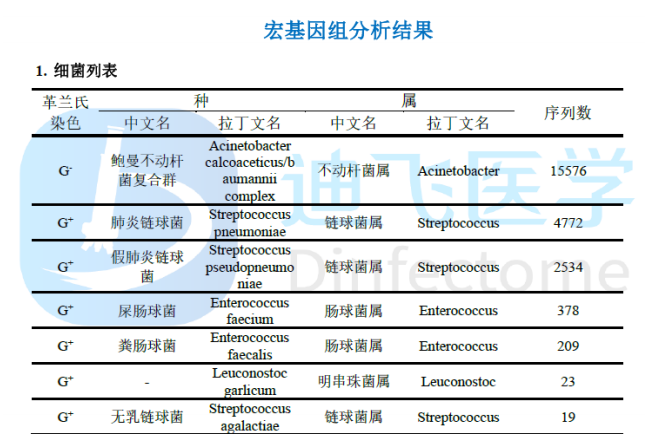
共识39
以前不知道病原体的时候,会盲目地经验性用药。但是如果我们广泛应用mNGS,而对mNGS了解不多,对mNGS报告的微生物还是全覆盖用药的话,那就是抗生素药物的另一种滥用。比如在肺泡灌洗液中看到鲍曼不动杆菌、链球菌属、肺炎链球菌、肠球菌、巨细胞病毒、耶氏肺孢子菌,如果觉得都是病原体,全部覆盖的话,这是不是抗生素药物的严重滥用呢?
mNGS引进临床应用后,的确有一部分的问题解决了,但是更多的问题又涌现出来了。只有不断的加强对感染与微生物的了解,才有可能利用好微生物检测工具,包括mNGS、多重PCR检测、培养组学等手段。所以,mNGS病原微生物检测结果,建议由具有一定生物信息学知识,并从事临床感染或临床微生物等专业人员,结合患者临床背景、影像学资料、其他的实验室检查结果,综合判断。不加以正确解读与甄别,盲目依据mNGS报告开展治疗,必将导致抗微生物药物的滥用。
对于新发病原,如SARS-CoV-2,mNGS以较快速度明确了病原,为下一步的检测、诊断、治疗、疫苗制备提供了条件。
对于少见病原,如鼠疫耶尔森菌,双相真菌(如马尔尼菲蓝状菌、荚膜组织胞浆菌、孢子菌等),鹦鹉热衣原体,耶氏肺孢子菌,钩端螺旋体,以及各种寄生虫(如阿米巴,疟原虫)引起的感染;或原始样本中数量较少的病原,如脑脊液的诺卡菌属、曲霉菌属、结核分枝杆菌,临床实验室常缺乏有效的检测手段,需要mNGS的结果作为参考。当然也必须与临床症候有明确相关性,方可考虑为致病微生物。

曾经有一个移植患者,没有培养的结果,但是早期mNGS检测出了镰刀菌属的序列数。临床为了谨慎起见,使用了伏立康唑,后来的确培养出来了镰刀菌。如果我们不应用mNGS,等到慢慢培养出来的话,可能对患者不利。所以,对于免疫力非常低下的患者,mNGS有时会是很好的选择。
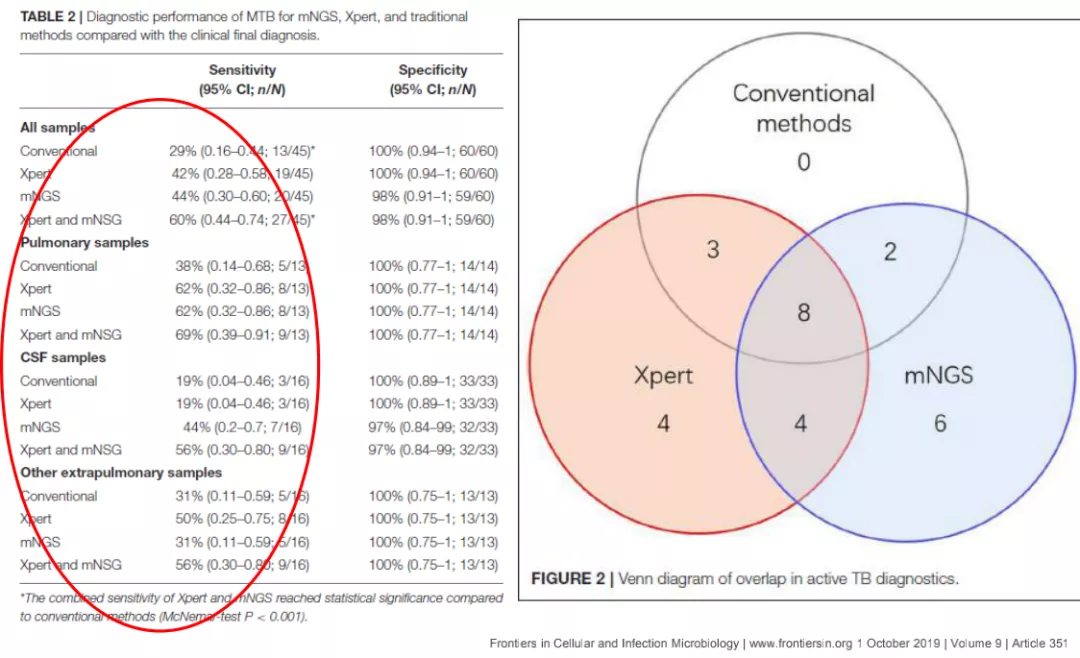
上图所示,这篇文章告诉我们,不论是mNGS还是Xpert培养,各有各的好处。
总结
最后强调,选择合格的样本,不要随便选择一个样本就去做mNGS测序,这样对后续的诊疗没有多大益处。另外,从事临床感染与微生物的医疗人员应加深对临床微生物与感染的认识,这样才能够更好地解释mNGS报告,给临床和患者带来更多的益处。否则盲目使用mNGS测序,会带来更多问题。
参考文献
[1] 2011 Apr 9;377(9773):1264-75. Lancet
[2]JID 2016:213 (15 February)
[3]CID 2021 Feb 19;ciab158. doi: 10.1093/cid/ciab158.
[4]JAMA Neurology Published online April 16, 2018
[5]Ai JW, et al. Emerg Infect Dis,2018,24(6):1087-1090
[6]Wang Q,et al. BMC infectious diseases,2018,18(1), 349.
[7]Frontiers in Cellular and Infection Microbiology | www.frontiersin.org 1 October 2019 | Volume 9 | Article 351
本文由《呼吸界》编辑 大奔 整理,感谢鲁炳怀老师的审阅修改!
专家介绍
鲁炳怀
中日医院,呼吸中心,临床微生物与感染实验室。主任医师,北大医学部教授,医学博士,北大医学部与北京协和医学院硕士生导师。社会兼职:中华医学会检验分会微生物学组委员,中国医促会临床微生物与感染分会常委。研究方向:临床微生物与感染病原学诊断,耐药机制。主持多项国家级与省部级科研项目。发表SCI收录文章近30篇。
本文完
排版:Jerry


