临床中,针对细菌感染和真菌感染的治疗关注点有很大不同。对于细菌感染,临床医生可能更多关注在较多的病原菌中及其耐药性分析,而对于真菌感染,病原菌种类有限,可选的药物种类也较少,且耐药问题及关注程度也远不及细菌。在真菌药物治疗方面,最重要的关注点可能是抗真菌药物的PK/PD特点。导致抗真菌治疗效果欠佳甚至治疗失败的原因,可能是药物暴露量不足或药物在感染局部的暴露量不足,以及患者无法耐受。这也是我们在抗真菌治疗中面临的挑战之一。因此,我们应更加深入地了解抗真菌药物的药动学特点及其对疗效和安全性的影响。本文主要阐述唑类抗真菌药的药动学特点及其临床应用。
一、唑类抗真菌药的药动学特点
目前临床已有5种唑类抗真菌药,包括氟康唑、伊曲康唑、伏立康唑、泊沙康唑和艾沙康唑,它们都是通过抑制真菌细胞壁麦角固醇的合成,是具有类似药理作用机制的一大类药物。它们的抗菌谱各有不同,例如泊沙康唑和艾沙康唑能够覆盖曲霉菌和毛霉菌,氟康唑的抗菌谱相对更窄,不覆盖曲霉菌。此外,它们在药动学(药物的吸收、分布、代谢、排泄、清除等)方面的差异更大,例如氟康唑、伏立康唑和艾沙康唑的口服生物利用度较伊曲康唑和泊沙康唑更好。在组织分布(中枢分布,尿路分布)、代谢途径、相互作用等方面也有各自的特点。这些也是临床选择这些药物以及患者使用药物后监测过程中重要的关注点。
表1 三唑类药物药动学特点
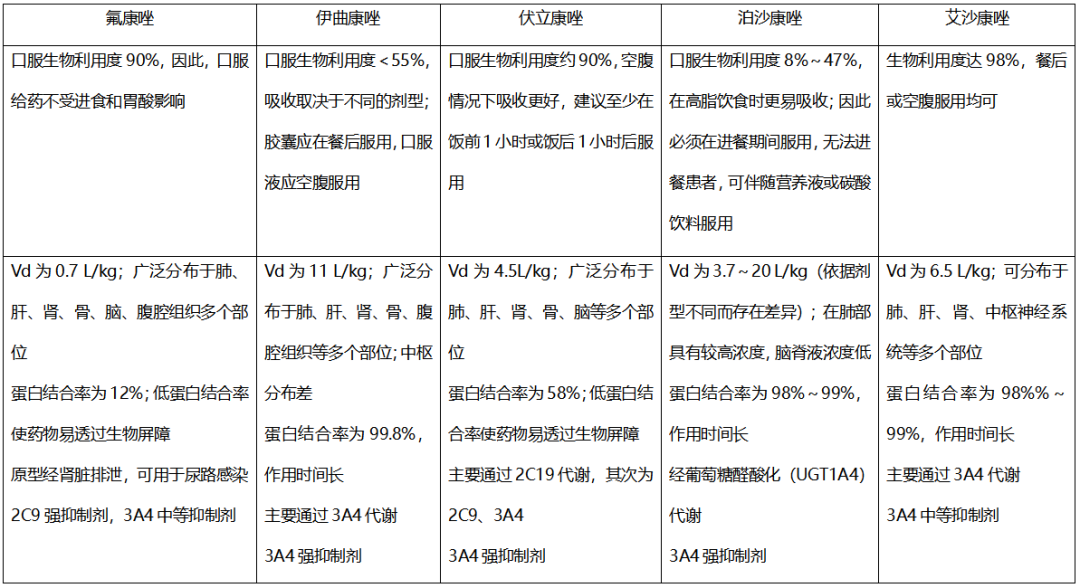
1、氟康唑
目前氟康唑预防使用的地位有所降低(不覆盖曲霉菌,念珠菌抗菌谱略窄),它是唯一经肾排泄的唑类药物,是念珠菌尿路感染的首选用药。氟康唑的生物利用度高,食物及胃肠pH影响小,尤其是隐球菌患者序贯治疗时,氟康唑可以替代静脉治疗。此外,该药的中枢分布好(50%~94%血药浓度),因此,在中枢神经系统隐球菌感染的治疗中,氟康唑占有重要地位。
氟康唑需要注意肾功能不全时的剂量调整,因为该药通过肾脏清除,尤其对于特殊人群,如老年人肾功能不全或新生儿肾功能尚未发育完整,氟康唑的半衰期要延长,而儿童在肾脏代谢比较活跃的情况下,氟康唑的半衰期缩短(表2),这是临床在药物使用剂量方面需要关注的问题。
表2 氟康唑在不同人群中的半衰期
2、伏立康唑
与氟康唑相同,伏立康唑的中枢分布好。而其特殊的药动学特点具有非线性,相同剂量下具有较大的个体差异,一些患者需要精细地制订个体化剂量。在儿童患者中,这种个体差异更大,所以按照公斤体重计算,不同儿童的剂量差异可能好几倍。这是因为儿童肝脏代谢的活跃程度和发育程度不同,个体差异会更加明显。另外,药物浓度与不良反应关系密切,治疗窗相对较窄。
一项研究按照伏立康唑50 mg和400 mg的剂量将研究对象分别纳入口服、静脉四个组,伏立康唑说明书所示半衰期约为6 h,而该研究中50 mg组的半衰期仅为3 h左右。通常情况下,药物的半衰期不随剂量的变化而变化,但伏立康唑不同,当药物的半衰期变短,会导致其在体内的暴露量变低,代谢变快。另外,伏立康唑口服生物利用度很高,这是在足量的情况下,因为药物剂量足,其首过效应相对较低,生物利用度可达到90%。但如果剂量不足,其肝脏的首过效应会较为明显,比较口服和静脉两个组别的AUC可以发现,此时伏立康唑的生物利用度仅有40%[1]。因此,伏立康唑剂量不同,它在体内的吸收和代谢情况就不同。
通常情况下,线性药动学指的是药物的浓度越高,其代谢速率等比例变快,但对于伏立康唑这种具有非线性药动学特点的药物,当药物浓度增加到一定程度后,代谢酶达到饱和,其代谢速率很难再成比例增长,此时即使增加一点剂量,都会可能导致药物浓度的大幅波动。因此,伏立康唑在临床应用时对剂量的要求更加精细。此外,药物在吸收、代谢过程中的代谢酶何时达到饱和,这与肝脏代谢酶的活跃程度有关。对于伏立康唑的目标剂量,不同患者之间亦不相同,要根据其浓度进行调整。由于亚洲人群还存在CYP2C19慢代谢的问题,所以会有更多的伏立康唑浓度变高的情况。
伏立康唑浓度的剧烈波动会影响疗效和安全性。如果患者代谢很快,当谷浓度<0.5 mg/L或1 mg/L时,就会影响伏立康唑的治疗效果。如果血药浓度监测以5 mg/L作为cut-off值,可以出现安全性问题,但对于亚洲人群,以3 mg/L作为cut-off值,就可以看到在肝损害发生率上具有显著性差异[2]。
韩国的一项RCT研究发现,在试验结束时,进行血药浓度监测组的大部分患者需要降低浓度,其中位浓度更低,而浓度更加集中在目标范围之内,如果没有进行血药浓度监测并调整剂量,其浓度较为分散[3]。
对于亚洲人群,在使用伏立康唑期间,建议进行血药浓度监测,并且建议一定要给患者负荷剂量。虽然伏立康唑的半衰期仅有6个小时,但因其非线性的药动学特点,如果不给负荷剂量,它达到稳态需要4~7 d;如果给了负荷剂量,达到稳态需要1~2 d,并且伏立康唑总的负荷剂量也不多,例如50%的剂量就可以达到通常药物的翻倍负荷剂量的效果。
3、泊沙康唑
泊沙康唑对对毛霉菌有效,具有线性药动学特点,不经过P450酶,而是通过葡萄糖醛酸化代谢。临床需注意影响口服吸收的因素,尤其是混悬液。该药的安全性好,通常剂量下药物浓度与不良反应相关性不大。
泊沙康唑属于BCS Ⅱ类药物,即溶解度差,吸收快。pH对泊沙康唑的溶解度有极大的影响,pH=1时,溶解度为800 μg/ml;pH=6.4时,溶解度<1 μg/ml;抑酸药物升高胃内pH,降低泊沙康唑溶解度,减少吸收。延缓胃排空有助于促进泊沙康唑在胃内吸收。药物进入小肠后,泊沙康唑析出结晶,吸收迅速减低。因此泊沙康唑混悬液只在胃部能被较好地吸收。食物能延迟胃排空,增加生物利用度。此外,加大单次剂量并不会显著改变泊沙康唑的药物吸收量,泊沙康唑混悬液少量多次给药能最大限度地提高吸收率。
如果使用了质子泵抑制剂,会显著降低泊沙康唑的吸收,而食物对血药浓度的影响也是巨大的[4]。一般临床在使用泊沙康唑混悬液时,一定要评估患者能否正常饮食,如果不能,使用该药很难达到满意的治疗效果。此外,促胃动力药(如胃复安)也会对药物浓度产生一定影响。
泊沙康唑口服生物利用度受多种因素影响,不同因素对浓度的影响有强有弱,有升有降[5]。800 mg/d是泊沙康唑口服混悬液吸收上限,即使再增加剂量,患者也不会有暴露量的增加[6]。而在预防方面,泊沙康唑存在明显的量效关系,如果患者吸收不好,会导致治疗失败[7,8]。在复发、难治患者的挽救治疗研究发现,泊沙康唑的浓度越高,治疗效果越好。
泊沙康唑肠溶片与混悬剂的剂量不同,在体内的过程也不同,肠溶片的生物利用度更高,使用时注意不能进行等量换算。
对于浓度不达标的情况,可以将泊沙康唑与维生素C、食物、碳酸饮料等同时服用,还应强调的是需评估患者的胃肠功能,如果存在胃肠功能障碍,混悬液不易达标,可以选择肠溶片或其他药物。对于泊沙康唑口服制剂,仍然建议进行血药浓度监测,主要是在吸收环节的个体差异。
4、艾沙康唑
艾沙康唑是新型唑类抗真菌药,上述唑类药物基本上都是以原型药物发挥作用,而对于艾沙康唑来说,临床使用的是硫酸艾沙康唑(isavuconazonium sulfate,也称艾沙康唑鎓),需要注意的是,它是艾沙康唑的前药,并不是艾沙康唑(isavuconazole)的硫酸盐。因其带正电的三唑环和肌氨酸基团而获得较好的溶解度(>100 mg/ml)。艾沙康唑通过变为前药的设计极大地提高了溶解度,避免使用环糊精,则无需考虑该赋形剂在肾损患者中蓄积而导致的肾毒性,同时也带来更好的生物利用度。
需要注意的是,在说明书及文献中对于艾沙康唑剂量的不同表述方法。艾沙康唑鎓372 mg=艾沙康唑200 mg。美国FDA说明书采用硫酸艾沙康唑鎓的剂量,而我国药监局及欧洲药监局(EMA)说明书采用艾沙康唑的剂量。
前药艾沙康唑鎓进入体内后,快速且完全(约98%)转化为活性艾沙康唑。口服制剂仅在90 min内可检测到前药艾沙康唑鎓,此后完全转化为活性产物,静脉制剂在8 h内可检测到前药艾沙康唑鎓。
研究发现,艾沙康唑静脉制剂输入1 h,在药物尚未输入结束时,其活性代谢产物的艾沙康唑就已经达到了峰浓度。同样,艾沙康唑鎓的达峰时间也不足1 h,其转化速度非常快[9,10]。
艾沙康唑口服生物利用度高,进食与胃pH不影响吸收。口服单剂量艾沙康唑后,绝对生物利用度为98%。另外,艾沙康唑表观分布容积大,组织分布广。艾沙康唑的平均稳态分布容积(Vss)约为450 L,提示其组织分布广[11]。艾沙康唑可快速渗透至大多数组织,14 d内在大多数组织/体液中达到稳定状态,不会随着时间的推移在组织/体液中积聚,并在大脑中达到潜在的有效浓度[12]。美国FDA的一篇综述提到,在小鼠中开展的研究发现,艾沙康唑在脑组织中的浓度是血药浓度的将近2倍。所以,在中枢曲霉或毛霉感染中,艾沙康唑是一种非常有前景的治疗药物。
艾沙康唑半衰期长,具有线性药动学特点,随着剂量的增加,其AUC成比例增加。注意艾沙康唑在使用时一定要给负荷剂量,推荐的负荷剂量:前48 h,每8小时两粒胶囊(相当于200 mg艾沙康唑),共给药6次。推荐的维持剂量是从末次负荷剂量给药后12~24 h开始每日一次,每次两粒胶囊(相当于200 mg艾沙康唑)。鼻饲是在溶解后1 h内给药,给药后使用5 ml液体冲管。
二、唑类药物相互作用关注点
临床应注意唑类药物的相互作用。伊曲康唑、伏立康唑和泊沙康唑都是CYP3A4的强抑制剂,尤其应注意其与他汀类药物、长春碱等药物的相互作用。氟康唑、艾沙康唑是CYP3A4的中等抑制剂,相互作用弱于其他唑类药物。尤其是艾沙康唑在治疗曲霉感染时,其相互作用较其他药物更少,例如与西罗莫司联合用药的患者,伏立康唑可使西罗莫司浓度升高10倍,但艾沙康唑对西罗莫司的影响相对较小[13]。艾沙康唑可以联用,而非禁忌。
三、小结
唑类抗真菌药在药动学方面各有特点,具有较大的差异。伏立康唑重点关注在代谢方面的个体差异,泊沙康唑重点关注影响吸收的因素,而艾沙康唑无论在代谢还是吸收方面都具有较好的药动学特点,所以其个体差异比较少,也不需要常规进行血药浓度监测。在治疗中需要考虑不同人群特点,保证疗效及安全性。
参考文献 (可上下滑动浏览)
[1] Hohmann N, Kocheise F, Carls A, et al. Dose-Dependent Bioavailability and CYP3A Inhibition Contribute to Non-Linear Pharmacokinetics of Voriconazole[J]. Clin Pharmacokinet, 2016, 55(12):1535-1545.
[2] Jin H, Wang T, Falcione B A, et al. Trough concentration of voriconazole and its relationship with efficacy and safety: a systematic review and meta-analysis[J]. J Antimocrob Chemother, 2016, 71(7):1772-1785.
[3] Park W B, Kim N H, Kim K H, et al. The effect of therapeutic drug monitoring on safety and efficacy of voriconazole in invasive fungal infections: a randomized controlled trial[J]. Clin Infect Dis, 2012, 55(8):1080-1087.
[4] Krishna G, Moton A, Ma L, et al. Pharmacokinetics and absorption of posaconazole oral suspension under various gastric conditions in healthy volunteers[J]. Antimicrob Agents Chemother, 2009, 53(3):958-966.
[5] Dolton M J, Brüggemann R J M, Burger D M, et al. Understanding variability in posaconazole exposure using an integrated population pharmacokinetic analysis[J]. Antimicrob Agents Chemother, 2014, 58(11):6879-6885.
[6] Ullmann A J, Cornely O A, Burchardt A, et al. Pharmacokinetics, safety, and efficacy of posaconazole in patients with persistent febrile neutropenia or refractory invasive fungal infection[J]. Antimicrob Agents Chemother, 2006, 50(2):658-666.
[7] Dolton M J, Ray J E, Chen S C-A, et al. Multicenter study of posaconazole therapeutic drug monitoring: exposure-response relationship and factors affecting concentration[J]. Antimicrob Agents Chemother, 2012, 56(11):5503-5510.
[8] Greco R, Barbanti M C, Lupo Stranghellini M T, et al. Coadministration of posaconazole and sirolimus in allogeneic hematopoietic stem cell transplant recipients[J]. Bone Marrow Transplant, 2016, 51(7):1022-1024.
[9] Schmitt-Hoffmann A, Roos B, Maares J, et al. Multiple-dose pharmacokinetics and safety of the new antifungal triazole BAL4815 after intravenous infusion and oral administration of its prodrug, BAL8557, in healthy volunteers[J]. Antimicrob Agents Chemother, 2006, 50(1):286-293.
[10] Schmitt-Hoffmann A, Roos B, Heep M, et al. Single-ascending-dose pharmacokinetics and safety of the novel broad-spectrum antifungal triazole BAL4815 after intravenous infusions (50, 100, and 200 milligrams) and oral administrations (100, 200, and 400 milligrams) of its prodrug, BAL8557, in healthy volunteers[J]. Antimicrob Agents Chemother, 2006, 50(1):279-285.
[11] Kovanda L L, Maher R, Hope W W, et al. Isavuconazonium sulfate: a new agent for the treatment of invasive aspergillosis and invasive mucormycosis[J]. Expert Rev Clin Pharmacol, 2016, 9(7):887-897.
[12] Schmitt-Hoffmann A-H, Kato K, Townsend R, et al. Tissue Distribution and Elimination of Isavuconazole following Single and Repeat Oral-Dose Administration of Isavuconazonium Sulfate to Rats[J]. Antimicrob Agents Chemother, 2017, 61(12):e01292-17.
[13] Groll A H, Desai A, Han D, et al. Pharmacokinetic Assessment of Drug-Drug Interactions of Isavuconazole With the Immunosuppressants Cyclosporine, Mycophenolic Acid, Prednisolone, Sirolimus, and Tacrolimus in Healthy Adults[J]. Clin Pharmacol Drug Dev, 2017, 6(1):76-85.
专家简介
孔旭东
中日友好医院主管药师,抗感染临床药师,信息药师;药事会秘书,抗菌药物管理小组秘书;卫健委临床药师培训基地带教师资;耶鲁纽黑文医院访问学者;中国医疗保健国际交流促进会临床微生物与感染分会青年委员;中国研究型医院学会药物评价专业委员会青年委员;北京药学会感染性疾病药物治疗与风险管理专业委员会委员。
本文根据「重症肺言之肺部少见真菌感染论坛」整理,感谢孔旭东药师予以审核。


