摘要
随着高分辨率胸部影像系统和肺癌筛查程序的应用,多原发肺癌(multiple primary lung cancer,MPLC)患者正成为临床实践中日益增长的人群。但是,MPLC诊断标准及其与肺癌肺内转移(intrapulmonary metastasis,IM)之间的鉴别仍然存在许多争议,特别是在组织学相似的病例中。本文在回顾现有文献的基础上,讨论了MPLC诊断标准的变化以及MPLC与IM的影像学、组织学和分子遗传学的鉴别诊断方法,并简要介绍了多学科诊断、算法、预测模型及人工智能在MPLC鉴别诊断中的应用。此外,我们还讨论了关于MPLC治疗方法的最新进展。根治性手术是治疗MPLC的主要手段,立体定向放疗(stereotactic body radiation therapy,SBRT)对不能手术的MPLC患者是安全可行的,而靶向治疗和免疫治疗经过合适的患者选择也可以应用于MPLC。
由于计算机断层扫描技术的发展,多原发肺癌(multiple primary lung cancer,MPLC)的诊断逐年增加。MPLC的诊断关键在于与肺癌肺内转移(intrapulmonary metastasis,IM)进行鉴别,特别是在二者组织学相同时,是多发性肺癌(multiple lung cancer,MLC)分期和后续治疗计划的基础。现有的诊断标准主要依据临床病理特征,但远不能满足临床需要,因此全世界都在努力探索新的、更准确的方法来区分MPLC和IM。大多数MPLC患者在疾病的早期确诊,因此手术治疗是最常见的治疗方法,但是手术并不适用于肺功能有限的患者。近年来靶向治疗及免疫治疗越来越多的应用于肺癌患者,但是关于相关治疗在MPLC中的应用情况仍不清楚。
因此,我们全面搜索了当前有关MPLC诊断、鉴别诊断以及治疗的文献,总结了现有的MPLC的诊断标准和鉴别诊断方法,并讨论了MPLC的手术治疗方案的选择及新的治疗方法,期望帮助临床更好地识别和处理MPLC患者。
一、概念与分类
自Beyreuther于1924年发表了第1例MPLC以来[1],临床开始关注MPLC。MPLC是指在肺内同时或先后发现2个或2个以上原发性肺癌病灶,而这些病灶不仅在解剖上是分离的,在起源上也是独立的。1975年,Martini和Melamed[2]根据术前影像资料及手术结果将MPLC分为同时性多原发肺癌(synchronous multiple primary lung cancer,sMPLC)与异时性多原发肺癌(metachronous multiple primary lung cancer,mMPLC)。但是这一分类标准在临床上并不适用,因此部分研究[3, 4]将两次诊断的时间间隔作为sMPLC与mMPLC的分类标准,多使用6或24个月。中国sMPLC分期手术的时间间隔多<6个月,因此我们建议以6个月作为分类标准。sMPLC中最大的病灶称之为主病灶,其余的病灶称之为次病灶。mMPLC根据诊断时间的先后分为第一原发性肺癌(first primary lung cancer,FPLC)和第二原发性肺癌(second primary lung cancer,SPLC)。
二、诊断与分期
1975年首次提出的诊断MPLC的临床病理标准(简称M-M标准)[2]具体如下(表1):(1)组织学类型不同;(2)组织学类型相同时分2种情况:①sMPLC必须满足3个条件:起源于原位癌;发生于不同肺叶或肺段;在共同的淋巴引流部位和肺外均无转移;②mMPLC满足以下条件之一即可:肿瘤起源于原位癌;肿瘤之间有2年的无瘤间隔;位于不同肺叶且无共同的淋巴结转移及肺外转移。M-M标准是当前应用最为广泛的诊断标准。虽然当组织学类型相同时,M-M标准在区分MPLC和IM方面缺乏准确性,但是M-M标准在当时的肺癌病理诊断及治疗条件下是有价值的。
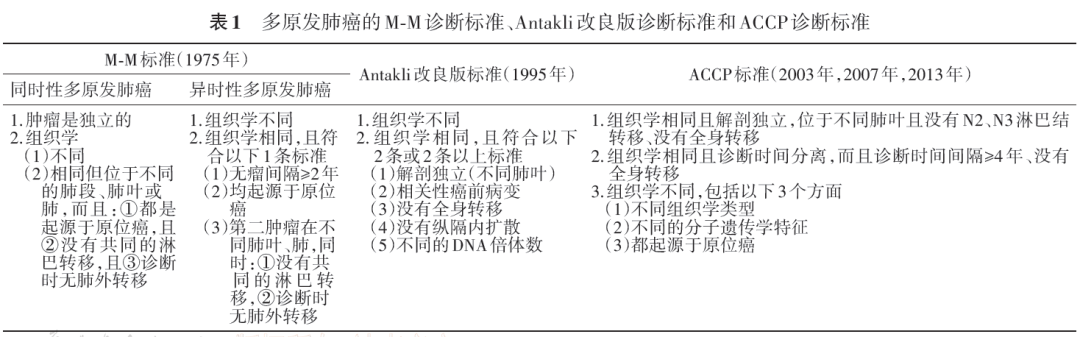
1995年,Antakli等[5]提出了一套改良的标准(表1)。Antakli标准相对宽泛,删去了无瘤间隔至少2年的要求,加入了DNA倍体数标准,但受限于当时的医疗水平,DNA检测技术未普及,该标准没有得到广泛的应用。
随着分子生物学和二代测序(next generation sequencing,NGS)技术的发展,美国胸科医师协会(american college of chest physicians,ACCP)将分子遗传特征纳入MPLC的诊断标准(表1)[6, 7, 8]。相较于M-M标准,ACCP标准延长mMPLC的无瘤间隔时间至4年,并且将无瘤间隔2~4年的MLC考虑为MPLC与IM的灰色地带。需要注意的是,ACCP标准将MPLC的诊断限制在不同肺叶,而M-M标准中多发病灶位于不同肺段是sMPLC的诊断标准之一。
2016年国际肺癌研究协会(international association for the study of lung cancer,IASLC)采用综合组织学评估(comprehensive histologic assessment,CHA)的方法,并建议结合肿瘤影像学表现、组织亚型、细胞形态、生长方式、转移情况以及分子遗传学特征等进行综合分析,最好通过多学科会诊来诊断MPLC[9]。IASLC标准分为术前临床标准与术后病理标准两部分(表2),更有利于临床医师术前评估患者,根据评估结果决定患者的治疗方案。相较于前三个诊断标准,IASLC标准更全面的考虑了患者动态的影像学变化及全面的组织学情况。但是CHA对病理学的要求更高,而且该标准中的影像学信息及生物标志物模式并不能确诊MPLC,这些缺点共同阻碍了IASLC标准的临床应用。

在第7版TNM分期中,MLC被认为是IM,该分期将同叶多个肺癌病灶归类为T3,同侧不同叶肺癌归类为T4,双侧肺癌归类为M1[10]。然而2016年的第8版肺癌TNM分期标准指出,MPLC应分别进行TNM分期,且无论肿瘤位于何处,均应单独处理[11]。
三、鉴别诊断
(一)影像学
多发性肺结节是指影像学上肺内存在≥2个直径均<3 cm的结节病灶,包括MPLC、IM以及良性结节等情况。对于多发性肺结节,2018年中国肺结节诊治专家共识建议单独的评估每个结节[12]。共识推荐从「外观」和「内涵」2个角度初步评估肺结节的良恶性,包括结节大小、形态、边缘及瘤-肺界面、内部结构特征及随访的动态变化,此外还可以联合肺癌预测模型对肺结节的良、恶性进行初步判断[12]。然而,共识并没有给出如何鉴别MPLC与IM的建议。但是,有多项研究表明CT或PET-CT可在无肿瘤组织的情况下帮助鉴别MPLC与IM[13, 14, 15, 16]。
1、多发性磨玻璃结节:磨玻璃结节通常代表良性病变或恶性程度相对较低的病变,如不典型腺瘤性增生、原位腺癌或微浸润性腺癌。然而,磨玻璃结节中固体成分的存在强烈暗示肿瘤侵袭[17]。Fleischer协会认为多发性磨玻璃结节应该是MPLC,而不是IM,与IASLC的建议一致[14]。还有研究表明多发性肺结节中至少存在1个磨玻璃结节且临床N0的肿瘤被认为是放射学上的MPLC,预后比传统意义上的MPLC(根据M-M标准)更好[13]。
2、多灶性GG/L肺癌:IASLC在第8版肺癌分期中提出了多灶性磨玻璃/贴壁状(ground-glass/lepidic,GG/L)肺癌的概念[18]。多灶性GG/L肺癌在病理上表现为贴壁模式生长,允许肺泡充气,所以在CT上表现为磨玻璃样结节[19, 20]。多灶性GG/L肺癌包括原位腺癌、微浸润性腺癌和以贴壁样生长为主的腺癌,被认为是独立的原发肿瘤[21]。Park等[22]通过分子遗传学分析发现肺腺癌和同步性GG/L结节的组合也倾向于遗传独立的肿瘤。但是气腔转移理论对多灶性GG/L肺癌的MPLC性质产生了质疑[23]。有证据表明,对于亚肺叶切除术后的Ⅰ期肺癌患者,气腔转移是一个不利的预后因素[24],而对肺叶切除术后的患者则不是[25]。这些研究提示气腔转移并不能跨肺叶发生,因此只有当多灶性GG/L肺癌位于不同肺叶时,才能被认为是MPLC。
3、PET-CT在MPLC鉴别诊断中的应用:除了CT的影像特征外,PET-CT图像中的SUV值同样有助于鉴别MPLC与IM。研究表明,MPLC患者的ΔSUV显著高于转移癌患者[15],两个病灶之间的SUVmax比值也有助于鉴别MPLC和IM[16]。但是还需要更大规模的研究来进一步证实这一发现。
(二)组织学
组织病理学是诊断肺癌的金标准,最先提出的M-M标准也是根据组织病理学来诊断MPLC[2]。但是,M-M标准对组织病理学的应用只限于组织学类型的评估。2009年Girard等[26]开发出CHA方法来区分MPLC与IM。CHA方法不仅考虑了病灶的组织学分类,而且将病灶的组织学亚型、组织学亚型百分比、细胞组分和间质组分纳入MLC的评估中[26]。概括的说,满足下列条件之一即可认为是MPLC[26]:①不同的组织学类型;②鳞状细胞癌的细胞和间质特征不同;③腺癌的主要组织学亚型不同;④腺癌的主要组织学亚型相似,但是其他组织学亚型百分比不同;⑤腺癌的组织学亚型相似,但是细胞和间质特征不同。随后的多项研究[27, 28]证实了CHA在鉴别MPLC与IM时的效能。2015年版WHO肺癌分类标准摒弃了细支气管肺泡癌的概念,引入肺腺癌贴壁亚型的描述[29]。因此,CHA建议浸润性腺癌按照新的五个亚型(贴壁型、腺泡型、乳头型、微乳头型和实质型)以5%的增量进行半定量评估。ISALC在基于Girard的CHA标准的基础上,加入贴壁生长、肿瘤细胞大小、有丝分裂率和核多形性等形态特征的评估,并得到了CHA在病理学家中具有良好重复性的结论[30]。这一发现证实了CHA在临床应用中的可行性,因此ISALC建议使用CHA鉴别MPLC与IM[9]。
(三)分子遗传学
1、单基因测序:在MLC鉴别诊断的分子遗传学探索过程中,最先研究的是p53基因。Matsuzoe等[31]发现p53突变在双发肺癌中的分布有3种不同的模式:(1)仅在一个病灶中突变,(2)在两个病灶中有不同的突变,(3)在两个病灶中是相同的突变。其中(1)或(2)为双原发性肺癌,(3)为IM。但是对于两个病灶都没有p53突变的病例无法给出明确的诊断。因此,后续的研究者们[32, 33]在检测p53基因突变的同时,增加了EGFR突变的检测,增加了鉴别MLC的有效性。此外,还有研究[34]发现将EGFR突变分析与KRAS突变分析结合起来同样可以确定大部分MLC的克隆状态。但是少部分高频突变基因的共同突变是否可以确诊IM,对于多个病灶都没有上述基因突变的病例该如何处理,这两个问题仍然困扰着临床医师对MLC的诊断和治疗。
2、多基因测序:随着NGS技术的发展,上述两个问题得到了部分解决。研究者们主要通过比较NGS技术与组织病理学的诊断效能来探讨NGS在MLC鉴别诊断中的价值。部分研究[35, 36, 37]表明在鉴别MPLC与IM时,多基因测序是组织病理学的有效补充。近期发表的研究[38, 39, 40]则表明与传统的组织病理学评估相比,多基因测序技术可能是一种更准确的诊断和预后工具。Chen等[41]还发现组织学特征结合多基因特征可以更有效鉴别MPLC和IM。此外,Wang等[42]还通过605个基因靶向测序建立了一套鉴别MPLC与IM的标准:①如果没有发现共重叠的基因改变,则可以诊断MPLC;②如果发现一个重叠的高频驱动基因改变伴或不伴有一个重叠的低频基因改变,则建议解释为MPLC;③如果发现3个以上的共同基因改变,则可以诊断IM。因此,NGS检测可以区分MPLC与IM,是MLC鉴别诊断的有用工具。
3、全基因测序: 近年来,全外显子及全基因组测序技术的出现再一次促进了MLC鉴别诊断的发展。在外显子水平进行全面的基因组图谱分析,可以准确区分MPLC与IM[43, 44]。但是,全基因组测序在MLC鉴别诊断中的应用应该在更大的队列中进行探索,以证实这一鉴别诊断方法的效用。
基因测序技术的出现和发展将MLC的鉴别诊断带入分子时代。从单基因测序到NGS多基因测序再到全基因组测序,不确定的MLC越来越少,以至于全基因组测序的MLC都可以被归类为MPLC或IM。但是MLC鉴别诊断基因测序的应用仍面临以下几个问题:①全基因组测序现在只在实验室应用阶段,距离临床应用的普及还有一段时间;②近些年的多基因测序数量从20个到805个不等,大部分都得出分子分析优于组织学评估的结论,但是多基因测序的最优基因数量仍没有定论;③多基因测序用于MLC鉴别诊断仍没有一个通用的标准。
4、其他分子遗传分析方法在MPLC鉴别诊断的应用:除基因突变分析外,在MPLC分子遗传分析鉴别诊断发展过程中还出现了包括染色体重排、比较基因组杂交、微卫星多态性分析等其他一些鉴别诊断方法。
在意识到单独分析驱动基因在MLC鉴别诊断中的不足后,Murphy 等[45]分析了肿瘤细胞染色体重排情况,并用PCR技术对重排位点进行验证,发现这种基于基因组重排和配对测序的基因谱系测试可能比单独分析驱动基因更准确、更特异的区分MPLC与IM。几年后Murphy等[46]进一步排除了生殖系的染色体重排对这种方法诊断效能的影响,发现这种诊断方法比组织学评估更能有效区分MPLC与IM。还有研究[47]发现比较基因组杂交相较于EGFR/KRAS突变诊断的MPLC的临床结果好于IM患者,说明比较基因组杂交有比少量的基因突变分析更好的诊断效果。
微卫星标记的分子分析是一种用于评估克隆起源的方法[48]。微卫星标记在基因组中大量存在,并显示出高度的多态性。微卫星多态性分析同样可以应用于MLC的鉴别诊断。Shen 等[49, 50]利用6个微卫星标记的等位基因变异所体现的「独特趋势」与「矛盾趋势」成功区分MPLC与IM。随后的一项研究[51]用同样的6个微卫星标记在血浆DNA和肿瘤标本中都观察到相同的微卫星改变,证明了血浆DNA中「独特趋势」和「矛盾趋势」同样有助于区分MPLC与IM。还有研究将杂合性缺失、p53突变、X染色体失活模式结合起来成功辨别了MLC克隆起源的异同[52]。
(四)多学科诊断、算法、预测模型和人工智能
上述的研究只纳入单一的因素鉴别MPLC与IM,近年来有研究表明还可以综合临床、影像学、组织学以及分子遗传学分析鉴别二者。Belardinilli 等[53]提出多学科诊断的概念,即在综合考虑了影像、病理及分子遗传学信息后,MLC的分类应依赖于多学科团队的集体判断。随后的研究者们[3,54, 55]基于临床信息、影像学、组织学及分子遗传学开发出一系列不同的算法,并证明这些算法是MLC分类的有用工具,可以指导MLC的治疗。
此外,还有研究表明预测模型[56]和人工智能[57]能有效帮助MPLC的诊断,但仍需要进一步的大样本研究来验证人工智能及预测模型的准确性和应用范围。
四、治疗
(一)手术治疗
在充分利用术前资料诊断MPLC后,下一步面临的是如何治疗的问题。鉴于MPLC患者大多在早期被诊断,手术是MPLC患者首选的治疗方法[58],而且多项研究表明手术的效果优于非手术治疗[59, 60, 61]。另一方面,MPLC手术疗效与单原发肺癌手术疗效相当,术后总生存率并没有显著差异[62, 63, 64]。然而,对于MPLC的最佳手术方式还没有达成共识。当前手术切除的范围主要由外科医生根据手术风险和收益来决定,并综合考虑肿瘤的特点及患者的状况。因此,我们回顾了近几年有关MPLC外科治疗的研究,以期指导不同情况下手术方式的选择。
1、sMPLC的手术治疗:总体来说,sMPLC手术治疗的预后尚佳[65, 66, 67]。在亚组分析中,如在同时性多原发肺腺癌[68, 69]、双侧sMPLC[70, 71]、同时性多原发非小细胞肺癌[72]以及病灶数量≥3个的sMPLC[73]的分析中,手术治疗仍可以获得较好的预后。在手术方式的选择方面,近期多项研究表明亚肺叶切除有不差于肺叶切除的预后[70,72, 73]。然而,在一项以同时性多原发肺腺癌为总体的研究中,却得出肺叶切除治愈率更高的结论,并建议对于术后残余肺功能可能较差的患者才考虑进行亚肺叶切除[68]。对于双侧sMPLC,双侧肺叶切除与肺叶切除加对侧亚肺叶切除相比,5 年总生存率并没有明显区别[70],因此建议双侧sMPLC可以选择主病灶肺叶切除加对侧亚肺叶切除[70]。双侧sMPLC还需要面临同期与分期手术选择的问题。既往多因肺功能的考虑而选择分期手术,但是近期来自中国的一项研究指出与分期切除相比,同期切除在降低成本、防止肿瘤进展方面具有显著优势[71]。此外,病灶大小、淋巴结转移、TNM分期、病灶数量及病灶位置都是sMPLC较好的预后评价指标[65, 66, 67, 68, 69, 70,74]。总之,在我们术前评估患者可能患有sMPLC后,无论是同侧还是双侧sMPLC,在完整切除病灶及患者肺功能允许的情况下,我们都优先选择同期亚肺叶切除术。
2、mMPLC的手术治疗:FPLC手术方式的选择建议参考相关指南[75],本文主要探讨SPLC的手术治疗方式。相较于sMPLC,mMPLC的研究相对较多,其中有大量的研究来自于美国国家癌症研究所监测、流行病学和最终结果(surveillance,epidemiology,and end results,SEER)数据库。SEER数据库是一个基于人群的癌症数据库,包含了大约26%的美国人口[76],为MPLC的研究带来了大量的样本。经过合适的患者选择,几乎所有的研究都表明手术治疗可以改善SPLC患者的预后,并且与FPLC手术效果相当[77, 78]。关于SPLC手术方式的选择,尚未形成一致的结论。这些研究中大部分得出肺叶切除与亚肺叶切除疗效相当的结论[77, 78]。然而,Baig等[79]的研究及Yang等[80]的研究却提出解剖切除可能比楔形切除提供更好的长期生存率。还有研究表明肺叶切除术应被视为SPLC的首选治疗方法,但亚肺叶切除术仍然是肺功能受限患者的选择[81]。此外,对于早期SPLC患者,足够数量的淋巴结评估可显著延长生存期[79,82]。根据建议,对侧SPLC使用超过10个淋巴结评估,同侧SPLC至少使用4个淋巴结评估[82]。在预后方面,年龄、性别、病灶的大小、肿瘤的分期、吸烟史以及无瘤间隔时间都是影响手术患者预后的因素[83, 84]。此外,针对第二原发性肺腺癌,CT形态也是预后的影响因素[85]。综上所述,因为现阶段还没有高质量的研究证据支持SPLC肺叶切除术与亚肺叶切除术的优劣,而且因为SPLC的手术效果与FPLC的手术效果相似[86],所以我们建议当前在参考单原发性肺癌手术治疗方式及综合评估患者肺功能的基础上选择合适的手术方式。此外,我们应根据病灶位置选择合适的淋巴结评估数量。今后有必要进行规范的、更大规模的研究,在诊断标准确定的前提下探讨SPLC最佳手术方式。
(二)立体定向放疗(stereotactic body radiation therapy,SBRT)
对于因严重并发症和有限的心肺储备而无法手术的MPLC患者,SBRT是一种安全有效的局部治疗方法[87, 88]。无论是sMPLC还是mMPLC,SBRT都能获得良好的局部控制和长期生存[87,89]。但是mMPLC患者的生存率要优于sMPLC患者[87,89],因此局部的SBRT似乎在mMPLC中更加适用。总体上,SBRT可以实现长期生存和良好的肿瘤控制,是MPLC患者,特别是呼吸功能受限的患者安全可行的治疗方案。此外,质子束治疗同样是mMPLC患者的治疗选择[90],但是其昂贵的价格阻碍了临床应用。
(三)化疗、靶向治疗和免疫治疗
如果手术及SBRT手段不可行,还可以选择包括化疗、靶向治疗及免疫治疗在内的全身治疗方法。来自SEER数据库的一项研究通过单变量Cox回归和倾向性评分匹配分析证明了化疗对SPLC有显著的治疗效果[91]。但这只是一项回顾性研究,到目前为止,还没有关于是否在MPLC患者中使用辅助化疗的随机试验。
对于医学上无法手术的MPLC患者,另一种可供选择的治疗方法是靶向治疗,特别是以EGFR为靶向的酪氨酸激酶抑制剂。Liao等[92]报道了对吉非替尼有不同反应的sMPLC病例,他们根据主病灶的基因检测结果使用吉非替尼,但是随访过程中发现其他病灶仍继续增大。正如前面提到的,大多数MPLC的病变在组织病理学上是不同的,或者具有不同的分子特征。因此,单个病变的基因突变检测结果不能完全反映肺内所有病变的基因情况,这可能会极大地限制靶向治疗在MPLC中的应用。但是,也有文献报道了1例具有不同的EGFR及RET突变的MPLC患者的治疗经验[93],在奥希替尼和减量的阿来替尼联合治疗下获得临床稳定,并且耐受性良好。因此,携带不一致驱动基因突变的MPLC患者可能受益于靶向治疗药物的组合,但在做出这些治疗决定之前,有必要仔细考虑这些药物的安全性。
近年来,许多免疫检查点抑制剂已被批准用于治疗晚期肺癌。然而,免疫检查点抑制剂对MPLC患者,特别是那些不同组织学类型的患者是否有效仍是未知的。Kodama等[94]报道了1例双侧肺癌对帕博利珠单抗表现出不同反应的病例,经病理证实为不同组织学类型的sMPLC。我国报道了1例细胞程序性死亡配体1(programmed cell death ligand 1,PD-L1)抑制剂成功治疗的mMPLC的病例,但对细胞程序性死亡受体1(programmed cell death protein 1,PD-1)抑制剂耐药,提示对于MPLC可能PD-L1抑制剂比PD-1抑制剂有更好的疗效[95]。另一方面,MPLC的多组学分析表明,由于不同病变之间基因组改变和免疫微环境的差异,单独使用PD-1/PD-L1抑制剂可能不是 MPLC 的最佳治疗策略[96]。还有一项病例报告提出在初发非小细胞肺癌用免疫检查点抑制剂控制良好的情况下,应考虑对第二原发非小细胞肺癌进行手术治疗[97]。
因此,MPLC因为病灶之间的独立性给了我们更多的选择,我们可以根据每个病灶的特点选择各自最合适的治疗方案,但是同时也应注意不同治疗方案不良反应的叠加。
五、总结与展望
虽然MPLC的诊断标准不断更新,但是因为临床应用场景的不同,当前仍没有统一的诊断标准,这也为MPLC的研究及后续的治疗带来了一定的困难。尽管在区分MPLC与IM方面有很大的困难,但是在过去的几十年里还是取得了重要的进展。目前的技术进步使我们能够根据CT或PET-CT的放射学特征、组织病理学特征和分子遗传学特征来鉴别MPLC与IM。其中NGS技术的发展在MPLC的鉴别诊断中起到了关键作用。此外,多学科管理、预测模型的出现及人工智能与MPLC的结合都为MPLC与IM的鉴别诊断带来了新的希望。到目前为止,根治性手术仍然是MPLC的主要治疗方法,但最佳的手术方式仍有待标准化。对于不能手术的MPLC患者,SBRT是一种具有良好疗效和安全性的替代方案。此外,免疫治疗和靶向治疗是新出现的治疗方法,经过合适的患者选择也可以应用于MPLC。未来的研究应致力于标准化MPLC的诊断及手术治疗方式,探讨MPLC与IM分子遗传学鉴别诊断的精准模式。
参考文献(略)
作者:温敬利 王馨雨 顾书君 李甜甜 石莉 程孔辉 齐栩;单位:南京医科大学第一附属医院呼吸与危重医学科;徐州市中心医院呼吸与危重症医学科;南京医科大学附属老年医院呼吸与危重症医学科


