今天和大家简单分享一下我们在抗菌药物应用中每天都遇到的、但临床可能并不太注意的问题,就是抗菌药物的「剂量选择」。
我们在会诊时可能经常会碰到这种情况:其他科室医生陈述了患者情况,询问我们建议用什么样的药物,但往往不会询问到底应该如何考虑剂量和间隔,偶尔有医生会问患者治疗效果一直不好,都已经用到美罗培南了,应该换成什么样的药物呢?其实这时也许只是剂量选择得不够,当我们增加了剂量后,就可能会达到临床治疗的效果,所以「剂量」是我们需要关注的重要问题。
一、抗菌药物合理剂量的重要性
何为抗菌药物的正确选择?除了使用正确的药物之外,还要包括选择正确的剂量、正确的用药间隔和正确的疗程。如前所述,我们临床非常关注「何种药物」,但剂量、间隔容易被忽略,而疗程则是更容易被忽略的问题,我们往往只知道抗菌药物的开始点,而不知道抗菌药物的结束点。
曾读到一句话:「我们似乎知道关于抗菌药物的所有事情,但却不知道应该给患者多大的剂量」 。其实现在,这个问题仍然困扰着我们,在临床过程中,如果没有治疗药物监测(TDM)的话,可能就无法给患者使用恰到好处的剂量,但假如我们能够把问题考虑得更全面一些,就可以最大程度地接近最合适患者的剂量,PK/PD使得对抗菌药物剂量的选择从以前「或多或少」任意的主观判断发展到可应用PK/PD模型确定最优化剂量的决策阶段。
抗菌药物的不合理应用会带来很多问题,如不良反应增多、细菌耐药性增长和抗感染治疗失败等,不合理应用的表现为无指征防治用药,抗菌药物品种选择错误,给药疗程、给药间隔及给药剂量不合理等。
1、抗菌药物过量导致不良反应
一项澳大利亚研究,在接受哌拉西林(PIP)、美罗培南(MEM)或氟氯西林(FLU)治疗的患者中行TDM,观察其神经毒性、肾毒性和肝毒性并发症。发现平均血清谷浓度(Cmin)在分别应用三种抗菌药物有神经毒性并发症的患者中显著升高,在应用哌拉西林、美罗培南有肾毒性并发症的患者中显著升高。可见超过阈值浓度,患者有50%的风险发生神经毒性、肾毒性事件。[1]
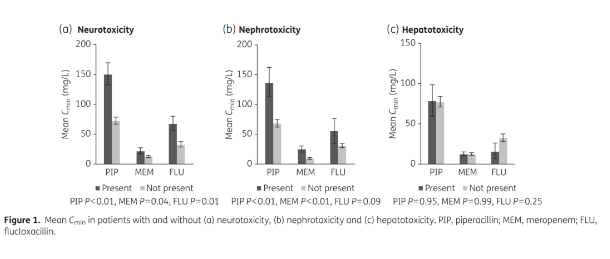
2、抗菌药物剂量不足会影响临床疗效
研究显示,美罗培南(MEM)或哌拉西林/他唑巴坦(TZP)治疗的ECMO患者中,约30%的患者没有达到有效治疗的PK/PD靶标,非ECMO患者中也存在剂量不足。[2]
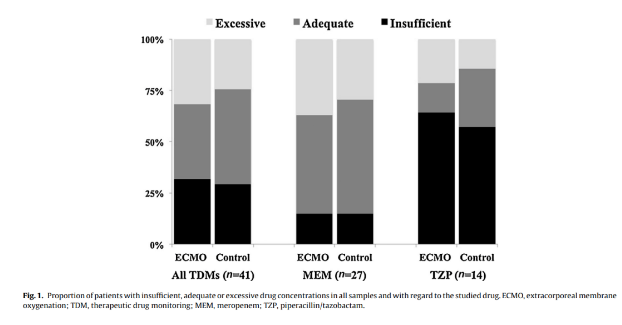
3、抗菌药物的剂量与耐药性
抗菌素耐药性(AMR)是人类健康的全球性威胁。提高抗菌素使用的准确性(抗菌药物的剂量、持续时间)能得到更好的临床疗效、减少药物耐药性的出现。体外试验发现,优化抗菌药物剂量是延缓抗生素耐药性发展的重要机制。
有个很重要的概念,是「突变选择窗」,当我们给的药物剂量很不够时,会带来临床治疗的失败,但如果剂量恰好落在突变选择窗的时候,就会出现「把敏感菌杀死了、把耐药菌筛选出来」的情况,所以剂量的不足和耐药的产生密切相关。[3]
二、什么因素会影响抗菌药物剂量?
我们需要综合几方面因素来考虑如何给感染患者提供最佳抗菌药物的剂量。
在药代学考量中,包括相对溶解度、蛋白结合、清除机制;在临床考量中,包括感染部位、疾病严重程度、身体成分、可能的病原学、当地耐药谱;在药效学考量中,包括杀灭细菌的时间过程、抗生素后效应、临床感染模型。[4]
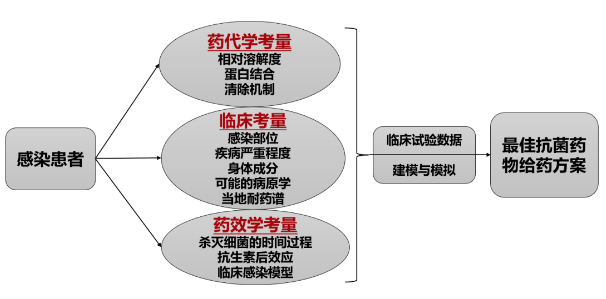
在讲最佳剂量之前,先回顾药物剂量选择中比较受关注的几个重要的「药代动力学参数」。
1、表观分布容积(apparent volume of distribution, Vd):
表观分布容积是一个假想的容积,不代表体内具体的生理性容积,可以反映药物分布的广泛程度或与组织中大分子的结合程度,是指体内药物总量平衡后,按测得的血浆药物浓度计算所需的体液总容积(即理论上药物均匀分布所占有的体液容积)。
根据Vd的情况可以分成亲水性抗菌药物、亲脂性抗菌药物,亲水性抗菌药物Vd较小,不易通过脂质细胞膜,分布于血液与体液中,如β-内酰胺类、氨基糖苷类、糖肽类、多粘菌素和氟康唑;亲脂性抗菌药物Vd较大,分布于脂肪组织,容易透过细胞膜进入细胞内,如喹诺酮类、大环内酯类、林可霉素和替加环素。
表. 常用抗菌药物的表观分布容积(Vd)

2、蛋白结合率(protein binding rate,PB):
蛋白结合率是药物与血浆蛋白结合的程度,即血液中与蛋白结合的药物占总药量的百分比。分成两种类型,与血浆蛋白结合的药物为「结合型药物」,它会暂时失去药理活性,体积增大,不易通过血管壁,「储存」于血液中。另一种是「游离型药物」,即未被血浆蛋白结合的药物,能透过生物膜进入相应的组织或靶器官产生效应或进行代谢与排泄。
药物分子与血浆蛋白结合有三个特点:可逆性(可以结合也可以游离)、饱和性、竞争性(不同的药物都可能来与血浆蛋白结合)。
3、清除率(clearance,CL):
清除率为各种不同清除方式的总和,除了肝肾清除之外,还包括干预因素的清除,比如血液净化技术清除和其他代谢途径(ECMO、人工肝等)的清除率需要临床特别关注和考量,特别是对危重症患者。
主要经肝脏清除:如大环内酯类、利福平和利奈唑胺等,在肾功能损害时多不需调整剂量。
经肝肾双通道代谢:部分β-内酰胺类、部分喹诺酮类等。
主要经肾脏排泄:如大部分β-内酰胺类、氨基糖苷类、氟喹诺酮类和糖肽类等,应根据肾功能损害程度及CRRT模式和参数进行调整。[5]
表. 常用抗菌药物的清除途径

三、抗菌药物剂量的考量:感染部位、干预因素、宿主因素
首先需要考量的是感染部位,不同的感染部位要选择不同的剂量;还包括宿主因素,同一个感染部位,不同的宿主要考虑不同的剂量;以及干预措施对药物剂量的影响,其中最常应用的就是危重患者中的肾脏替代治疗。
1、感染部位
1)肺:呼吸科最常见的感染部位就是肺部,大环内酯类、喹诺酮类、替加环素和利奈唑胺在呼吸道上皮衬液中的浓度高于血药浓度,是很好的治疗选择;喹诺酮类在支气管黏膜或分泌物中的浓度高于血药浓度,而β-内酰胺类在支气管黏膜或分泌物中的浓度低于血药浓度的50%。
治疗呼吸道感染另一种方式是雾化吸入,选择黏膜不吸收且局部组织浓度高的药物,如氨基糖苷类(妥布霉素、阿米卡星)、多粘菌素E。
表. 常用抗菌药物的肺泡上皮衬液浓度/血药浓度
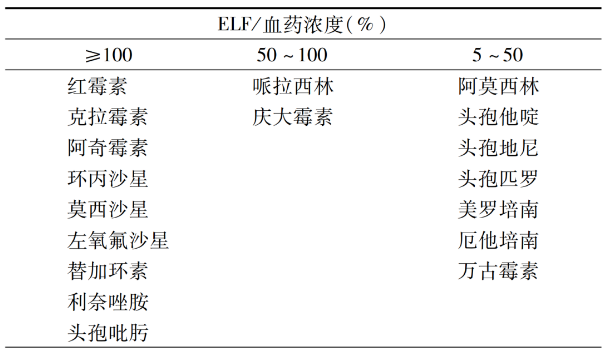
表. 常用抗菌药物的支气管黏膜或分泌物浓度/血药浓度

2)中枢神经系统: 第三四代头孢菌素、氨曲南、碳青霉烯类、磺胺类、喹诺酮类、万古霉素、利福平及异烟肼等药物脑脊液中浓度较高 。很多药物可以局部给药,通过鞘内注射来达到更好的组织穿透性。[5]
表. 常用抗菌药物的脑脊液/血药浓度
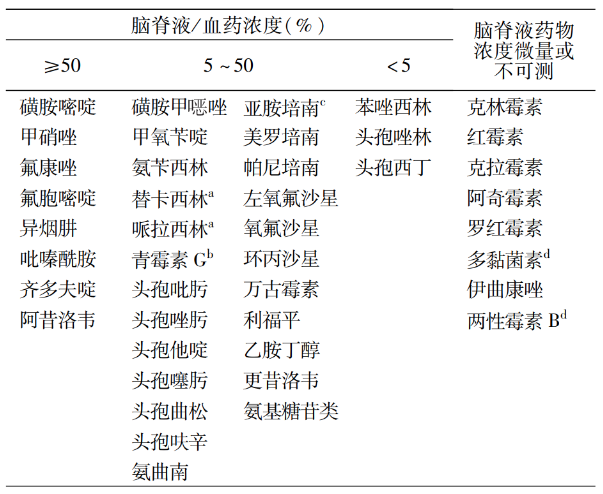
3)血: 对于血流感染,要综合Vd、PB考量,药物Vd越小,PB越高,药物向组织渗透较慢,血液浓度高,停留时间久,对血流感染效果越佳,如苯唑西林、替卡西林、头孢唑啉、头孢曲松、达托霉素及万古霉素。
面对球菌感染时,是选择用利奈唑胺还是万古霉素呢?从药代动力学参数来考虑,万古霉素的血药浓度要高一些,利奈唑胺的组织浓度要高一些。在治疗皮肤软组织感染的时候,亲脂性的抗菌药物相比亲水性抗菌药物有更高的皮肤渗透性,在治疗选择上就可以有所参考。当骨组织出现感染时,能够有效治疗的抗菌药物包括林可霉素、克林霉素、磷霉素、喹诺酮药物等等。克林霉素最重要的一个特点是适用于骨组织感染。
简要总结感染部位的PK和合适的剂量:肺脏、骨、中枢神经系统感染,抗菌药物渗透性低,需要增加剂量(CNS系统给最大剂量),骨感染同时增加输注时间。对于血流感染,由于Vd、CL增加,需要提供负荷剂量,或同时增加给药频次。而软组织感染取决于身体成分,肥胖患者需要增加剂量。[4]
以美罗培南为例,我们要根据感染部位选择药物剂量,处理不同感染要给予的药物剂量是不同。如CAP、尿路感染、妇科感染、皮肤或软组织感染,可以500mg q8h,静脉滴注;HAP、腹膜炎、中性粒细胞减少合并感染、败血症可以1g q8h,静脉滴注;脑膜炎则2g q8h,静脉滴注。
2、干预因素:
主要包括肾脏替代治疗、人工肝、ECMO。
简要和大家介绍肾脏替代治疗(CRRT)中需要考虑的因素,首先要了解肾脏替代治疗的原理:
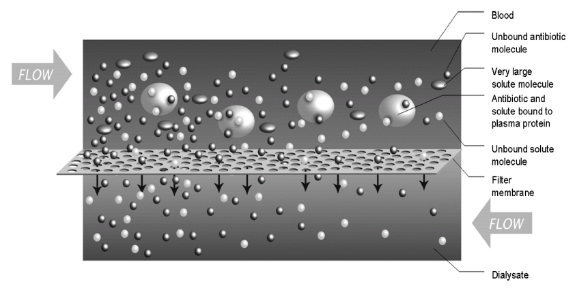
上图是「持续血透」的模式图,血透是应用扩散原理,依靠透析液和血浆之间的浓度梯度被动进行溶质交换。滤过膜的上面是血液、下面是透析液,大的球体是血浆蛋白,小的球体是抗生素和一些没有结合的小分子物质,结合在蛋白上的抗菌药物不能被滤过,而没有结合在蛋白上的抗菌药物是可以通过滤过膜的,可见蛋白结合率对于CRRT的患者多么重要,间隔、剂量也是密切相关的因素。
第二种临床上常用的肾脏替代治疗是「持续血液滤过」,血液滤过是对流原理,通过机器(泵)产生的压力梯度,在滤过压的作用下滤出大量液体和溶质,即超滤液,同时,补充与血浆液体成分相似的电解质溶液,即置换液。分成后置换和前置换两种方式,如下图。也和蛋白结合率密切相关,结合在蛋白上的抗菌药物是不能够被滤过去的。
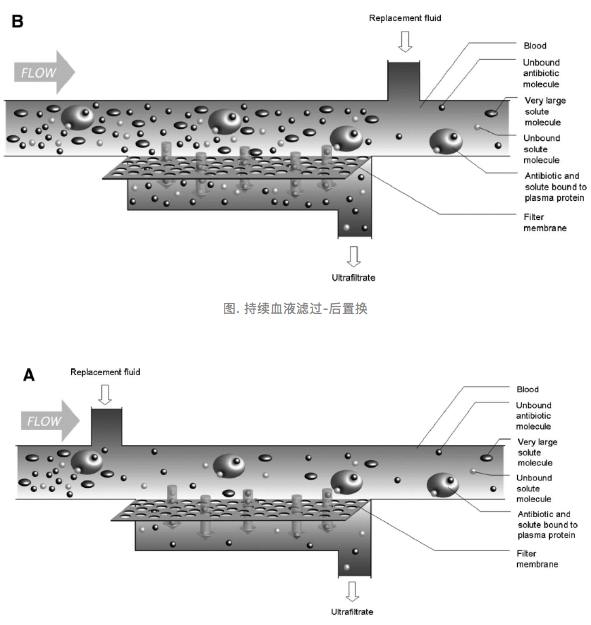
图. 持续血液滤过-后置换
形成超滤液后,补充的是置换液,后置换和前置换滤过的原理是一样的,但前置换在补液体时稀释了血流,在这种情况下,考虑剂量时就需要一个前置换的矫正系数,因为它滤过的效率是完全不一样的。
影响PK的因素还和以下因素相关:1)CRRT滤膜的特性:包括滤膜孔径、滤膜吸附能力;2)CRRT模式:包括持续静脉-静脉血液滤过透析(CVVHDF)、持续静脉-静脉血液滤过(CVVH),通过肾脏清除的药物,清除效率CVVHDF>CVVH,非肾脏清除药物,CRRT对其清除影响小,各种模式区别不明显;3)CRRT治疗剂量:治疗剂量越大,清除越快;4)抗菌药物特性:水溶性/脂溶性、PB、Vd。
举个例子,我们看看CVVH对CL的影响,在两项针对美罗培南在CVVH中药代动力学的研究中(基线基本匹配),应用不同的「滤过膜」(聚丙烯腈和聚砜)导致不同的筛漏系数(0.63±0.252 vs 1.09±0.10);加上「不同的滤过速度」(25-30mL/min vs. 45.8±6.2 mL/min), 导致CRRT清除率显著不同,分别为17.2 mL/min和49.7±8.3 mL/min。对于同一个患者或基线情况类似的患者,就会产生完全不同的剂量推荐(美罗培南 500mg bid vs. 1g tid)。
我们可能永远达不到最佳的抗菌药物使用剂量,但在临床上考虑到的因素越多,就越接近更恰当的剂量,应该无限地接近最恰当的剂量。
CRRT患者药物剂量计算的基本原则,Vd决定初始或负荷剂量,总清除率(CLtot)决定给药间隔和维持剂量,其中CRRT患者CLtot包括CLCRRT 和CLnon-CRRT (残余肾清除和肝脏途径清除),PB是决定 CLCRRT 的重要因素。
在透析的过程中,我们常犯的错误是什么? 是接受CRRT的患者抗菌药物用量不足 [6] 。 接受CRRT的患者往往感染都比较严重,甚至出现重症的感染,我们临床上要考虑的主要方面是达到治疗疗效,安全性的方面也需要考虑,但如果单纯考虑安全性的问题,丧失了剂量的选择,导致剂量不足的话,就给患者会带来一个更大的隐患。
还包括人工肝、ECMO的问题,在临床上都需要根据具体情况来进行分析处理。
3、宿主因素:
1)肥胖:我们在临床上,特别是在监护室里遇到的肥胖患者越来越多了,单纯一个肥胖因素就会对我们的药代动力学参数造成很多很复杂的影响——增大的质量(脂肪和肌肉组织)可能导致「Vd增加」,同时「Vd也可能减少」,比如因为肾脏血流、肾小球滤过率(GFR)、肾脏质量增加、非酒精性脂肪肝(影响以CYP2E1为底物和进行黄嘌呤氧化酶或N-乙酰转移酶反应的药物)等原因;还可能使「CL减少」,如年龄或肥胖相关性肾病;血管疾病,心输出量减少,组织灌注减少;非酒精性脂肪肝(影响通过CYP3A4代谢的药物)。[7]
另外,多数药物剂量采用实际体重为基准,但肥胖者需考虑体重构成比与药物的分布对用药剂量计算的影响。常用于药物剂量计算的有理想体重指数IBW(ideal body weight)、校正体重ABW(adjusted body weight)、瘦体重LBW(lean body weight)。[8]
表. 常见的体重指标公式及评估肾功能的计算方程

对于亲水性药物,Vd小,组织穿透性差、在脂肪中沉积少,主通过肾脏排泄,临床使用IBW以及ABW来推算。而脂溶性药物Vd大,肝脏是其主要清除代谢方式,需要比标准体重计算出的负荷剂量更大的剂量以快速达到起治疗效果的血药浓度,按照TBW给药。
在剂量调整的时候,即使是水溶性药物,肥胖患者因为其血容量更高因此需要的负荷剂量更大。计算脂溶性药物的维持剂量还得考虑到药物在脂肪中的沉积以及半衰期的延长。CL可能由于患者GFR增加,或肥胖相关性肾病以及脂肪肝等因素而降低。
2)老年人:在药代动力学方面,增龄会对老年人造成影响,包括生物利用度下降(胃排空延迟,胃粘膜萎缩,胃酸分泌减少,胃液PH增加,影响口服药物生物利用度);Vd改变(体液总量、细胞内液减少,肌肉组织减少而脂肪相对增多。水溶性药物:Vd减少;脂溶性药物:Vd增加);PB降低(低蛋白血症,PB降低,血药浓度增加);以及CL减少(肝脏结构和功能减退,肝血流量减低;肾单位减少,肾血流量减少,GFR下降)。这就直接影响药物的选择。
3)孕妇:药代动力学方面包括吸收减慢(胃排空速度减慢,口服抗菌药物吸收减慢,血药峰浓度延迟到达,但仍可达有效的药物生物利用度);Vd增大(血浆容积增大,血药浓度降低);CL增加(血流增速,血流量增多,GFR增加);代谢负荷重(肝脏生理性负荷增加,对毒素敏感性增加,易发生肝损害);PB降低(液体增加,低蛋白血症,PB降低,血药浓度增加,分布到组织和经胎血屏障的药物量增加,增加孕妇的不良反应和对胎儿的毒性作用)。这些因素我们在临床上也需要进行考量。
4)肾功能不全:药物或其代谢产物经肾脏排泄减少,半衰期延长,导致血药浓度升高,同时,也需要考虑水肿、血浆白蛋白降低使药物与蛋白的结合量减少,药物游离部分增多,血药浓度升高。这两种因素都会导致不良反应的增加。
5)肝功能不全:代谢降低(肝脏自身代谢降低,对肝药酶诱导减少);CL降低(肝脏清除降低,导致药物蓄积);PB降低(血浆蛋白合成减少,PB减少,药物游离部分增加);Vd增大(大量腹水致药物的Vd增大);生物利用度下降(胃肠道淤血、水肿,影响口服药物的吸收)。
6)低蛋白血症:蛋白结合率越高的药物对PK参数的影响越大,游离抗菌药物浓度升高,使抗菌药物的CL增加;Vd增大,降低血清药物浓度。
举个例子:PB高(85-90%)且主要经肾小球滤过的药物:当PB的变化从99%-98%和从99%-95%,游离型药物分别增加2倍和5倍,有利于达到有效血药浓度。但常伴Vd和CL增加,浓度很快下降;而PB低的药物:当PB的变化从5%-4%或从5%到1%,对游离型药物浓度影响较小。[5]
7)危重症:危重症对患者的影响是多方面的,有些因素会使CL增加,如大量液体复苏导致心输出量增加、20-30%肾功能亢进(CrCl>120ml/min)、替代治疗(CRRT或ECMO)可能增加;有些因素又可能使CL降低,如急性肝肾功能损伤。对于某一位患者来说,CL到底是增加还是降低了,需要临床特别仔细考量。
同时,还有一些外界因素会对危重症患者造成多重影响,如造成Vd增加,包括液体复苏、毛细血管渗透性增加、低蛋白血症、CRRT或ECMO等替代治疗等。[9,10]
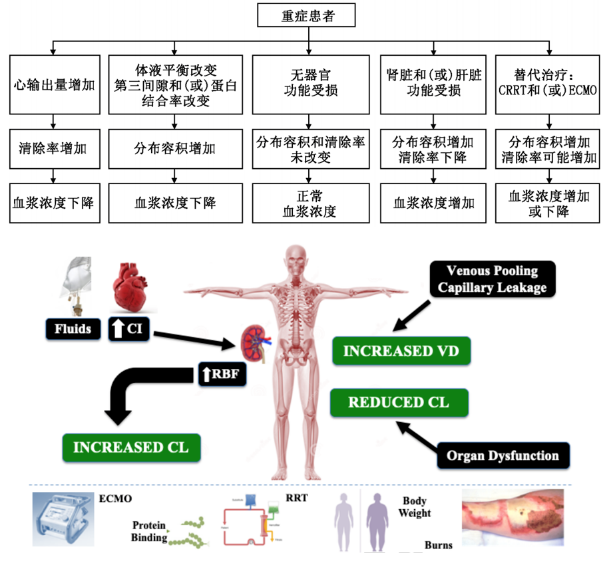
图. 影响重症患者PK/PD的因素
还有一点需要指出,不同因素会对同一患者造成影响,同一患者的不同阶段也会使PK参数发生非常大的改变,这都需要我们在临床上做出非常细致的调整。
总结
抗菌药物合理使用需要全面了解「患者、病原体与抗菌药物 」三者的特点与相互关系,要综合考虑各种复杂的因素及其相互影响,关注患者的病理生理状态 并应用PK/PD 调整用药方案,使病人承担最小的风险,获得最大的治疗效益。
在药物剂量方面,唯一不变的就是变化,病情的变化会带来PK参数的变化,我们要随时根据病情的严重程度和变化进行相对应的抗菌药物调整,来尽可能给患者使用最佳的药物剂量。
参考文献
[1]Imani S, et al. J Antimicrob Chemother. 2017 Oct 1;72(10):2891-2897.
[2]Donadello K, et al. Int J Antimicrob Agents. 2015 Mar;45(3):278-82.
[3]Rawson TM, et al. Nat Rev Microbiol. 2021 Jun 22.
[4]Onufrak NJ,et al. Clin Ther. 2016 Sep;38(9):1930-47.
[5]中国医药教育协会感染疾病专业委员会. 中华结核和呼吸杂志,2018,41(6):409-446
[6]Shaw, A. R. et al. Seminars in Dialysis, 2016
[7]Meng L, et al. Pharmacotherapy 2017;37 (11):1415–31
[8]田婷婷等. 中国抗生素杂志,2016,41(12):893-897. Meng L, et al. Pharmacotherapy 2017;37 (11):1415–31.
[9]Roberts JA,et al. Lancet Infect Dis. 2014 Jun;14(6):498-509.
[10]Annoni F, et al. Expert Rev Anti Infect Ther. 2020 Jan;18(1):27-35.
专家介绍

李燕明
北京医院呼吸与危重症医学科主任,博士生导师,主要研究领域:呼吸系感染,气道过敏性疾病,呼吸危重症。牵头承担国家传染病重大专项课题、国家重点研发计划、国自然面上项目,作为分中心负责人参与卫计委行业专项、国家科技支撑计划等多项研究。国家呼吸专科医疗质量控制中心常务副主任;中国医师协会呼吸医师分会常委;中华医学会呼吸病学分会危重症学组委员;中国康复协会呼吸病学分会副主任委员,青年委员会主任委员;北京医学会呼吸病学分会常委;中国女医师协会药学分会副主任委员;中华预防医学会呼吸病预防与控制专业委员会委员;Allergy中文版主编。

廖艺璇
北京大学医学部博士,北京医院呼吸与危重症医学科医师,国家呼吸医疗质量与控制中心成员,美国密西根大学访问学者。研究方向为慢性气道疾病、睡眠呼吸疾病,参与多项国家自然科学基金、国家重点研发计划等课题,发表SCI及中文核心期刊论文。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢李燕明教授的审阅修改!


