引言
这个病例我们要关注的有3个时间节点,首先是中间的时间节点,2015年患者因「腹痛、腹泻半年」首次入住我院消化内科,当时胸片检查示肺部未见明显异常,腹部CT检查示部分小肠管壁增厚,也无明显淋巴结肿大;而在此前5年的2010年,患者最开始出现腹痛、腹泻表现,当时诊断考虑为克隆恩病,这本该是关注的第一个时间节点;到2017年2月,患者开始出现呼吸困难、咳嗽、咳痰,检查发现多种自身抗体阳性,肺内多发结节实变影,经激素等免疫治疗后症状一过性改善,又再次加重,入院后查炎性指标显著升高……当这3个时间节点串联成一条线时,你们会想到什么?患者被我团队收治后,我们以多发肺结节、实变这一影像学特点为切入点进行分析,遗憾的是患者没能等到最终揭晓结论就因休克死亡。可是,为何从患者最初的腹痛腹泻到7年后呼吸困难、咳嗽、咳痰,进而疾病接踵而至,这种恶性程度极高的肠道淋巴瘤才被揭穿「可憎爪牙」?回顾病程,值得总结思考。
患者无明显诱因出现咳嗽、咳痰,逐渐出现活动后呼吸困难,首次入院治疗后明显改善,20天后又复发再次入院
患者是一位49岁的男性,湖南人,于2017年4月主诉「呼吸困难、咳嗽、咳痰2月」第一次入住我院呼吸科。患者从2017年2月开始,无明显诱因出现咳嗽症状,咳少许白粘痰,否认发热、畏寒、胸痛、咯血、呕吐、腹痛或腹胀,以及排便习惯的改变。在当地医院完善胸部CT检查示:沿支气管血管束分布的多发结节性阴影及实变,纵隔淋巴结肿大,考虑「肺炎」,给予「头孢类」抗生素治疗10天,但咳嗽症状无改善,并逐渐出现活动后呼吸困难,平地行走50米即感呼吸困难。为求进一步诊治患者于2017年3月来中南大学湘雅二医院呼吸与危重症医学科门诊就诊。

图1:肺部CT示双肺多发结节、实变影
完善肺部CT示:双肺多发结节、实变影,纵隔淋巴结肿大(图1:A、B);电子支气管镜:未见明显异常。右上叶前支活检病理组织学检查:镜下见肺组织及支气管黏膜组织呈慢性炎症改变,纤维组织增生,局部较多炎症细胞浸润,以淋巴细胞为主,切片未见癌及结核证据。
为了明确诊断,患者于2017年4月首次入住呼吸科。
(一)体格检查
体温38.1℃,脉搏102次/分,呼吸20次/分,血压102/60mmHg。营养良好,神清,全身浅表淋巴结未触及肿大。双侧瞳孔等大等圆,对光反应灵敏。口腔粘膜无出血点,咽部无充血,扁桃体无肿大。胸廓无畸形,双侧呼吸动度对称,语颤无增强,双肺叩诊清音,双肺呼吸音清晰,未闻及干湿性罗音和胸膜摩擦音。心界无扩大,心率102次/分,律齐,心音无明显增强和减弱,各瓣膜听诊区未闻及病理性杂音。腹部平软,全腹无压痛及腹肌紧张,肝、脾肋缘下未触及,腹部移动性浊音阴性,肠鸣音正常。双下肢无浮肿。
(二)检验资料
血常规:WBC 10.72*109/L,Hb 93g/L,N 80.4%。
肝肾功能正常;
炎症指标:ESR 104mm/h,PCT 0.16ng/ml,CRP 82.3mg/L;
心脏相关:BNP:555.0pg/ml;心肌酶、肌钙蛋白阴性;
病原学检查:G试验、GM试验、新型隐球菌荚膜抗原、巨细胞病毒、风疹病毒、单纯疱疹病毒1型、弓形虫、柯萨奇病毒、EB病毒、HIV抗体均阴性;
结缔组织相关检查:髓过氧化物酶(MPO)、蛋白酶3(PR3)、抗肾小球基底膜(GBM)抗体、抗CCP抗体和抗核抗体(ANA)1:80阳性,余类风湿因子、补体、ENA、ANCA均阴性。
结核相关检查:PPD皮试1:2000,1:10000、结核全套、r-干扰素释放试验均阴性。
24小时尿蛋白定量为363.42mg/d。
神经肌电图显示双侧腓神经早期受损。
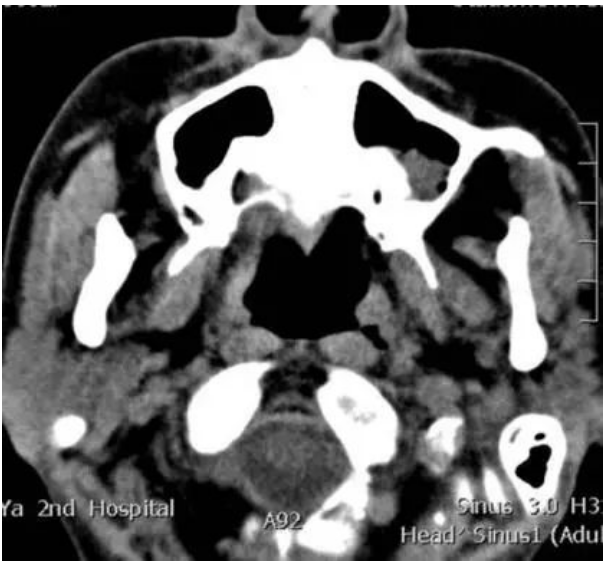
图2:鼻窦CT示左侧上颌窦内软组织影
副鼻窦CT显示左上颌窦有异常软组织混浊,密度不均匀(图2)。
结合患者病史、实验室及影像学检查,考虑该患者为肉芽肿性多血管炎(GPA)。给予甲泼尼龙(40mg/d)口服和环磷酰胺(0.2g,每月两次)静脉注射。
治疗10天后,患者症状得到明显改善。复查胸部CT示:双肺大部分病变缩小,部分结节病变增加(图1:C、D)。与此同时实验室检查也有所改善:ESR 31mm/h,CRP 27.6 mg/L。患者治疗2周后症状好转出院。但出院20天后,患者再次出现呼吸困难、咳嗽、咳痰,并出现发烧(最高温度为39℃),遂于2017年5月15日再次入院。
2年前患者曾入住我院消化内科,对当时病历分析后又做了哪些检查?……以多发肺结节、实变这一影像学特点为切入点进行分析
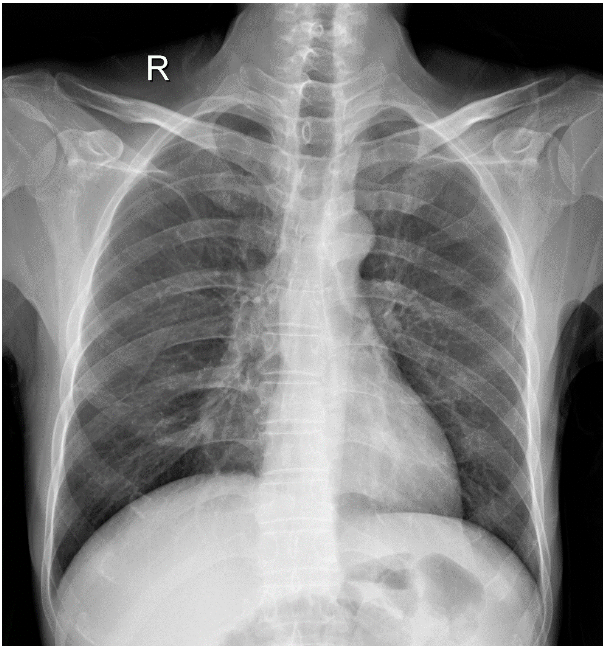
图3:胸片(2015年3月)未见明显异常

图4:腹部CT示小肠管壁增厚,腹膜后多发肿大淋巴结
实际上,2015年3月,患者就因「腹痛、腹泻半年」首次入住我院消化内科。当时胸片检查示肺部未见明显异常。腹部CT检查示部分小肠管壁增厚,无明显淋巴结肿大(图4:A、B)。
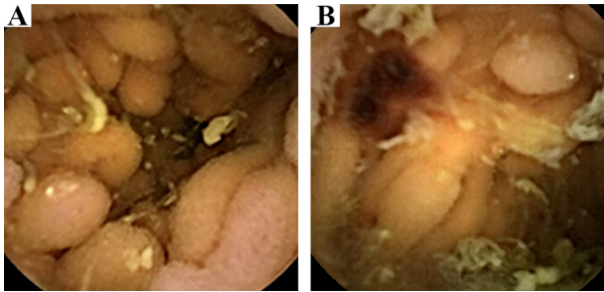
图5:弥漫性肠壁增厚、水肿,多发息肉
胶囊内镜下见弥漫性粘膜增厚和水肿,十二指肠、空肠和回肠近端表面有粘膜侵蚀的多发息肉样结节(图5),回肠中部以下无病变。
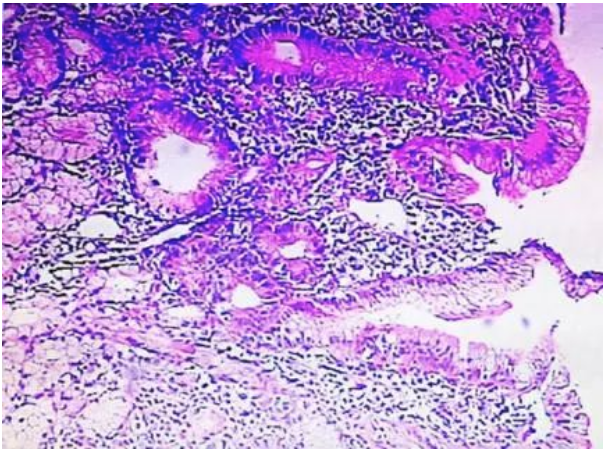
图6:肠粘膜病理组织学结果示粘膜炎性细胞浸润
胃镜引导下十二指肠粘膜活检病理组织学检查示粘膜慢性炎症,灶性浅表糜烂伴炎性渗出物(图6)。由于不典型的内镜和病理表现,最初给患者的诊断为克罗恩病,给予硫唑嘌呤100mg Qd(1月),甲泼尼龙32mg Qd(逐渐减量,半年后停药),经上述治疗后,患者的症状得到缓解,但停药后又间断出现腹痛2次,患者自服甲泼尼龙片后可以缓解,此后未再规律使用激素。患者个人史无特殊,家族中也无类似病史。患者本人否认家族性遗传病史,否认冶游史。
第二次入院后,对其进行如下检查:
(一)体格检查:
体温 37.7℃,脉搏118次/分,呼吸20次/分,血压89/65mmHg。营养良好,神清,全身浅表淋巴结未触及肿大。双侧瞳孔等大等圆,对光反应灵敏。口腔粘膜无出血点,咽部无充血,扁桃体无肿大。胸廓无畸形,双侧呼吸动度对称,语颤无增强,双肺叩诊清音,双肺呼吸音清晰,未闻及干湿性罗音和胸膜摩擦音。心界无扩大,心率118次/分,律齐,心音无明显增强和减弱,各瓣膜听诊区未闻及病理性杂音。腹部平软,全腹无压痛及腹肌紧张,肝、脾肋缘下未触及,腹部移动性浊音阴性,双肾区无叩击痛。肠鸣音正常。关节无红肿,无杵状指(趾),双下肢无浮肿
(二)检验检查:
血常规:WBC 31.46×109/L, N 91%;
ESR 74mm/h,CRP 202mg/L;
动脉血气分析(吸氧2L/min):PaO2 68mmHg,PaCO2 30mmHg,SaO2 95%。
结缔组织疾病相关检查:MPO、PR3、抗GBM抗体、抗CCP抗体和ANA均为阴性。
胸部CT:两肺内病灶较前明显增多、增大,纵隔淋巴结较前增大,新发右侧胸腔积液,双下肺新增多发片状影(图1E,F)。
腹部CT:小肠壁增厚,横结肠附近有软组织肿块,腹内和腹膜后间隙有多发肿大淋巴结(图4C,D)。
回顾患者的临床特点如下:
1、一般情况:中年男性,慢性病程。
2、症状:患者多系统受累(肺、胃肠、鼻窦),经激素等免疫症状改善后再加重并出现发热。
3、体征:体温升高,肺部体格检查无明显异常体征。
4、辅助检查:①实验室检查:WBC、N%显著升高,CRP、ESR升高;②第一次住院期间发现髓过氧化物酶(MPO)、蛋白酶3(PR3)、抗肾小球基底膜(GBM)抗体、抗CCP抗体和抗核抗体(ANA)1:80等多种自身抗体阳性;再次复查抗体转阴;③肺部CT:双肺多发结节实变影,及纵隔多发肿大淋巴结,经激素治疗后病变明显改善,之后病情再次加重;④腹部CT;胃肠道管壁增厚、肿块影,腹膜后淋巴结增大。
总结该患者的病例特点后进行总结分析:患者为中年男性,2010年开始出现腹痛、腹泻表现,当时诊断考虑为克隆恩病,给予激素治疗后症状好转,但仍有间断发作;2017年2月开始出现呼吸困难、咳嗽、咳痰,检查发现多种自身抗体阳性,肺内多发结节实变影,经激素等免疫治疗后症状一过性改善后再次加重,入院后查炎性指标显著升高。由此,团队以多发肺结节、实变这一影像学特点为切入点进行分析,诊断思路线路图如下(图7):
图7:诊断分析线路图
入院第25天,患者出现嗜睡、休克、心动过速(每分钟145次)和低血压(66/54 mmHg),血乳酸增加到14.2 mmol/L,最终死于休克
首先分析患者是否感染性疾病:
(1)细菌感染
支持点:多表现为急性病程,临床症状多有发热、咳嗽、咳痰,胸部CT可以表现为结节、实变影。
不支持点:患者病程较长,多系统受累,第一次住院没有发热中毒表现,病原学检查阴性。不支持细菌感染的特点。
(2)真菌感染
支持点:临床症状可呈慢性病程,有反复咳嗽、咳痰,胸部CT可以表现为结节、实变。
不支持点:缺少真菌感染的相关病原学依据。
(3)结核感染
支持点:可以表现为慢性过程,临床症状有反复咳嗽、咳痰,胸部CT可以表现为结节、实变。
不支持点:患者无结核中毒症状,如长程午后低热、盗汗、消瘦、乏力。实验室检查抗酸染色阴性,T-SPOT阴性。不支持结核分枝杆菌感染的特点。
是否为非感染性疾病呢?
(1)系统性血管炎:是以血管炎症与破坏为主要病理改变的一组自身免疫性疾病。
支持点:本病患者多系统受累,第一次住院期间多种血管炎相关抗体阳性,如MPO、PR3、GBM、ANA 1:80阳性,且经激素治疗后临床症状及肺部影像较前明显改善。
(2)恶性肿瘤:
支持点:本病患者有肺及消化道多发结节、肿块,全身多发肿大淋巴结。
不支持点:激素治疗后结节较前缩小,肺组织病理组织学检查阴性。
(3)淋巴瘤。
支持点:全身多发肿大淋巴结,肺部及消化道多发结节、肿块,激素治疗后一过性好转再加重。
不支持点:肺组织病理组织学检查阴性。
治疗中,患者在使用免疫抑制剂情况下出现了发热、炎症指标升高及肺部影像学短期内进展,我们考虑患者合并肺炎,给予莫西沙星(0.4g/d)抗感染,继续给予甲泼尼龙(40mg/d)治疗原发病。入院后第3天,患者症状稍有改善,复查炎症指标较前下降:WBC 24.76×109/L,N 94.20%;ESR 67mm/h,CRP 159 mg/L。
基于抗感染治疗有效,但患者病情仍较危重,故将抗生素升级为美罗培南(1.0g,Q8h),同时将甲泼尼龙减至16mg/d。但入院第9天,患者的病情开始逐渐恶化,并出现持续性腹胀,同时血象再次升高:WBC40.67×109/L,N 97.1%。此时,感染不能解释上述血象表现,故予完善骨髓穿刺。骨髓细胞学检查未见明显异常。患者逐渐出现严重消化不良和腹胀,药物治疗后症状不能缓解,予进行胃肠减压,减压管排出约200ml深红色血液,提示胃肠道出血,给予护胃、止血等对症治疗。
由于患者多次复查血常规提示白细胞逐渐升高,团队考虑其可能是恶性肿瘤,尤其恶性淋巴瘤。但患者病情危重,并伴呼吸衰竭,行肺组织穿刺活检的风险极高,遂予完善PET-CT。
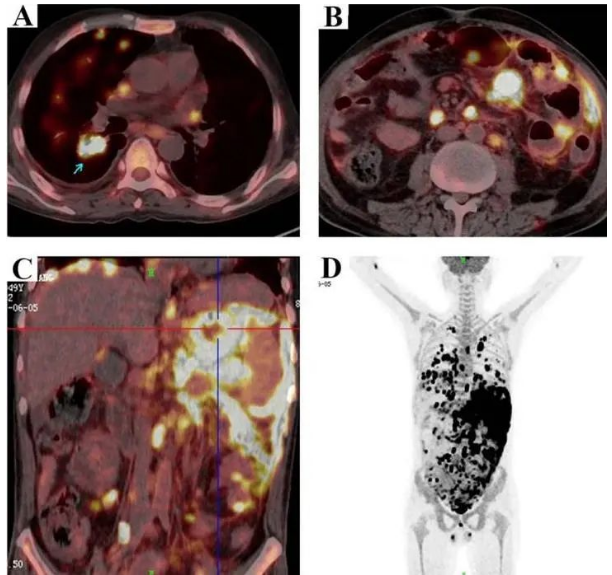
图8 :18F-FDG PET/CT示全身弥漫性SUV增高的肿块、结节及淋巴结
18F-FDG PET/CT检查,结果示胃(SUV max,27.9)、左小肠壁(SUV max,41.7)、双侧肾上腺(SUV max,34.9)中存在大量具有高代谢活性的病变,胆囊(SUVmax,19.5)、腹膜(SUVmax,44.4)、广泛淋巴结(SUVmax,32.5)、肺(SUVmax,32.5)、右胸膜(SUVmax,14.2)、右心房(SUVmax,16.47)、心包(SUVmax,16.4)和左额窦(SUVmax,14.05)(图8)。
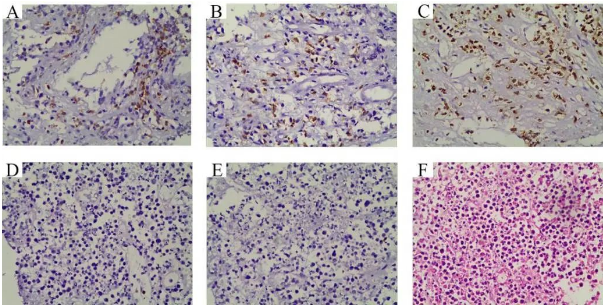
图9:脾周组织病理组织学结果 免疫组化染色示CD3 (A), CD8 (B), CD56 (C)阳性,CD4 (D)及CD20 (E)阴性. HE染色 (F)示单一的,小到中等大小的淋巴细胞。
根据PET-CT结果在CT引导下对脾脏周围组织进行经皮穿刺活检。脾周组织病理组织学检查结果示一个小到中等大小的淋巴细胞浸润,CD3、CD8和CD56阳性,CD4和CD20阴性(图9)。
在入院的第25天,患者出现嗜睡、休克、心动过速(每分钟145次)和低血压(66/54 mmHg)。血乳酸增加到14.2 mmol/L,最终患者死于休克。
最终结论依据在握,这种病极易误诊,恶性程度高,预后极差,2年生存率不足20%
至此,已经可以明确最后的诊断结论。该患者为罹患II型肠病相关型T细胞淋巴瘤伴全身广泛转移,恶性肿瘤模拟血管炎。诊断依据如下:
1、一般情况:中年男性,慢性病程。
2、症状:患者多系统受累(肺、胃肠、鼻窦),经激素等免疫症状改善后再加重并出现发热。
3、体征:体温升高,肺部体格检查无明显异常体征。
4、辅助检查:①实验室检查:WBC、N%显著升高;②第一次住院期间发现髓过氧化物酶(MPO)、蛋白酶3(PR3)、抗肾小球基底膜(GBM)抗体、抗CCP抗体和抗核抗体(ANA)1:80等多种自身抗体阳性;③肺部CT:双肺多发结节实变影,及纵隔多发肿大淋巴结,经激素治疗后病变明显改善,之后病情再次加重;④腹部CT;胃肠道管壁增厚、肿块影,腹膜后淋巴结增大。⑤鼻窦CT:鼻窦内软组织影。⑥18F-FDG PET/CT发现全身弥漫性SUV增高的肿块、结节及淋巴结。⑦脾周组织病理组织学检查符合II型肠病相关型T细胞淋巴瘤。
显然,这是一个遗憾的病例。7年病程,最终发展至此,经过层层剥茧才揪出这种恶性程度极高的肠道淋巴瘤的「可憎爪牙」。那么,从该病例中,应该得到哪些经验与体会?
1、原发性胃肠道淋巴瘤占所有非霍奇金淋巴瘤(NHL)的4%-20%,主要来源于B细胞,而原发性胃肠道T细胞淋巴瘤极为罕见,仅占胃肠道非霍奇金淋巴瘤的4%-6% [1]。与B细胞淋巴瘤相比,胃肠道T细胞淋巴瘤更具侵袭性,治疗效果较差,预后较差。肠病相关型T细胞淋巴瘤(Enteropathy-associated T-cell lymphoma,EATL)是一种罕见的、恶性程度极高的源自肠上皮内T淋巴细胞的肠道淋巴瘤,其临床表现缺乏特异性,很容易被误诊为其他消化系统疾病,如肠结核、克罗恩病和结肠癌等。本病罕见,极易误诊,恶性程度高,预后极差,2年生存率不足20% [2]。根据世界卫生组织基于形态学、免疫表型和临床特征的分类方案,EATL分为I型和II型。前者在北欧和美国占优势,与腹腔疾病密切相关。后者在欧洲很少见,与乳糜泻无关,且分布范围更广,呈散在分布[3]。在亚洲,中国[4]、台湾[5]、韩国[6]和日本[7]报道的EATL病例通常与腹腔疾病无关,提示亚洲的EATL以II型为主。II型EATL十分罕见,仅占EATL的10%-20%[3]。
2、EATL的主要临床表现包括腹痛、体重减轻、腹泻、呕吐、排便习惯改变、疲劳、厌食或溃疡、梗阻或穿孔引起的急腹症[2, 8]。小肠是最常见的受累部位,尤其是空肠和回肠近端。EATL早期好发于胃肠道或肠系膜淋巴结。随着疾病的进展,EATL可扩散到肝脏、脾脏、皮肤或其他器官[8]。弥漫性粘膜增厚和水肿伴多处浅溃疡和结节状或溃疡性粘膜病变是EA TL的特征性内镜检查结果[9];然而,EATL的典型内镜特征鲜有报道。组织学上,II型EA TL主要由小形到中形的单形细胞组成。免疫组织化学显示CD3、CD7、CD8和CD56为阳性,而CD4为阴性[10]。由于临床、内镜和组织学表现的多样性,早期诊断EATL非常困难,容易被误诊为其他胃肠道疾病。
3、肉芽肿性多血管炎,是一种全身性坏死性血管炎,影响中小型血管。系统性血管炎与恶性肿瘤密切相关。据统计,大约0.5%-5%的血管炎实际上是恶性肿瘤[11],而0.7%的恶性肿瘤有血管炎的表现[12]。在肿瘤性疾病中,淋巴增生性恶性肿瘤是最常见的与血管炎相关的肿瘤,而实体瘤则不太常见。有人提出以下理论来解释血管损伤的潜在机制[13, 14]:1)肿瘤细胞可能导致循环免疫复合物清除受损,从而损伤毛细血管后小静脉的内皮细胞;2) 肿瘤细胞可触发针对血管内皮的免疫反应;3) 肿瘤和内皮细胞表达共同的抗原,产生免疫球蛋白,可导致肿瘤和血管内皮的损伤;4) 肿瘤细胞可作为致敏剂,从而激活宿主中的超敏血管炎;5)肿瘤细胞可释放多种细胞因子引起内皮损伤。恶性肿瘤继发血管炎的临床表现多种多样,并与受累器官的变化有关。组织病理学检查有助于区分原发性或继发性血管炎。
参考文献
[1] Anderson JR, Armitage JO, Weisenburger DD. Epidemiology of the non-Hodgkin's lymphomas: distributions of the major subtypes differ by geographic locations. Non-Hodgkin's Lymphoma Classification Project. Annals of oncology : official journal of the European Society for Medical Oncology. 1998; 9:717-20.
[2] Grigg-Gutierrez NM, Estremera-Marcial R, Caceres WW, Toro DH. Primary Enteropathy-Associated T-Cell Lymphoma Type 2: An Emerging Entity? Cancer Control. 2015; 22:242-7.
[3] Ondrejka S, Jagadeesh D. Enteropathy-Associated T-Cell Lymphoma. Curr Hematol Malig Rep. 2016; 11:504-13.
[4] Yu F, Xu J, Jiang Z. Type enteropathy-associated T-cell lymphoma presenting with whole gastrointestinal tract involvement: report of a case. Zhonghua Bing Li Xue Za Zhi. 2016; 45:56-8.
[5] Hsiao CH, Lee WI, Chang SL, Su IJ. Angiocentric T-cell lymphoma of the intestine: a distinct etiology of ischemic bowel disease. Gastroenterology. 1996; 110:985-90.
[6] Lee YS, Kang CS, Kim BK, Shim SI. Extranasal T/NK-cell lymphoma presenting as intestinal diverticulum. J Korean Med Sci. 2000; 15:229-32.
[7] Katoh A, Ohshima K, Kanda M, Haraoka S, Sugihara M, Suzumiya J, et al. Gastrointestinal T cell lymphoma: predominant cytotoxic phenotypes, including alpha/beta, gamma/delta T cell and natural killer cells. Leuk Lymphoma. 2000; 39:97-111.
[8] Zhang JC, Wang Y, Wang XF, Zhang FX. Type I enteropathy-associated T-cell lymphoma in the colon of a 29-year-old patient and a brief literature review. Onco Targets Ther. 2016; 9:863-8.
[9] Hong YS, Woo YS, Park G, Lee K, Kang SH, Lee HW, et al. Endoscopic Findings of Enteropathy-Associated T-Cell Lymphoma Type II: A Case Series. Gut Liver. 2016; 10:147-51.
[10] Liong CC, Ravindran S, Gnana Kumar G, Chin EF, Koh PS, Chan WK. Enteropathy-associated T-cell lymphoma: An extremely rare cause of chronic diarrhoea. Med J Malaysia. 2016; 71:88-90.
[11] Solans-Laque R, Bosch-Gil JA, Perez-Bocanegra C, Selva-O'Callaghan A, Simeon-Aznar CP, Vilardell-Tarres M. Paraneoplastic vasculitis in patients with solid tumors: report of 15 cases. J Rheumatol. 2008; 35:294-304.
[12] Hutson TE, Hoffman GS. Temporal concurrence of vasculitis and cancer: a report of 12 cases. Arthritis Care Res. 2000; 13:417-23.
[13] Buggiani G, Krysenka A, Grazzini M, Vasku V, Hercogova J, Lotti T. Paraneoplastic vasculitis and paraneoplastic vascular syndromes. Dermatol Ther. 2010; 23:597-605.
[14] 施宏莹, 赵丽丹, 徐东, 张烜, 田新平, 曾小峰. 恶性肿瘤模拟血管炎24例临床分析 %J 中华风湿病学杂志. 2015; 19:534-9+78.
专家介绍

罗红
教授,一级主任医师,博士生导师,中南大学湘雅二医院呼吸与危重症医学科主任,危重症亚专科主任,中华医学会呼吸病学分会呼吸危重症学组委员,中国医师协会内科医师分会委员,中国医师协会呼吸医师分会委员,中国医师协会呼吸医师分会危重症医学工作委员会副主任委员,中国残疾人康复协会肺康复专委会常委兼ICU肺康复学组副组长,湖南省医师协会呼吸医师分会会长,湖南省医学会呼吸病学专业委员会副主任委员。

欧阳若芸
中南大学湘雅二医院呼吸与危重症医学科主任医师,教授,医学博士,博士生导师。2012年赴美国南加州大学医学中心访学1年。研究方向:睡眠呼吸障碍、肺部罕见病。担任中华医学会呼吸病学分会第十一届委员会睡眠呼吸障碍学组委员,中国医师协会呼吸医师分会睡眠呼吸障碍工作委员会委员,中国首届研究型医院学会罕见病分会理事,中国罕见病联盟呼吸病学第一届常务委员。主持国家级课题1项,参加国家级课题3项,主持省部级课题4项,获省级成果奖3项,发表专业学术论文60余篇,其中以第一作者或通讯作者发表SCI论文10余篇,Medline论文10余篇,获院医疗新技术奖2项。

纵单单
中南大学湘雅二医院呼吸与危重症医学科,主治医师。湖南省医学会呼吸病学专业委员会青委会副主委,湖南省医师协会呼吸医师分会秘书,湖南省慢阻肺联盟委员,湖南省睡眠呼吸联盟委员。主持国家自然科学基金课题一项,主持湖南省自然科学基因课题一项,以第一作者或通讯作者发表SCI论文9篇,核心期刊论文10余篇。


