目的:分析合并支气管扩张(bronchiectasis,BE)对社区获得性肺炎(community acquired pneumonia,CAP)住院患者的临床特征和预后的影响,并探讨影响其 30 天病死率的独立危险因素。
方法:基于 CAP-China 网络平台的全国多中心回顾性研究。收集 2014 年 1 月 1 日至2014 年 12 月 31 日期间,在北京、山东、云南地区 13 所三级教学医院住院的 6056 例 CAP 患者的临床资料,比较 CAP 合并 BE 患者(BE-CAP 组)与不合并 BE 患者(非 BE-CAP 组)的临床特征、病原学分布和治疗预后的差异,Logistic 回归分析影响 BE-CAP 住院患者 30 天病死率的独立危险因素。
结果:5880例 CAP 患者被纳入最终分析,BE-CAP 患者占比 10.8%(637/5880),与非 BE-CAP 患者相比,BE-CAP 患者多为女性,较多比例患者合并慢性阻塞性肺疾病、支气管哮喘、既往糖皮质激素吸入史和 1 年内有 CAP 病史。BE-CAP 患者出现呼吸困难、发绀的比例更多,动脉血氧分压更低,达临床稳定中位时间延长(6 d比4 d,P<0.001),呼吸衰竭发生率明显高于非 BE-CAP 患者(27.8% 比 19.7%,P<0.001),最常见的感染细菌为铜绿假单胞菌。合并 BE 对 CAP 患者的疾病严重程度、总住院时间和病死率无显著影响。BE-CAP患者 30 天病死率为 2.2%,Logistic 回归分析显示初始治疗失败[比值比(odds ratio,OR)6.675,95%可信区间(confidence interval,CI)4.235~10.523,P<0.001]、呼吸衰竭(OR 5.548,95%CI 3.681~8.363,P<0.001)、血尿素氮>7.0 mmol/L(OR 2.490,95%CI 1.625~3.815,P<0.001)、白蛋白<35.0 g/L(OR 1.647,95%CI 1.073~2.529,P=0.022)和 CURB-65 评分(OR 1.691,95%CI 1.341~2.133,P<0.001)是影响 BE-CAP 患者 30 天病死率的独立危险因素。
结论:BE-CAP 患者缺氧症状更明显,呼吸衰竭发生率更高,对于初始治疗失败、并发呼吸衰竭、血尿素氮>7.0 mmol/L、白蛋白<35.0 g/L的 BE-CAP 患者应及时进行治疗评估以降低病死率。
社区获得性肺炎(community acquired pneumonia,CAP)仍是全球重要的健康问题之一,2019 年全球疾病负担调查显示下呼吸道感染是降低伤残调整寿命年的第四位原因[1]。虽然医疗技术与经济水平不断发展,但 CAP 仍有较高的发病率和病死率。在美国下呼吸道感染是感染性疾病中致死的首要原因[2]。美国 CAP 平均住院率为 464.8/10 万人,院内平均病死率为 7.4%[3]。在德国每年 CAP 发病率约为 9.7‰,30 天病死率为12.9%[4]。我国对成人 CAP 患者的研究显示 30 天病死率为 4.2%[5]。入住重症监护病房(intensive care unit,ICU)的 CAP 患者病死率可达 20%~30%[6]。支气管扩张(bronchiectasis,BE)是以「慢性感染–炎症–纤毛黏膜受损–结构性肺损伤」为恶性循环的慢性化脓性感染疾病,是继慢性阻塞性肺疾病(简称慢阻肺)、支气管哮喘的第三大慢性气道疾病[7-8]。BE 患病率近年在全球范围内呈上升趋势,英国女性患病率从 2004 年 350.5/10 万增至 566.1/10 万,男性患病率从 2004 年 301.2/10 万增至 485.5/10 万[9]。在美国 BE 患病率年增长率为8.0%[10]。既往对合并 BE 的 CAP(简称 BE-CAP)患者的研究显示 BE 患者发生CAP的风险较高,与非BE-CAP患者相比,BE-CAP患者具有不同的人口学特征和病原学分布[11]。我国对于BE-CAP患者的研究较少,由于 BE 患者气道结构改变,气道慢性炎症和反复急性加重应用抗生素,BE-CAP 患者可能具有不同的临床特征和治疗预后,本研究将对此进行探讨。
一、资料与方法
1、临床资料
本研究为全国多中心回顾性研究,研究中心包括北京、山东、云南三省 7 市的 13 所三级教学医院,收集 2014 年 1 月 1 日—2014 年 12 月 31 日期间出院主要诊断包括「肺炎」或「肺部感染」的病例,按照参照文献[12]制定纳入、排除标准。
1)纳入标准
(1)年龄>14 岁;(2)肺部影像学出现新发的浸润影或间质性改变,同时具备以下标准之一:1)新近出现咳嗽、咳痰症状或原有的呼吸道症状加重,伴或不伴胸痛、胸闷憋气;2)发热(腋温≥37.3 ℃)或低体温(腋温<36.0 ℃);3)肺部听诊可闻及干湿性啰音或出现肺实变体征;4)实验室检查白细胞计数>10×109/L或<4×109/L,伴或不伴细胞核左移。排除标准:(1)未在入院 48 h 内发生的肺炎;(2)由非感染因素引起的类似于肺炎症状体征或影像学表现的疾病,如肺水肿、肺栓塞、肺血管炎、肺间质病、肺癌等;(3)免疫抑制患者(接受器官或骨髓移植,免疫抑制剂治疗,半年内接受放化疗,口服糖皮质激素醋酸泼尼松≥10 mg/d 持续 3 周以上,人类免疫缺陷病毒感染,脾切除,血液恶性肿瘤等);(4)妊娠或哺乳期妇女;(5)出院后 72 h 再入院。
BE 诊断标准:临床表现为慢性咳嗽、咳脓痰、咯血或呼吸困难等症状。影像学直接征象:(1)支气管内径从中心至周围无逐渐变细;(2)支气管内径/伴行肺动脉内径>1;(3)支气管影像在外周或纵隔胸膜 1 cm 范围内可见;间接征象为支气管壁增厚(支气管内径<80% 外径)、黏液嵌塞、树芽征或马赛克征[7]。
BE-CAP 诊断标准:出院主要诊断包括「肺炎」或「肺部感染」患者,合并 BE 基础疾病,具有肺炎影像学表现,与 BE 伴感染相区分。
2)病原学诊断方法和标准
参考文献[13]的方法和标准。(1)合格痰标本(光镜下每低倍野鳞状上皮细胞计数<10 个、白细胞计数>25 个或鳞状细胞与白细胞比值<2.5)细菌定量培养浓度≥1×107 cfu/mL或连续 2 次以上培养出同一细菌浓度为1×105~1×106 cfu/mL定义为致病菌。痰细菌定量培养方法:将痰加入 1% 的痰标本消化液,放入 37 ℃ 恒温条件下,60~90 min 后完全液化为匀液,用直径 3 mm 接种环取一满环液化痰液,接种于 7%~10% 的血平板或巧克力琼脂平板上。先在 A 区划线 20~40 条,然后在 Ⅰ、Ⅱ、Ⅲ 区分别划线 4 条(划线前接种环需灭菌),接种后于 37 ℃ 恒温下培养 18~20 h,然后计算各区菌落数及每毫升痰液中细菌数。(2)支气管肺泡灌洗液细菌定量培养浓度≥1×104 cfu/mL 定义为致病菌。(3)胸腔穿刺液培养阳性的细菌一般为肺炎致病菌(排除皮肤表面细菌污染)。(4)血培养阳性在排除其他部位的感染后,认为是肺炎致病菌。(5)尿抗原检测主要检测肺炎链球菌、非典型病原体军团菌,阳性定义为感染。(6)血清学检测主要检测非典型病原体(支原体、衣原体、军团菌)和病毒,IgM 阳性或(恢复期)IgG 抗体增加 4 倍以上定义为感染。(7)鼻(咽)拭子或痰标本核酸检测主要检测病毒,聚合酶链式反应核酸阳性者定义为感染。
2、方法
收集患者年龄、性别、基础疾病、入院 24 h 内临床表现、胸部影像表现和实验室指标、院前用药、病原学诊断、抗生素方案、第 4 天及第 14 天临床评估、并发症和预后转归等信息。参考文献[5]定义以下指标:(1)体重指数:体重/身高的平方,正常值为 18.5~23.9 kg/m2,≥24.0 kg/m2 为超重。(2)吸入因素:包括进食或饮水呛咳、吞咽困难、胃食管反流病、假性球麻痹、鼻–胃管置入、长期卧床、阿尔兹海默症、帕金森病等。(3)CAP 疾病严重程度评分:肺炎严重指数评分(pneumonia severity index,PSI)和 CURB-65 评分。PSI 评分[14]:≤90 分为低危(Ⅰ~Ⅲ 级)、91~130 分为中危(Ⅳ 级)、>130 分为高危(Ⅴ 级)。CURB-65 评分[15]:C(意识障碍)、U(尿素氮>7.0 mmol/L)、R(呼吸频率≥30 次/min)、B(收缩压<90 mm Hg或舒张压≤60 mm Hg。1 mm Hg=0.133 kPa)、年龄≥65 岁,每一项各 1 分,0~1 分为低危,2 分为中危,3~5 分为高危。(4)临床稳定标准[16]:不用退热药物体温≤37.8 ℃ 持续 24 h 以上;呼吸频率≤24 次/min;静息情况下心率≤100 次/min;不用升压药物收缩压≥90 mm Hg;不吸氧血氧饱和度≥90%,满足以上全部条件。(5)初始治疗失败[12]:初始抗感染治疗患者病情无改善或改善后病情再次恶化,包括进展性肺炎(入院 72 h 内病情迅速恶化,需要有创机械通气或血管活性药物维持血压治疗)和无反应型肺炎(初始治疗 72 h 不能达到临床稳定标准)。(6)医疗保健相关性肺炎(healthcare-associated pneumonia,HCAP)危险因素[17]:近 90 d 急诊住院史≥2 d;近 30 d 接受静脉抗生素或家庭输液治疗;在医院或透析门诊接受血液透析或腹膜透析肾脏替代治疗;长期居住养老院或护理机构。(7)铜绿假单胞菌感染危险因素[18]:既往分离出铜绿假单胞菌(尤其从呼吸道中获得)和 90 d 内住院治疗及接受过胃肠外抗生素治疗(2019 年美国胸科学会/美国感染病学会 CAP 指南)。(8)治疗过度:无铜绿假单胞菌感染风险的患者(非 ICU)应用抗铜绿假单胞菌的 β-内酰胺或 β-内酰胺+喹诺酮;普通病房患者或<65 岁、无基础疾病、无铜绿假单胞菌感染风险的 ICU 患者应用 β-内酰胺(抗或不抗铜绿假单胞菌)+喹诺酮。(9)治疗不足:有铜绿假单胞菌感染风险,未应用抗铜绿假单胞菌药物治疗。
本研究中,意识障碍包括嗜睡、昏睡、浅昏迷、深昏迷,影像学特征中超过 2 个肺叶的浸润为多肺叶浸润,呼吸衰竭定义为平静呼吸室内空气条件下,动脉血氧分压<60 mm Hg 伴或不伴动脉血二氧化碳分压>50 mm Hg。
本研究获得中日友好医院伦理委员会批准(2015-85),并对所有患者个人信息保密。
3、统计学方法
采用 SPSS 24.0 统计软件。计量资料首先进行正态检验(Kolmogorov-Smirnov 检验),符合正态分布用均数±标准差表示,采用独立样本 t 检验;不符合正态分布用中位数(四分位数)[M(Q1,Q3)]表示,采用 Mann-Whitney 检验。计数资料用例数(百分比)表示,组间比较采用 χ2 检验或 Fisher 确切概率法。单因素分析 P<0.05 的变量进入 Logistic 回归分析。双侧 P<0.05 为差异具有统计学意义。
二、结果
1、研究人群一般情况
5880 例CAP住院患者纳入最终分析,BE-CAP 患者占10.8%(637/5880),入组 CAP 患者男性偏多(53.7%),中位年龄 66.0(53.0,78.0)岁。
2、两组患者人口学特征及病情严重程度比较
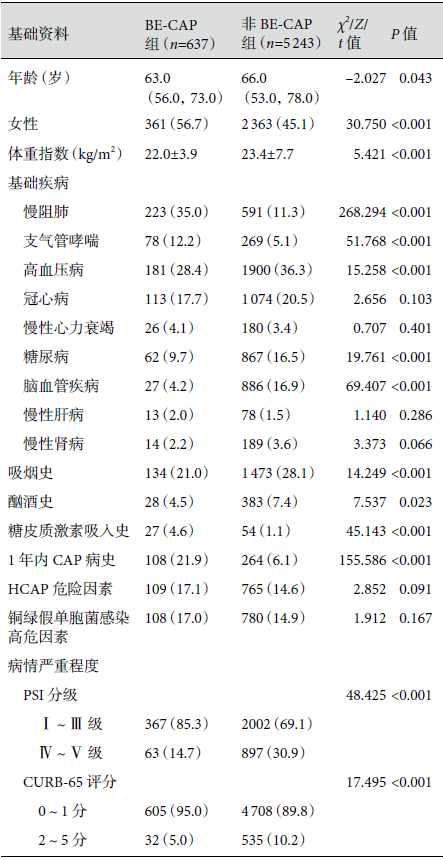
与非 BE-CAP 组相比,BE-CAP 组女性患者较多,体重指数偏低,较多比例患者合并慢阻肺、支气管哮喘、既往糖皮质激素吸入史和1年内有CAP病史;PSI和CURB-65评分低危者占比例较多,合并 BE 未增加CAP的病情严重程度。结果见表1。
表1:两组患者人口学特征和病情严重程度比较[M(Q1,Q3)/例(%)/(均数±标准差)]
3、两组患者临床表现及影像学特征比较
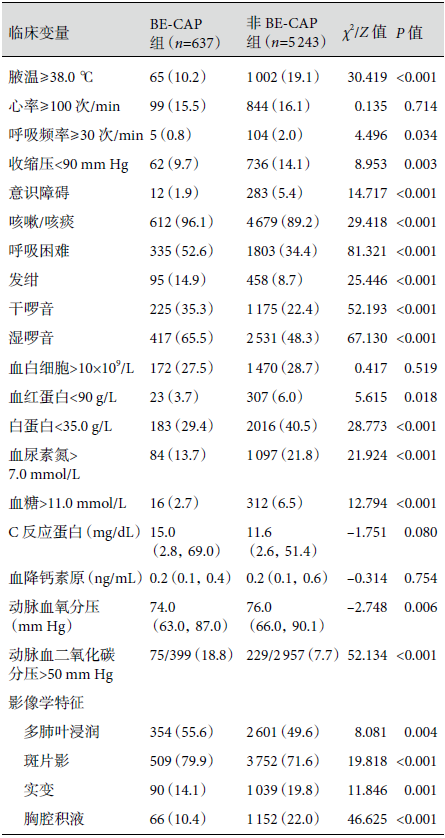
与非 BE-CAP 患者相比,BE-CAP 患者出现咳嗽咳痰、呼吸困难、发绀和肺部听诊闻及干湿性啰音的比例明显偏高,动脉血氧分压更低,动脉血二氧化碳分压>50 mm Hg的患者比例更高(18.8% 比 7.7%)。BE-CAP 患者并发肾功能不全、低蛋白血症和贫血的比例偏低,影像学表现以多肺叶浸润(55.6%)和斑片影(79.9%)多见,较少比例患者合并胸腔积液或肺实变,差异具有统计学意义。结果见表2。
表2:两组患者临床表现和影像学比较[例(%)/M(Q1,Q3)]
4、两组患者治疗和预后结果比较
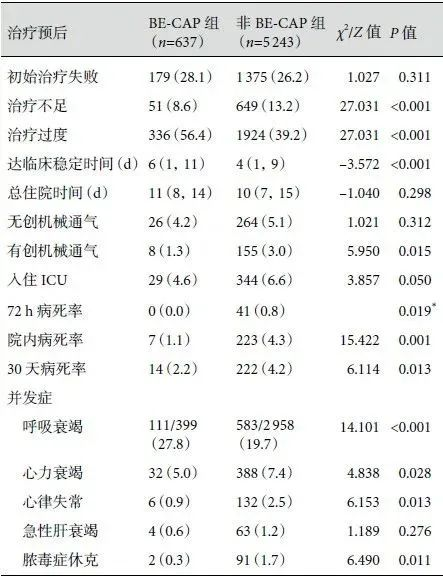
与非 BE-CAP 患者相比,BE-CAP 患者达临床稳定中位时间延长(6 d 比 4 d,P<0.001),呼吸衰竭发生率显著偏高(27.8% 比 19.7%,P<0.001),两组患者的 ICU 入住率、总住院时间比较无明显统计学差异,BE-CAP 患者 30 天病死率偏低。结果见表3。
表3:两组患者治疗和预后比较[例(%)/M(Q1,Q3)]
*Fisher 确切概率法。
5、两组患者病原学分布比较
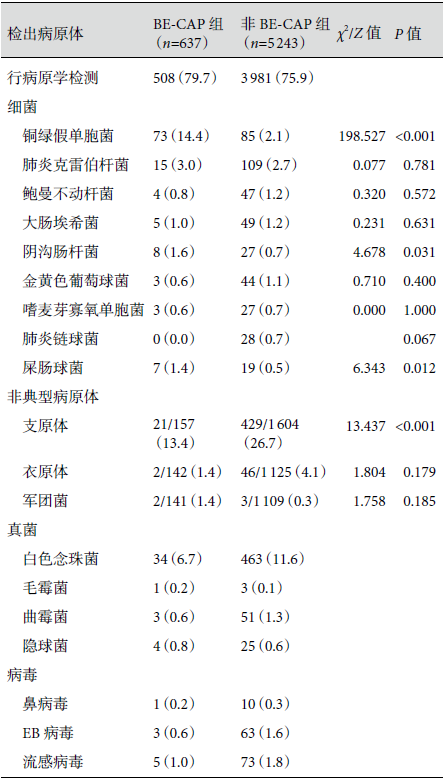
76.3%(4489/5880)的 CAP患者进行了病原学检测,痰标本检测率 63.8%,尿抗原检测率和呼吸道病毒核酸检测率分别为 2.7% 和 5.2%。BE-CAP 组最常见的检出病原体为铜绿假单胞菌(14.4%)、支原体(13.4%)和白色念珠菌(6.7%),铜绿假单胞菌检出率明显高于非 BE-CAP 组患者(14.4% 比 2.1%,P<0.001)。非 BE-CAP 组最常见的检出病原体为肺炎克雷伯杆菌(2.7%)、支原体(26.7%)和白色念珠菌(11.6%)。单因素分析显示合并 BE 可增加铜绿假单胞菌感染风险[比值比(odds ratio,OR)6.635,95% 可信区间(confidence interval,CI)4.727~9.314,P<0.001]。结果见表4。
表4:两组患者病原学分布比较[例(%)]
6、BE-CAP 患者生存组和死亡组临床特征的单因素分析
与生存组患者比较,死亡组患者合并慢阻肺、脑血管疾病的比例较多,并发意识障碍、发绀、血压下降、肾功能不全、低蛋白血症和贫血的患者比例更高,CURB-65 和 PSI 评分中、高危患者比例显著偏高,初始治疗失败率较高,并发呼吸衰竭、入住 ICU 的比例显著高于生存组,差异具有统计学意义。结果见表5。
表5 BE-CAP 患者生存组与死亡组的临床特征比较[M(Q1,Q3)/例(%)]
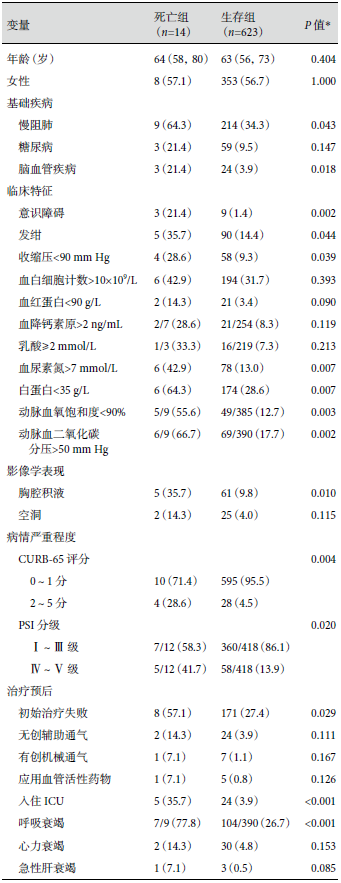
*Fisher 确切概率法。
7、影响 BE-CAP 患者 30 天病死率的危险因素分析
Logistic 回归分析(校正年龄、性别、CURB-65 评分和 PSI 分级)结果显示:初始治疗失败[校正后的比值比(adjusted odds ratio,aOR)6.675,95%CI 4.235~10.523,P<0.001)]、呼吸衰竭(aOR 5.548,95%CI 3.681~8.363,P<0.001)、血尿素氮>7.0 mmol/L(aOR 2.490,95%CI 1.625~3.815,P<0.001)、白蛋白<35.0 g/L(aOR 1.647,95%CI 1.073~2.529,P=0.022)和 CURB-65 评分(aOR 1.691,95%CI 1.341~2.133,P<0.001)是影响 BE-CAP 患者 30 天病死率的独立危险因素。
三、讨论
本研究是国内首次对 BE-CAP 患者进行临床特征和预后因素分析的大样本多中心、回顾性研究。涵盖人口学特征、病情严重程度、临床表现、影像学、病原学和治疗预后等信息。研究人群包括青少年(>14 岁)、老年人,包括普通病房和重症监护病房患者。研究发现 BE-CAP 患者具有不同的临床特征,但合并 BE 不增加 CAP 患者的病情严重程度、总住院时间和病死率。除 CURB-65 评分外,初始治疗失败、并发呼吸衰竭、血尿素氮>7.0 mmol/L和白蛋白<35.0 g/L是影响 BE-CAP 患者 30 天病死率的独立危险因素,临床诊治中应加强对危险因素的评估和治疗以改善预后。
本研究结果显示 BE-CAP 患者占 CAP 住院患者的比例为 10.8%,高于国外 Polverino 等[11]和 Sanchez-Muñoz 等[19]研究中 BE-CAP 患者的比例,分别为 2.0% 和 3.97%,也较国内 2013 年对 7 省市 40 岁以上人群的问卷调查研究中的 BE 患病率(1.2%)高[20]。近期对三甲医院呼吸内科住院患者疾病组成的调查研究中,BE 疾病构成比(5.2%~13.8%)与本研究结果相近[21-22]。
本研究中,相比于非 BE-CAP 患者,BE-CAP 患者女性偏多,合并慢阻肺和支气管哮喘的患者比例明显更高,与既往的研究结果一致[11, 23]。美国医疗保健数据的研究显示 BE-慢阻肺重叠综合征的患者比例达 50%,具有较高的医疗负担[24]。也有研究认为慢阻肺可能是 BE 的病因之一[25]。在本研究中 BE-CAP患者既往糖皮质激素吸入史比例偏高,也可能与同时合并慢阻肺、哮喘有关。在英国胸科学会关于 BE 的指南中,不建议对没有其他适应证(哮喘、慢阻肺、炎症性肠病等)的 BE 患者长期应用糖皮质激素[7]。BE 患者由于气道结构改变、慢性感染和炎症使得气道抵抗力下降,发生 CAP 的风险增加。本研究中 BE-CAP 患者既往 1 年内发生 CAP 的比例明显偏高,与既往的研究一致[11]。并且 BE-CAP 患者缺氧症状较明显,动脉血氧分压更低,并发呼吸衰竭的患者比例显著升高,这可能与 BE 患者气道慢性感染促进白细胞介素-8、肿瘤坏死因子-α 等促炎因子释放,气道炎症反应较重有关[26],也可能为 BE 患者气道结构损害和反复急性加重导致肺功能下降所致。但合并 BE 不增加 CAP 患者无创和有创机械通气发生率,也不增加 CAP 患者的病情严重程度和病死率,与既往研究结果一致[11, 19]。在 Sanchez-Muñoz 等[19]的回顾性研究中,BE-CAP 较非 BE-CAP患者平均住院时间延长(P<0.001),本研究显示 BE-CAP 患者达临床稳定时间延长,对总住院时间无显著影响。铜绿假单胞菌是 BE 患者最常见的感染病原菌,也是 BE 急性加重、住院率和病死风险增加的独立危险因素[27-28]。研究显示铜绿假单胞菌感染的 CAP 患者临床表现也更严重(动脉血氧合指数更低),CURB-65 评分和肺炎严重指数评分均较高,30 天病死率也显著升高(18% 比 6%,P<0.001)[29]。本研究中 BE-CAP 患者铜绿假单胞菌的分离率显著高于非 BE-CAP 患者,合并 BE 显著增加了铜绿假单胞菌感染风险,与既往研究一致[11, 30]。BE 相关的指南建议对首次分离出铜绿假单胞菌的 BE 患者根除铜绿假单胞菌治疗,可减少急性加重,改善生活质量和临床预后[7-8]。
本研究结果显示,初始治疗失败、并发呼吸衰竭、血尿素氮>7.0 mmol/L、白蛋白<35.0 g/L和 CURB-65 评分是影响 BE-CAP 患者 30 天病死率的独立危险因素。本研究中 BE-CAP 患者初始治疗失败率为 28.1%,稍高于非 BE-CAP 患者(26.2%),但差异无统计学意义(P=0.311),初始治疗失败的 BE-CAP 患者 30 天病死率显著增加,与既往对 CAP 患者的研究一致[31-32]。初始治疗失败的 CAP 患者年龄较大、合并较多基础疾病,感染真菌或多重耐药细菌的风险更高,并发呼吸衰竭、心力衰竭、脓毒血症等并发症的比例也更多,这些均可能增加病情严重程度和病死风险[33-36]。BE-CAP 患者反复感染频率较高,频繁住院应用抗生素使细菌耐药风险增加,尤其是耐药铜绿假单胞菌,需根据痰培养+药敏结果选择抗生素以降低初始治疗失败风险。对反复感染或急性加重的 BE 患者指南建议长期口服或吸入抗生素治疗,可减少急性加重,改善临床症状和生活质量,目前仍需进一步大样本的临床前瞻性研究进行探讨[7]。呼吸衰竭是 CAP 患者常见的并发症,本研究 BE-CAP 患者呼吸衰竭发生率显著高于非 BE-CAP 患者,BE-CAP 死亡患者呼吸衰竭发生率为 77.8%,显著高于生存组。研究显示并发呼吸衰竭的 CAP 患者 ICU 入住率、机械通气率和病死率均显著升高[37-38]。既往对 BE-CAP 患者的研究显示合并 BE 不增加 CAP 患者呼吸衰竭发生率,但呼吸困难临床症状较明显,动脉血氧指数更低[11]。对于呼吸衰竭的 BE 患者研究显示应用无创辅助通气治疗改善率达 65.4%[39]。对于呼吸衰竭的 CAP 患者应用有创机械通气可作为病死率增加的独立预测因素[40]。血尿素氮为 CURB-65 和 PSI 评分标准之一,用以评估 CAP 患者的病情严重程度[14-15]。血尿素氮升高原因包括排泄减少、肠道中尿素吸收增加或尿素产量增加。相关研究报道 ICU 和死亡 CAP 患者的血尿素氮水平升高,主要与感染引起有效循环血容量减少,肾素血管紧张素醛固酮系统激活使近端肾小管重吸收尿素增加有关[41-42]。血尿素氮也可结合其他临床指标(白蛋白、D-二聚体)预测 CAP 病死率。Ugajin 等[41]的回顾性研究显示血尿素氮与白蛋白的比值为 CAP 病死风险的独立预测因素,比值越高,病死风险也越高。血尿素氮联合D-二聚体可用于识别高死亡风险的重症新型冠状病毒肺炎患者(受试者操作特征曲线下面积 0.94,95%CI 0.90~0.97)[43]。本研究进一步证实血尿素氮>7.0 mmol/L是 BE-CAP 患者 30 天病死率的独立预测因素。CAP 中白蛋白降低的机制包括感染促进组织分解代谢,以及炎症细胞因子可能降低肝脏细胞产生白蛋白[45]。既往研究证实白蛋白降低可预测 CAP 患者的 ICU 入住率和病死率[42, 45]。在动物实验中,发现人血清白蛋白可抑制导致氧化、亚硝化应激和血管低反应性的炎症过程,发挥对小鼠内毒素休克的保护作用[46]。并且在临床试验中也证实白蛋白在治疗脓毒症休克的患者中具有降低病死率的潜在优势[47]。对于白蛋白在 CAP 患者中的保护作用及机制需要进一步的临床研究。
本研究的优势在于:(1)为全国、多中心大样本的回顾性研究,研究人群包括青少年(>14 岁)、老年人,包括普通病房和重症监护病房患者,研究结果具有代表性。(2)研究对象具有影像学资料,严格按照纳入、排除标准入组患者,排除可能影响 CAP 临床特征和治疗预后的免疫抑制状态患者、妊娠哺乳期特殊患者,研究结果具有可靠性。(3)对于 BE-CAP 患者临床特征和治疗预后的国内研究较少,BE 患病率较前增加,有必要提高对 BE 患者的认识。
本研究也有一定的的局限性:(1)尽管我们的研究方法尽可能减少了选择偏倚,但仍难以避免回顾性研究的固有缺陷,未进行随访监测;(2)病原学检测方法不足,导致肺炎链球菌的检出率较低,以及较多患者未进行病原学检测和院前接受了抗感染治疗,导致本研究的病原学结果不具有代表性;(3)研究人群主要为住院的 CAP 患者,不足以作为 BE 的流行病学调查结果。
本研究回顾性分析了 BE-CAP 患者的临床特征和预后影响因素,为临床诊治提供基础依据,仍需进一步开展大样本、前瞻性的研究进一步探讨。
利益冲突:本研究不涉及任何利益冲突。
参考文献略。
引用本文:张慧娟, 韩秀迪, 刘学东, 曹彬, 李辉, 王一民, 李丽娟, 崔晓静, 陈亮, 周飞, 薛春雪, 李艳丽, 肖颖, 刘萌, 张春晓, 邢西迁, 索立俊, 刘波, 王金祥, 于国华, 王光强, 姚学新, 于红霞, 王蕾, 朱晓莉, 中国肺炎研究网(CAP-China). 社区获得性肺炎合并支气管扩张患者临床特征和预后因素分析. 中国呼吸与危重监护杂志, 2022, 21(4): 251-259. doi: 10.7507/1671-6205.202103036
本文转载自公众号「中国呼吸与危重监护杂志」
原链接戳:社区获得性肺炎合并支气管扩张患者临床特征和预后因素分析


