摘要
急性呼吸衰竭是重症监护病房(ICU)最常见的呼吸危重症,病因复杂,有时采用常规手段很难获得病因诊断。肺组织活检技术对于不明原因呼吸衰竭的危重症患者的救治具有重要潜在临床应用价值,而国内目前开展较少。本文基于经支气管镜肺活检、经支气管冷冻肺活检与超声引导下经皮穿刺活检三种活检手段在呼吸危重症患者中的大量临床经验,着重介绍适应证与禁忌证的把握、根据不同活检方式的优缺点与患者肺内病灶的特点进行综合选择、不同呼吸支持方式下肺活检技术的操作要点,介入操作场景的选择以及相关并发症的防治与处理,旨在推广相关肺活检手段在呼吸危重症患者中的应用,以期提高危重患者救治成功率。
急性呼吸衰竭是重症监护病房(intensive care unit,ICU)最常见的呼吸危重症,因其病因复杂,病情危重,有时采用常规手段很难获得病因诊断。以最具代表性的低氧性呼吸衰竭疾病——急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)为例,尽管2012年ARDS柏林诊断的定义更为确切,临床实践中应用更方便,但实际并未针对引起ARDS的病因进行定义[1],初始诊断时病因不明的患者高达8%[2-3]。此外,通过对ARDS患者的尸检进行研究发现,仅45%的患者呈典型的弥漫性肺泡损伤(diffuse alverolar damage,DAD)表现[4];即使部分患者初始诊断为感染性疾病,其组织病理也可表现为对激素敏感的病理改变,或随着病程动态演变为激素敏感型病理改变[5]。由于ARDS的病因及病理的高度异质性,初始诊断时病因不明的ARDS患者,积极行肺活检可以为70%以上的患者获得明确诊断,改变治疗方案[6],甚至可以降低激素敏感型病变的患者在院病死率[7]。
肺组织活检技术对于病因不明的呼吸危重症患者的救治具有重大潜在临床应用价值。鉴于此,中国医师协会呼吸医师分会呼吸危重症专委会及介入呼吸病学工作委员会联合推出了本专家意见,希望籍此推动这些肺活检技术的规范应用。意见着重于两方面内容:不同活检方式的患者选择,不同呼吸支持方式下的操作要点及相关并发症的防治与处理。而具体相关操作只介绍与危重症相关的要点,详细技术介绍与操作流程请参考相关资料[8-11]。
一、呼吸危重症肺组织活检技术概述
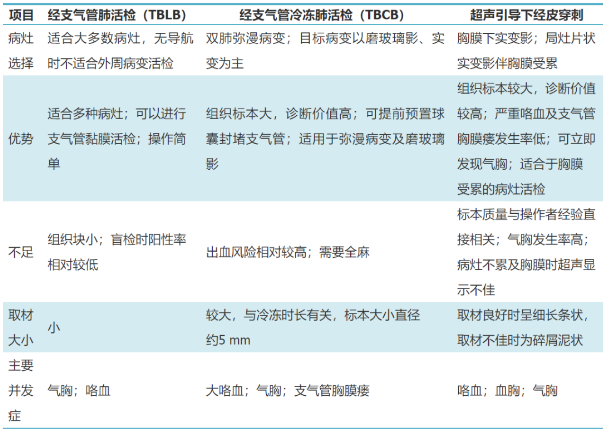
传统呼吸危重症患者的肺活检手段以外科开胸肺活检(open-lung biopsy,OLB)为主[12],大部分手术室内操作,少部分在床旁进行[13]。外科肺活检对ARDS的诊断效能超过80%,创伤较大,持续性漏气和出血等手术相关并发症超过30%,因而难以广泛开展。近年来,更为微创的活检方式,包括经支气管透壁肺活检术(transbronchiallungbiopsy,TBLB)、经支气管冷冻肺活检(transbronchialcryobiopsy,TBCB)和影像学引导的经皮穿刺活检等技术渐趋成熟。TBLB较为常用,大多可在非X线透视辅助下床旁完成,但所获取的标本较小,其诊断率仅约35%,联合肺泡灌洗诊断率可达74%。但TBLB的气胸等并发症发生率高达20%~23.7%[14],限制了其在呼吸危重症患者中的应用。TBCB已经被证实在间质性肺病具有与外科肺活检相近的诊断效能[15],TBCB安全性更佳,尤其是在影像导航技术(如锥形束CT、径向超声支气管镜)的辅助下进行,可进一步减少操作风险[16]。因此,近年来应用日益广泛,已成为间质性肺疾病的重要诊断手段,并有望成为外科肺活检的替代方案[9]。中日友好医院初步探索了TBCB在不明原因ARDS中的应用价值[17],发现其诊断率达92%,80%的患者因此而改变治疗决策,并发症方面气胸发生率约16%,术中大量出血约占12%,仅8%的患者出现持续性漏气。影像学引导的经皮穿刺活检因其操作简单、定位准确,临床应用也逐渐增多[18]。常用引导方式主要包括CT和超声引导。CT能灵敏显示肺部病变,适合于各种肺部病变的定位与穿刺,但由于危重患者转运困难,且部分呼吸支持方式[例如体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)]出血风险较大,目前应用较少。超声引导下穿刺活检技术因操作方法简便、便于床旁进行,适合于呼吸危重症患者外周肺部病变的活检。超声仪器便捷、可移动,并且引导经皮活检时可避开含气肺组织、坏死区、空洞、含气支气管及粗大的供血血管等结构,故更适合于在床旁进行。目前临床常用的肺活检技术对比见表1。
二、适应证与禁忌证
适应证和禁忌证的把握需要临床医生根据患者当前情况、家属意愿、科室具备的救治条件等多方面慎重权衡利弊,灵活判定。原则上肺活检没有绝对禁忌证,最终取决于临床医师对这项操作获益与风险的综合判断。患者存在病因不明的呼吸衰竭,并且根据详细病史、可获取的全面检验、影像学及常规支气管镜检查仍无法明确诊断[18-19],或疾病快速进展而无法用原诊断解释者,在多学科讨论后判断需进行肺组织活检,则可考虑进行相应操作。但呼吸危重症患者行肺组织活检风险比普通患者风险大,更应严格把握禁忌证,包括但不限于:(1)严重凝血功能异常[例如血小板<60×109/L;凝血酶原时间(PT)延长超过3 s,部分活化凝血酶时间(ACT)比值1.5以上]或使用抗血小板药物及抗凝药物;(2)合并严重脏器功能不全,如严重肺动脉高压、循环不稳定等,预计无法耐受活检;(3)无法排除心源性肺水肿、肝肺综合征等肺外疾病累及肺脏;(4)目前的呼吸支持条件仍无法满足通气和氧合需求,且不具备进一步提高呼吸支持水平的条件;(5)无法获取知情同意。开展冷冻肺活检者应具备熟练操作呼吸内镜,且已独立开展常规冷冻肺活检(资质要求参照《呼吸内镜诊疗技术临床应用管理规范(2019年版)》),具有处理术中严重突发事件的经验。开展经皮肺穿刺活检者应能够熟练操作超声仪器,熟识肺部超声征象。
各项活检技术适合的病灶各不相同(图1),应该根据患者的情况、病灶特点、活检医生熟悉的操作技术、并发症的处理条件等共同决定如何选择活检方式。
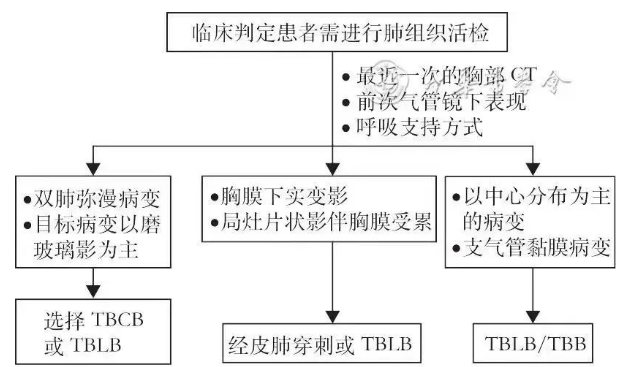
图1 不同病灶类型肺活检方式的选择
三、不同呼吸支持方式下肺活检技术的操作要点
(一)高流量氧疗
ICU内的氧疗方式以高流量氧疗最为推荐。TBLB和经皮肺穿刺的操作要点与普通患者类似。若患者清醒、配合且呼吸较平稳,不建议常规使用镇静药物;若患者情绪紧张或呼吸急促,可予以适当镇静,目标躁动-镇静评分(richmond agitation and sedation scale,RASS)0~-1。操作过程中应调高吸入氧浓度或流量,严密监测患者的氧合情况。操作结束后若患者情况相对稳定,建议调回原始的氧疗参数。由于ICU患者行支气管镜检查术并发症的发生率高于一般患者[20],建议术毕常规复查胸片及血气分析。
(二)无创正压通气
操作前予以纯氧吸入或根据呼吸机条件尽量提高吸氧浓度,确保患者的氧合处于可达到的最佳状态。
拟行TBLB者,应常规经无创呼吸机雾化利多卡因等麻醉药物,进镜前可同时经静脉途径泵入丙泊酚、瑞芬太尼等短效类镇静镇痛药物,以减轻患者痛苦及焦虑情绪,有助于降低呼吸窘迫患者的呼吸驱动。提前选择合适的面罩连接可插入气管镜的专用转接头,经专用转接头插入气管镜后经鼻进镜。注意观察无创呼吸机的工作情况,以确保在支气管镜检查术过程中仍然能够维持足够的通气和氧合[21-23]。
拟行经皮穿刺者,确定穿刺体位后使用灰阶和彩色多普勒超声对病灶进行扫查,为避免穿刺病灶坏死或出血区域,有条件者可采用超声造影显示病灶微灌注状态,同时避开粗大血管及支气管,选择最佳穿刺进针点及最短进针路线。嘱患者进行吸气屏气或呼气屏气时快速完成穿刺动作。每次穿刺均应清晰显示针尖及活检针道,取材标本不满意可改变针道及方向再穿刺。穿刺次数宜少不宜多,避免同一针道反复穿刺。尽量穿刺一侧病变并减少穿刺次数,同时避开所有富血供区域,以避免出现致命性咯血。每次穿刺后都需要在相应部位或扩大范围进行重新扫查,以观察有无新发气胸或胸腔积液。全部穿刺完毕或体位变动后应再次确认没有新发气胸或胸腔积液。
(三)有创正压通气
为减少患者的痛苦和并发症、降低呼吸驱动,应予以充分镇静镇痛,并根据情况使用肌肉松弛(肌松)药,达到对刺激无反应且自主呼吸消失。将呼吸机模式改为控制通气模式,吸入氧浓度(fraction of inspiration O2,FiO2)调至100%,并将呼气末正压(positive end-expiratory pressure,PEEP)降至0或能维持氧合的最低PEEP,维持血氧饱和度(SpO2)≥90%。术前应常规试验性将呼吸支持参数调节为术中呼吸支持水平,以评估患者能否耐受手术。不能维持氧合者,应考虑提升呼吸支持方式,如辅以ECMO支持。若无法予以更高级的呼吸支持方式,则应重新评估肺活检的可行性。
麻醉满意后,将支气管镜通过三通接口插入人工气道内,以保证支气管镜检查术过程中维持足够的通气和氧合[24]。术中应持续监测气道压,防止气道压过高(35~40 cmH2O,1 cmH2O=0.098 kPa)。若术中出现SpO2降至90%以下则应立刻停止操作,退出支气管镜,将PEEP调回至原水平并继续予以正压通气。注意听诊双肺呼吸音与术前有无变化。若无明显变化,待SpO2回升后方可再次操作;若呼吸音明显异常,则立刻停止所有操作,并完善床旁胸片等检查。
拟行TBCB者需常规建立人工气道,在手术室或床旁于全麻下进行操作。不推荐使用喉罩[9]。根据医院条件和操作者熟练程度选择气管插管或者硬质支气管镜下操作。宜选择内径7.5 mm以上气管插管或者10号以上硬镜。对于危重患者建议预置封堵球囊。术毕根据镜下出血情况决定是否需要延长留置时间。径向超声支气管镜有助于识别活检位置周围有无粗大血管。推荐在床旁透视或径向超声支气管镜、虚拟支气管镜、磁导航等导航技术的引导下,确定活检位置的引流支气管及活检深度,并将冷冻探头插入拟活检位置。每次冷冻操作后,有条件者应立即行床旁透视或利用床旁B超观察有无气胸。若出现气胸,应立即停止操作,根据气胸量采取相应处置措施。具体术中操作请参考相应专家共识[9]。
拟行经皮肺穿刺者需在深镇静、无自主呼吸的前提下,由助手通过呼吸机面板予以吸气末或呼气末暂停,选择显示良好并能够避开血管及大支气管的切面及最短针道进行穿刺。全部穿刺完毕或体位变动后应再次确认没有气胸或新发胸腔积液,再将呼吸机参数调整回穿刺前参数。
(四)ECMO
ECMO患者出血及血栓的风险较其他患者更高。在活检前根据患者病情停用抗凝药物2~6 h以上[25],复查ACT或活化部分凝血活酶时间(activeated partial thromboplasting time,aPTT)降至基础水平,PT延长不超过3 s,纤维蛋白原不低于2 g/L,血小板>60×109/L或输注血小板后>60×109/L即刻可考虑进行活检。
ECMO患者在活检时应充分镇痛镇静,部分患者可应用肌松剂,以确保患者无自主呼吸,避免患者出现呛咳影响ECMO血流量。在操作过程中维持流量稳定非常重要,以便在出现并发症时仍能维持良好的通气和氧合。
拟行TBCB者应该常规于相应段水平的支气管预置封堵球囊。每次冷冻后迅速将支气管镜、冷冻探头拔出的同时,由助手立即充起球囊,进行封堵止血。若为扩张球囊,应确保球囊压力为0.5~1.0标准大气压;若为乳胶封堵球囊,约注入气体或生理盐水10 ml。操作过程中,获取组织块不宜超过3~4块[26-27]。术毕继续留置封堵球囊,2~4 h后复查气管镜检查观察出血情况。松开封堵球囊后观察若仍有活动性出血,则继续充起球囊封堵相应支气管,暂不恢复抗凝;无活动性出血者可考虑恢复抗凝,并再次充起球囊封堵相应支气管以防止抗凝引起活检部位再次出血。待抗凝达标后,再次复查支气管镜,明确无活动性出血后撤除球囊。拔除球囊前,应尽可能地清理气道内血凝块,以改善通气,减少后续感染风险,并且有助于进一步明确有无活动性出血。
ECMO支持下经皮肺穿刺的出血风险同样较高。根据操作者经验、患者出凝血倾向决定穿刺前是否需要经支气管镜预置封堵球囊[28]。建议球囊放置于叶水平支气管,封堵支气管后再进行穿刺操作。若患者没有人工气道,2~6 h后可考虑短时间松开球囊观察有无咯血,无咯血可堵上球囊并恢复抗凝治疗,抗凝达标后再松开球囊,根据气道分泌物性状决定继续留置或拔除。
ECMO往往需要联合使用其他呼吸支持方式,故同时需要兼顾另一种呼吸支持方式对应的操作要点。
四、不同呼吸支持方式下的场景及策略选择
肺组织活检是一项潜在风险较大的操作,在呼吸危重症患者中尤甚。在进行活检操作前,不仅需要充分进行术前评估,还需要对操作难度和手术细节进行预判,预估操作时间,提前选择操作场景、内镜、导航方式等。呼吸危重症患者往往需要较高的呼吸支持条件,应权衡ICU团队的呼吸支持能力与介入团队的处置应变能力之间的平衡,对操作场景进行综合判定。
(一)操作场景宜选择在ICU
患者无法脱离高水平的呼吸支持或其他生命支持手段,包括高吸氧浓度的正压通气和经鼻高流量氧疗、持续血液净化、ECMO等;操作仅依靠便携或床旁呼吸内镜即可完成时;病灶较为明显,操作无需引导技术,或仅依靠便携虚拟导航、便携或床旁B超等小型引导设备即可完成时;仅需支气管肺泡灌洗、球囊扩张、简单TBLB等短时间、简单的呼吸内镜操作;病情危重,需立即介入的紧急情况;ICU配备了大型呼吸内镜主机,可接驳超细呼吸内镜、治疗型呼吸内镜或超声呼吸内镜等。
(二)操作场景宜选择在介入手术室
对于部分操作复杂、需要多学科参与、手术时间长、需要手术麻醉科介入参与的介入操作宜选在介入手术室进行。例如操作需要CT、大型B超、C型臂X线机、增强现实以及磁导航等不宜搬动的大型仪器设备引导,或需要全身麻醉下硬质气管镜操作等需要多学科、多设施共同参与的;操作需要大型呼吸内镜主机,接驳超细呼吸内镜、治疗型呼吸内镜或超声呼吸内镜等;患者出血倾向明显或需同时行病灶消融等需要长时间、复杂呼吸内镜操作。
五、常见活检并发症的预防及处理
(一)气胸
气胸是肺活检后的常见并发症,多数在术后即刻出现,部分可延迟到术后24 h。对于普通患者而言,轻微气胸无需引流,可自行吸收。需要置管引流的气胸约占气胸患者的1/4[29-31]。活检方式相关的气胸危险因素包括活检部位靠外周[9]、穿刺针偏粗[32]等。对于呼吸窘迫的患者,本身即存在气胸的风险;存在人工气道的患者行气管镜检查会产生一定水平的内源性PEEP[33],活检会进一步增加气胸发生的概率。在接受正压通气的患者,下述引起呼吸机相关肺损伤的危险因素也同样可能增加活检相关气胸风险:气道压力过高[34-35]、过强的自主呼吸驱动[36-37]、大潮气量[38-39]、高PEEP[39]、存在间质病、严重ARDS等基础肺部疾病[40]。因此,适当的镇静甚至肌松、避免出现呛咳、降低气道内压力(包括降低PEEP、减少呼吸驱动、限制潮气量等)、选择18~20 G穿刺针等措施均有助于预防气胸的发生。
在任何活检操作后均应该常规对患者复查肺部超声或床旁胸片。出现气胸时,可观察到活检部位的胸膜滑动征消失、呈A线,尤其是穿刺后气胸可立刻观察到原穿刺部位出现「肺点」。若患者无需正压通气,少量气胸加强观察即可,一般自行吸收无需处理。若患者为正压通气状态,应继续保持PEEP处于较低水平,尽快完善床旁胸片观察气胸的严重程度。少量气胸者可以在低水平PEEP下继续正压通气,严密观察患者氧合、通气、胸片的变化情况;若相对稳定,可继续观察,否则应尽快留置闭式引流。大量气胸时不论何种呼吸支持方式,均应放置引流。
(二)出血
出血是另一常见并发症,可以表现为咯血或血胸。出血与气胸的发生率相当[41]。对于任何操作而言,术前的凝血状态、抗凝/抗血小板药物的使用都与出血风险直接相关。与肺活检相关的出血风险包括活检方式[42]、活检部位的选择[9]、肺动脉高压[43]、穿刺针道较长[44]等。预防致命性大出血的有效手段包括充分评估出凝血功能、封堵球囊、利用导航系统、缩短穿刺针道、避让支气管等。提前预置封堵球囊是防止致命性大咯血的有效手段,行TBCB、需ECMO支持的患者等出血高危人群建议常规留置。充分的术前评估且熟练掌握各种活检操作对于降低出血并发症有着重要意义。
一旦出现咯血,首先应保障气道通畅,提高呼吸支持条件保证通气与氧合,并调整患者体位便于气道引流。其次是尽快止血。TBLB肺活检后创面渗血较为常见,一般可自行停止;镜下少量出血可考虑局部喷洒凝血酶冻干粉、肾上腺素冰盐水止血。经皮肺穿刺术后少量咯血也较为常见,多数患者无需处理。若出血量较多,根据情况予以血凝酶肌肉注射或垂体后叶素静脉泵入,必要时进行血管造影明确出血部位并进行介入栓塞或联系胸外科会诊评估可否手术止血。
活检后还可能出现血胸等并发症,尤其是需要抗凝的患者。活检前、活检后即刻以及活检后1~2 d应该常规复查胸水超声,评估有无新发液性暗区及相应液性暗区的回声情况,判断有无出血,并根据出血情况予以治疗。
(三)气体栓塞
气体栓塞是一种罕见而潜在致命的并发症,肺活检时进入肺静脉的空气回到体循环导致系统性气体栓塞。部分患者无明显症状,因此总体发生率可能被低估。严重者可表现为心脏/神经系统相关症状,如循环衰竭、意识丧失、黑曚等[45-46]。危险因素包括通过正常通气肺脏的针道长度、活检组织条数、俯卧位或右侧卧位等[47]。理论上,咳嗽、深吸气或气道内压力增加也可能促进气栓的发生。患者尽量选择平卧位,操作时避免气道内压力大幅度波动可能有助于减少气体栓塞的发生。
(四)其他
其他报告的并发症包括低血压[48]、急性心肌梗死[49]和低氧进一步恶化[50]。完备的术前准备及充分的呼吸支持仍然是避免相关并发症的必要条件。
六、标本处理
活检标本均应尽快处理送检。根据临床考虑疾病的可能性,拟送常规病理者直接将标本放入带福尔马林液体的无菌小瓶送检,标本可室温下长时间保存。拟送微生物检查者应将取出的组织块小心放入少量无菌生理盐水的无菌容器中,以保持标本湿度及微生物活性。普通培养在室温保存,2 h内送检[51]。放入过程需注意无菌操作,无菌生理盐水没过组织块即可。低温保存可适当延长保存时间,若非工作时间或不能及时送检的标本,建议 4 ℃冰箱保存,最长保存时间不超过24 h。
参考文献
[1]RanieriVM, RubenfeldGD, ThompsonBT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23):2526-2533. DOI: 10.1001/jama.2012.5669.
[2]de ProstN, PhamT, CarteauxG, et al. Etiologies, diagnostic work-up and outcomes of acute respiratory distress syndrome with no common risk factor:a prospective multicenter study[J]. Ann Intensive Care, 2017, 7(1):69. DOI: 10.1186/s13613-017-0281-6.
[3]GibelinA, ParrotA, MaitreB, et al. Acute respiratory distress syndrome mimickers lacking common risk factors of the Berlin definition[J]. Intensive Care Med, 2016, 42(2):164-172. DOI: 10.1007/s00134-015-4064-y.
[4]ThilleAW, EstebanA, Fernández-SegovianoP, et al. Comparison of the Berlin definition for acute respiratory distress syndrome with autopsy[J]. Am J Respir Crit Care Med, 2013, 187(7):761-767. DOI: 10.1164/rccm.201211-1981OC.
[5]HaririLP, NorthCM, ShihAR, et al. Lung histopathology in coronavirus disease 2019 as compared with severe acute respiratory sydrome and H1N1 influenza: a systematic review[J]. Chest, 2021, 159(1):73-84. DOI: 10.1016/j.chest.2020.09.259.
[6]PapazianL, DoddoliC, ChetailleB, et al. A contributive result of open-lung biopsy improves survival in acute respiratory distress syndrome patients[J]. Crit Care Med, 2007, 35(3):755-762. DOI: 10.1097/01.CCM.0000257325.88144.30.
[7]GerardL, BidoulT, Castanares-ZapateroD, et al. Open lung biopsy in nonresolving acute respiratory distress syndrome commonly identifies corticosteroid-sensitive pathologies, associated with better outcome[J]. Crit Care Med, 2018, 46(6):907-914. DOI: 10.1097/CCM.0000000000003081.
[8]中华医学会呼吸病学分会介入呼吸病学学组. 成人诊断性可弯曲支气管镜检查术应用指南(2019年版)[J]. 中华结核和呼吸杂志, 2019, 42(8):573-590. DOI: 10.3760/cma.j.issn.1001-0939.2019.08.005.
[9]中华医学会呼吸病学分会介入呼吸病学学组, 中国医师协会呼吸医师分会介入呼吸病学工作委员会. 经支气管冷冻活检技术临床应用专家共识[J]. 中华结核和呼吸杂志, 2019, 42(6):405-412.DOI: 10.3760/cma.j.issn.1001-0939.2019.06.002.
[10]中国抗癌协会肿瘤介入学专业委员会, 中国抗癌协会肿瘤介入学专业委员会胸部肿瘤诊疗专家委员会. 胸部肿瘤经皮穿刺活检中国专家共识(2020版)[J]. 中华医学杂志, 2021, 101(3):185-198.DOI: 10.3760/cma.j.cn112137-20200907-02576.
[11]陈敏华, 梁萍, 王金锐. 中华介入超声学[M]. 北京:人民卫生出版社, 2017.
[12]RajR, RapariaK, LynchDA, et al. Surgical lung biopsy for interstitial lung diseases[J]. Chest, 2017, 151(5):1131-1140. DOI: 10.1016/j.chest.2016.06.019.
[13]BaumannHJ, KlugeS, BalkeL, et al. Yield and safety of bedside open lung biopsy in mechanically ventilated patients with acute lung injury or acute respiratory distress syndrome[J]. Surgery, 2008, 143(3):426-433. DOI: 10.1016/j.surg.2007.06.003.
[14]BulpaPA, DiveAM, MertensL, et al. Combined bronchoalveolar lavage and transbronchial lung biopsy: safety and yield in ventilated patients[J]. Eur Respir J, 2003, 21(3):489-494. DOI: 10.1183/09031936.03.00298303.
[15]Troy, Laurenk, Grainge, et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study[J]. Lancet Respir Med, 2020. 8(2): 171-181.DOI: 10.1016/S2213-2600(19)30342-X.
[16]ZhouG, RenY, LiJ, et al. Safety and diagnostic efficacy of cone beam computed tomography-guided transbronchial cryobiopsy for interstitial lung disease: a cohort study[J]. Eur Respir J, 2020, 56(2). DOI: 10.1183/13993003.00724-2020.
[17]ZhouG, FengY, WangS, et al. Transbronchial lung cryobiopsy may be of value for nonresolving acute respiratory distress syndrome: case series and systematic literature review[J]. BMC Pulm Med, 2020, 20(1):183. DOI: 10.1186/s12890-020-01203-w.
[18]ManhireA, CharigM, ClellandC, et al. Guidelines for radiologically guided lung biopsy[J]. Thorax, 2003, 58(11):920-936. DOI: 10.1136/thorax.58.11.920.
[19]HetzelJ, MaldonadoF, RavagliaC, et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: expert statement from the cryobiopsy working group on safety and utility and a call for standardization of the procedure[J]. Respiration, 2018, 95(3):188-200. DOI: 10.1159/000484055.
[20]SteinbergKP, MitchellDR, MaunderRJ, et al. Safety of bronchoalveolar lavage in patients with adult respiratory distress syndrome[J]. Am Rev Respir Dis, 1993, 148(3):556-561. DOI: 10.1164/ajrccm/148.3.556.
[21]AntonelliM, ContiG, RiccioniL, et al. Noninvasive positive-pressure ventilation via face mask during bronchoscopy with BAL in high-risk hypoxemic patients[J]. Chest, 1996, 110(3):724-728. DOI: 10.1378/chest.110.3.724.
[22]ChinerE, Sancho-ChustJN, LlombartM, et al. Fiberoptic bronchoscopy during nasal non-invasive ventilation in acute respiratory failure[J]. Respiration, 2010, 80(4):321-326. DOI: 10.1159/000314074.
[23]BaumannHJ, KloseH, SimonM, et al. Fiber optic bronchoscopy in patients with acute hypoxemic respiratory failure requiring noninvasive ventilation-a feasibility study[J]. Crit Care, 2011, 15(4):R179. DOI: 10.1186/cc10328.
[24]ChooR, AnanthamD. Role of bronchoalveolar lavage in the management of immunocompromised patients with pulmonary infiltrates[J]. Ann Transl Med, 2019, 7(3):49. DOI: 10.21037/atm.2019.01.21.
[25]SmithMC, EvansPT, PrendergastKM, et al. Surgical outcomes and complications of bedside tracheostomy in the ICU for patients on ECMO[J]. Perfusion, 2022, 37(1):26-30.DOI: 10.1177/-267659120979564.
[26]Du RandIA, BlaikleyJ, BootonR, et al. British Thoracic Society guideline for diagnostic flexible bronchoscopy in adults: accredited by NICE[J]. Thorax, 2013, 68(Suppl 1):i1-i44. DOI: 10.1136/thoraxjnl-2013-203618.
[27]李强. 呼吸内镜学[M]. 上海:上海科学技术出版社, 2003.
[28]ZhaoY, JiangF, YuH, et al. Bronchus-blocked ultrasound-guided percutaneous transthoracic needle biopsy (BUS-PTNB) for intubated patients with severe lung diseases[J]. Crit Care, 2021, 25(1):359. DOI: 10.1186/s13054-021-03782-4.
[29]RuudEA, StavemK, GeitungJT, et al. Predictors of pneumothorax and chest drainage after percutaneous CT-guided lung biopsy: a prospective study[J]. Eur Radiol, 2021, 31(6):4243-4252. DOI: 10.1007/s00330-020-07449-6.
[30]HuoYR, ChanMV, HabibAR, et al. Pneumothorax rates in CT-Guided lung biopsies: a comprehensive systematic review and meta-analysis of risk factors[J]. Br J Radiol, 2020, 93(1108):20190866. DOI: 10.1259/bjr.20190866.
[31]MorelandA, NovogrodskyE, BrodyL, et al. Pneumothorax with prolonged chest tube requirement after CT-guided percutaneous lung biopsy: incidence and risk factors[J]. Eur Radiol, 2016, 26(10):3483-3491. DOI: 10.1007/s00330-015-4200-7.
[32]HeerinkWJ, de BockGH, de JongeGJ, et al. Complication rates of CT-guided transthoracic lung biopsy: meta-analysis[J]. Eur Radiol, 2017, 27(1):138-148. DOI: 10.1007/s00330-016-4357-8.
[33]JollietP, ChevroletJC. Bronchoscopy in the intensive care unit[J]. Intensive Care Med, 1992, 18(3):160-169. DOI: 10.1007/BF01709240.
[34]GammonRB, ShinMS, GrovesRH, et al. Clinical risk factors for pulmonary barotrauma: a multivariate analysis[J]. Am J Respir Crit Care Med, 1995, 152(4Pt 1):1235-1240. DOI: 10.1164/ajrccm.152.4.7551376.
[35]BoussarsarM, ThierryG, JaberS, et al. Relationship between ventilatory settings and barotrauma in the acute respiratory distress syndrome[J]. Intensive Care Med, 2002, 28(4):406-413. DOI: 10.1007/s00134-001-1178-1.
[36]BrochardL, SlutskyA, PesentiA. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure[J]. Am J Respir Crit Care Med, 2017, 195(4):438-442. DOI: 10.1164/rccm.201605-1081CP.
[37]SpinelliE, MauriT, BeitlerJR, et al. Respiratory drive in the acute respiratory distress syndrome: pathophysiology, monitoring, and therapeutic interventions[J]. Intensive Care Med, 2020, 46(4):606-618. DOI: 10.1007/s00134-020-05942-6.
[38]SlutskyAS, RanieriVM. Ventilator-induced lung injury[J]. N Engl J Med, 2013, 369(22):2126-2136. DOI: 10.1056/NEJMra1208707.
[39]GattinoniL, MariniJJ, CollinoF, et al. The future of mechanical ventilation: lessons from the present and the past[J]. Crit Care, 2017, 21(1):183. DOI: 10.1186/s13054-017-1750-x.
[40]AnzuetoA, Frutos-VivarF, EstebanA, et al. Incidence, risk factors and outcome of barotrauma in mechanically ventilated patients[J]. Intensive Care Med, 2004, 30(4):612-619. DOI: 10.1007/s00134-004-2187-7.
[41]SabatinoV, RussoU, D'AmuriF, et al. Pneumothorax and pulmonary hemorrhage after CT-guided lung biopsy: incidence, clinical significance and correlation[J]. Radiol Med, 2021, 126(1):170-177. DOI: 10.1007/s11547-020-01211-0.
[42]HetzelJ, EberhardtR, PetermannC, et al. Bleeding risk of transbronchial cryobiopsy compared to transbronchial forceps biopsy in interstitial lung disease -a prospective, randomized, multicentre cross-over trial[J]. Respir Res, 2019, 20(1):140. DOI: 10.1186/s12931-019-1091-1.
[43]DigumarthySR, KovacinaB, OtrakjiA, et al. Percutaneous CT guided lung biopsy in patients with pulmonary hypertension: assessment of complications[J]. Eur J Radiol, 2016, 85(2):466-471. DOI: 10.1016/j.ejrad.2015.12.007.
[44]AppelE, DommarajuS, CamachoA, et al. Dependent lesion positioning at CT-guided lung biopsy to reduce risk of pneumothorax[J]. Eur Radiol, 2020, 30(11):6369-6375. DOI: 10.1007/s00330-020-07025-y.
[45]FreundMC, PetersenJ, GoderKC, et al. Systemic air embolism during percutaneous core needle biopsy of the lung: frequency and risk factors[J]. BMC Pulm Med, 2012, 12:2. DOI: 10.1186/1471-2466-12-2.
[46]OrnelasE, Fernandez-VilchesS, GallardoX, et al. Massive coronary air embolism after CT-guided lung needle biopsy[J]. Intensive Care Med, 2018, 44(10):1748-1749. DOI: 10.1007/s00134-018-5165-1.
[47]Monnin-BaresV, ChassagnonG, Vernhet-KovacsikH, et al. Systemic air embolism depicted on systematic whole thoracic CT acquisition after percutaneous lung biopsy: incidence and risk factors[J]. Eur J Radiol, 2019, 117:26-32. DOI: 10.1016/j.ejrad.2019.05.016.
[48]KaoKC, TsaiYH, WuYK, et al. Open lung biopsy in early-stage acute respiratory distress syndrome[J]. Crit Care, 2006, 10(4):R106. DOI: 10.1186/cc4981.
[49]LettieriCJ, VeerappanGR, HelmanDL, et al. Outcomes and safety of surgical lung biopsy for interstitial lung disease[J]. Chest, 2005, 127(5):1600-1605. DOI: 10.1378/chest.127.5.1600.
[50]PalakshappaJA, MeyerNJ. Which patients with ARDS benefit from lung biopsy?[J]. Chest, 2015, 148(4):1073-1082. DOI: 10.1378/chest.15-0076.
[51]中国老年医学学会检验医学分会感染性疾病学组. 经皮肺穿刺标本临床微生物检测流程及质量控制专家共识[J]. 中华检验医学杂志, 2019, 42(1):21-25. DOI: 10.3760/cma.j.issn.1009-9158.2019.01.006.
执笔:冯莹莹(中日友好医院呼吸与危重症医学科);周国武(中日友好医院呼吸与危重症医学科);吴晓东(同济大学附属东方医院呼吸与危重症医学科);冯靖(天津医科大学总医院呼吸与危重症医学科)
委员(以姓氏拼音为序):白冲(海军军医大学第一附属医院呼吸内科);陈成水(温州医科大学附属第一医院);程真顺(武汉大学中南医院呼吸与危重症医学科);董宇超(海军军医大学第一附属医院呼吸内科);冯靖(天津医科大学总医院呼吸与危重症医学科);郭述良(重庆医科大学附属第一医院呼吸与危重症医学科);顾晔(上海市肺科医院肺内科);淦鑫(南昌大学第一附属医院呼吸与危重症医学科);侯刚(中日友好医院呼吸与危重症医学科);胡轶(武汉市中心医院呼吸与危重症医学科);蒋进军(复旦大学附属中山医院呼吸科);罗凤鸣(四川大学华西医院呼吸与危重症医学科);罗红(中南大学湘雅二医院呼吸与危重症医学科);李强(同济大学附属东方医院呼吸与危重症医学科);李时悦(广州医科大学附属第一医院呼吸内科);黎毅敏(广州医科大学附属第一医院);潘频华(中南大学湘雅医院呼吸与危重症医学科);孙加源(上海市胸科医院呼吸与危重症医学科);孙忠民(西安交通大学第一附属医院呼吸与危重症医学科);谢俊刚(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);邢丽华(郑州大学第一附属医院呼吸与危重症医学科);解立新(解放军总医院呼吸与危重症医学部);许能銮(福建省立医院呼吸科);姚孟英(郑州大学第一附属医院呼吸与危重症医学科);张波(中日友好医院超声科);张杰(北京天坛医院呼吸内科);周庆涛(北京大学第三医院呼吸与危重症医学科);詹庆元(中日友好医院呼吸与危重症医学科);张伟(海军军医大学第一附属医院呼吸内科);张新(复旦大学附属中山医院呼吸科);曾奕明(福建省医科大学附属第二医院呼吸与危重症医学科)
利益冲突
所有作者均声明不存在利益冲突
通信作者:詹庆元,中日友好医院呼吸中心 中日友好医院呼吸与危重症医学科 国家呼吸医学中心 中国医学科学院呼吸病学研究院 国家呼吸疾病临床医学研究中心 世界卫生组织戒烟与呼吸疾病预防合作中心,北京 100029,Email:drzhanqy@163.com;李强,同济大学附属东方医院呼吸与危重症医学科,上海 200120,Email:liqressh@hotmail.com.
本文转载自订阅号「中华医学杂志」(ID:nmjc191)
原链接戳:标准与规范 | 呼吸危重症患者行肺组织活检操作的专家意见
引用本文:中国医师协会呼吸医师分会呼吸危重症专委会, 中国医师协会呼吸医师分会介入呼吸病学工作委员会. 呼吸危重症患者行肺组织活检操作的专家意见 [J] . 中华医学杂志, 2022, 102(22) : 1641-1647. DOI: 10.3760/cma.j.cn112137-20211019-02316.


