毛霉菌病(Mucormycosis)又称接合菌病(Zygomycosis),是一种由接合菌亚门、毛霉目、毛霉科中的多种真菌(主要为根霉菌和毛霉菌)所致的疾病,也是一种发病急、进展快、病死率高的条件致病性真菌感染。
概念及病原学特点
概念
毛霉菌(Mucor)又称黑霉、长毛霉,是一类菌丝较宽(6~25 μm)、几乎无隔的真菌,为需氧菌,但可在无氧条件下生长,在25~55℃温度下,可以在绝大多数的培养基中生长。其特征如下:
- 宽菌丝:菌丝壁两侧不平行,透明、薄壁带状。
- 菌丝几乎无隔,呈特征性的扭曲、塌陷或折叠状。
- 菌丝分枝间隔不规则,通常呈直角分枝。
- 生长迅速,菌落絮状或棉花状。
- 在组织中主要呈菌丝态。
病原学特点
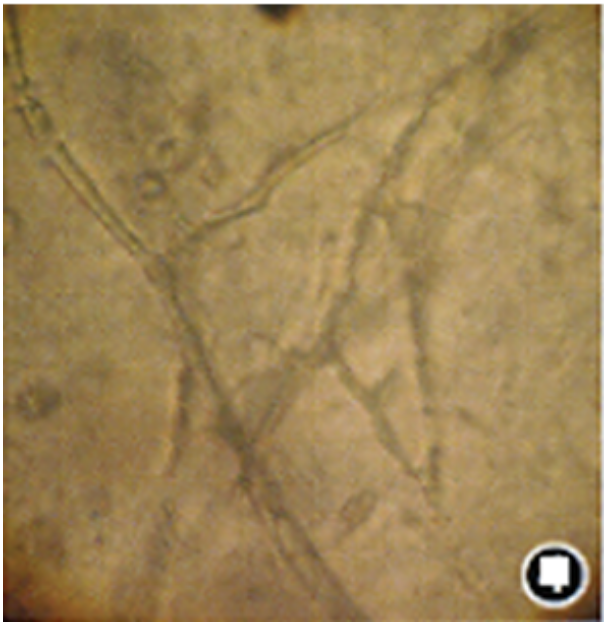
病例活检组织中可见大量粗大、无节、呈直角分枝的毛霉菌菌丝。

光镜下可见粗大、无节、呈直角分枝的菌丝。
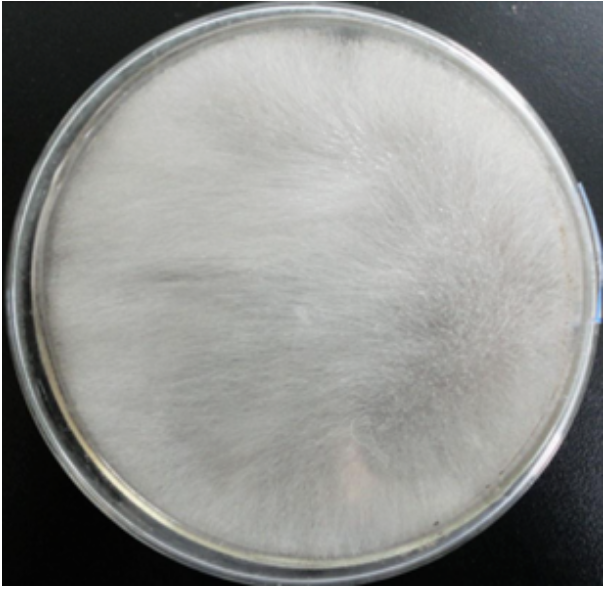
培养特性:表面为棉花样,初为白色,后变成灰色和其他颜色。
流行病学特点
在真菌感染中,毛霉菌病发病率高,且发病率逐年升高。1876年德国Furbinger首次描述,1885年,Arnold Paltauf发表了第一例播散性毛霉菌病病例。全球确切发病率/患病率尚不清楚,因为很少有基于人口的研究,法国一项为期10年的研究显示毛霉菌病发病率为1.2/10000。
印度的毛霉菌病发病率(约9.5/10万)一直都远远高于世界平均水平,其患病率是发达国家的80倍。据媒体报道,感染毛霉菌病的新冠肺炎患者数量激增,当「新冠」遇上「毛霉菌」,这无疑是雪上加霜!在印度以外的国家,与新冠相关的毛霉菌病感染很少。为什么印度的情况如此不同呢?可能的原因:①在新冠大流行之前,毛霉菌病在印度发病率已经很高;②毛霉菌病的暴发与受污染的产品有关;③糖尿病在印度的流行率高,而且患者往往血糖控制不佳。
毛霉菌病是一种罕见的机会性真菌感染,其典型表现为进展迅速,主要侵犯糖尿病和免疫抑制患者(如血液系统恶性肿瘤、造血干细胞移植、实体器官移植等)。按照临床表现不同可分为鼻脑毛霉菌病、肺毛霉菌病、胃肠道毛霉菌病、皮肤毛霉菌病等。一位18岁肾移植后男性患者因肺毛霉菌病切除左肺下叶,后又在胸廓切开处发生了皮肤的散播性毛霉菌感染。
- 传播媒介:污染空气吸入或直接接触感染。创伤皮肤移植、昆虫叮咬、外科手术和烧伤感染,通过土壤或灰尘使烧伤部位感染。
- 易感对象:人,动物中的牛、马、犬、猪、鸟等都易感,实验鼠也易感。
- 性别差异:好发于男性,男女比例约为2.3~3:1。
- 季节性:8月和9月。
- 危险因素:①血液系统恶性疾病(白血病、淋巴瘤、多发性骨髓瘤);②中性粒细胞减少症;③药物引起的免疫抑制(抗肿瘤药物、激素治疗、抗排斥治疗、去铁胺的应用);④糖尿病(Ⅰ、Ⅱ型)伴或不伴酮症酸中毒;⑤慢性肾功能不全;⑥慢阻肺;⑦实体器官移植、骨髓移植及造血干细胞移植;⑧严重烧伤,严重创伤;⑨HIV及吸毒者。
美国一项临床研究利用全国住院资料数据库和普查数据,评估了2000—2013年国家范围内的IA-RH(侵袭性曲霉病相关住院)和M-RH(毛霉菌病相关住院)发生率的变化趋势,结果显示毛霉菌病相关住院率年均增长5.15%[1]。澳大利亚一项多中心、回顾性研究纳入在2004—2012年确诊和临床诊断的74例毛霉菌病患者的资料,旨在评估澳大利亚毛霉菌病患者的流调情况及临床结局,结果发现毛霉菌病涉及众多科室,主要为血液科[2]。
意大利的一项回顾性、横断面(描述分析)研究分析了2001—2013年入住某医院的30例毛霉菌病的恶性血液病患者的医疗记录,旨在评估毛霉菌病在恶性血液病患者中的流行病及临床表现特点,结果显示恶性血液病(包括AML、ALL、CML、CLL、NHL、HL、MM)患者毛霉菌病发病率高达4.29%,其中大部分是急性白血病患者[3]。上述美国临床研究结果发现恶性血液病患者毛霉菌病增长超过曲霉[1]。
伏立康唑的广泛使用是毛霉菌病增加的原因之一。侵袭性接合菌病患者在伏立康唑及卡泊芬净引入后明显增加,该新兴真菌感染的出现与免疫抑制人群增多及新型抗真菌药物的广泛使用有关。瑞士日内瓦大学医院1989—2008年之间侵袭性接合菌病与抗真菌药物使用之间的关系,研究提示伏立康唑预防治疗使毛霉菌病风险显著增加,伏立康唑暴露还可增加接合菌毒性。
慢性肺部疾病亦是毛霉菌病的危险因素。反复肺部感染会导致呼吸道黏膜受损,纤毛运动减退与肺结构破坏,削弱了呼吸道的防御功能;缺氧和高碳酸血症等因素使中性粒细胞释放过氧化物减少,不能有效地破坏真菌细胞壁和DNA。
肺部毛霉菌感染好发于有基础疾病(如糖尿病、急性白血病、器官移植、慢阻肺及重症肺炎、手术及创伤等)和免疫功能低下的患者[4]。慢阻肺患者常应用糖皮质激素治疗,而激素可以降低巨噬细胞功能,减弱巨噬细胞抑制真菌孢子生长的作用。浙江大学医学院附属第一医院诊断的9例肺毛霉病患者,4例来自于呼吸科,其中支气管扩张和慢阻肺患者各1例,血液科4例,肾内科1例[5]。
临床表现及分类
临床表现:
毛霉菌病无特异的临床表现,临床可见发热(使用广谱抗生素无效),咳嗽,呼吸困难,咯血,伴或不伴胸痛,可侵犯血管壁而引起血栓和组织坏死,如侵犯气道,可引起声音嘶哑等。
分类:
- 鼻脑型:是最常见的一种类型(24%~39%)。
- 肺型:肺仅次于脑的受累器官(24%~30%)。
- 播散型:脑为最常见的播散部位,常迅速致死(15%~23%)。
- 皮肤型:切口红肿不明显;坏死组织多,病变进展迅速(19%~26%)。
- 胃肠型:多见于回肠末端、盲肠及结肠,食道及胃亦可累及(2%~11%)
- 混合型。
组织病理学特点和影像学特点
组织病理学特点:
浸润、血栓形成和坏死是其特征。镜下显示病变呈急性炎症过程,组织严重坏死、化脓,其中可见大量巨噬细胞及中性粒细胞和嗜酸性粒细胞浸润,间质纤维组织增生,毛细血管壁增厚。病变区域内包括坏死区、血管壁、血管腔和血栓内均可见大量菌丝,但是极少见到肉芽肿,是本病的特征性改变。
影像学特点:
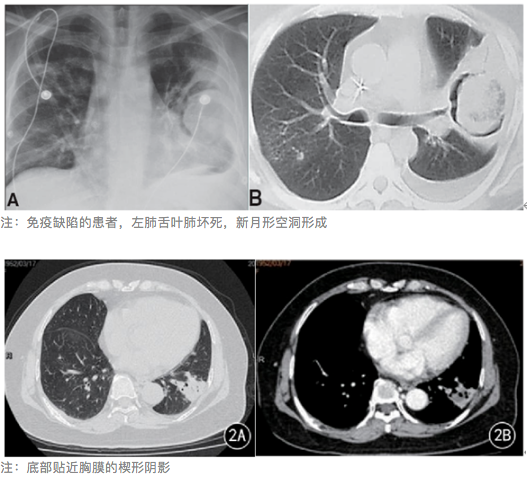
- 单发或多发的肺实变,常伴空洞。
- 底部贴近胸膜的楔形阴影。
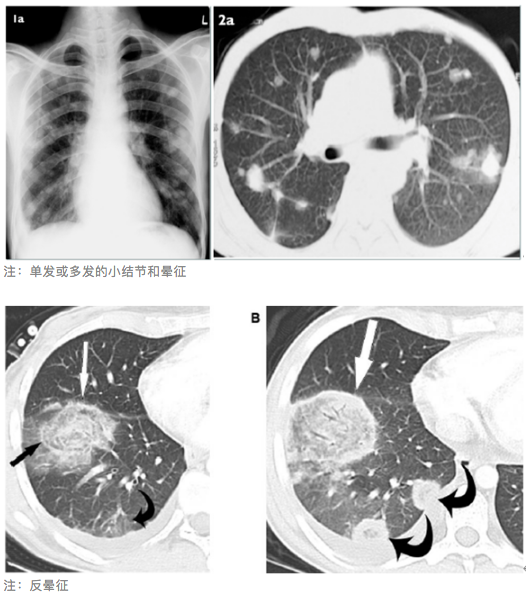
- 单发或多发的小结节和晕征。
- 反晕征。
- 气管内病变。
- 其他:胸腔积液,累及纵隔、肋骨等。
诊断、治疗、预后
诊断:
在影像学方面,虽难以与侵袭性肺曲霉相鉴别,但多具有以下特征性表现:10个或更多部位的多发结节;胸腔积液;反晕征;与肺梗死毗邻的蜂窝组织炎。使用荧光增白剂的直接镜检临床样本可快速诊断,镜下可见菌丝粗细不均(6~25 μm),无分隔或很少分隔,不规则的带状外观[6]。样本的培养视为基本的检测方法,虽然敏感性不是最佳,但可用于鉴别诊断和药敏试验。强烈推荐组织样本的病理学检测用于区别曲霉菌、形态类似真菌及不同毛霉菌,从而指导临床治疗[6]。其他包括DNA测序和PCR等分子技术在诊断方面尚未标准化,也未获得专家认可[7]。
毛霉菌病的确诊主要通过真菌病原学和组织病理学,最终诊断依赖于病理发现并经培养证实,但培养的假阴性多。组织病理学或涂片常成为诊断的唯一证据。G试验、GM试验等在毛霉菌感染时均为阴性。
治疗:
毛霉菌病的治疗方法包括:①手术清创;②两性霉素B脂质体及复合体静脉剂;③泊沙康唑缓释片和静脉剂;④艾沙康唑(已在美国获得毛霉菌病一线治疗及欧洲补救治疗的许可)。
欧洲临床微生物与感染性疾病学会(ESCMID)和欧洲医学真菌联合会(ECMM)毛霉菌病诊断和管理指南以及第6届欧洲白血病感染会议(ECIL-6)白血病和造血干细胞移植患者侵袭性念珠菌病、曲霉菌病及毛霉菌病的治疗指南均建议,毛霉菌病治疗以外科清创和两性霉素B抗真菌治疗为主[6]。2019年ECMM与真菌病研究小组教育与研究联合会(MSG ERC)联合发布的最新毛霉菌病全球诊疗指南建议:除系统性抗真菌治疗外,优先推荐尽早对毛霉菌病进行完整的外科手术治疗(A-Ⅱu)。外科手术的治疗毛霉菌病可使患者死亡率降低55%,但对于血液病患者尤其是血小板减少患者,外科清创效果显著仍存在一定的局限性[8]。
抗真菌治疗一线单药疗法—指南建议:
- 在所有系统感染中,优先推荐两性霉素脂质体B 5~10 mg/(kg·d)进行一线治疗(A-Ⅱu/A-Ⅲ)。
- 如果发生严重肾毒性,可适时减量,但剂量低于5 mg/(kg·d)的推荐证据不足(C-Ⅲ)。
- 应该开始就应用最大剂量,不应缓慢增加剂量。
- 对于无中枢神经系统受累患者,中度推荐5 mg/(kg·d)两性霉素B脂质复合物(B-Ⅱu)。
- 当有可替代药物,不推荐使用两性霉素B脱氧胆酸盐。
- 中度推荐艾沙康唑用于毛霉菌病的一线治疗(B-Ⅱ)。
- 中度推荐泊沙康唑缓释片和静脉剂型一线治疗(B-Ⅱu),使用泊沙康唑口服混悬液证据不足(C-Ⅱu)。
抗真菌治疗联合治疗—指南建议:
- 抗真菌联合疗法证据尚不确切。有限数据支持多烯和唑类或多烯加棘白菌素类药物组合。在毒性无明显增加情况下,可合理予以联合治疗,但效果未知。
- 联合用药的证据有限(C-Ⅲ/C-ⅡIu)
抗真菌治疗补救治疗—指南建议:
- 优先推荐艾沙康唑补救治疗(A-Ⅱ)。
- 优先推荐泊沙康唑缓释片或静脉剂被用于补救治疗(A-Ⅱ),而泊沙康唑口服混悬液证据不足(C-Ⅱu)。
- 如果艾沙康唑或泊沙康唑一线治疗失败,则优先推荐两性霉素B脂质体剂型(A-ⅡIut/B-Ⅱu/B-Ⅲ)。
治疗药物:
(1)两性霉素B
- 适应证:可用于曲霉、念珠菌、隐球菌、组织胞浆菌、毛霉菌等引起的侵袭性真菌感染患者。
- 药代动力学:几乎不被肠道吸收,静脉给药较为理想。血浆结合率高,可通过胎盘屏障、血浆半衰期为24小时,肾脏清除很慢。
- 毒性反应:使用过程中常出现高热、寒战、呕吐、静脉炎、低钾血症及肝肾功能损害等毒性反应。
- 延长两性霉素B脱氧胆酸盐注射时间可增加患者对药物的耐受性,减少肾毒性。(推荐级别为C级)。
(2)两性霉素B含脂制剂
- 目前有3种制剂,包括两性霉素B脂质复合体(ABLC)、两性霉素B胶质分散体 (ABCD)和两性霉素B脂质体(L-AmB)。
- 因其分布更集中于单核-吞噬细胞系统如肝、脾和肺组织,减少了在肾组织的浓度,故肾毒性较两性霉素B去氧胆酸盐降低。抗真菌谱同上,采用脂质体技术制备,价格较昂贵。
- 适应证:可用于曲霉、念珠菌、隐球菌、组织胞浆菌等引起的侵袭性真菌感染患者;无法耐受传统两性霉素B制剂的患者;肾功能严重损害,不能使用传统两性霉素B制剂的患者。
- 药代动力学:非线性动力学,易在肝脏及脾脏中浓集,肾脏中则较少蓄积。
(3)泊沙康唑
- 指南推荐泊沙康唑用于毛霉菌病的治疗。欧洲白血病感染会议指南推荐:当两性霉素B完全禁忌时可使用泊沙康唑,或联合使用作为一线治疗(CⅢ);泊沙康唑(BⅡ)作为挽救治疗[9]。ESCMID/ECMM指南推荐:泊沙康唑4×200 mg/d或2×400 mg/d作为毛霉菌病的一线治疗(B);沙康唑4×200 mg/d或2×400 mg/d作为挽救治疗(A)[6]。
- 泊沙康唑安全性良好,可用于多种特殊人群。对于老年人、肝肾功能损害者无需调整剂量,且尚未确定在13岁以下儿童患者中的安全性和有效性。
治疗时间—指南建议:
- 强烈推荐治疗至免疫抑制状态逆转并影像学完全恢复(A-Ⅲ)。
- 在病情稳定之前,中度推荐静脉治疗(B-Ⅱ)。
- 当转为口服治疗时,强烈推荐艾沙康唑或泊沙康唑缓释片(A-Ⅱ)。可使用泊沙康唑口服混悬液,但证据不足,尤其在其他剂型可选情况下(C-Ⅱu)。
- 可在有特殊考量的儿童、辅助治疗、重症患者及经济学的角度对毛霉病治疗进行药物监测,这是未来发展的方向。
预后:
毛霉菌病患者能否痊愈取决于下列因素:外科清创,抗真菌治疗效果,治疗高血糖,纠正粒细胞减少,或减少免疫抑制药物等。
毛霉菌病危害显著,预后极其不良。一项多中心前瞻性观察性研究纳入234例成人HSCT受者,共250例IFD事件,其中曲霉菌占59.2%,念珠菌占24.8%,接合菌占7.2%,其他霉菌占6.8%,旨在评估HSCT患者IFD的流调特点及临床结局等。结果发现,与念珠菌和曲霉导致的感染相比,接合菌(毛霉菌)导致的感染预后相对较差,其临床结局恶化患者比例明显较高。澳大利亚一项多中心回顾性研究纳入在2004—2012年之间确诊/临床诊断的74例毛霉菌病患者资料,旨在评估澳大利亚毛霉菌病患者的流调情况及临床结局,结果发现各科室毛霉菌病患者180天病死率约为60%。
小结
毛霉菌病发病率逐年增加,涉及众多科室,且病死率高。该病的诊断方法有限,外科清创治疗疗效显著,但存在一定的局限性。权威指南推荐,两性霉素B可用于毛霉菌病的预防、一线治疗及挽救治疗中,但其治疗不良反应发生率高。艾沙康唑、泊沙康唑具有抗毛霉菌活性,且潜在药物相互作用少,特殊人群用药安全。
参考文献
[1] Vallabhaneni S, Benedict K, Derado G, et al. Trends in Hospitalizations Related to Invasive Aspergillosis and Mucormycosis in the United States, 2000-2013[J]. Open Forum Infect Dis, 2017, 4(1):ofw268.
[2] Kennedy K J, Daveson K, Slavin M A, et al. Mucormycosis in Australia: contemporary epidemiology and outcomes[J]. Clin Microbiol Infect, 2016, 22(9):775-781.
[3] Noorifard M, Sekhavati E, Jalaei Khoo H, et al. Epidemiology and clinical manifestation of fungal infection related to Mucormycosis in hematologic malignancies[J]. J Med Life, 2015, 8(Spec Iss 2):32-37.
[4] 武薇,李钊,邵长周,等. 肺毛霉病临床诊断学特征分析并文献复习[J]. 中华诊断学电子杂志,2016,4(4):272-276.
[5] 应琳,郑静,张培,等. 肺毛霉病九例诊疗体会[J]. 中华结核和呼吸杂志,2013,36(4):299-301 .
[6] Cornely O A, Cuenca-Estrella M, Meis J F, et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) Fungal Infection Study Group (EFISG) and European Confederation of Medical Mycology (ECMM) 2013 joint guidelines on diagnosis and management of rare and emerging fungal diseases[J]. Clin Microbiol Infect, 2014, 20 Suppl 3:1-4.
[7] Tissot F, Agrawal S, Pagano L, et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients[J]. Haematologica, 2017, 102(3):433-444.
[8] Tedder M, Spratt J A, Anstadt M P, et al. Pulmonary mucormycosis: results of medical and surgical therapy[J]. Ann Thorac Surg, 1994, 57(4):1044-1050.
[9] Tissot F, Agrawal S, Pagano L, et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients[J]. Haematologica, 2017, 102(3):433-444.
[10] Neofytos D, Horn D, Anaissie E, et al. Epidemiology and outcome of invasive fungal infection in adult hematopoietic stem cell transplant recipients: analysis of Multicenter Prospective Antifungal Therapy (PATH) Alliance registry[J]. Clin Infect Dis, 2009, 48(3):265-273.
作者介绍

樊芳芳
山西医科大学第一医院,主治医师;全国肺栓塞与肺血管病学青年协作组委员;山西省医师协会肺血管中青年委员会委员;山西省医师协会呼吸医师分会委员;预防学会呼吸病防控专委会青委;曾于中日友好医院进修半年。
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:毛霉菌病的诊治进展


