1967年,Ashbaugh等首次通过呼吸力学来评价急性呼吸窘迫综合征(ARDS)的严重程度,呼吸力学可能会促进对个体严重程度的理解(即所谓的ARDS「表型」),并成为个性化机械通气设置的目标。目前呼吸力学已经成为ARDS临床评估中有用的监测工具。事实上经典ARDS往往表现为肺顺应性下降,需要较高的通气压力才能获得正常的气体交换。然而,小潮气量保护性通气策略能够减少呼吸机相关肺损伤(VILI),提高ARDS患者的生存率,但是限制潮气量往往可能会导致人机不同步。因此,对ARDS患者整体和区域呼吸力学变化的认识及对于人机对抗波形的认知具有重要的临床意义。ARDS属于限制性通气功能障碍疾病谱中的典型,显然,所有的限制性疾病可能表现相似的通气波形,我们不可能通过波形来「诊断」ARDS,但可以通过波形来分析肺力学的特点和严重程度,并据此设定可能更合理的通气策略。本篇以ARDS为例讨论限制性疾病的通气共性。
力学特点
呼吸系统顺应性下降
ARDS患者由于肺泡病变导致的渗出增加、肺泡实变塌陷等原因导致功能残气量下降,可参与通气的肺泡数量明显降低,顺应性下降。
气道阻力增加
ARDS动物模型表明:在弥漫性肺损伤时,气道阻力明显增加。ARDS中气道阻力的增加归因于气道分泌增加、肺容积减少、迷走神经反射和气道高敏等。有研究显示部分ARDS患者存在不同程度的气道开放压力。
病变不均一
典型的ARDS患者肺部病变呈现重力依赖性加重的特点,背侧和肺底部肺组织的病变程度明显较腹侧更重。这种特点提醒我们力学的静态评估和监测可能是不够的,在整个自主驱动过程中,动态的跨肺压的异常分布也需要引起注意。
上述力学的改变会导致患者呼吸肌肉动员增强、氧耗增加、通气量增高,给「小肺」带来过度牵张和剪切损伤。最基本的静态顺应性监测可通过平台压来计算;而自主呼吸状态下的力学评估也有多种有创或无创手段,此处不再赘述。
波形评估
ARDS患者机械通气时突出的问题是由于顺应性下降、低氧血症、肺牵张增强等导致的强自主驱动(图1)。在无医源性手段控制前,患者呼吸频率快、分钟通气量高,甚至出现反比通气,表现为明显的呼吸窘迫。由运动方程可知(见前文「机械通气波形分析:基础篇」),过强的通气「动力」与增加的「阻力」之间使得通气相关损伤(VILI、P-SILI等)的风险明显增加。因此,ARDS通气过程中对「动力」(自主驱动)和「阻力」的评价应该贯穿始终。
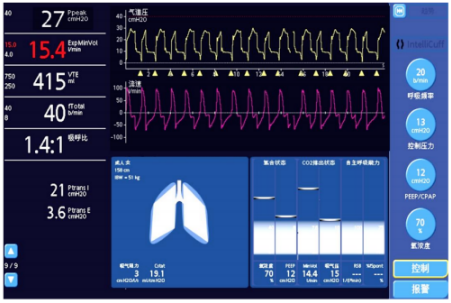
图1 ARDS患者的机械通气
触发做功增加
患者自主吸气产生预设流量和压力触发水平触发呼吸机送气。ARDS患者过强的吸气驱动在触发阶段瞬间爆发(类似呃逆),可以在极短时间内产生很强的胸腔负压,在呼吸机压力时间波形上可以看到触发期大幅度、短时间的压力下降。通常情况下吸气驱动强会伴随潮气量明显增高,但对于顺应性极差的患者则不一定。ARDS肺部病变的不均一性使得不同肺组织间的跨肺压差值增加。因此,从肺保护的角度,我们不应仅仅考虑静态跨肺压,吸气触发瞬间的高跨肺压对肺的损伤也应予以关注。
有些临床医生为了降低呼吸频率,可能采用较高的压力触发方式。我们极不推荐这种「策略」,它不仅明显增加触发做功(造成患者窒息感、交感兴奋性增强),而且显著增加了触发期的跨肺压。如图2B所示,患者此时可能潮气量并不太高,呼吸频率也仅为10次/min左右,但可以看到触发期压力降幅较大、吸气相压递增、吸气时间不足、主动呼气等问题,说明患者驱动较强,而图2A所示患者自主驱动明显弱于图2B患者。当然,这只是通过波形的定性评估,是否处理以及如何处理需要结合Pmus的量化评估。
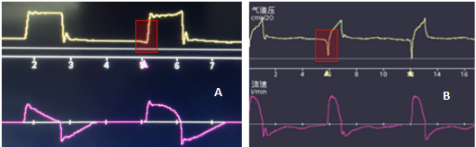
图2 ARDS患者波形
「高高瘦瘦」的流量波形
ARDS呼吸力学特点以顺应性下降为重要表现。除了潮气量降低之外,压力型通气模式下的流量波形形态也有特征性变化,表现为「高高瘦瘦」。所谓的「高」是指峰流量明显增高(图3A),主要与自主驱动增强明显相关(或预设压力增高);「瘦」是指有效吸气时间缩短,与顺应性降低、肺容积变小有关。与此有关的一个指标是「时间常数」(时间常数=顺应性×气道阻力)。限制性疾病患者顺应性明显下降,时间常数减小,被动通气时肺充气时间也明显缩短,在常规的吸气时间设置下切换流量通常为0,且常见「流量平台」(图3B)。从人机同步角度考虑,吸气时间的设置「宁短勿长」,尽可能留出自主代偿空间。因自主吸气时间明显缩短,部分患者适当延长吸气时间对降低呼吸频率有一定帮助。
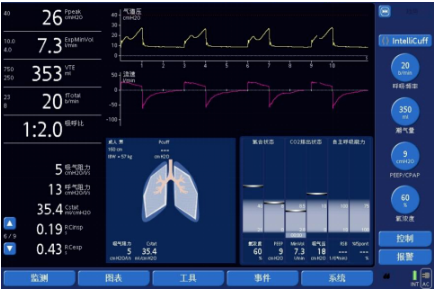
图3 ARDS患者流量波形
吸气过程的「流量饥饿」现象
流量饥饿与吸气驱动增强和呼吸机限制参数(流量、潮气量)有关。在容量型通气(预设流量和潮气量)模式下,由于高自主驱动使流量需求明显增高,预设值不能满足患者当前需求时,吸气相的气道压力「不增反降」,定义为「饥饿现象」(图4)。「流量饥饿」会导致负压性损伤的发生,严重的可引起负压性肺水肿、气压伤等。临床上应避免「流量饥饿」的发生。
「流量饥饿」一般在吸气初期即出现,与该现象有关的参数主要是设置流量,尤其采用恒流模式时。从机械通气参数的角度考虑,可以通过提高吸气峰流量(缩短吸气时间)、增加潮气量等方式来处理「流量饥饿」;也可以更换为压力型通气模式,但这样可能明显增加潮气量。对于严重力学受损的患者,加强镇静镇痛、降低通气需求是首选方法。
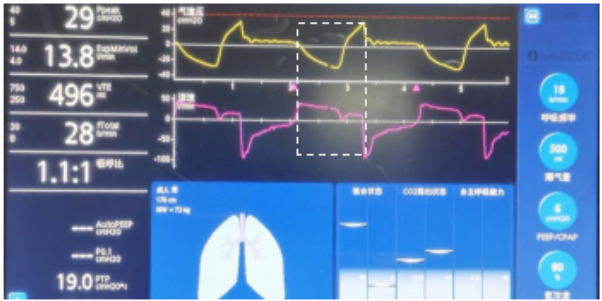
图4 流量饥饿
双吸气
双吸气定义为连续两次极短时间间隔的通气过程。主要有两种形式:①机控通气开始后出现较强的自主吸气并延续到呼气早期引起二次触发通气;②自主通气开始驱动延续到呼气早期触发二次通气。无论哪种形式,由于首次呼气尚未完全,二次吸气都会显著增加潮气量,显然不利于ARDS患者肺保护通气的实施。
图5所示ARDS患者的参数调整,A为初始设置,可见偶有双吸气现象(图5A),自主节律较慢,当吸气驱动较强时诱发了一次双吸气;而前次吸气驱动因未达界值未诱发双吸气。管床医生因监测潮气量过大,予降低吸气压力,调整后双吸气频率明显增加(图5B)。在ARDS肺保护通气中,限制潮气量是基础,但也应清楚潮气量的高低不仅仅由参数决定,最终还受患者吸气努力大小的影响。设置的支持力度和自主驱动强度一般呈现为跷跷板样效应,此消彼长。在参数调整时可以考虑增加支持力度和频率来压制自主驱动,同时注意潮气量和分钟通气量的变化。
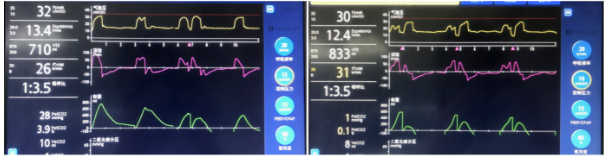
图5 双吸气
反转触发
反转触发(图6)是指机控通气开始后吸气相出现自主吸气努力,且机控通气和自主节律的出现呈固定比例(比如1:1、2:1等)。正常的自主触发过程是患者自主吸气带动呼吸机开始送气,反转的意思即为呼吸机送气带动自主呼吸的出现。这种不同步现象在重度镇静的ARDS患者中较常见,在脑死亡患者中也有发现;其形态多样,确切的因果机制尚不清楚。反转触发不仅会导致潮气量增加,也会使驱动压更难以控制,且引起患者耗氧量增加,可能导致患者血流动力学不稳定。反转触发通常仅有自主吸气痕迹,一般不会引起双吸气,如果潮气量超限,需要进行必要的处理。部分患者合并CO2潴留,增加通气量(优先调整频率)后「反转触发」消失(压控模式下潮气量往往会较前降低)。
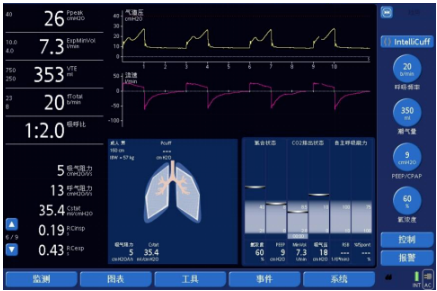
图6 反转触发可能
总结
人机交互是ARDS患者机械通气过程中存在突出矛盾的重要关注点,当然这种矛盾并非ARDS患者特有,其可出现于任何机械通气的患者。就目前的证据而言,缓和的通气过程对防止肺损伤的加重是有益的。ARDS以高通气需求为特点,「小肺」、肺病变的不均一性使过强的自主驱动有潜在诱导肺损伤的风险。因此,除了针对病变本身导致的力学改变的静态和动态评估,通过波形来识别自主驱动的有无、强弱以及对保护性通气策略实施的影响也至关重要。当波形提示自主节律和驱动「异常」时,我们可以进一步测量驱动压、跨肺压、Pmus、POCC、P0.1等来量化评估。
参考文献
[1] Meyer N J, Gattinoni L, Calfee C S. Acute respiratory distress syndrome[J]. Lancet, 2021, 398(10300):622-637.
[2] Chen L, Sorbo L D, Grieco D L, et al. Potential for Lung Recruitment Estimated by the Recruitment-to-Inflation Ratio in Acute Respiratory Distress Syndrome[J]. Am J Respir Crit Care Med, 2020, 201(2):178-187.
[3] Pelosi P, Ball L, Barbas C S V, et al. Personalized mechanical ventilation in acute respiratory distress syndrome[J]. Crit Care, 2021, 25(1):250.
[4] Yoshida T, Fujino Y, Amato M B, et al. Fifty Years of Research in ARDS. Spontaneous Breathing during Mechanical Ventilation. Risks, Mechanisms, and Management[J]. Am J Respir Crit Care Med, 2017, 195(8):985-992.
[5] Amato M B, Meade M O, Slutsky A S, et al. Driving pressure and survival in the acute respiratory distress syndrome[J]. N Engl J Med, 2015, 372(8):747-755.
[6] Fan E, Brodie D, Slutsky A S. Acute Respiratory Distress Syndrome: Advances in Diagnosis and Treatment[J]. JAMA, 2018, 319(7):698-710.
[7] Baedorf Kassis E, Su H K, Graham A R, et al. Reverse Trigger Phenotypes in Acute Respiratory Distress Syndrome[J]. Am J Respir Crit Care Med, 2021, 203(1):67-77.
[8] Coppola S, Pozzi T, Chiumello D. Reverse trigger in COVID-19 ARDS[J]. Minerva Anestesiol, 2021, 87(11):1271-1272.
作者简介

郑霞
主任医师,教授;浙江大学医学院附属第一医院重症医学科副主任;中国医师协会重症医学医师分会青年委员会副主任委员;浙江省数理医学学会重症超声学组副组长;浙江省医学会重症医学分会青年委员会委员;浙江省医学会血栓与止血分会秘书。

何国军
浙江大学医学院附属第一医院呼吸治疗师、内科组组长;毕业于四川大学华西医学中心呼吸治疗与危重症监护专业;中国病理生理学会危重病医学专业委员会呼吸治疗学组委员兼秘书;浙江省呼吸治疗联盟常务委员;组织、参编多部专业著作、指南和专家共识;主要研究领域:重症患者的呼吸支持和气道管理。
作者:郑霞,何国军;单位:浙江大学医学院附属第一医院
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:机械通气波形分析:ARDS患者的人机交互


