病情介绍
患者,女,38岁,公务员,因「干咳10天,发热7天,进行性呼吸困难4天」于2021-11-21入院。
患者10天前(2021-11-11)于服激素期间,受凉后出现干咳,不著,接触刺激性气味无明显加重,无流涕、咽痛,无头痛、头晕,无畏寒、寒战及发热,无全身肌肉酸痛及关节疼痛,未予特殊药物治疗。7天前(2021-11-14)患者出现发热,Tmax38.6℃,无畏寒、寒战,口服布洛芬退热,体温可降至正常,于当地县医院静滴「阿莫西林/克拉维酸钾」(用量不详)、「热毒宁」治疗。4天前(2021-11-17)患者出现呼吸困难,一般日常活动即可出现,伴乏力,体温再次升高,Tmax38℃。于当地医院就诊,行胸部CT平扫(2021-11-18)示:双肺见弥漫絮状、片状高密度影,边界模糊,继续上述药物抗感染治疗。
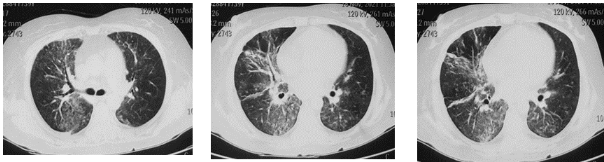
图1:胸部CT(2021-11-18)提示双肺弥漫性片絮状渗出、边界模糊
病情无好转,患者于2021-11-19转诊于上级医院,查血常规示:WBC 5.47×109/L,EOS 0.09×109/L,LYM 0.23×109/L,HB 112g/L,PLT 173×109/L;CRP 80.35mg/L,ESR 23mm/h;肺炎支原体IgM(-);尿常规:尿蛋白1+;肝功能:ALT 65u/L, AST 69u/L,TBIL 56.4umol/L,DBIL 46umol/L,CR 32umol/L。
给予「甲泼尼龙片 20mg qd及退黄补钙」(具体用药不详)治疗,继续静滴「阿莫西林/克拉维酸钾」联合左氧氟沙星0.5 qd po抗感染治疗。患者呼吸困难进行性加重,静息状态下尚可,床上翻身即可出现呼吸困难,于2021-11-21抗生素改为「头孢哌酮舒巴坦3.0g q8h」静滴。患者症状无明显缓解,为求进一步治疗于2021-11-21来我院急诊。
急诊查血气分析(鼻导管吸氧10L/min)示:pH7.41,PaO2 41mmHg,PaCO2 28mmHg,Lac 5.9mmol/L,BE -6.9mmol/L,HCO3-17.7mmol/L;血常规:WBC 15.36×109/L,LYM 1.05×109/L,HB 117g/L,PLT 288×109/L ;CRP 199.12mg/L;生化全套:ALT 50U/L,AST 61U/,TBIL 59.19umol/L,DBIL 39.24umol/L;TP 52.3g/l,ALB 30.5g/L;BUN 8.87mmol/L,CR 34.9umol/L。
诊断
重症肺炎、I型呼吸衰竭,肝功能异常
立刻给予无创呼吸机辅助通气,美罗培南抗感染、氨溴索化痰、多索茶碱解痉平喘、异甘草酸镁保肝治疗,于2021-11-22转入RICU。自发病以来,精神差,饮食睡眠欠佳,大小便尚可,体重较前无明显减轻。
入院查体:T 36.6℃,HR 114次/分,RR 30次/分,BP 120/80mmHg,SpO2 100%( FiO2 0.9,NPPV:IPAP 10cmH2O,EPAP 5cmH2O )。 发育正常,表情痛苦,查体合作。Cushing面容,全身皮肤粘膜轻度黄染,双上臂可见散在紫色淤点,双下肢可见散在片状紫红色皮疹,散在紫色毛细血管网3×4cm,按压不褪色,左侧腰部可见一圆形暗红色皮疹,中间可见圆形破损。 全身浅表淋巴结无肿大。呼吸急促,呼吸动度增强。双肺呼吸音粗,双肺未闻及干湿啰音,未触及胸膜摩擦音。 心前区无隆起,心尖搏动位置正常,心界无扩大,心率114次/分,心音有力,律齐,各瓣膜听诊区未闻及杂音,无心包摩擦音。 腹软,无压痛及反跳痛,肝脾肋下未及 。四肢关节无肿胀、压痛。双下肢无水肿。
既往史:荨麻疹性血管炎4年,长期服用激素及免疫抑制剂,多数时间维持甲强龙剂量12-20mg qd,间断因病情复发增加激素用量,先后服雷公藤、羟氯喹、甲氨蝶呤、硫唑嘌呤、吗替麦考酚酯、沙利度胺等免疫抑制剂。发现间断尿蛋白阳性4年,1+~2+,血肌酐正常。2月前甲强龙调整为20-24mg qd治疗荨麻疹性血管炎,为提高免疫力在某私人公司行「脐带血干细胞治疗」1次,之后出现肝功异常,停用免疫抑制剂,于当地医院住院,考虑药物性肝损伤可能性大,予保肝、退黄治疗,并短时增加激素用量至80mg qd,肝功好转出院。否认高血压病、糖尿病,心脑血管病史,否认神经精神疾病史,否认肝炎史、结核史、疟疾史,常规预防接种史不详,幼年时无百日咳、麻疹等相关病史,未接种新冠疫苗。6年前行剖腹产手术、输卵管结扎术。血型AB型 RH阳性,有输血史(2021-10曾输注冰冻血浆、洗涤红细胞)。否认药物过敏史。
个人史:生于山东省德州市夏津县,久居本地,无疫区、疫情、疫水接触史,无牧区、矿山、高氟区、低碘区居住史,无化学性物质、放射性物质、有毒物质接触史,无吸毒史,无吸烟、饮酒史,无冶游史。
婚育史:已婚,配偶健在。孕2产2,2005年顺产1子,2015年剖腹产产1女,后行输卵管结扎术,子女体健。
家族史:父母健在,否认家族性遗传病史。
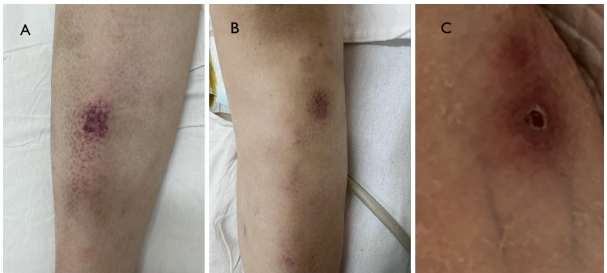
图2:患者皮疹。A、B为双下肢散在片状紫红色皮疹伴毛细血管网,C为左侧腰皮疹
入院诊断
1、重症社区获得性肺炎 2、急性呼吸窘迫综合征(重度)3、荨麻疹性血管炎 4、系统性红斑狼疮?5、肝功能异常
诊疗经过:第一阶段 MICU (2021.11.22-2021.12.15)
积极给予呼吸支持,入院后应用无创呼吸机辅助通气,因呼吸衰竭不能纠正,于2021-11-23行气管插管接呼吸机辅助通气(PC模式:FiO20.5, PC 10cmH2O ,PEEP 8cmH2O, RR12bpm),氧和不能纠正,给予俯卧位改善通气,氧和指数略有改善,因出现气压伤,停止俯卧位通气,于2021-11-23 22:15 开始VV-ECMO治疗。
为明确肺部感染病原学,行床旁纤维支气管镜检查及肺泡灌洗。气管镜下见双侧各叶段支气管黏膜光滑完整,未见明显异常。BALF细胞计数分类:巨噬细胞 15.5%、中性粒细胞77.5%、淋巴细胞6.5%、嗜酸粒细胞0.5%,BALF细菌涂片、真菌涂片、抗酸杆菌涂片、弱抗酸涂片、细菌培养、真菌培养、EB病毒核酸、军团菌核酸、支原体核酸、衣原体核酸、结核分枝杆菌鉴定及耐药点检测均阴性。人肺孢子菌核酸检测(+),CT值 31.15;巨细胞病毒核酸检测(+),CT值 23.01;BALF mNGS 提示:人疱疹病毒5型(巨细胞病毒)100200 RPTM(reads per ten million)、人冠状病毒HKU1型58550 RPTM、耶氏肺孢子菌 1502 RPTM、指状青霉 14 RPTM、图宾根曲霉 1 RPTM。病原微生物相关血清学实验:血TB.SPOT(-)(A 0,B 1),血清G试验 610.81pg/ml 。根据检验结果调整抗感染治疗方案为更昔洛韦 300mg q12h(11-22至12-15)、联磺甲氧苄啶 3片 qid(11-22至12-13)、哌拉西林/他唑巴坦 4.5g q6h(11-22至11-29)。完善自身抗体、补体检验、细胞免疫及体液免疫功能检验评估自身免疫病基础病。
经治疗患者病情好转不明显,仍需VV-ECMO支持治疗,复查血常规血细胞进行性下降,2021-11-29结合外周血三系细胞计数及骨髓穿刺活检结果,考虑骨髓抑制为更昔洛韦药物不良反应所致,更换为西多福韦抗巨细胞病毒治疗。2021-11-29复查胸部CT较前明显进展(见图3B)。
为明确肺内病变进展原因,2021-11-29再次行床旁气管镜:双侧各叶段支气管黏膜粗糙,可见白色粘稠痰液。于左肺下叶外后基底段行冷冻肺活检。BALF 新型冠状病毒核酸(-)、人耶氏肺孢子菌(-)、巨细胞病毒核酸检测(+)CT值20.87。冷冻肺活检病理:(肺)支气管粘膜慢性炎;周围肺组织肺泡结构尚存,肺泡间隔略增宽,伴慢性炎细胞浸润,局灶间隔内纤维母细胞增生,肺泡上皮增生,个别肺泡上皮内可见病毒包涵体,CMV染色阳性。肺泡腔内见炎性渗出物及组织细胞聚集,部分肺泡腔内masson小体形成,少数肺泡腔内见透明膜。局灶渗出物内见PAS(+),银染(+),粘液卡红染色(-)的球菌,不除外孢子菌的可能。结合临床,符合弥漫性肺泡损伤之病理改变。免疫组化结果:CMV(+),CK7(+),TTF-1(+),KP-1(+)。特殊染色结果:Masson(+),弹力染色(+),PAS(-),银染(-),粘卡(-)。
从病原、病理方面支持CMV肺炎,病理存在机化性肺炎(OP),坚持以抗CMV为主的抗感染治疗方案,患者淋巴细胞进行性减低至0.06*109/L,减少糖皮质激素用量(入院40mg/日减至20mg/日)。组织培养为耐碳氢霉烯阴沟肠杆菌(金属β内酰胺酶+,对阿米卡星、替加环素敏感)及白念珠菌。BALF mNGS可见巨细胞病毒、人冠状病毒HKU1型、霍氏肠杆菌、屎肠球菌、白念珠菌、耶氏肺孢子菌(参见图3D)。
调整抗感染方案为:西多福韦+头孢哌酮钠舒巴坦钠+万古霉素+伏立康唑。调整治疗后患者三系细胞逐步恢复,于2021-12-5更换为更昔洛韦抗病毒治疗,治疗期间患者病情稳定,体温正常,FiO2自100%逐步下调至50%。
患者白细胞再次出现进行性减少,2021-12-12出现发热伴血压下降,CRP 44.57mg/L、PCT 0.17ng/ml,考虑感染性休克,给予多粘菌素+替加环素治疗,体温控制不佳。因不排除导管相关性感染且患者病情允许的情况下,停VV-ECMO并拔除深静脉置管,仍反复发热,2021-12-15复查气管镜检查见气道黏膜充血水肿,较多黄粘痰,BALF培养为耐碳青霉烯阴沟肠杆菌(金属β内酰胺酶+,对阿米卡星敏感,替加环素中介,粘菌素WT)。BALF-PCR:巨细胞病毒(-)、腺病毒(+) CT值12.74,GM实验 0.26;血病原学检查:GM 0.1;血腺病毒(+)CT值26.5。BALF mNGS(图3E)人腺病毒B亚型、人疱疹病毒5型、霍氏肠杆菌。发热原因考虑合并CRE、腺病毒感染。为明确腺病毒来源,对患者床单元环境采样,对救治医护人员以及邻近床单元患者取咽拭子查腺病毒核酸均为阴性,考虑为既往潜伏感染在免疫状态低下时病毒复制、扩增、感染。
抗感染方案再调整:换用西多福韦抗病毒,氨曲南+头孢他啶阿维巴坦静滴联合阿米卡星雾化吸入抗CRE治疗,磺胺甲噁唑减量至2片 qd 预防PJP,伏立康唑同前。患者发热逐步控制,期间痰培养为同种CRE,监测血常规提示白细胞减少较前好转、CRP、PCT逐渐下降,淋巴细胞计数始终较低,最高0.25*109/L。2021-12-20复查床旁气管镜可见双侧各叶段支气管粘膜充血水肿,较多黄粘痰(图3F),肺泡灌洗液仍有CRE生长,复测BALF-腺病毒PCR (+), CT值较前上升至13.28。2021-12-20复查胸部CT较前明显减轻(图3G),但肺部影像学特点较11-29改变明显,表现为沿支气管血管束分布的斑片影、实变或磨玻璃影。考虑感染后机化性可能,继续应用小剂量甲强龙治疗(12mg)。2021-12-24复查BALF腺病毒(+)CT 21.02,BALF培养仍无曲霉菌生长,停伏立康唑抗真菌治疗,其余治疗继续同前,体温好转,呼吸衰竭纠正,脱机训练后氧和指数无下降,2021-12-27拔除气切管,2021-12-30转出RICU至呼吸与危重症医学普通病房继续治疗。第一阶段患者淋巴细胞计数明显减少,波动在0.12至0.5*109/L期间。
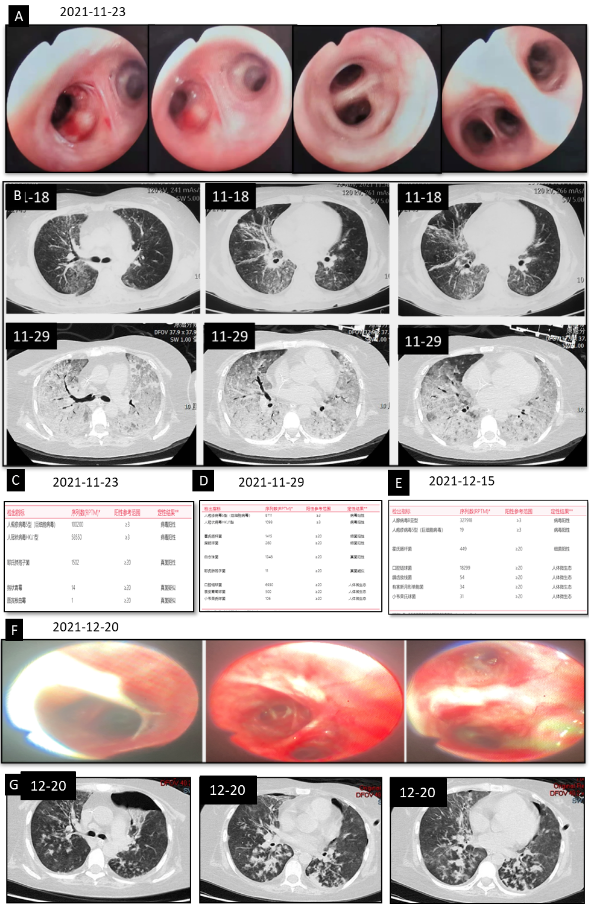
图3:患者气管镜、CT检查及BALF-NGS检验结果
A为2021-11-23气管镜下表现;B为患者入院前及2021-11-29胸部CT检查对比图;C为2021-11-23NGS检验结果;D为2021-11-29BALF-NGS检验结果;E为2021-12-15BALF-NGS检验结果;F为2021-12-20复查气管镜下表现;G为2021-12-20复查CT表现。双肺多发小斑片影,沿支气管血管束分布,可见树芽征。
第二阶段:呼吸与危重症医学普通病房(2021.12.30-2022.2.9)
转入呼吸与危重症医学普通病房后患者病情稳定,无发热,氧疗支持逐步下调,自高流量吸氧(30%,45L/min)下调至鼻导管吸氧(3L/min),患者氧和指数在350mmHg以上,无胸闷、气短表现。转入之后继续应用头孢他啶阿维巴坦+氨曲南静滴联合阿米卡星雾化抗CRE治疗,甲强龙12mg 治疗自身免疫疾病及抗炎治疗,复方磺胺甲恶唑 1片 qd 口服预防PJP。
根据患者2021-12-20胸部CT特点追踪患者既往住院资料,2021年7月曾在我院风湿科住院查结核感染T细胞阳性,分析肺部影像变化原因,考虑可能情况有(1)免疫低下宿主腺病毒感染表现?(2)感染后机化性?(3)持续免疫低下致潜伏结核活动,继发性肺结核?为明确诊断于2022-1-4行纤维支气管镜检查+TBLB+肺泡灌洗,气管镜下表现未见明显异常(图4A),结合影像学于左肺下叶背段行肺泡灌洗。肺泡灌洗液腺病毒(+)CT 29.23,TBLB-NGS腺病毒B型 12RPTM。BALF及TBLB真菌、细菌、结核分枝杆菌Gene-Xpert、分枝杆菌培养均为阴性。血查腺病毒核酸阴性。TBLB病理:(左下背TBLB)支气管黏膜急慢性炎;周围肺组织、肺泡结构尚存,肺泡间隔略增宽,可见纤维母细胞增生,伴急慢性炎细胞浸润,部分肺泡上皮增生,肺泡腔内可见吞噬细胞聚集,请结合临床。免疫组化结果:CMV(-),CK7(+),KP-1(+)。特殊染色结果:PAS(-),银染(-),粘卡(-)。
综合上述病原学检查结果及病理表现,考虑肺部表现为腺病毒感染伴发感染后机化所致。培养未见CRE,停头孢他啶阿维巴坦、氨曲南、阿米卡星。故拟应用第4剂西多福韦抗腺病毒治疗,患者血白细胞再次出现进行性下降,出现粒缺、淋巴细胞计数低至0.11* 10
9/L,因不排除是否西多福韦所致骨髓抑制副作用,暂停第4剂西多福韦治疗。
2022-1-7患者出现心率增快,120-130次/分,无发热,无呼吸困难,完善检查排除心衰、 心肌缺血、甲亢、电解质紊乱等因素。2022-1-9出现干咳且进行性加重,血常规粒细胞进行性下降,2022-1-10突发畏寒、寒战伴发热,体温最高38.1℃,血小板显著降低伴CRP升高、降钙素原正常。应用哌拉西林他唑巴坦抗感染治疗。复查胸部CT提示双肺渗出较2021-12-20好转(图4B)。
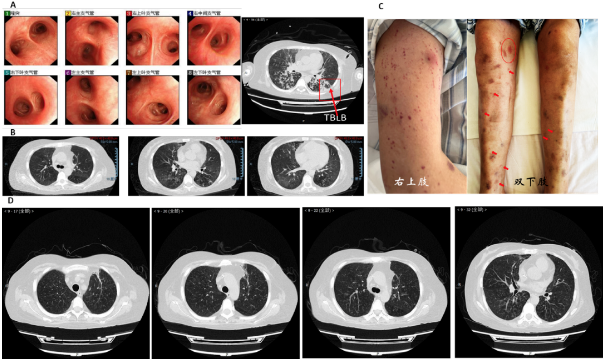
图4:治疗第二阶段气管镜、CT表现及皮疹
A为2022-1-4纤支镜下表现:未见明显异常,右侧CT指示TBLB部位。B为2022-1-10复查CT检查,较2021-12-20CT肺部渗出性病变明显好转。C为患者右上肢及双下肢皮疹表现。D为2022-1-25复查胸部CT,双肺渗出较前吸收,新出现散发粟粒样结节。
患者仍反复发热,伴血细胞减少,考虑需警惕噬血细胞综合症可能,于2022-1-13查血清铁蛋白1444ng/ml↑,甘油三酯 3.17mmol/L ↑,凝血四项:纤维蛋白原正常 ,D-D 0.83mg/L;NK细胞活性 正常;sCD25测定 升高 22822pg/ml (< 6400)。行骨髓穿刺,骨髓涂片:增生活跃,网状、吞噬细胞多见,易见吞噬有核红、成熟红细胞及血小板现象。考虑噬血细胞综合征诊断成立,病因方面,重点鉴别原发病活动导致HLH或持续腺病毒感染继发HLH,患者非幼年及青少年起病,原发性HLH可能性不大。予复查自身免疫相关指标,邀请风湿科及血液科会诊,未见原发病活动证据,考虑HLH继发于感染。
结合近期病原检查结果,BALF及组织应用传统微生物方法、PCR方法及mNGS能获取的病原仅有腺病毒,因此考虑腺病毒感染继发HLH可能。故继续给予西多福韦抗病毒治疗并同步应用地塞米松+依托泊苷+丙种球蛋白治疗噬血细胞综合征。经上述治疗2周,患者热峰较前上升至39℃,发热周期自24小时缩短至10-12h,炎症因子进行性升高,转氨酶、LDH较前明显升高,IFN-γ高达4300.43ng/ml(参考值<23.1)。查体患者出现新发皮疹(图4C),胸腹部查体无阳性体征。再次邀请风湿科会诊,考虑新发皮疹与荨麻疹性血管炎无关。
HLH病因再分析:患者腺病毒载量明显减少时出现HLH,文献复习儿童患者中,腺病毒血症可能诱发HLH,成人少见,用腺病毒感染诱发HLH较难解释。再次循证溯源,患者既往TSPOT阳性,此次复查阴性,考虑为免疫抑制所致假阴性,目前持续高热,针对嗜血的治疗未能控制发热,考虑患者发热可能与潜在未控制的感染因素有关,结合近期持续免疫低下、结核感染病史,考虑不能完全排除结核病。予复查胸部CT同步送检血超敏mNGS检验。2022-1-25复查胸部CT(图4D)提示双肺磨玻璃渗出较2022-1-10好转,新发多发粟粒样结节。超敏mNGS分别在血浆、血细胞检出结核分枝杆菌复合群,血浆:1RPTM 结核分枝杆菌复合群、1RPTM腺病毒B亚型;血细胞:5RPTM结核分枝杆菌复合群。
调整诊断
血型播散性结核病继发HLH。
诊断依据:①免疫缺陷患者;②既往IGRA阳性;③反复发热,以ADV感染及HLH均不能合理解释;④影像学肺内新发散在粟粒样结节;⑤血mNGS检测可见结核分枝杆菌。给予抗结核治疗,患者仍反复发热,热峰高达39.8℃,持续1周,抗结核第2周起热峰逐步下降并控制在正常温度,复查患者粒细胞计数、血小板计数恢复正常,细胞因子较前明显降低,甘油三酯降至正常,肝功恢复正常。粒细胞缺乏纠正1周以上、体温恢复正常3日以上,患者于2022-2-9出院。患者出院后在北京观察2周体温正常、血细胞无下降、肝功无异常后回乡。
第三阶段:出院后病情反复(2022.3.5-2022.3.25)
2022-2-26受凉后再次发热,体温最高39.9℃,伴咳嗽、咳白痰。口服退热药后体温正常。当地医院查血常规 WBC 3.31×109/L, LYM 0.66×109/L,HB 109g/L,PLT 65×109/L;CRP 72.6mg/L;肝功能:ALT 33u/L, AST 133u/L,TBIL 53.4umol/L,DBIL 36.1umol/L。患者持续发热,每日最高体温达39℃以上。无腹痛、尿频。
2022-3-5返回中日友好医院急诊查血常规 WBC 2.03×109/L,NE 1.66×109/L,LYM 0.15×109/L,HB 93g/L,PLT 53×109/L;CRP 73.14mg/L,遂收入院。入院查体:T 38.6℃,P 94次/分,R 28次/分,BP 92/61mmHg。卧床,皮肤巩膜黄染,浅表淋巴结未触及肿大,双肺呼吸音清,未闻及干湿性啰音。肝肋下7cm、剑突下3cm触及,Murphy征(+),脾肋下3cm触及,移动性浊音(-),双下肢可凹性水肿。
入院诊断
1、发热原因待查 感染性疾病(血型播散型肺结核?肺部合并新发机会性感染?胆系感染?);非感染性疾病(噬血综合征复发?风湿免疫病进展?)2、肝脾肿大、黄疸原因待查(噬血综合征复发?血液系统疾病?药物性肝损伤?)3、慢性肝病?4、全血细胞减少原因待查 噬血综合征?脾亢?血液系统疾病?
复查胸部CT(图5A),提示肺部仍有血型播散性肺结核表现,较前好转;复查血mNGS:结核分枝杆菌复合群 2RPTM。查体发现Murphy征阳性,2022-3-9MRCP (图5B)见,胆囊壁水肿,考虑胆囊炎,给予美罗培南抗感染治疗后体温好转。患者三系仍低,影像学提肝大,理化指标示肝细胞性黄疸,转氨酶轻度升高。为评估HLH活动情况,查血清铁蛋白21.7ng/ml、甘油三酯1.93mmol/L、纤维蛋白原1.24g/L 、sCD25 37071pg/ml(参考值<6400),以上符合2004年HLH诊断标准,但甘油三酯、纤维蛋白原仅轻度异常,建议复查骨髓细胞学检查,患者拒绝。行肝脏穿刺活检,病理见:1、重度脂肪肝、小叶性肝炎、慢性淤胆;2、抗酸染色阳性;3、肝窦扩张、可见嗜血现象。病理支持肝结核 ,同时可能存在抗结核药物肝损害,予停用利福平,改为利福喷丁、异烟肼、吡嗪酰胺、左氧氟沙星。患者三系减少与感染相关。经抗感染治疗后患者情况好转出院。
出院后半月、1月、2月随访患者,体温正常,监测血细胞计数、肝功能、甘油三酯基本正常。
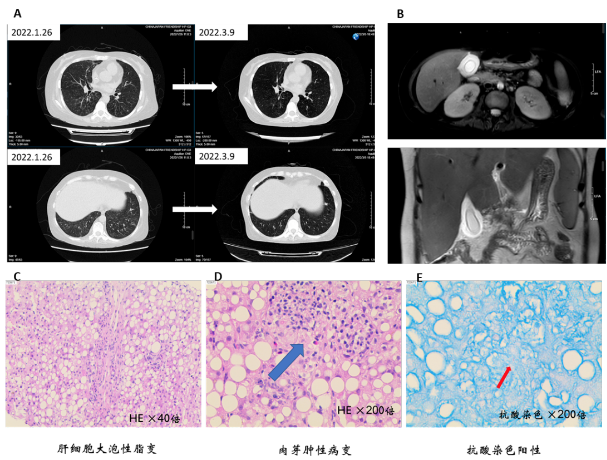
图5 患者第3次住院检查
A为复查CT与上次对比;B为MRCP可见胆囊壁水肿、胆囊炎症;C-E为肝穿刺病理:C可见肝细胞大泡性脂变,D可见肉芽肿性病变,E为抗酸染色可见抗酸杆菌一条
讨论
免疫缺陷宿主罹患社区获得性肺炎(community acquired pneumonia,CAP),易发展为合并急性呼吸衰竭的重症肺炎,除积极有效的生命支持治疗外,病原诊断是诊治成功的关键[1],也是临床医生面临的一大挑战。长时间(>3月)或大剂量应用糖皮质激素(>0.5mg/kg/d)可导致宿主免疫功能低下[1]。
免疫缺陷宿主CAP与免疫功能正常CAP的病原谱不同,李丽娟等研究发现糖皮质激素长期应用宿主合并CAP时病原体以细菌为主(铜绿假单胞菌最为常见),其次为病毒和混合感染[2]。早期准确全面的病原诊断,可使治疗更为精准、有效。对于免疫缺陷宿主的重症肺炎,应积极运用多种病原检测方法,如多种传统病原学检测(涂片镜检、培养、PCR等),有条件可考虑送检mNGS。
本例患者发病初期,经PCR+mNGS确定为CMV合并PCP感染,一方面进行机械通气、ECMO等呼吸支持,一方面准确使用抗感染药物,患者病情得以缓解。多种抗感染药物联合使用时,需警惕药物的不良反应。
本例患者前期治疗中较为突出的是更昔洛韦引起的骨髓抑制。本例患者在此后的每次病情发生变化时,都积极进行了病因的鉴别,并力求病原、病理的诊断。在免疫缺陷宿主中,还应警惕潜伏感染活动。本例患者在MICU期间,出现腺病毒肺炎,经环境采样及病区患者、医护鼻咽拭子检测,均未发现腺病毒,我们推测患者发生腺病毒肺炎为免疫低下时的复燃。腺病毒肺炎是近年来常见的病毒性肺炎的一种,可发生于免疫健全与免疫功能低下的患者,甚至造成重症肺炎[3]。重症感染可应用西多福韦抗病毒治疗[4,5,6]。在儿童患者中,有腺病毒血症诱发噬血细胞综合征的病例报道,而成人中罕见[7]。
本例患者在转出MICU后出现HLH,但用腺病毒感染导致HLH难以解释,在HLH病因的不断求证中,确定了血行播散性肺结核的诊断。回顾之前的IGRA检测为阳性,考虑新发结核病为结核复燃可能。这也提醒我们,在我国这样的结核高流行地区,在免疫缺陷宿主中,要时刻警惕潜伏结核发展为活动性结核病的可能。
本例患者以HLH为结核的表现,给诊断带来较大的困难。对HLH的求因,对结核复燃的高度警惕,和对相关检测技术的熟练运用,是本例成功诊治的关键。结核病的实验室诊断方法包括:抗酸染色、分离培养、PPD实验、IGRA,结核分枝杆菌PCR检测乃至二代测序技术等[8]。播散性结核病可诱发噬血细胞综合征[9]。
此例病人病情非常复杂,先后3次在我院住院,历时4月诊治,多种病原检测方法、病理诊断为该患者的多次病情变化指明了方向。回顾病人险象环生的救治过程,从药物所致骨髓抑制、腺病毒感染、噬血细胞综合征以及最终血行播散型结核病的确诊,循证医学贯穿了整个过程,而缜密的临床思维是破开「乱象」的「利刃」。
参考文献
[1] AZOULAY E, RUSSELL L, VAN DE LOUW A, et al. Diagnosis of severe respiratory infections in immunocompromised patients [J]. Intensive care medicine, 2020, 46(2): 298-314.
[2] 李丽娟, 王金祥, 刘波, et al. 糖皮质激素长期应用宿主合并社区获得性肺炎的临床特征及预后分析 [J]. 2018, 98(10): 6.
[3] CAO B, HUANG G H, PU Z H, et al. Emergence of community-acquired adenovirus type 55 as a cause of community-onset pneumonia [J]. Chest, 2014, 145(1): 79-86.
[4] SUN B, HE H, WANG Z, et al. Emergent severe acute respiratory distress syndrome caused by adenovirus type 55 in immunocompetent adults in 2013: a prospective observational study [J]. Critical care (London, England), 2014, 18(4): 456.
[5] LIU C, NING W W, CHEN Y B, et al. Treatment of a case presenting as critical adenoviral ARDS using Cidofovir with early combinatorial prone ventilation and ECMO [J]. The clinical respiratory journal, 2020,
[6] MOON S M, CHOE J, NA S J, et al. Comparative Study on the Effect of Cidofovir Treatment for Severe Adenovirus Pneumonia [J]. Journal of intensive care medicine, 2021, 36(12): 1436-42.
[7] OTTO W R, BEHRENS E M, TEACHEY D T, et al. Human Adenovirus 7-Associated Hemophagocytic Lymphohistiocytosis-like Illness: Clinical and Virological Characteristics in a Cluster of Five Pediatric Cases [J]. Clin Infect Dis, 2021, 73(7): e1532-e8.
[8] LI Y, JIAO M, LIU Y, et al. Application of Metagenomic Next-Generation Sequencing in Mycobacterium tuberculosis Infection [J]. Frontiers in medicine, 2022, 9(802719.
[9] SHI Y F, SHI X H, ZHANG Y, et al. Disseminated Tuberculosis Associated Hemophagocytic Lymphohistiocytosis in a Pregnant Woman With Evans syndrome: A Case Report and Literature Review [J]. Front Immunol, 2021, 12(676132.
作者简介

刘岩
副主任医师,硕士研究生导师,医学博士,美国访问学者。现就职于烟台毓璜顶医院,感染科医师。临床工作12年,经验丰富,擅长各种疑难复杂重症感染的诊治。担任:山东省重症医学分会POCT亚组 秘书兼委员;山东省大数据研究会 副秘书长;山东省重症感染学会 委员;烟台市感染病学会 委员;欧美同学会感染病分会 委员。主持山东省自然科学基金面上项目1项;发表SCI、中华及核心期刊数篇,主编论著2部。
文字:刘岩(烟台毓璜顶医院)、周海翼、崔晓敬、张祎、张晓岩、曹彬;审校:王一民(中日友好医院 武汉市金银潭医院)
本文转载自订阅号「京港感染论坛」
原链接戳:【肺炎精粹】“临床思维+循证”才是诊治疑难危重肺炎的唯一捷径——一例免疫缺陷宿主重症肺炎成功救治经验分享


