摘要
特发性炎性肌病(idiopathic inflammatory myopathy,IIM)是以四肢近端肌肉慢性炎症为特征性表现的一组异质性疾病。与IIM相关的间质性肺疾病(IIM-associated interstitial lung disease,IIM-ILD)是IIM患者致残和致死的重要原因之一。IIM-ILD患者的起病方式、临床表现,发展过程、治疗反应和疾病预后呈异质性。由于IIM-ILD诊断与病情评估需要多学科共同参与,免疫抑制治疗药物前瞻性研究资料有限,治疗方案的临床选择差异较大,因此亟需制定IIM-ILD诊断和治疗的共识,供临床医师在临床诊治实践中借鉴。中国研究型医院学会呼吸病学专业委员会组织国内从事IIM-ILD基础与临床研究的呼吸病学、风湿免疫学,放射学等多学科的专家,基于现有文献资料,结合专家经验,共同制定本共识。本共识主要对IIM-ILD流行病学、临床特征、诊断与病情评估、治疗药物和治疗方案等方面做了较为系统阐述。经专家讨论和投票,共形成18条推荐意见,其中7条是关于IIM-ILD诊断和评估的推荐意见,11条是关于IIM-ILD治疗药物和方案选择的推荐意见,以期规范化诊断和治疗我国IIM-ILD患者,推动开展相关的临床和基础研究工作。
特发性炎性肌病(idiopathic inflammatory myopathy,IIM),简称肌炎(myositis),是一组以四肢近端肌肉受累和慢性炎症为突出表现的异质性疾病。目前IIM分为:皮肌炎(dermatomyositis,DM)、抗合成酶抗体综合征(antisynthetase syndrome,ASS)、包涵体肌炎(inclusion body myositis,IBM)、免疫介导坏死性肌炎(Immune-mediated necrotizing myopathy,IMNM)和多发性肌炎(polymyositis,PM) [1, 2, 3, 4, 5] 。其中DM和ASS更为常见 [4, 5] ,以往研究中的PM包括了现在分类中的ASS和IMNM。IIM可累及皮肤、肺脏、关节和心脏等多个系统及器官,而间质性肺疾病(interstitial lung disease,ILD)是IIM累及肺脏的最常见临床表现。特发性炎性肌病相关间质性肺疾病(idiopathic inflammatory myopathy-associated interstitial lung disease,IIM-ILD)是IIM患者致残和致死的重要原因 [6, 7, 8] 。
近年来随着肌炎抗体谱的使用和对IIM-ILD认识的提高,在ILD的临床实践中观察到IIM-ILD患者明显增多,但迄今国内外尚无IIM-ILD临床诊断及治疗相关的指南或共识,亟需由IIM-ILD诊疗相关的专家制定IIM-ILD的诊治共识,以规范IIM-ILD的诊断和治疗,改善患者预后,提高本领域的临床和科研水平。为此,中国研究型医院学会呼吸病学专业委员会组织国内呼吸科、风湿免疫科、放射科等多学科的专家,基于国际及我国现有临床证据和专家的诊治经验制定了本共识;同时,本共识提出了IIM-ILD临床诊治和研究中若干尚不明确、有待解决的问题,期望通过建立我国IIM-ILD多学科、多中心合作,开展相关临床和基础研究,积累研究证据,为今后制定诊治指南奠定基础。
一、流行病学
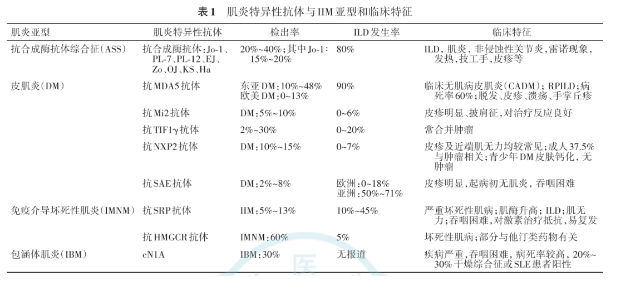
近年荟萃分析显示,人群中IIM-ILD的患病率为0.41%:亚洲、美国和欧洲报道的患病率分别为0.5%、0.23%和0.26%;皮肌炎、肌炎、无肌病皮肌炎中ILD患病率为0.42%、0.35%、0.53% [9, 10, 11, 12, 13, 14, 15]。IIM患者的ILD患病率存在种族,地理分布差异,亚洲人种ILD患病率高于欧美人种,提示遗传和环境因素在IIM-ILD发病机制中具有一定作用。文献报道IIM患者的ILD发生率各不相同,且存在较大差异。成人IIM的ILD发生率在20%~78%之间 [10, 11, 12, 13, 14, 15]。在青少年IIM队列中,ILD发生率低于成年人,为8%~13% [12]。国内尚无人群中IIM-ILD患病率数据。国内学者报道IIM患者中ILD发生率为21.9%~74.8% [9];皮肌炎、肌炎和无肌病皮肌炎中ILD发生率分别为73.6%、55.1%和92.7% [11]。IIM患者的ILD发生率与肌炎特异性抗体存在较强相关性(表1)。抗Jo-1抗体阳性的IIM-ILD发生率为72%~86% [10,14,16];抗黑色素瘤分化相关蛋白(melanoma differentiation-associated gene 5,MDA5)抗体阳性DM患者ILD发生率高达90%以上 [11],且亚洲人群的无肌病皮肌炎患者易出现快速进展性ILD(rapidly progressive interstitial lung disease,RP-ILD) [13,17]。
二、临床表现
大多数IIM-ILD患者呈慢性起病(>3个月)或亚急性起病(1~3个月),部分患者呈急性(<1个月)起病 [6,14, 15, 16]。少数急性起病的患者,在1个月内胸部影像肺间质性病变明显加重,伴进行性呼吸困难和低氧血症,导致急性呼吸衰竭,称为RPILD,尤其以抗MDA5抗体阳性的DM-ILD患者多见 [17]。
IIM-ILD患者临床表现包括IIM和ILD两方面的表现。IIM与ILD的发生、活动程度、严重性可不平行。ILD与IIM可同时发生,ILD亦可在IIM诊断后出现,部分患者则以ILD起病,数月或数年后才被诊断IIM [6,14]。
IIM-ILD患者ILD的临床表现则与其他的ILD类似,主要表现为咳嗽、咳痰,活动后气短,呼吸困难;咯血、胸痛则少见。肺部查体可闻及爆裂音。累及呼吸肌时,可加重呼吸困难;肌炎累及吞咽肌时,可出现吞咽困难和胃食管反流。
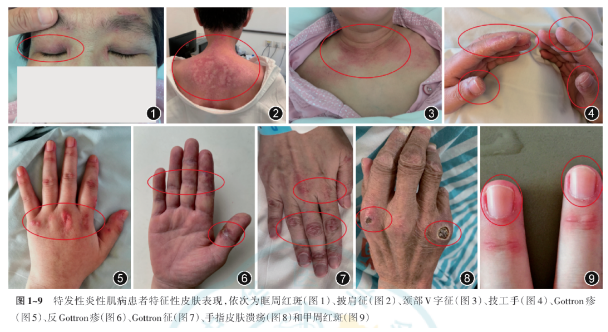
IIM临床表现有对称性近端肌无力、肌痛;各种皮疹(图1~9),如眶周红斑、Gottron疹、Gottron征、披肩征、「V」字征、甲周红斑、皮肤溃疡;雷诺现象、关节肿胀/压痛,技工手,不明原因发热等。对DM有诊断意义的特异性皮疹有眶周红斑、Gottron疹、Gottron征等 [1,4, 5,18]。
在呼吸科就诊的部分IIM-ILD患者,ILD可为其仅有的临床表现 [16],或仅有轻微肌炎,不典型皮疹等IIM相关临床表现,容易漏诊误诊。
三、胸部影像学
胸部HRCT扫描是筛查和诊断IIM-ILD的重要辅助检查。IIM-ILD患者的胸部HRCT表现包括磨玻璃影、实变影、网状影、蜂窝影、不规则线状影,条索影,牵拉性支气管扩张等 [19, 20, 21]。与特发性间质性肺炎(IIP)分型类似,IIM-ILD依据HRCT表现分为不同类型:非特异性间质性肺炎(NSIP)型、机化性肺炎(OP)型、NSIP型与OP型重叠、普通型间质性肺炎(UIP)型、弥漫性肺泡损伤(DAD)型等。HRCT分型与肺组织病理有较好一致性 [10,12];其中NSIP型,NSIP型与OP型重叠,OP型最常见,而UIP型和DAD型少见。HRCT能帮助区别肺部可逆炎症性病变(如NSIP型与OP型)或不可逆纤维化病变(如UIP型),评价肺部病情好转及复发,指导临床治疗 [19, 20, 21]。HRCT表现为NSIP型与OP型的IIM-ILD患者对治疗的反应和预后好于DAD型和UIP型;而IIM-ILD患者HRCT表现为网状影,牵拉性支气管扩张和蜂窝影,提示纤维化病变为主,预计可能对治疗反应有限。抗MDA5抗体阳性DM-ILD患者HRCT表现为类OP型,或下肺胸膜下实变影伴磨玻璃影和网状影,部分患者对治疗反应较差,预后不佳 [21, 22]。胸部HRCT可早期发现IIM-ILD,评估ILD范围、类型、疗效、进展及复发 [15,19, 20, 21];提供与肺部感染、肺泡出血、肿瘤等鉴别诊断线索。
【推荐意见1】对于初诊或疑似IIM-ILD患者,推荐胸部HRCT检查。患者ILD病情恶化时,及时复查胸部HRCT;病情好转或稳定,每隔3~6个月复查胸部HRCT,以监测疾病进展和复发,评估治疗效果。(投票专家30人;赞成27票,反对0票,弃权3票)。
四、肺功能检查
IIM-ILD患者的肺功能检查主要包括用力肺活量(FVC)、肺总量(TLC)及肺一氧化碳弥散量(DLCO)等指标。患者主要表现限制性通气功能障碍和弥散功能下降 [14, 15, 16]。肺功能主要用于IIM-ILD筛查,评估IIM-ILD严重程度,疾病活动性,药物疗效,疾病进展和复发等 [14, 15, 16]。FVC占预计值%≥50%和DLCO占预计值%≥30%为轻中度ILD;FVC占预计值%<50%,DLCO占预计值%<30%为重度ILD [23]。IIM-ILD患者FVC占预计值%较基线值增加≥10%,且DLCO占预计值%相对增加≥15%考虑IIM-ILD改善;FVC占预计值%较基线值相对下降≥10%,或DLCO占预计值%相对下降≥15%,考虑IIM-ILD恶化;FVC下降 ≥5% 与<10%之间,和DLCO 下降≥15%亦有临床意义 [24]。
【推荐意见2】对于初诊或疑似IIM-ILD患者,推荐肺功能检查;治疗后每隔3~6个月,复查肺功能检查,以评估疗效,监测疾病进展和复发等。(投票专家30人,赞成29票,反对0票,弃权1票)。
五、实验室检查
1.常规化验:主要包括血常规、血沉、肝肾功能、C反应蛋白等检查,其中血清肌酸激酶、醛缩酶、转氨酶和乳酸脱氢酶是反映肌肉受累及肌炎活动的生化指标 [18,25]。有条件的医疗机构可检测与IIM-ILD预后相关指标如血清铁蛋白、KL-6、SP-D、SP-A及淋巴细胞亚群等。
2.自身抗体谱:包括抗核抗体(ANA)、抗可提取核抗原抗体(ENA)、类风湿因子(RF)、抗环瓜氨酸肽(CCP)抗体、抗中性粒细胞胞质抗体(ANCA)等,应作为疑诊IIM-ILD的常规检查,有助于IIM与其他特定结缔组织病(CTD)的鉴别诊断 [25, 26]。
3.肌炎自身抗体:肌炎自身抗体分为肌炎特异性自身抗体(myositis specific autoantibody,MSA)和肌炎相关性自身抗体(myositis associated autoantibody,MAA) [26, 27]。MSA与IIM亚型,临床症状、临床表型、并发症、治疗反应和预后密切相关(表1) [5,28, 29, 30, 31, 32, 33, 34, 35]。与IIM-ILD相关MSA主要包括抗合成酶(anti-aminoacyl tRNA synthetases,ARS)抗体与抗MDA5抗体等 [5,27, 28, 29]。抗合成酶(ARS)抗体包括抗Jo-1、PL-7、PL-12、EJ、KS、OJ、Ha、Zo抗体等;IIM-ILD患者常检测到是抗Jo-1抗体。抗ARS抗体阳性的IIM患者常合并有ILD [10,14,27]。抗ARS抗体阳性的IIM患者常出现包括肌炎、ILD、非侵蚀性关节炎、雷诺现象、技工手和发热等系列临床表现,称为抗合成酶抗体综合征(antisynthetase syndrome,ASS) [32];ASS-ILD患者对激素及免疫抑制剂初始治疗反应较好,但肺部慢性炎症持续存在,易复发和缓慢进展 [33]。抗MDA5抗体阳性的DM患者约90%发生ILD [11,13]。部分DM患者肌肉受累轻,甚至无明显肌肉受累表现,既往称为临床无肌病性皮肌炎(Clinically amyopathic dermatomyositis,CADM)。亚洲人抗MDA5抗体阳性的CADM患者易出现RP-ILD,对激素及免疫抑制剂治疗反应差,病死率为50%~80% [17,34, 35, 36]。
MSA是支持IIM诊断的重要血清学指标 [26, 27,32, 33],是与其他CTD进行鉴别诊断的重要参考指标 [18,25];但并不是所有IIM诊断的必要条件。目前对肌炎抗体谱的检测方法有多种 [37],尚无统一的「金标准」,均存在假阳性和假阴性的可能性,部分IIM患者肌炎抗体阴性。因此,在临床实践中需要注意结合患者临床症状、体征等综合判断肌炎抗体检测结果。
【推荐意见3】对于初诊或疑似IIM-ILD的患者,推荐肌炎抗体谱筛查,并由有经验的临床医师根据患者临床表现进行解读和确认。(投票专家30人;赞成30票,反对0票,弃权0票)。
六、肌肉磁共振显像与肌电图
IIM-ILD患者如有典型DM皮疹或ASS皮肤体征,且MSA阳性,一般无需行肌电图、肌肉磁共振等检查 [4,38]。部分诊断不明确IIM-ILD患者,肌肉磁共振、肌电图检查对IIM诊断有一定帮助;肌肉磁共振可指导选择合适的肌肉活检部位。
七、组织活检
1.肺组织活检:IIM-ILD的诊断主要依据临床表现、胸部HRCT、血清肌炎抗体和肺外器官受累的评估,很少需要肺活检组织病理诊断ILD。对于IIM的ILD类型判断主要依据胸部HRCT [19,39]。IIM-ILD不存在特定的病理特征,根据病理改变难以与IIP鉴别。采用肺组织活检对IIM的ILD进行病理分类,不会改变IIM-ILD临床治疗决策 [12,38,40]。但在疑似或需要排除其他肺部疾病,如肺部感染、肺泡出血、恶性肿瘤或药物性肺损伤等,可酌情选择支气管肺泡灌洗(BAL)细胞计数和分类、经支气管镜肺活检、经支气管冷冻肺活检、经皮肺组织穿刺活检、外科肺活检等。进行肺组织活检前,需谨慎评估,权衡患者的获益与风险。
【推荐意见4】对于初诊或疑似IIM-ILD的患者,大多数情况下不建议进行肺组织活检,在需要排除其他肺部疾病,如肺部感染、肺泡出血、恶性肿瘤等,可结合患者病情、意愿以及本医疗机构的条件,酌情选择支气管肺泡灌洗和肺活检方法。(投票专家30人;赞成29票,反对0票,弃权1票)。
2.皮肤及肌肉活检:IIM-ILD患者如有典型DM皮疹或ASS皮肤体征,且MSA阳性,一般无需行皮肤活检及肌肉活检 [4]。对于有典型DM皮疹而MSA阴性的IIM-ILD患者,皮肤活检有助于DM-ILD的诊断。对于仅有肌无力、肌酶升高,而无皮肤表现和MSA阴性的疑似IIM患者,需要行肌肉磁共振、肌电图和肌活检等检查,明确肌炎诊断。
八、诊断
对于临床疑似IIM-ILD患者,应参照ILD患者的临床诊疗路径 [39,41],详细收集患者的临床病史,同时关注IIM相关临床症状和体征的收集 [18,38,40];并进一步安排系列检查:(1)胸部HRCT、肺功能(通气+容量+弥散)检查;(2)血清学检查,除常规血清学,自身抗体谱检测外,应包括肌炎抗体谱、肌酶谱等;(3)必要时,酌情选择肌肉MRI、肌电图、支气管镜、肺活检等检查。建议IIM-ILD临床诊断流程如下(图10)。

IIM-ILD诊断包括IIM和ILD诊断,参照IIM诊断标准 [1, 2, 3, 4, 5,32]和ILD相关共识及指南 [39,41]对疑似IIM-ILD患者分别进行IIM及ILD诊断。IIM-ILD诊断涉及到呼吸科、风湿免疫科、皮肤科等学科的临床医师、放射科医师以及病理科医师(必要时),建议采取多学科专家共同参与多学科讨论(MDD)模式。MDD模式,特别是风湿病专家参与可提高IIM-ILD诊断率,避免侵入性诊断操作 [42]。临床实践和临床研究显示,MDD模式提高了IIM-ILD诊断的敏感度、特异度和准确性,有助于制订合理的治疗方案,使患者获益 [40,42, 43]。
【推荐意见5】对于初诊、疑似、复发或难治性IIM-ILD患者,推荐有条件的医疗机构采取MDD模式诊断IIM-ILD和制定治疗方案。(投票专家30人;赞成30票,反对0票,弃权0票)。
九、治疗
IIM-ILD的治疗尚无国际指南及共识,基于有限的前瞻性临床研究、回顾性观察及专家经验,我们总结了IIM-ILD疾病评估,治疗时机,药物治疗和非药物治疗的现有证据及治疗建议。
1.IIM-ILD评估:对IIM-ILD患者,建议全面评估IIM-ILD患者的病情,包括IIM-ILD患者的疾病活动性、受累脏器的严重程度、是否存在预后不良的危险因素(如急性/亚急性起病,ILD快速进展、抗MDA5抗体阳性、老年、低氧血症、低淋巴细胞血症、铁蛋白、KL-6、C-反应蛋白升高和FVC较低) [7, 8,44, 45],为制定合理的治疗方案、判断预后提供依据;并建议在治疗过程中,密切随诊、判断疗效、动态评估病情变化,及时调整治疗方案。
对ILD评估主要包括:ILD起病形式,进展速度,呼吸困难及咳嗽程度,HRCT病变范围、类型、病变可逆性;氧合指数,肺功能损害程度,伴随疾病,预后不良的危险因素 [38,40,44,46]以及筛查潜在感染和肿瘤等。
【推荐意见6】确诊的IIM-ILD患者治疗前,应对患者的IIM与ILD病情进行全面评估,尤其针对ILD相关的临床症状、肺功能、HRCT及预后不良的危险因素等方面评估。(投票专家30人;赞成22票,反对5票,弃权3票)。
2.治疗时机:启动IIM-ILD治疗时机,需综合患者ILD严重程度、临床过程、肌炎特异性抗体、预后不良相关的危险因素、合并症,结合患者意愿 [45, 46]。建议:(1)慢性起病,有症状的IIM-ILD应开始全身激素治疗,或激素联合免疫抑制剂治疗。(2)对于有症状,急性和亚急性IIM-ILD患者,选择激素联合免疫抑制剂治疗。(3)对于临床无肌病性皮肌炎(CADM)或抗MDA5抗体阳性合并ILD,即使ILD症状轻微,初始治疗应免疫抑制剂联合激素。(4)对IIM患者,其ILD无症状,病变轻,肺功能正常,且无肌炎活动表现,结合患者意愿,可给予密切随访观察;如病情进展则需开始治疗。
3.治疗药物:临床治疗IIM-ILD主要药物有糖皮质激素 [47]、免疫抑制剂、生物制剂、抗纤维化药物等 [40]。其中免疫抑制剂有硫唑嘌呤(AZA) [48]、环磷酰胺(CYC) [49]、甲氨蝶呤(MTX) [50]、霉酚酸酯、环孢素(CsA) [51]、他克莫司 [52]等药物(见表2)。

糖皮质激素(简称激素):通常作为一线药物与各种免疫抑制剂联合治疗IIM-ILD [45, 46, 47]。
对慢性起病的IIM-ILD患者推荐泼尼松初始剂量从0.5~1.0 mg·kg-1·d-1起始(或相等剂量的甲泼尼龙) [40,45, 46, 47],最大日剂量不超过80 mg。激素初始剂量持续4~8周,视患者临床症状、HRCT、肺功能改善情况,逐渐减量,至维持剂量泼尼松5~10 mg/d。激素的起始剂量要根据患者IIM-ILD的严重程度、伴随疾病而定;IIM-ILD患者有控制不佳的糖尿病、严重骨质疏松或胃肠道溃疡、恶性肿瘤等基础疾病,初始激素治疗剂量酌情减少。
对急性起病、严重、快速进展及危重的IIM-ILD患者,建议初始大剂量激素(泼尼松>1.0 mg·kg-1·d-1或相等剂量的甲泼尼龙)联合免疫抑制剂治疗方案;或采用静脉激素冲击剂量 [18,40],并联合免疫抑制剂治疗方案,即每天静脉注射500~1 000 mg甲基泼尼松龙,连续3 d后,过渡到口服泼尼松每天1.0 mg/kg,视病情改善,逐渐减量。
主要不良反应包括:增加体重、高血糖、高血压、骨质疏松症、股骨颈坏死、青光眼、白内障和机会性感染等。
免疫抑制剂:激素联合免疫抑制剂作为IIM-ILD一线治疗方案,是治疗IIM-ILD的基石。在具体选择免疫抑制剂治疗IIM-ILD时,要结合每个患者具体状况,注意排除药物相关禁忌证。
霉酚酸酯:是肌苷单磷酸脱氢酶的抑制剂,抑制鸟苷核苷酸从头合成,控制T细胞和B细胞的生成,并通过减少促纤维化细胞因子来减轻肺部疾病的进展 [53]。霉酚酸酯与激素联合一线治疗IIM-ILD患者,或激素抵抗后加用霉酚酸酯治疗后患者FVC增加,泼尼松用量减少 [48,53, 54]。与硫唑嘌呤和环磷酰胺相比,霉酚酸酯优点是肝肾毒性小,耐受性较好 [5
4]。目前霉酚酸酯与激素联合方案更多用于慢性进展IIM-ILD患者的一线治疗 [40,45,54]。
霉酚酸酯口服剂量为1 000~2 000 mg/d。常见不良反应有胃肠道反应、贫血和白细胞减少、机会性感染、可能诱发肿瘤。此药相对安全,其不良反应可随剂量减少而降低。
钙调磷酸酶抑制剂(calcineurin inhibitor):(1)环孢素:是一种钙调磷酸酶抑制剂,能抑制IL-2介导的CD4+T细胞活化,抑制IL-2和其他细胞因子的转录。在一项前瞻性、开放标签随机临床试验中,激素+环孢素联合一线治疗IIM-ILD患者,52周时无进展生存率为71%,生存率为93%;激素+环孢素一线治疗ASS-ILD患者的有效率达96.8% [55]。环孢素用于激素耐药抗Jo-1抗体阳性的ILD患者或难治性ASS-ILD患者治疗,能改善或稳定患者FVC,减少患者激素剂量 [56]。回顾性研究显示,环孢素与激素和环磷酰胺联合方案治疗DM相关急性、亚急性间质性肺炎,部分患者的肺功能和影像改善或稳定,患者生存率较常规治疗历史对照组提高 [57, 58]。环孢素剂量通常从每天2~5 mg/kg体重开始给药,分2次给药。根据环孢素血清谷浓度,调整剂量,维持血清谷浓度100~200 μg/L [51,55]。要密切监测患者的肾功能,当肌酐水平升高>30%时,停止使用环孢素。常见的不良反应包括高血压、肾功能损害、胃肠道反应、继发感染等。(2)他克莫司(tacrolimus):是第二代钙调磷酸酶抑制剂,又名FK-506,对IL-2介导的CD4+ T细胞活化抑制作用较环孢素高。前瞻性随机临床试验显示,他克莫司与激素联合一线治疗IIM-ILD,患者52周时无进展生存率为87% [55]。在单臂、多中心前瞻性临床试验中,他克莫司和激素联合治疗IIM-ILD患者,52周生存率为88.0%,52周无进展生存率为76.4% [59]。Meta分析显示,经他克莫司治疗,难治性IIM-ILD患者FVC和DLCO改善或稳定分别为89.3%和81.3% [60]。多中心前瞻性临床试验显示,抗MDA5抗体阳性的DM-ILD患者他克莫司与激素和静脉环磷酰胺联合治疗,可提高MDA5抗体阳性IIM-ILD患者的6个月生存率 [61]。
他克莫司和环孢素同为钙调磷酸酶抑制剂,均可分别与激素联合作为一线、二线及难治性IIM-ILD的治疗方案。环孢素或他克莫司的选择,主要取决于药物安全性,患者个体反应,临床医生的经验,使用过程中均要监测血药浓度。有学者认为,他克莫司可用于经其他免疫抑制剂治疗无效的难治性IIM-ILD患者 [40,50]。
他克莫司剂量为1~3 mg/d,2次/d;需要根据血清谷浓度调整剂量,维持谷浓度5~10 μg/L。常见的不良反应为感染、肾毒性、低镁血症、高血压、肝毒性、恶性肿瘤等。
环磷酰胺(cyclophosphamide)是一种烷化剂,对T细胞具有多重作用,可导致其免疫记忆受损,是在CTD-ILD中唯一有随机、安慰剂对照临床研究数据的免疫抑制剂。但环磷酰胺治疗IIM-ILD多为小样本回顾性临床研究 [49,62, 63]。在系统综述中,经环磷酰胺治疗后,57% IIM-ILD患者的VC和64%患者的DLCO明显改善 [62]。静脉环磷酰胺冲击治疗进展性IIM-ILD患者,大约一半患者的FVC和HRCT评分获得改善 [63]。经环磷酰胺冲击联合环孢素和激素治疗的皮肌炎相关急性、亚急性间质性肺炎患者的生存率高于接受常规治疗的患者 [58]。一项多中心前瞻性环磷酰胺静脉冲击与激素和他克莫司联合治疗抗MDA5抗体阳性DM-ILD的研究显示,与逐步升级治疗组相比,初始三药联合治疗组患者6个月存活率有明显差异 [61]。
治疗IIM-ILD环磷酰胺静脉剂量0.3~1.0 g/m2体表面积或10~30 mg/kg体重,每2周或每月1次,与激素联合6~12个月。口服环磷酰胺剂量范围为1~2.5 mg/kg体重/d [48]。最常见的不良反应是轻度至中度恶心呕吐、白细胞减少,影响生育能力,机会性感染;出血性膀胱炎和恶性肿瘤少见。考虑其潜在毒性,目前国外学者倾向用于治疗快速进展、严重、难治性IIM-ILD患者 [39,58,63]。
硫唑嘌呤(azathioprine,AZA)是6-巯基嘌呤的衍生物,通过抑制嘌呤合成,抑制DNA、RNA及蛋白质合成,从而抑制淋巴细胞的增殖。对激素抵抗的IIM-ILD患者加用硫唑嘌呤治疗后,54%患者FVC及 DLCO增加,呼吸困难减轻,泼尼松剂量减少 [48];硫唑嘌呤和激素联合治疗抗Jo-1抗体阳性IIM-ILD患者有效率为50% [64]。硫唑嘌呤口服剂量为2~3 mg·kg-1·d-1。有条件医疗机构可在使用硫唑嘌呤前,检测硫唑嘌呤甲基转移酶(TPMT)的活性水平。硫唑嘌呤使用过程中,应定期监测血常规,肝功能等,不良反应包括白细胞减少、机会性感染、肝酶升高和皮肤癌等。
甲氨蝶呤(methotrexate,MTX)是一种叶酸拮抗剂,通过抑制二氢叶酸还原酶,阻碍DNA合成,影响T细胞生成和活化。甲氨蝶呤通常用于治疗炎症性关节炎和肌炎。系列病例报道中,26%~31%的IIM-ILD患者接受过MTX治疗 [40,50],但有关MTX与激素联合治疗IIM-ILD的有效性及安全性数据非常有限。一项回顾性研究中,有17例IIM-ILD患者接受MTX和激素联合治疗,临床反应率为47%(8/17) [50]。目前MTX通常不作为IIM-ILD的常规治疗药物。
生物制剂:(1)利妥昔单抗(rituximab- anti-CD20 antibody,RTX)是一种针对B细胞CD20抗原蛋白的单克隆抗体,可使B细胞耗竭长达6个月。很少有报道将利妥昔单抗与传统免疫抑制剂联合作为IIM-ILD患者的一线治疗,主要用于治疗难治性抗Jo-1抗体阳性或抗MDA5抗体阳性的IIM-ILD患者。利妥昔单抗治疗肌炎随机对照试验结果表明,抗Jo-1抗体阳可预测难治性IIM患者对利妥昔单抗治疗有较好的治疗反应 [65]。反复难治性或进展性ASS-ILD患者经利妥昔单抗治疗后,随访1年和3年,多数患者肺功能和CT影像稳定或改善 [66, 67]。文献总结报道28例抗MDA5抗体阳性RP-ILD利妥昔单抗治疗,其中大部分患者为对常规治疗耐药的难治性病例,经利妥昔单抗治疗后,有15例(53%)对利妥昔单抗有治疗反应 [68]。利妥昔单抗用法为静脉注射1 000 mg/次,间隔2周,每个疗程共2次。根据病情可在6~12个月后接受第2个疗程。不良事件主要包括感染,皮疹,心律失常等。(2)其他生物制剂:病例报道显示,巴利昔单抗、托珠单抗等其他生物制剂对抗MDA-5抗体阳性难治性RP-ILD-DM部分患者有一定效果 [69, 70]。
免疫球蛋白:静脉输注免疫球蛋白(IVIg)不属于免疫抑制治疗。其用于治疗IIM-ILD的数据仅限于个案报告和病例系列报道。IVIg可考虑用于难治性、严重或快速进展的IIM-ILD,或对免疫抑制剂有明显禁忌证的IIM-ILD患者 [71]。IVIg用法为每天0.4 g/kg体重,每个月用5 d,连续用3~6个月。不良反应有头痛、发热、疲劳、恶心、心动过速和过敏。
JAK抑制剂:托法替布(tofacitinib,TOF)是一种Janus激酶抑制剂,可阻断多种细胞因子的信号传导,包括干扰素和IL-6。国内的单臂开放标签前瞻性临床试验中,对病程<3个月、FVC占预计值%>50%的抗MDA5抗体阳性DM-ILD患者,给予托法替布(10 mg/d)早期联合激素治疗,6个月生存率高于历史对照组 [72]。对大剂量激素、环孢素和环磷酰胺三联治疗无效的难治性抗MDA5抗体阳性DM-ILD患者,加用托法替布(10 mg/d)治疗后,5例的患者中有3例治疗反应良好并存活;而未接受托法替布治疗的6例患者均死亡 [73]。这些结果显示JAK抑制剂是一种新的潜在早期抗MDA5阳性DM-ILD和难治性RPILD的治疗方法,需要在更大样本的新发病例或难治性病例的随机对照临床试验中进一步证实。
托法替布主要不良反应是感染,特别是病毒感染;接受托法替布治疗的患者的巨细胞病毒再激活率为100%和带状疱疹感染率为60%。
4. IIM-ILD治疗方案:IIM-ILD患者临床病程,对治疗反应及临床预后存在相当大的异质性。因此,IIM-ILD患者治疗应早期、规范、个体化,多学科参与制定治疗策略和治疗方案,使患者获得最佳的症状改善,肺功能水平恢复到接近基线,维持更长时间的疾病缓解或稳定。
初始治疗策略制定和治疗方案选择要综合考虑IIM-ILD患者ILD起病形式(急性/亚急性或慢性起病)、ILD严重程度、肺部病变可逆性、MSA、预后不良的危险因素 [18,31,44, 45]。基于回顾性研究,病例系列、有限的前瞻性随机临床试验,结合专家意见 [18,40,45, 46],对IIM-ILD患者处理流程和药物治疗方案选择(图11)建议如下。

IIM-ILD初始治疗:激素是治疗IIM-ILD患者的基础药物。回顾性观察结果显示,有47%~48%的IIM-ILD患者对激素单药治疗无效 [74, 75],或在单用激素治疗后疾病进展 [48,56],激素单药治疗IIM-ILD复发较高 [76, 77, 78, 79, 80]。激素和免疫抑制剂早期联合治疗,对IIM-ILD生存有益 [78, 79]。虽然无随机安慰剂对照临床试验,回顾性研究及大多数专家支持初始使用各种免疫抑制剂与激素联合用于IIM-ILD患者初始治疗,可更好地控制疾病,减少激素用量,减少疾病复发 [40,45,49]。
激素联合各种免疫抑制剂包括环磷酰胺、硫唑嘌呤、霉酚酸酯、他克莫司、环孢素等 [38,48, 49,51, 52, 53],均用于IIM-ILD患者初始治疗。但前瞻性或随机对照试验指导医生IIM-ILD免疫抑制剂选择证据有限。一项回顾性观察研究比较了霉酚酸酯、环磷酰胺、硫唑嘌呤等药物对IIM-ILD患者的疗效,各药物对改善患者肺功能和减少激素用量的效果相似 [48]。一项单中心回顾性研究观察到,轻度至中度肺功能损害的IIM-ILD患者经硫唑嘌呤或霉酚酸酯治疗,均能改善患者FVC,减少患者泼尼松用量 [54]。前瞻性随机对照试验及回顾性研究显示,激素联合他克莫司或环孢素治疗IIM-ILD效果相当 [55,77]。对于IIM相关急性、亚急性间质性肺炎患者,激素、环孢素和静脉环磷酰胺冲击三药联合治疗,1/2患者存活 [58]。
IIM-ILD患者可表现为RP-ILD,是IIM患者预后不良的危险因素。小样本病例系列及个案报道静脉激素冲击联合免疫抑制剂治疗严重急性呼吸衰竭及RP-ILD的IIM患者,部分患者有效 [58,81]。对于IIM患者的RP-ILD治疗,部分专家仍然建议酌情选择静脉激素冲击剂量联合免疫抑制剂治疗方案 [18,40,45]。
慢性起病无肺外表现的IIM-ILD患者是否需要治疗,目前缺乏证据,多数专家倾向对无ILD症状的IIM患者,ILD稳定,与患者共同讨论决策,可选择每3~6个月随访观察;如病情进展则开始治疗。
基于回顾性观察及有限的前瞻性随机对照试验 [48,54, 55,59],IIM-ILD初始治疗的免疫抑制剂选择,需综合ILD严重程度,起病形式,药物安全性及临床医生的经验等。
【推荐意见7】对于初治的IIM-ILD患者,推荐大多数情况下给予激素联合免疫抑制剂治疗方案。(投票专家30人;赞成28票,反对0票,弃权2票)。
【推荐意见8】初治的慢性、轻-中度IIM-ILD患者,推荐激素与霉酚酸酯或硫唑嘌呤联合治疗方案。(投票专家30人;赞成30票,反对0票,弃权0票)。
【推荐意见9】初治的急性、重度IIM-ILD患者,推荐大剂量激素与钙调磷酸酶抑制剂(环孢素或他克莫司)或环磷酰胺等免疫抑制剂联合治疗方案。(投票专家30人;赞成27票,反对2票,弃权1票)。
ASS-ILD治疗:ASS-ILD治疗方案的选择,主要依据ILD起病形式,严重程度,胸部CT(病变可逆性),肺外症状,药物安全性等综合考虑。既往回顾性临床研究提示,激素单药治疗ASS-ILD有效率为50%~90% [14],但激素单药治疗ASS-ILD患者复发较高 [76, 77],部分患者激素耐药以及长期使用激素耐受性差 [48
,56]。多数学者倾向初始治疗激素联合免疫抑制剂。激素联合钙调磷酸酶抑制剂治疗ASS-ILD患者2年无进展生存率高于激素单药治疗患者 [80]。在回顾性病例系列和队列研究中,激素联合霉酚酸脂、硫唑嘌呤、环磷酰胺、他克莫司、环孢素等治疗方案均在临床实践中用于ASS-ILD患者初始治疗,但没有随机对照试验证明其中一种药物优越性。一项单中心硫唑嘌呤或霉酚酸酯治疗轻度至中度肺功能损害的IIM-ILD患者回顾性研究(其中2/3为ASS-ILD患者)观察到,治疗后患者FVC改善,泼尼松用量减少,患者对霉酚酸酯耐受性好于硫唑嘌呤 [54]。当ASS-ILD有其他肌肉外特点时,如炎症性关节炎选择硫唑嘌呤,皮肤受累选择霉酚酸酯 [31,33]。小样本前瞻性随机对照试验及回顾性研究显示,激素联合他克莫司或环孢素治疗ASS-ILD效果相当 [55,77]。对于快速进展及危重ASS-ILD患者,病例系列及个案报道静脉激素冲击联合免疫抑制剂治疗,大部分患者有效 [81]。
【推荐意见10】慢性起病、轻至中度ASS-ILD初治患者,建议激素联合霉酚酸酯或硫唑嘌呤治疗方案。(投票专家30人;赞成30票,反对0票,弃权0票)。
【推荐意见11】对于急性起病、重度ASS-ILD初治患者,选择大剂量激素联合环磷酰胺或钙调磷酸酶抑制剂(环孢素或他克莫司)治疗方案。(投票专家30人;赞成29票,反对1票,弃权0票)。
【推荐意见12】对于快速进展及危重ASS-ILD患者,酌情选择激素冲击剂量联合环磷酰胺,加或不加钙调磷酸酶抑制剂(环孢素或他克莫司)治疗方案。(投票专家30人;赞成24票,反对2票,弃权4票)。
抗MDA5抗体阳性DM-ILD治疗:目前抗MDA5抗体阳性DM-ILD的主要治疗方案是激素联合免疫抑制剂 [31,82]。日本的多中心前瞻性研究纳入29例抗MDA5+DM-ILD患者,给予泼尼松(1.0 mg·kg-1·d-1)联合他克莫司和静脉注射环磷酰胺治疗,患者的6个月生存率明显高于从大剂量激素开始逐步添加其他免疫抑制剂的历史对照组患者(89%比33%) [61]。另一项多中心前瞻性随机临床研究的亚组分析显示,抗MDA5+DM-ILD患者激素联合他克莫司组52周时无进展生存率为63%,激素联合环孢素组为40% [55]。病例系列报道,大剂量激素联合霉酚酸酯亦用于抗MDA5+DM-ILD患者初始治疗及对他克莫司耐药的患者治疗 [83]。
抗MDA5抗体+RP-ILD-DM患者对激素联合免疫抑制剂治疗反应较差,病死率较高 [35, 36],缺乏有效的治疗方案。几项回顾性研究比较了激素+钙调磷酸酶抑制剂和环磷酰胺三药联合治疗与激素+钙调磷酸酶抑制剂或激素+环磷酰胺二药联合治疗抗MDA5抗体+RP-ILD效果,结果并不一致 [84, 85, 86]。近年有关MDA5抗体+RP-ILD处理的西班牙专家组共识中,推荐对MDA5抗体+RP-ILD患者选择激素+钙调磷酸酶抑制剂二药联合疗法;或激素+钙调磷酸酶拮抗剂和静脉注射环磷酰胺三药联合疗法 [87]。当钙调磷酸酶抑制剂不可用时,可考虑霉酚酸酯替代 [84]。
鉴于现有抗MDA5抗体+DM-ILD的主要证据为回顾性研究,仅有少数小样本前瞻性开放标签临床试验;抗MDA5抗体阳性DM-ILD患者治疗方案的选择取决于患者病情和医生的经验。
【推荐意见13】对于初治的抗MDA-5抗体阳性DM-ILD患者,建议依据ILD起病形式、严重程度,酌情选择激素与钙调磷酸酶抑制剂(如钙调磷酸酶抑制剂不适用,选择霉酚酸酯)或环磷酰胺等免疫抑制剂的二联或三联治疗方案。(投票专家30人;赞成24票,反对2票,弃权4票)。
复发和难治性IIM-ILD处理:(1)IIM-ILD复发处理。部分IIM-ILD患者初始治疗ILD改善,但在激素减量,或停用后出现病情复发,甚至多次复发,发展为进展性肺纤维化 [6,16,33]。其中,ASS-ILD患者激素减量,病情复发率较高 [33,76, 77]。对于IIM-ILD复发患者,建议再次评估患者是否有导致复发的其他可能原因,如合并肺部感染、药物性肺损伤、呼吸肌无力等。对于IIM-ILD复发治疗:增加激素剂量,维持原有免疫抑制剂 [76],或更换其他免疫抑制剂 [39],或增加一种免疫抑制剂 [39,76]。经免疫抑制剂转换,或增加免疫抑制剂治疗仍然无效,考虑选择利妥昔单抗治疗 [66, 67]、静脉注射免疫球蛋白(IVIg)等 [71]。回顾性研究显示对常规免疫抑制治疗耐药,反复复发或进展ASS-ILD患者经利妥昔单抗治疗后,多数患者肺功能和CT影像稳定或改善 [66, 67]。
【推荐意见14】对于IIM-ILD患者,ILD复发,在排除感染等其他因素后,建议酌情增加激素剂量;或更换免疫抑制剂种类,或增加一种免疫抑制剂等治疗。对反复复发或进展性抗ASS-ILD患者,酌情选择利妥昔单抗治疗。(投票专家30人;赞成,28票,反对0票,弃权2票)。
难治性IIM-ILD处理:IIM-ILD患者经激素联合1种及1种以上免疫抑制剂治疗后,ILD仍然进展,为难治性IIM-ILD。在调整治疗前,建议再次详细评估,确定患者是否有导致病情进展的其他可能原因,如合并肺部感染、药物性肺损伤、呼吸肌无力等。对难治性IIM-ILD治疗方案调整包括:更换不同的免疫抑制剂;或增加一种免疫抑制剂 [50,56,60];或选择其他挽救性疗法:如利妥昔单抗、托法替布、静脉注射免疫球蛋白、血浆置换 [39,66,82]。
【推荐意见15】对于难治性IIM-ILD患者,排除感染等其他原因后,建议更换不同免疫抑制剂;或增加一种免疫抑制剂;或酌情选择其他替代方案:如利妥昔单抗、静脉注射免疫球蛋白(IVIg)等。(投票专家30人;赞成28票,反对0票,弃权2票)。
5.随访及疗程:IIM-ILD患者初始治疗1个月后,应对患者临床症状(如呼吸困难、咳嗽、皮疹及肌力等)、HRCT和肺功能进行复查,评估患者对前期治疗的反应,监测相关药物不良反应。如果改善,激素逐步减量,维持免疫抑制剂治疗;适当延长复查间隔时间,每隔3~6个月再评估,根据治疗反应继续调整治疗。患者FVC下降超过10%或DLCO下降超过15%,临床症状恶化或HRCT显示病变范围增加,提示IIM-ILD治疗失败和疾病进展。应每隔2至4周,或更频繁地评估患者对治疗的反应及病情变化。
IIM-ILD激素和免疫抑制剂治疗疗程目前没有共识。多数IIM-ILD患者需要长期免疫抑制治疗。ASS-ILD患者在激素减量,停用激素及免疫抑制剂治疗后,复发率较高 [76, 77],应定期随访,及时发现和处理。
6. 抗纤维化治疗:部分IIM-ILD患者肺纤维化,经激素联合免疫抑制剂的治疗,仍然发展为进展性肺纤维化表型 [33,77]。IIM-ILD患者如在治疗的24个月内,患者FVC占预计值%较基线值相对下降≥10%;或FVC占预计值%较基线值相对下降≥5%,且DLCO占预计值%相对下降≥15%;或FVC占预计值%较基线值相对下降≥5%,且HRCT示肺纤维化加重;或FVC占预计值%较基线值相对下降≥5%,且呼吸症状恶化,或呼吸症状持续恶化,且HRCT示肺纤维化加重;在排除其他原因后,判断为进展性肺纤维化表型 [86]。RCT结果表明,尼达尼布可以延缓具有进展性肺纤维化表型ILD的肺功能下降,减少急性加重频率,延长无进展生存,从而降低病死率 [88]。吡非尼酮具有延缓进展性肺纤维化表型ILD,未分类的进展性间质性肺疾病患者肺功能下降的速度 [89, 90]。
【推荐意见16】对于具有进展性肺纤维化表型的IIM-ILD患者,推荐在激素联合免疫抑制剂治疗基础上,加用抗肺纤维化药物(如尼达尼布或吡非尼酮)。(投票专家30人;赞成30票,反对0票,弃权0票)。
7. 非药物治疗:IIM-ILD患者除药物治疗外,非药物治疗方法有助于减轻IIM-ILD症状,改善及提高患者生活质量。建议对有静息或活动后低氧血症患者进行氧疗或移动性氧疗;对能耐受的患者,运动训练对肌肉组织和功能恢复有益 [91]。通过肺康复治疗改善呼吸困难、抑郁、焦虑和生活质量 [92]。建议患者每年接种流感和肺炎疫苗。预防机会性肺部感染(如耶氏肺孢子菌)。根据美国风湿病学会的建议对长期使用泼尼松的患者进行骨保护,以避免椎体压缩性骨折 [93]。
【推荐意见17】建议IIM-ILD患者酌情选择运动训练,肺康复等非药物治疗方法,减轻症状,改善及提高活质量。(投票专家30人;赞成30票,反对0票,弃权0票)。
8.其他治疗方法:(1)血浆置换:治疗性血浆置换(therapeutic plasma exchange,TPE)是一种血液纯化方法,可去除循环细胞因子、免疫复合物、免疫球蛋白和补体成分。文献报道14例难治性抗MDA5抗体阳性RP-ILD患者,经血浆置换挽救性治疗后,9例存活,5例死亡 [94, 95]。(2)肺移植:有病例系列和个案报道,肺移植用于治疗无反应的难治性IIM-ILD患者及抗MDA5抗体难治性RP-ILD患者。抗MDA5抗体阳性RP-ILD患者诊断后,宜早考虑肺移植作为一种治疗选择 [68,84]。
十、并发症及处理
纵隔气肿:IIM-ILD患者纵隔气肿的发生率约为8.3%~11.8% [96, 97, 98],主要表现为呼吸困难加重、颈部或面部肿胀、皮下气肿、颈部疼痛和咳嗽等。纵隔气肿主要发生在DM-ILD和抗MDA5抗体阳性DM-ILD患者,并可发生在DM诊断之前,是DM预后不良危险因素。纵隔气肿的治疗包括卧床休息,氧疗,相关气胸胸腔引流,以及肌炎和IIM-ILD药物治疗。
肺部感染:吸入性肺炎是肌炎患者,常见的感染,发生率为7%~26%,主要发生在确诊后第1年内,可能与患者食管受累、通气功能不全等相关 [38]。其次,激素及免疫抑制剂联合治疗IIM-ILD患者容易合并机会性感染(如肺结核、肺孢子菌、白色念珠菌和曲霉等),是导致IIM-ILD患者死亡重要原因之一 [6,8],需要注意预防,及时发现及处理 [38,45]。
恶性肿瘤:IIM容易并发恶性肿瘤,大约1/4的IIM患者在发病前或发病后3年内罹患恶性肿瘤 [99, 100]。恶性肿瘤是成年人IIM患者死亡的主要原因之一 [9,101, 102]。系统性综述和荟萃分析结果表明,皮肌炎、高龄、男性、伴吞咽困难、皮肤溃疡以及抗TIF1γ抗体阳性的IIM患者,发生恶性肿瘤风险增高 [102]。IIM-ILD患者发生恶性肿瘤风险低于IIM无ILD患者 [9,103],对IIM-ILD患者应酌情进行恶性肿瘤筛查。
【推荐意见18】对于已诊断或疑似IIM-ILD的患者,建议酌情进行恶性肿瘤的筛查。(投票专家30人;赞成29票,反对1票,弃权0票)。
十一、研究方向
共识专家组认为,在IIM-ILD临床诊治和研究中存在诸多尚不明确、有待解决的问题,应建立全国多中心、多学科合作基础上的IIM-ILD前瞻性队列注册登记数据,解决以下重要临床问题:(1)前瞻性随机的临床对照试验,确定哪种免疫抑制剂与激素联合最适合IIM-ILD患者的初始治疗或长期维持治疗;(2)进行基于MSA分层特别是抗MDA5抗体阳性或抗ARS抗体阳性的IIM-ILD患者的前瞻性临床试验,为MSA临床表型循证治疗提供证据;(3)评估生物标志物,如 KL-6、SP-A、SP-D、铁蛋白等在IIM-ILD早期筛查、评估病情、疗效及预后判断中地位;(4)探索难治性RP-IIM-ILD病例的治疗方案,以挽救其生命;(5)进一步研究疾病的病理生理学机制,探索和确定IIM-ILD患者治疗新靶点,制定更好的治疗策略。
执笔人:赵转华、叶俏、黄慧、陈智勇、叶霜、王国春、徐作军、蔡后荣
共识制定讨论专家名单(按姓名首字母排序):蔡后荣(南京鼓楼医院呼吸与危重症医学科);陈碧(徐州医科大学附属医院呼吸与危重症医学科);陈娟(宁夏医科大学附属医院呼吸与危重症医学科);陈起航(北京医院放射科);陈智勇(上海市第六人民医院风湿免疫科);程真顺(武汉大学中南医院呼吸与危重症医学科);代静泓(南京鼓楼医院呼吸与危重症医学科);黄慧(中国医学科学院北京协和医学院北京协和医院呼吸与危重症医学科);蒋捍东(上海交通大学医学院附属仁济医院呼吸与危重症医学科);金洪(四川大学华西医院呼吸与危重症医学科);李慧(中山大学附属第七医院呼吸与危重症医学科);李惠萍(同济大学附属上海市肺科医院呼吸与危重症医学科);李梦涛(中国医学科学院北京协和医学院北京协和医院风湿免疫科);罗群(广州医科大学附属第一医院呼吸与危重症医学科);马万里(华中科技大学同济医学院附属协和医院呼吸与危重症医学科);孟婕(中南大学湘雅三医院呼吸与危重症医学科);孟莹(南方医科大学南方医院呼吸与危重症医学科);彭红(中南大学湘雅二医院呼吸与危重症医学科);邱婷(浙江大学医学院附属邵逸夫医院呼吸与危重症医学科);饶珊珊(贵州省人民医院呼吸与危重症医学科);谈文峰(南京医科大学附属第一医院风湿免疫科);王国春(中日友好医院风湿免疫科);王迁(中国医学科学院北京协和医学院北京协和医院风湿免疫科);魏路清(天津北辰医院呼吸与危重症医学科);吴婵媛(中国医学科学院北京协和医学院北京协和医院风湿免疫科);吴华香(浙江大学医学院附属第二医院风湿免疫科);徐作军(中国医学科学院北京协和医学院北京协和医院呼吸与危重症医学科);叶俏(首都医科大学附属北京朝阳医院北京呼吸疾病研究所职业病与中毒医学科);叶霜(上海交通大学医学院附属仁济医院风湿免疫科);于文成(青岛大学附属医院呼吸与危重症医学科);张惠兰(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);赵铁梅(解放军总医院呼吸与危重症医学科);赵转华(太原市中心医院呼吸与危重症医学科);郑金旭(江苏大学附属医院呼吸与危重症医学科)
参考文献(略)
作者:中国研究型医院学会呼吸病学专业委员会
通信作者:蔡后荣,南京鼓楼医院呼吸与危重症医学科;徐作军,中国医学科学院北京协和医院呼吸与危重症医学科
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【诊疗方案】特发性炎性肌病相关间质性肺疾病诊断和治疗中国专家共识
引用本文: 中国研究型医院学会呼吸病学专业委员会. 特发性炎性肌病相关间质性肺疾病诊断和治疗中国专家共识 [J] . 中华结核和呼吸杂志, 2022, 45(7) : 635-650. DOI: 10.3760/cma.j.cn112147-20220108-00025.


