
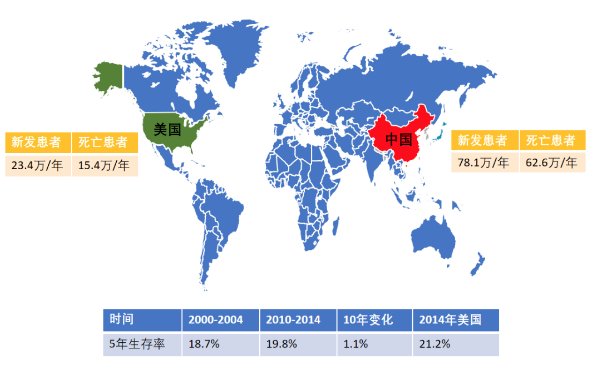
肺癌是我国乃至全世界发病率和死亡率第一的癌症。以美国为例,每年新发患者为23.4万,死亡患者为15.4万;我国每年新发患者大概统计数据目前为78.1万,死亡患者为62.6万。从5年生存率的时间表可见,2000年到2004年,5年生存率为18.7%,2010年到2014年,5年生存率为19.8%。
从「分地区数据」和「性别数据」看中国肺癌特点

中国肺癌的特点,分地区数据看,发病人数最高的是东部地区,同样也是死亡人数最高的地区。可能与该地区医疗资源丰富,人群对肿瘤筛查和治疗较为重视,以及可能的人口老龄化最为严重等等相关因素有关系。我国东部地区主要指京津冀地区,辽宁、上海、江苏、浙江、福建、山东、广东、海南这11个省(市)。这是分布的总体情况。
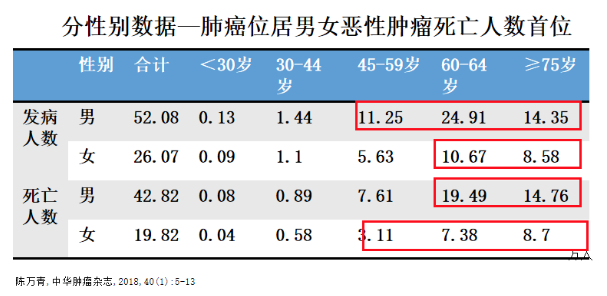
如果按照分性别数据看,肺癌位居男女恶性肿瘤死亡人数首位的年龄段,男性≥45岁发病人数最高,女性≥60岁发病人数最高;男性≥60岁死亡人数最高,女性≥45岁死亡人数最高。这是按照发病和死亡人数年龄段来进行的大致划分。
光动力治疗(PDT)目前主要是应用于早期中央型肺癌的根治治疗和早期周围性肺癌的根治治疗
肺癌目前的治疗情况,随着诊断的早晚发生了一些明显改变。过去我国的肺癌一旦发现确诊以后,基本上属于中晚期,但近年来随着不断推动肺癌早筛早诊方案,因此早期发现肿瘤的案例越来越多,治疗方案也发生了一些改变。
目前针对早期肿瘤,比如I-II期和多数IIIA期的肿瘤,在保证
1.患者身体机能较好;2.早期患者。这两大基本前提下,主要以手术治疗为主;对于中晚期肿瘤,以放/化疗相互结合一起治疗。这部分主要针对于
1.范围广,无针对性;2.可和手术结合治疗;3.副作用较大。同时近年来发展的靶向/免疫治疗,根据基因突变位点针对性治疗,也取得了良好效果。对于一些局部的治疗,比如气管的肿瘤,气管内的原发瘤或者转移瘤等等,这类局部性肿瘤,很多则采取微创消融技术,
1.创伤面小,患者群广;2.可和多种方案联用。它对于气道阻塞或者局部一些肿瘤也能起到好的效果。
PDT(光动力疗法)是目前较为先进的针对局部肿瘤的微创消融技术,它有几大好处: 1.选择性好;2.肿瘤消除彻底;3.协同作用。它可以和其他的方法,比如手术放化疗,靶向、免疫或者其他消融技术相结合,能起到协同作用;4.术后出血情况相对比较少,即并发症、大出血的相对较少;5.不良反应轻微。因此,PDT(光动力疗法)是一种创伤比较小,容易推广应用的局部治疗的一个微创方法。
PDT(光动力疗法)目前可联合哪些现有的治疗方案合并进行治疗肺癌?
一、PDT+手术。
对某些气管内肿瘤,尤其对气管内的原发肿瘤,生长比较大,阻塞比较严重,范围比较大的,就可以采取光动力治疗。治疗以后,1.缩小手术范围;2.重获手术适应证。也就是可以再结合手术,让患者重新获得手术的机会。
二、PDT+放/化疗。1.增加放化疗的敏感性;2.协同新辅助。
三、PDT+靶向药物/免疫。这种方式可即刻解决症状,为患者赢得治疗「时间窗」。
四、PDT+消融。比如冷冻,冷消融或热消融,氩气刀、电刀,可与提高冷冻的这些办法相结合,可使气道内的肿瘤达到比较好的切除效果。甚至彻底根除肿瘤,大出血风险低。
五、PDT+支架。较严重的气道狭窄,在没有机会得到镜下快速治疗的情况下,病人一旦发生窒息可能危及生命,在这种情况下我们可以使用支架,支架使用以后改善通气,再使用光动力进行治疗。以此可能提高患者生存质量。
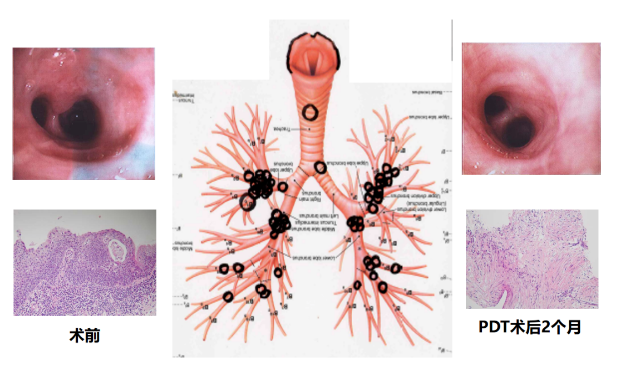
关于PDT治疗,目前主要是应用于两方面:一是早期中央型肺癌的根治治疗;二是早期周围性肺癌的根治治疗。但是,对于早期周围性肺癌的根治治疗,目前还没有得到广泛应用,还在试行阶段,有待进一步探索。
NCCN指南对于PDT(光动力治疗)的推荐类别/级别越来越高
对于PDT的发展情况。中华人民共和国国家卫生健康委员会发布的2018年版《原发性肺癌诊疗规范》中提到:1.PDT用于不能手术和拒绝手术的中央型气道狭窄患者的治疗;2.PDT用于管壁浸润型治疗(一般在切除腔内肿瘤后)。这里所指的意思是比如说和其他的相融办法相结合,消除肿瘤以后再共同治疗。
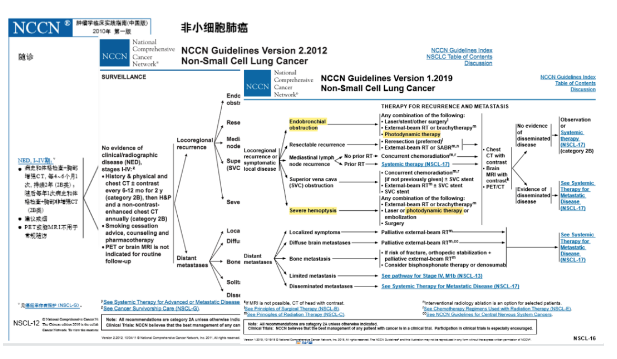
再看NCCN指南的变迁。2010年版,是可以用于局部复发的,以及气管阻塞和严重咯血的,但是没有推荐级别;到2012.V2版,规定可用于局部复发的,以及气管阻塞和严重咯血的,作为2A类推荐;到2019.V1版,规定可用于局部复发或者有局部症状,以及气管阻塞和严重咯血的,作为2A类推荐。
因此,在NCCN指南情况中,可以看到,对于PDT(光动力治疗)的推荐类别/级别越来越高。

从日本肺癌临床实践指南的变迁中可以看到,2018版指南新增:1.PDT用于早期中央型肺癌(特别是瘤体≤1.0cm)的根治治疗(1C类推荐);2018版指南未更改:2.恶性胸膜间皮瘤的术中治疗。也就是说可以在术中消除残存的一些病灶。
人类对光动力治疗的研究和探索不断,我国对PDT研究做出巨大努力……卟啉类药物是光动力治疗的关键要素,全球应用广泛

谈关于HpD-PDT的临床应用之前,先看看PDT治疗的发展历程。1904年是光动力发展的起始点,这一年,Herman Tappeiner和A. Jesionek首先将其正式定义为「光动力作用」。1910年,hausmann报道了血卟啉(Hp)引起的光动力学损伤作用。这个时期人们对光动力的应用还是有争论的。随着1960年血卟啉衍生物(HpD)的制备产生,再到1976年,HpD-PDT成功治疗了1例复发膀胱癌。1978年,首次完整报HpD-PDT治疗皮肤肿瘤研究结果。1980年,首次为13例支气管肺癌患者进行了内窥镜下光动力治疗。至此,光动力奠定了一定的位置。
如果说1904年是光动力发展的起始点,那么1982年一定算光动力发展上的重大突破点。1982年,国际抗癌联盟(UICC)首次将PDT专题列入代表大会议程(第十三届)。紧接着,1986年,日本共同发起成立国际光动力学会(IPA),中国也首次报道了PDT消化道肿瘤取得良好效果。
在此不得不提中国对「光动力」研究所做出的努力。1980年13例支气管肺癌患者进行了内窥镜下光动力治疗,很大程度上我国也想自主研发这项技术所必须使用到的光敏剂。但在我国当时,光敏剂一直没有得到产出,而国外的光敏剂价格高昂,国家当时未予批准研发这项技术,因此该项技术也没有得到广泛应用。但很快
到2006年,我国便研发出自己的光敏剂,且得到国家批准。因此,从2006年后,我国的「光动力」在肺癌领域,尤其是气道狭窄、恶性肿瘤等治疗中得到了逐步、广泛的推动和应用 , 起到了非常好的效果,也得到了非常好的结果。
此后,对于光动力治疗的研究进入了快速发展期。1999年,加拿大批准首个PDT治疗药物。2006年,CFDA批准PDT用于肿瘤治疗。2011年,FDA批准卟啉类药物用于胸 膜间皮瘤治疗(孤儿药,又称为罕见药,用于预防、治疗、诊断罕见病的药品)。 到如今,PDT治疗的探索未曾间断,以期为人类带来更多获益。
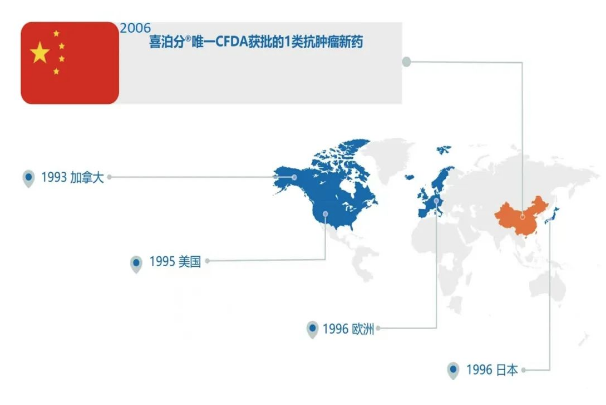
卟啉类药物是光动力治疗的关键要素,全球应用广泛。比如:1993年,加拿大将其应用于部分梗阻性食管癌、早期的非小细胞性肺癌(NSCLS)、Barrett食管的不典型性增生、晚期肺癌以及食道癌;1995,美国将其应用于原发移行性细胞膀胱癌、部分或完全性梗阻食管癌、部分或完全梗阻性NSCLS、Barrett食管的不典型增生、胆管癌和恶性胸膜间质瘤(孤儿药)、微侵袭性非小细胞肺癌(不适宜手术或放疗者);1996年,欧洲将其应用于食管癌和肺癌的辅助治疗、早期肺癌的根治、Barrett食管癌非典性增生(孤儿药);同年,日本将其应用于早期肺癌、浅表食管癌、胃癌、早期宫颈癌和异型增生。在中国,卟啉类药物(喜泊分)于2006年被作为唯一被中华人民共和国国家食品和药品监督管理局(CFDA)获批的1类抗肿瘤新药,广泛应用于治疗消化系统癌、支气管肺癌、膀胱癌、口腔及浅表癌,治疗鲜红癍痣,并用于定位诊断上述癌变及白斑等癌前病变。可见卟啉类药物在临床方面的应用已较为成熟。
究竟何谓光动力治疗(PDT)?是如何治疗的?
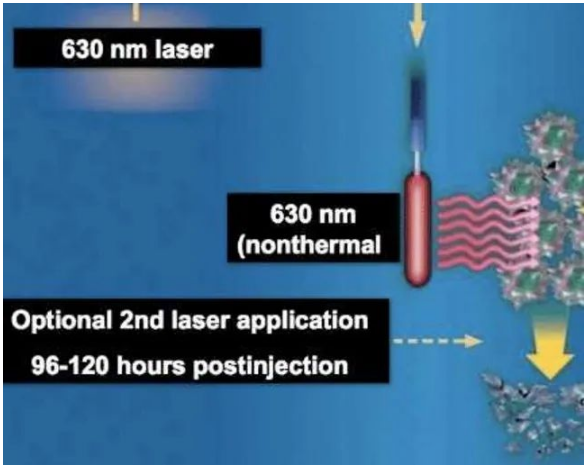
光动力治疗(Photodynamic therapy,PDT),是一种有氧分子参与伴随生物效应的光敏化反应,其通过特定波长的激光照射使组织吸收的光敏剂激发,氧分子通过能量传递,产生自由基和单态氧等活性氧,产生细胞毒性作用,从而导致肿瘤细胞受损乃至死亡的治疗方法。
注射光敏剂示意

来看看全过程。光敏剂是治疗的一个重要因素。First Step:先确定适宜的患者以后,将血卟啉注射液(光敏剂)以5mg/kg,加入250ml生理盐水,静脉避光
光敏剂有个特殊性,能促进肿瘤组织在肿瘤组织内得不到代谢。因此血卟啉注射液可选择性地富集于肿瘤组织,同时肿瘤淋巴回流系统受阻,最终肿瘤细胞间质中HpD与正常组织形成浓度差。

Secend Step:在48小时后,根据患者不同的部位选择适宜光纤(柱状/点状/球状)和能量,计算好时间,采用630nm激光照射。为什么要采用630纳米左右的激光进行照射?这是因为照射以后很快有光照的作用,会产生自由基和单太阳的活性氧,产生细胞毒性作用能够,从而导致肿瘤细胞受损,细胞坏死。因此这时我们要在短期内进行清理,以达到气道通畅的效果。
这里要注意两个方面,一是肿瘤细胞坏死以后气道的梗阻,二是损伤的气管壁导致气管壁的支气管动脉随着气管壁外的肺动脉破裂而造成大出血,这是两个最为严重的并发症。
Third Step:72-96小时后,内镜清除坏死组织并观察病灶情况,必要时进行第2次激光照射,术后严格避光护理30d±。
关于异物的取出方式:1.吸引;2.活检钳钳夹;3.大块的二氧化碳冷冻冻取;小的异物可机化,自体吸收,或者随痰液排出。

这是光敏剂的作用机理。如图所示,不再作解释。
HpD-PDT肿瘤治疗机制:光敏剂靶向富集肿瘤细胞,精准、高效破坏肿瘤细胞
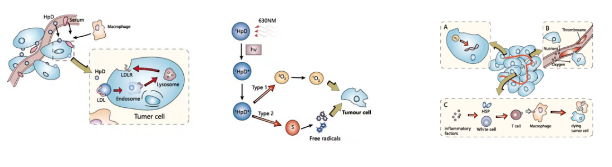
这是HpD-PDT肿瘤治疗机制,光敏剂靶向富集肿瘤细胞,精准、高效破坏肿瘤细胞。图左显示的是1.光敏剂靶向富集到肿瘤细胞。1)HpD主要通过低密度脂蛋(LDL)等脂质通路富集肿瘤细胞形成较高浓度分布;2)同时肿瘤淋巴回流系统受阻,肿瘤细胞间质中HpD长期滞留,最终与正常组织形成浓度差。图中显示的是2.光敏剂经过光能跃迁,发生Ⅰ和Ⅱ型光化学反应。1)基态分子氧(3O2)通过光能能量转换为激发态单态氧(1O2);2)各受体分子通过电子传递最终生产自由基;单态氧与自由基具有细胞毒性,靶向破坏肿瘤细胞。图右显示的是3.靶向细胞毒性和免疫应答破坏病变组织。1)氧自由基直接作用于DNA分子,造成损伤,细胞凋亡;2)单态氧作用于内皮细胞和血管壁,导致血栓形成,肿瘤缺乏氧气和营养物质;3)炎症介质释放,激活免疫系统,激活效应T细胞,产生特异性抗肿瘤细胞效应。
看看PDT可治疗的病灶部位,尤其在肺内、在气管内照射的部位。有两个因素,一是光敏剂,二是光纤能照到的地方,所以并非外周的病变光纤可能到达不到部位,凡是能通光纤能到达的部位,都可以进行照射治疗。主要用于气管,能通组织气管、叶支气管和断支气管这些部位,在更远端的一些就不好到达。另外目前可以通过一些导航技术,通过导航引导的作用,可以到达更远端的小肿瘤,所以对于外部的小肿瘤,有可能也会取得好的治疗效果。目前正在尝试。
PDT治疗适应症主要为支气管内肿瘤,周围性肿瘤有待探索
关于PDT治疗适应症,第一大类就是支气管内肿瘤。其中包括:
1、气管支气管内肿瘤根治适应症;单侧病灶最大直径≤1cm;病灶位于气管支气管粘膜层,未侵及软骨;位于隆突附近无法切除的肿瘤;影像学检查未发现淋巴结转移和远处转移;吻合口局部复发或经过放疗、激光、微波治疗后局部复发浅肿瘤;适合行内镜治疗和激光治疗。
2、气管支气管内肿瘤姑息性治疗;单侧病灶最大直径≧2cm,阻塞管腔,呼吸困难;病灶侵及支气管软骨或外膜;气道梗阻导致呼吸困难或阻塞性肺癌;放疗、化疗后复发的顽固性支气管内肿瘤;气管梗阻放置支架后肿瘤复发再次梗阻气管。
第二大类是周围性肺癌,但这部分还有待探索。主要是肺癌远离心脏和纵隔脏器;拒绝手术和放疗;年龄大、体质弱、全身情况差或伴有严重的内科疾病、无法承受手术、放疗、化疗;呼吸道肿瘤手术或放疗后复发,难以再次手术或放疗者。
关于术中光动力治疗,目前有胸膜肿瘤或纵隔肿瘤可以通过胸腔镜和纵隔镜导入光导纤维行光动力治疗;III-IV期支气管肺癌患者,影像学检查无法完全手术切除者,可以考虑通过手术将大块肿瘤切除后再对残余病灶进行光动力治疗,降低肿瘤复发率,从而延长患者的生存期;术前考虑患者有可能发生胸膜广泛播散,PDT可以控制播散转移病灶。
关于PDT治疗的禁忌症:
1、血卟啉症及其它因光而恶化的疾病,如系统性红斑狼疮、皮肌炎;
2、已知对卟啉类或对任何赋形剂过敏者;
3、明显的凝血功能障碍者;
4、肿瘤已侵犯大血管及邻近主要血管;
5、存在眼科疾病需在30天内灯光检查者;
6、光纤无法到达的肿瘤部位;
7、食管癌病灶侵及气管、食管支气管瘘、支气管纵隔瘘患者;
8、有严重心肺功能不全,有严重高血压、心脏病病史患者;
9、患者属于恶病质状态,预计生存期小于3个月。
但以上这些禁忌症,只是相对的禁忌症,不是绝对禁忌症。比如说严重的气道阻塞,患者虽然有恶病质状态,但是有严重的气道阻塞随时可能死亡的情况,在这种情况下我们可以与家属进行积极沟通,在关键时刻缓解呼吸困难、抢救患者生命的前提下,这些禁忌症可以变为相对禁忌症。
如患者有心脏病和高血压无法行手术和放疗,只有光动力微创治疗的风险最小,并有治愈肿瘤或者延长生存期、提高生存质量可能的时候,经患者或患者家属签字也可行光动力,但一定要在严密监视下完成。

PDT术后常见的副作用就是光敏反应。典型的阳光照射后有光过敏,还有日光灯照射后的光过敏,皮肤发生红斑、渗出,严重时有局部的出血。《PDT术后患者避光指南》也作出了明确规定:
术后第1天:避免暴露在阳光下的一切可能性;呆在有避光窗帘的房间内,避免阳光直射;只使用一个≤60瓦灯泡(11瓦节能);如观看电视:安全距离>2m,并佩戴墨镜。
术后第2-7天:渐渐增加室内照明光线,可逐步恢复正常室内照明;白天保持在室内,避免靠近窗户,天黑后可户外活动;避免直接暴露在阳光下,如外出需穿避光服;如不慎暴露皮肤在阳光下,发生刺痛或灼烧感,应立即隔离避光,并立即就诊。
术后第8-14天:避免阳光直射和强的室内照明;可短时间户外活动(10-15m),需穿避光服并在遮荫下活动;如皮肤无光敏反应可增逐渐增加户外活动时间;如发生光敏反应,及时就诊,并停止户外活动/皮肤曝光。
术后15天以上:慢慢接受阳光直接照射,逐步回到从前状态(用手在阳光下测试5m后,逐渐增加时间和频率,每次增加15m);至少3个月不宜日光浴/太阳光/日光浴床;至少30天内避免强光眼部检查。
参考文献
[1] Rebecca L, et al. CA CANCER J CLIN 2018;(68):7–30
[2] 陈万青,中华肿瘤杂志,2018,40( 1 ): 5-13
[3] Allemani C,et al. Lancet. 2018 Mar 17;391(10125):1023-1075
[4] Simone CB,et al.Journal of Thoracic Disease,2012,4(1):63-75
[5] Akopov A,et al. Photodiagnosis and Photodynamic Therapy 2014(11):259-264
[6] 李黎波,许德余.肿瘤光动力治疗学[M].北京:科学出版社,2018:342-344.
[7] Simone CB,et al.Journal of Thoracic Disease,2012,4(1):63-75
[8] PascualG,et al.Nature.2017,541(7635):41-45
[9] Stylli SS,et al.Journal of Clinical Neurouscience.2006(13):615-625
[10] Lovell JF,et al.Chem.Rev.2010,110(5):2839-2857
[11] Ethirajan M,et al.Chem.Soc.Rev.2011(40):340-462
专家介绍

金发光
教授,主任医师,博士生导师,现任空军军医大学第二附属医院呼吸与危重症医学科主任,唐都医院大内科主任。兼任世界内镜医师协会呼吸内镜协会副会长、内镜临床诊疗质量评价专家委员会常务委员、陕西省医学会内科学分会主任委员、呼吸结核分会名誉主任委员、中华医学会内科学分会常务委员等。
本文由《呼吸界》编辑 冬雪凝 整理自 CACP 2022,感谢金发光教授的审阅修改!


