编前语
「通过刺激患者自身的免疫系统攻击肿瘤细胞的能力」,这是昨天颁发的2018年两位诺贝尔生理学或医学奖得主,70岁美国免疫学家詹姆斯•艾利森(James Allison)与76岁的日本生物学家本庶佑(Tasuku Honjo)在上世纪末、本世纪初为癌症治疗建立了一个全新的原则。而100多年以来,科学家们一直希望能够通过改进患者自身的机体免疫系统来抵御癌症。免疫治疗是靠激活机体的免疫细胞来杀伤肿瘤细胞,部分患者甚至能在停药后达到长期缓解!然而,一方面,免疫治疗的现状面临诸多瓶颈:医生掌握少、患者不理解、操作难规范,另一方面,免疫治疗渐渐被「神化」、被个别不正规机构滥用……对肺癌患者的治疗现状,专家带来了怎样的思考?临床上又有哪些权威客观的实际病例解读?
北京时间10月1日下午5 : 30,2018年度诺贝尔生理或医学奖颁给了美国得州大学免疫学家James P. Allision和日本京都大学教授Tasuku Honjo,以表彰他们对肿瘤免疫治疗做出的研究贡献。
虽然「魏则西」事件让肿瘤免疫疗法在中国大陆遭遇寒冬,但事实上该事件中采用的DC-CIK细胞免疫疗法在中国乃至美国就没有获得过临床应用批准,该疗法并非免疫治疗的主流。
免疫检查点抑制剂有令人瞩目的疗效和长期持久的应答,哪些具体疗法已获批准进入临床应用?
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)作为主动免疫治疗方向的一个重要方法,因其令人瞩目的疗效和长期持久的应答,已用于黑色素瘤、霍奇金淋巴瘤、膀胱癌等多个瘤种。在晚期非小细胞肺癌(non-small cell lung cancer,NSCLC),程序性细胞死亡蛋白-1(programmed death-1,PD-1)及其配体(programmed death-ligand 1,PD-L1)抑制剂如Nivolumab、Pembrolizumab、Atezolizumab和Durvalumab已获批准进入临床应用,中国大陆批准了纳武单抗(Nivolumab)。诺贝尔生理或医学奖颁给免疫「刹车系统」的发现人,是对肿瘤免疫疗法的肯定。除了两位诺贝尔奖获奖者,还有一位名叫陈列平的中国学者发现了PD-L1并证明抗体抑制可抑制肿瘤生长,值得被人们记住。
免疫治疗使部分NSCLC患者治疗前景「峰回路转」,更是对肺癌个体化精准治疗蓝图的完善
自EGFR驱动基因发现以来,NSCLC治疗进入驱动基因指导下的靶向治疗时代。驱动基因EGFR、AKL、ROS等的发现,给驱动基因阳性患者带来无进展生存期(progression-free survival,PFS)、总生存期(overall survival, OS)上的明显获益。然而,NSCLC中占多数的驱动基因阴性患者并不能从靶向治疗中获益,此类人群能够接受的大多是传统化疗,带给患者生存获益有限。值得庆幸的是,NSCLC免疫原性强,其肿瘤突变负荷(tumor mutation burden,TMB)及PD-L1表达水平较高。这提示NSCLC患者可能会从免疫治疗中获益。通过恰当的人群筛选或与其他治疗方式灵活的联合应用,免疫治疗使驱动基因阴性NSCLC患者治疗前景「峰回路转」,更是对肺癌个体化精准治疗蓝图的完善。
免疫治疗是利用自身免疫系统来攻击肿瘤,接受免疫治疗存活5年的患者中75%仍对免疫治疗有治疗应答
免疫治疗与传统治疗方式直接作用于肿瘤细胞不同,是作用于自身免疫系统,利用自身免疫系统来攻击肿瘤。抗肿瘤免疫应答通过持续识别和记忆肿瘤抗原,随着时间不断增强和扩大,循环不断重复,抗肿瘤免疫反应持续加强;随着免疫应答的扩大,一些细胞毒性T细胞分化为成熟记忆T细胞,即使在原始抗原刺激不存在时,这些细胞依然能够提供长期免疫记忆保护。因此,免疫治疗能为患者带来持久获益和长期生存。CA209-003研究 5年随访结果提示接受免疫治疗存活5年的患者有75%仍对免疫治疗有治疗应答。
免疫治疗引起NSCLC二线治疗巨大变革
随着NSCLC一线治疗和支持治疗的改善,进入二线治疗的患者不断增加。二线治疗已成为NSCLC患者全程管理中的重要组成部分。然而,传统的标准二线治疗方式化疗能够给患者带来的获益非常有限:客观缓解率(objective response rate, ORR)约10%、中位生存时间(median overall survival, mOS )约2~6m、1年生存率约15~30%。免疫治疗出现后首先尝试用于二线或后线的NSCLC治疗。CheckMate-017和CheckMate-057是二线应用PD-1抑制剂Nivolumab分别针对鳞癌和非鳞癌的Ⅲ期临床试验研究。
结果显示,无论PD-L1表达与否,二线使用Nivolumab后2年、3年生存率明显优于多西他赛化疗方案。KEYNOTE-010也提示Pembrolizumab 完胜多西他赛。 2018年AACR会议上公布中国的CheckMate-078研究也提示在二线使用免疫治疗效果明显优于多西他赛化疗,五年生存率甚至达到20%。
基于上述实验,NCCN指南推荐PD-1/PD-L1抑制剂包括Nivolumab(无论PD-L1表达与否)、Atezolizumab(无论PD-L1表达与否)、Pembrolizumab(PD-L1³ 1%)成为包括鳞癌和非鳞癌患者在内的NSCLC首选二线治疗方案。不仅在疗效优于化疗,不良反应发生率也明显低于化疗,患者的生活质量更高。免疫治疗引起NSCLC二线治疗巨大变革。
如何使更多的人群获益?免疫联合治疗策略应运而生
KEYNOTE-024显示在一线治疗中或许只有PD-L1≥50%这样高度选择的人群才能从PD-1/PD-L1抑制剂免疫单药治疗中获益。但PD-L1≥50%的患者在普通人群中只占到15%左右,如何使更多的人群获益成为目前亟待解决的问题。采用某种方式使弱免疫原性肿瘤变成对免疫治疗敏感的强免疫原性肿瘤,即将「冷肿瘤」转化为「热肿瘤」,或能进一步扩大从免疫治疗获益的人群并加强免疫治疗的功效。免疫联合治疗策略应运而生,包括免疫联合免疫、免疫联合化疗、免疫联合抗血管抑制剂在内的多种临床试验相继展开,都取得了良好的效果。比如KEYNOTE-189研究通过免疫和化疗联合的方式,甚至可以不筛选PD-L1表达水平而将PD-1/PD-L1抑制剂直接用于一线。这些联合的方法都使得从免疫治疗中获益的人群扩大并改善了治疗效果。
免疫治疗在肿瘤中的应用已逾百年。然而直到免疫检查点抑制剂的诞生,免疫治疗才真正实现在肺癌临床应用中的长足进展。在免疫治疗获得诺贝尔医学奖高歌猛进的同时,仍有许多问题需要我们思考,人类目前对免疫治疗的认识只是冰山一角,真正用其战胜肿瘤的探索才刚刚开始……
看看临床上的相关病例
患者向某某,男,68岁,因「咳嗽、咳痰7天」于2017年4月26日到我院就诊。入院后行胸部CT提示:左上肺占位,左肺门及纵隔淋巴结肿大,心包少量积液(图1)。PET-CT提示:左肺中央型肺癌,左肺门及纵隔淋巴结转移,心包转移。支气管镜下见左主支气管及左上叶支气管有新生物生长致管腔狭窄(新生物距隆突约2cm)(图2)。于左上叶支气管活检,病理诊断:肺鳞癌。诊断为:左肺鳞癌 T4N3M1a Ⅳ期。基因检测:EGFR(-)、ALK(-)、ROS1(-)。于2017年5月、6月、7月行紫杉醇联合奈达铂化疗3次。
2017年7月底,患者出现活动后气促及痰中带血症状。
2017年8月,复查胸部CT提示肺部病变增大(图1),疗效评估为疾病进展。行PD-L1检测提示为阳性。于2017年8月开始接受Pembrolizumab治疗,每3周用药一次。
2017年9月,复查CT提示肺部病变明显缩小(图1)。且患者咳嗽、咳痰、活动后气促及痰中带血症状均逐渐消失。2018年9月复查CT提示肺部病变进一步有所缩小(图1)。
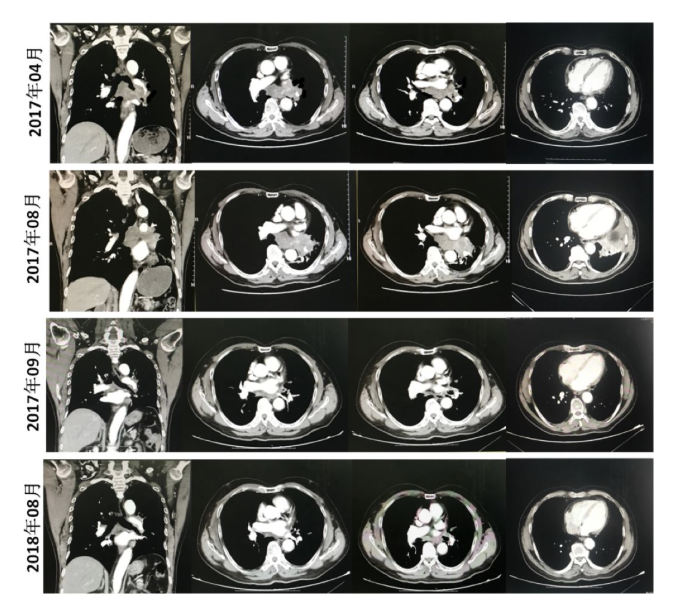
图1:胸部CT
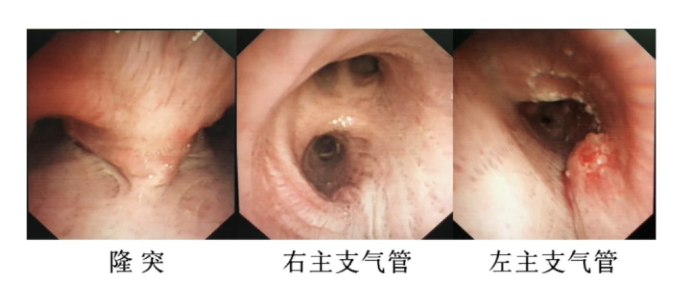
图2:支气管镜下表现

人体的免疫系统是人体免受到疾病侵袭的保障。近年学界开始通过免疫介导杀伤肿瘤细胞。PD-1单抗或PD-L1单抗均已被证实可阻断PD-1与PD-Ll的结合,恢复T细胞的活性,进而杀死肿瘤细胞。目前关于PD-1单抗或PD-L1单抗治疗非小细胞肺癌(non-small cell lung cancer, NSCLC)的研究较多。已被FDA批准用于治疗非小细胞肺癌的Pembrolizumab及nivolumab均属于PD-1抗体,两药已在我国上市,目前仅nivolumab在我国获批了NSCLC的适应症。
Keynote 024研究证实Pembrolizumab一线治疗PD-L1表达≥50%的NSCLC患者较化疗的PFS延长了4.3月(10.3m vs 6m, P<0.001),OS延长15.8月(30 vs 14.8m, P=0.002)。KEYNOTE 042也发现Pembrolizumab一线治疗PD-L1表达≥1% NSCLC患者也能较化疗延长4.6个月的OS(16.7m vs 12.1m, P=0.0018)。Keynote 010研究将Pembrolizumab用于既往接受过化疗出现疾病进展,且PD-L1 表达≥1%的NSCLC患者,发现Pembrolizumab的OS优于多西他赛(13.6m vs 8.6m)。FDA曾批准Pembrolizumab可用于一线治疗超过50%PD-L1表达的转移性NSCLC患者,或二线治疗含铂双药化疗进展后至少1%PD-L1表达的转移性NSCLC患者。
KEYNOTE 189研究结果被认为正在进一步改变肺癌治疗的临床实践。该研究发现,无论PD-L1表达状态如何,Pembrolizumab和培美曲塞联合铂类化疗的治疗方案较单独化疗显著延长了PFS(HR = 0.52 [95%CI, 0.43-0.64]; p<0.00001)和OS(HR = 0.49 [95%CI, 0.38-0.64]; p<0.00001),将患者的死亡风险降低了一半。2017年5月,FDA批准了Pembrolizumab和培美曲塞联合卡铂用于一线治疗无EGFR或ALK驱动基因阴性的晚期非鳞癌NSCLC患者的治疗。
未来还会有更多的免疫治疗药物不断获批上市,肺癌治疗的免疫时代正逐渐向我们走来。对于驱动基因阴性无靶向治疗机会的肺癌患者又多了一种新的治疗手段,免疫治疗将会为更多的患者在精准治疗中获益。
作者介绍



